水体中的重金属由于会对人类及其他有机体产生毒害作用, 已经越来越受到人们的重视.因此, 对于水体中重金属的去除就变得十分必要(Zheng et al., 2015).在过去, 已经有很多种方法(如膜过滤、吸附等)被用于重金属的去除(Ding et al., 2014; 曹飞丽等2014).其中, 吸附被认为是一种很有效的方法, 尤其是环境中的生物质吸附剂如壳聚糖被认为是一种很有潜力的吸附剂.本课题组长期从事磁性纳米材料吸附处理含重金属和有机污染物废水(Zhang et al., 2016; Jiang et al., 2015; Gong et al., 2015; Deng et al., 2013; Tang et al., 2012; Gong et al., 2012), 取得了较好的效果.
腐殖酸是另一种环境污染物, 主要来源于动物体和植物体的分解过程.水体中存在腐殖酸时, 不仅会恶化水体, 同时还会降低水体色度.对于腐殖酸本身来说, 由于其结构中存在羧基、羟基, 因此, 在水体中通常带负电荷(Maghsoodloo et al., 2011).此外, 溶液的pH对腐殖酸的溶解度也有很大的影响, 在强酸性条件下很难溶, 而在弱酸性及碱性条件下可以完全溶解.因此, 溶液pH值是腐殖酸去除过程中需要重点考虑的一个参数.根据以往的研究, 人们尝试了很多的方法用于去除腐殖酸, 如超滤膜法、吸附法及絮凝法(刘芭等, 2013;Lin et al., 2012).
值得注意的是, 以往的许多关于污染物去除的研究都只是在单一的体系中进行, 然而在真实的环境中, 它们往往是共存的.因此, 近年来有一些研究开始关注复合污染的问题及吸附剂的连续利用.本课题组之前也研究过用磁性碳纳米管同时去除农药和铜离子(Tang et al., 2012);Dai等(2011)用一种吸附了铜离子的壳聚糖小球来吸附磷酸盐.然而, 对于本实验讨论的腐殖酸和铜离子, 由于腐殖酸带有羧基, 在环境中会自发地与铜离子发生络合反应, 这会导致对它们的去除变得更加困难和复杂.因此, 探讨腐殖酸和铜离子在单一和复合体系中的吸附行为就变得很有必要.近来也有学者研究了腐殖酸对铜离子去除的影响(Yang et al., 2014);Li等(2016)研究了富里酸和腐殖酸对彼此吸附效果的相互影响.
壳聚糖(CS)主要来源于甲壳素的脱乙酰作用, 是目前被广泛应用的一种生物质聚合物, 它具有易生物降解、无毒及生物兼容性等特点.近年来, 壳聚糖被广泛用于去除重金属、染料、腐殖酸等污染物.这主要是由于壳聚糖聚合物中具有大量的羟基、氨基等功能基团, 这些基团能和一些污染物发生络合、离子交换及静电引力作用, 从而达到去除污染物的效果(Travlou et al., 2013).但单纯的壳聚糖是亲水的、容易团聚, 并且在酸性条件下, 壳聚糖上的氨基容易被质子化, 因此, 需要对壳聚糖进行交联以增强其稳定性.针对这些缺陷, 研究人员主要用交联、负载、掺杂等方式来克服.例如, Liu等(2014)通过加入化学交联剂将壳聚糖的分子链交联, 以增强其稳定性;Cho等(2015)和Zhu等(2014)通过将壳聚糖负载在Fe3O4磁性材料上, 以及向壳聚糖小球中掺杂聚乙烯醇的方式增加其机械强度.此外, 由于壳聚糖具有交联成直径较大球状的特点, 方便回收后再利用, 如Dai等(2012)将吸附过铜离子的壳聚糖小球用于溶液中磷酸盐的再吸附.
基于此, 本研究以三聚磷酸钠(STPP)为交联剂, 并以向壳聚糖中掺杂聚乙烯醇(PVA)的方式合成一种可连续使用的PVA/壳聚糖小球, 将其用于吸附腐殖酸和铜离子.同时, 进行3种类型的实验:① 壳聚糖小球对腐殖酸和铜离子的单独吸附实验;② 先用壳聚糖小球吸附铜离子(或腐殖酸), 再用这种吸附铜离子(或腐殖酸)的小球来吸附腐殖酸(或铜离子);③ 壳聚糖小球在腐殖酸-铜离子复合体系中对腐殖酸和铜离子的去除实验.
2 材料与方法(Materials and methods) 2.1 试剂和仪器试剂:壳聚糖、聚乙烯醇、三聚磷酸钠(STPP)、Cu(NO3)2·3H2O均为分析纯, 腐殖酸为化学纯.
仪器:JSM-5600LV型场发射扫描电镜(日本电子株式会社), Nicolet-5700型傅里叶变换红外光谱仪(岛津公司), Scientific-K-Alpha-1063型X射线光电子能谱分析仪(赛默飞世公司), Nano-ZS90型Zeta电位分析仪(马尔文仪器公司), Perkin-Elmer-700型火焰原子吸收光谱仪(美国珀金埃尔默公司), 总有机碳(TOC)分析仪(岛津公司).
根据之前的研究(Satio et al., 2004), 对腐殖酸进行了进一步的纯化, 纯化方法如下:将10 g腐殖酸加到1 L去离子水中, 并用NaOH调节pH=10, 匀速搅拌24 h后过滤, 滤掉溶液中的难溶物;将得到的溶液的pH调节到2, 并继续搅拌12 h;然后将得到的溶液在6000 r·min-1下离心, 对得到的沉淀物先用0.01 mol·L-1的盐酸清洗2遍, 再用去离子水清洗并离心(10000 r·min-1)2遍;将最后得到的离心产物干燥, 并配成1000 mg·L-1的储备液.
2.2 壳聚糖小球的制备将2.0 g壳聚糖加到50 mL的醋酸溶液(2%, 体积分数)中, 超声30 min使壳聚糖完全溶解.将4.0 g PVA加到50 mL去离子水中, 并在80 ℃下搅拌(800 r·min-1)5 h.然后将上述2种溶液混合, 并在70 ℃下继续搅拌2 h, 将得到的混合液在常温下静置48 h.静置完成后, 将混合液逐滴加入到300 mL、250 mg·L-1的三聚磷酸钠溶液中, 并低速搅拌(100 r·min-1)使PVA/CS凝胶在搅拌过程中转化成小球.滴加完后, 将混合物继续低速搅拌12 h.最后将得到的小球先水洗, 使pH达到7左右, 最后冷冻干燥.
2.3 实验方法与设计 2.3.1 单一组分吸附在单组分吸附实验中, 将150 mg壳聚糖小球分别加到250 mL 40 mg·L-1的腐殖酸和铜溶液中, 在25 ℃、150 r·min-1下振荡, 在设置好的间隔时间内取样.分别在pH=4.0、6.4和7.0下进行上述实验.
2.3.2 连续吸附实验在腐殖酸-铜离子连续吸附实验中, 先将150 mg PVA/CS小球加到250 mL 40 mg·L-1的腐殖酸溶液中, 并在150 r·min-1下振荡24 h, 振荡完成后将锥形瓶中的溶液倒掉, 留下小球并在常温下静置24 h, 静置完成后再向盛有小球的锥形瓶中加入250 mL 40 mg·L-1的铜溶液, 搅拌, 在设置好的间隔时间内取样.并用相同的方法再进行铜离子-腐殖酸连续吸附实验.
2.3.3 复合组分吸附实验在复合吸附实验中, 将150 mg壳聚糖小球加入到250 mL铜离子-腐殖酸的复合溶液中(在加入小球前混合液先搅拌12 h使铜-腐殖酸体系达到平衡, 复合溶液中铜和腐殖酸按不同的浓度配比, 具体见表 1), 并振荡24 h.因为在复合吸附实验中看到了较明显的沉降现象, 因此, 只能测量上清液中的铜和腐殖酸浓度.
| 表 1 复合吸附实验中铜离子和腐殖酸的浓度组成 Table 1 Ratios of HA and copper concentration in coexisting adsorption |
溶液中铜离子的测定采用火焰原子吸收光谱法, 溶液中的腐殖酸是通过测总有机碳含量而确定的, 平衡时吸附到各种PVA/CS小球上的铜离子和腐殖酸的含量通过式(1) 确定.
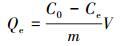
|
(1) |
式中, Qe为小球的平衡吸附量(mg·g-1);C0为溶液中铜离子和腐殖酸的初始浓度(mg·L-1);Ce为吸附平衡时铜离子和腐殖酸的浓度(mg·L-1);V为溶液体积(mL);m为加入的吸附剂的质量(mg).
3 结果分析(Results and discussion) 3.1 PVA/CS小球的表征结果从微球的宏观状态可以看出, 微球的表面呈白色, 其平均直径大约为2.0 mm(图 1a).同时, 通过微球表面的SEM发现其表面是一种褶皱的多孔结构(图 1b), 这样的结构可以增强其比表面积.
 |
| 图 1 壳聚糖小球的宏观照片(a)和SEM图片(b) Fig. 1 Macroscopic image (a) and SEM micrographs (b) of chitosan beads |
图 2给出了壳聚糖小球(PVA/CS小球)、壳聚糖及STPP的红外图谱.壳聚糖和壳聚糖小球的图谱显示, 在3409 cm-1处出现—OH和—NH2的伸缩振动峰, 1650和1599 cm-1处为—NH2的弯曲振动峰;此外, 1426和1374 cm-1分别代表C—O键和C—N键的伸缩振动峰, 而1074 cm-1处表示C—O的骨架振动峰(Wen et al., 2012).STPP的红外图谱显示, 在1151和893 cm-1处有STPP中的2个重要基团:P=O和P—O.通过比较壳聚糖小球和壳聚糖的红外图谱, 发现在1555 cm-1处出现了一个新的特征峰, 这是由壳聚糖上带正电的质子化后的氨基和带负电的STPP交联时产生的一种新的结构(Moura et al., 2009).
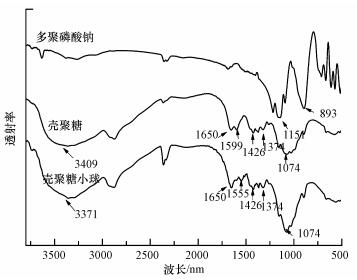 |
| 图 2 多聚磷酸钠、壳聚糖和壳聚糖小球的红外图谱 Fig. 2 FTIR spectra of STPP, chitosan and PVA/CS bead |
PVA/CS小球吸附铜离子的结果见图 3a, 结果表明, pH对微球吸附铜离子的影响不大.在pH=6.4时, 其吸附能力相对于pH=4.0时有轻微提升, 而在pH=6.4和7.0时, 小球对铜离子的吸附容量几乎没有变化.
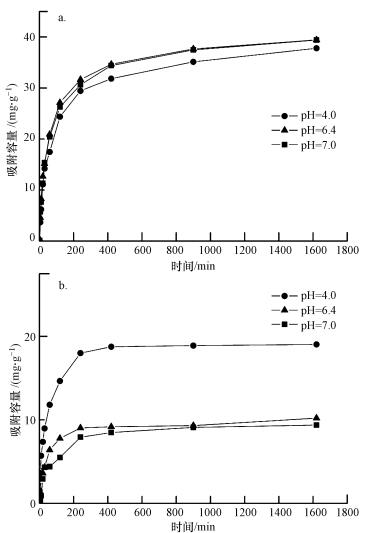 |
| 图 3 壳聚糖小球在不同pH条件下对铜离子(a)和腐殖酸(b)的吸附 Fig. 3 Copper (a) and HA (b) adsorption by PVA/CS beads at different pH values |
为了解释产生这种趋势的原因, 首先测试了壳聚糖小球的ζ电位(图 4), 结果显示, 壳聚糖小球的等电点为pH=6.4, 这与之前文献中测量的结果相近(Yan et al., 2006).从之前的文献(Rao et al., 2007)中可知, 铜离子在不同的pH下会呈不同的状态(如Cu2+、Cu(OH)+、Cu(OH)2、Cu(OH)3-), 并且铜离子在pH>7.5时会发生沉淀.因此, 根据ζ电位结果显示, 在pH>6.4时, PVA/CS小球对铜离子的吸附量会增加, 因为铜离子和小球之间的静电引力作用.当pH < 6.4时, 小球和铜离子之间由于静电斥力其相互作用能力会变弱, 并且当pH < 6.4时, H+和Cu2+竞争PVA/CS小球上的吸附位点, 从而导致吸附量减少.而在pH=4.0~6.4之间, 小球的吸附效果应该有一个较明显的提升, 因为小球的等电点为pH=6.4.然而实际结果显示, 它们之间的差异并不明显.因此, 推测铜离子与小球之间的相互作用可能不是由静电引力主导的.
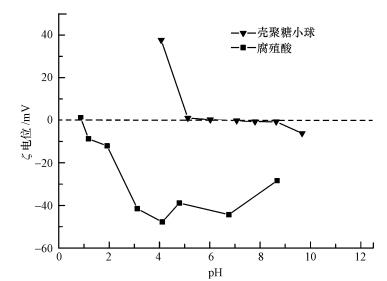 |
| 图 4 壳聚糖小球和腐殖酸的ζ电位 Fig. 4 ζ potential of PVA/CS bead and HA |
为了进一步探讨ζ电位与实际吸附情况产生差异的原因, 同时证实它们之间的实际作用机理, 本文对吸附铜离子前后的小球做了XPS分析, 结果显示(图 5), 在PVA/CS小球的N 1s能谱上有2个能谱信号(图 5a), 分别是399.6 eV和401.5 eV, 它们分别代表—NH2和—NH3+中的氮元素.然而在小球吸附了铜离子之后, 可以明显地看到, N的能谱在406.7 eV上出现了一个新的特征峰(图 5c).这一变化表明铜离子夺取了N的孤对电子, 导致能谱上N的能级增加.除此之外, 图 5d显示, 在吸附铜离子之后PVA/CS小球的O 1s能谱在530.6 eV出现了一个新的特征峰, 这说明在小球吸附铜离子的过程中, 小球中的氧元素也参与了反应.N和O能谱的变化表明, 铜离子与小球之间的相互作用可能是形成一种以铜离子为核、以N和O包围的螯合环结构(Lee et al., 2001).
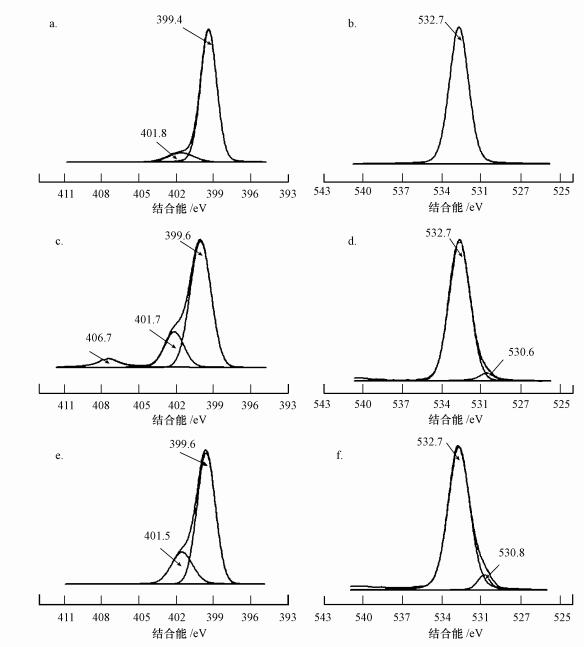 |
| 图 5 PVA/CS小球(a.N1s, b.O1s)及吸附铜离子(c.N1s, d.O1s)和腐殖酸(e.N1s, f.O1s)后的氮、氧X射线光电子能谱 Fig. 5 XPS spectra of PVA/CS beads before and after adsorption(N1s(a), O1s(b) for clean PVA/CS beads; N1s(c), O1s(d) for PVA/CS beads after copper adsorption; N1s(e), O1s(f) for PVA/CS beads after HA adsorption) |
由于考虑到吸附平衡前后溶液的pH值对吸附剂表面官能基团及吸附质的形态有较大影响, 因此, 本文还进一步比较了铜离子吸附前后溶液pH的变化(表 2).对于铜离子, 吸附达到平衡后溶液的pH值较初始pH有所降低;溶液的初始pH值低, 其达到吸附平衡时pH降低的幅度较小, 溶液的初始pH值高, 其达到吸附平衡时pH降低的幅度大.出现这种结果的原因是铜离子带正电荷, 当它被吸附到壳聚糖小球上后, 会使得溶液中的阳离子含量减少, 导致质子的含量增加, 从而使得溶液的pH值降低.通常, 溶液pH的变化也会使壳聚糖小球表面的氨基的质子化程度发生变化, 在铜离子吸附实验中, 正是由于吸附平衡时溶液的pH值都降低, 且降幅有所不同, 从而导致初始pH为6.4和7.0时, 壳聚糖的吸附容量变化不大, 因为吸附平衡时, 它们的pH值分别为5.8和6.1, 变化不大.
| 表 2 腐殖酸和铜离子吸附前后溶液pH的变化 Table 2 The pH values of copper and HA solution before and after adsorption |
为了更好地与铜离子的吸附过程相比, 在3种pH条件下(4.0、4.6、7.0) 进行了PVA/CS小球对腐殖酸的吸附实验, 结果见图 3b.由图可知, pH对小球吸附腐殖酸有较大的影响, 随着pH值从4.0增加到7.0, 小球的吸附效果出现了一个明显的下降, 这说明在低pH条件下, 小球对腐殖酸的吸附更高效.根据腐殖酸的ζ电位结果(图 4)可知, 腐殖酸在pH大于0.8的范围内ζ电位都小于零, 这是由腐殖酸上大量的羧基、酚羟基解离造成的.因此, 在pH<6.4时, 小球中的—NH3+和腐殖酸中的羧基会通过静电引力的作用互相结合;当pH>6.4后, 随着溶液中H+浓度降低, 氨基的质子化程度降低, 导致小球表面的—NH3+基团数量减少, 使得用于吸附腐殖酸的吸附位点减少(Wan et al., 2008).
为了进一步探究腐殖酸和小球之间的作用机理, 对小球吸附腐殖酸前后的表面做XPS能谱分析(图 5).结果显示, N的能谱图中没有出现新的特征峰, 这就说明壳聚糖小球和腐殖酸之间只存在简单的物理作用.可以看到, 小球吸附腐殖酸后的O元素能谱中在530.6 eV处出现了一个新的特征峰(图 5f), 这应该是吸附腐殖酸后, 腐殖酸中的氧特征峰.与此同时测量了吸附前后溶液pH值的变化情况(表 2), 结果显示, 吸附前后腐殖酸溶液的pH变化较小.因为对于腐殖酸而言, 由于其本身是带负电的, 并且与壳聚糖主要发生离子交换反应, 当腐殖酸上的羧基与壳聚糖上的质子化后的氨基结合后, 会导致溶液中的阴离子含量减少, 进而使水电离的OH-含量增加, 使得溶液的pH值有所升高.但由于腐殖酸本身是一种天然的有机物, 表面带有很多官能团, 对溶液pH具有缓冲作用, 因此, 吸附平衡时溶液的pH值相比于溶液的初始pH增大的幅度很小, 因此, 对吸附平衡时壳聚糖小球的吸附容量影响较小.
3.4 铜离子和腐殖酸吸附能力的比较为了探讨本研究合成的PVA/CS小球对铜离子和腐殖酸的去除效率及小球的使用价值, 比较了以往研究使用的去除铜离子和腐殖酸的方法、效果及所用的吸附材料(表 3).通过比较发现, 本实验合成的PVA/CS小球对铜离子和腐殖酸有较好的吸附效果.
| 表 3 不同材料对铜离子和腐殖酸去除效果的比较 Table 3 Comparison of removal efficiencies of different materials for copper ion and humic acid |
首先用先吸附了腐殖酸的PVA/CS小球(腐殖酸-小球)去吸附铜离子, 将吸附结果与小球直接吸附铜离子的结果进行比较, 发现铜离子在小球上的吸附量是在腐殖酸-小球上的2倍(图 6a).接着用先吸附了铜离子的小球(铜-小球)去吸附腐殖酸, 结果显示, PVA/CS小球对腐殖酸吸附能力没有铜-小球对腐殖酸的吸附能力强(图 6b).因此, 综合图 6结果可知, 小球吸附腐殖酸后, 其表面的腐殖酸会抑制小球对铜离子的继续吸附;而小球在先吸附铜离子之后, 其表面的铜会促进小球对腐殖酸的继续吸附.
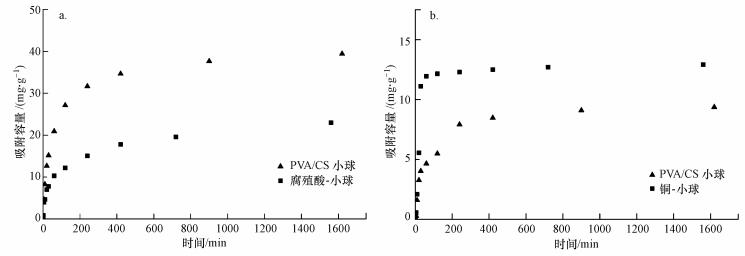 |
| 图 6 壳聚糖小球和腐殖酸-小球对铜的吸附(a)及壳聚糖小球和铜-小球对腐殖酸的吸附(b) Fig. 6 The adsorption of copper on chitosan bead and HA-bead (a) and the adsorption of HA on chitosan bead and copper-bead (b) |
根据以往的文献可知, 腐殖酸含有大量的功能基团(如羧基、羟基和酚类), 而这些基团可以与铜离子互相作用, 因此, 腐殖酸本来应该是能促进小球对铜离子的吸附(Yang et al., 2014; Sheng et al., 2010).但在本实验中, 腐殖酸-小球对铜的吸附能力相比于壳聚糖小球对铜离子的吸附能力降低了, 导致这种结果的原因可能如下:首先, 在PVA/CS小球表面, 腐殖酸和铜离子具有相同的吸附位点, 因此, 当小球吸附了腐殖酸后导致小球表面的可用于吸附的位点减少, 对铜离子的连续吸附能力也就变弱.值得注意的是, 小球表面的腐殖酸会增加小球表面的吸附位点, 但它占用的吸附位点要比它新增的位点多.其次, 当腐殖酸吸附到小球表面后, 会在小球表面形成空间位阻, 使铜离子难以通过该位阻与小球接触, 从而导致其吸附量降低.
另外, 氨基是铜离子和腐殖酸在PVA/CS小球表面的吸附位点, 同时腐殖酸也会和铜离子发生配合反应(Mao et al., 2015; And et al., 2000).根据这两点可推测, 腐殖酸在铜-小球上的吸附量增加可能是因为小球表面形成了一种小球-铜-腐殖酸的复合结构, 并且这种结构的作用力要大于腐殖酸和小球之间的静电引力作用.
为了进一步揭示连续吸附过程的可能机理, 对实验过程中所用到的小球进行XPS能谱分析(C 1s), 结果见图 7, 图谱中各种能级的碳含量见表 4.通过比较图 7a和7b可知, 在288.8 eV处出现了一个新的C元素的特征峰, 这个新的特征峰来自于腐殖酸中的羧基.而且由表 4可以看到, 吸附了铜离子的腐殖酸-小球表面的C=O(或O—C—O)的含量(18.3%)要多于吸附了铜离子的小球表面的含量(15.9%).这其中羧基的出现及C=O含量的增加证明了之前的猜想:小球吸附了腐殖酸后在其表面覆盖了一层腐殖酸.此外, 通过比较图 7b和7c并结合表 4可以发现, 腐殖酸-小球吸附铜离子之后, 相较于PVA/CS小球吸附腐殖酸后, 其表面的C=O含量要多出2.0%(18.3% vs16.3%), 而羧基(—COOH)含量却减少了2.1%(2.0%vs4.1%).羧基的减少说明吸附在小球表面的腐殖酸中的一部分羧基也参与了与铜的络合反应, 符合前面的猜想;并且腐殖酸提供的位点不足以抵消其占用的位点及产生的位阻效应.
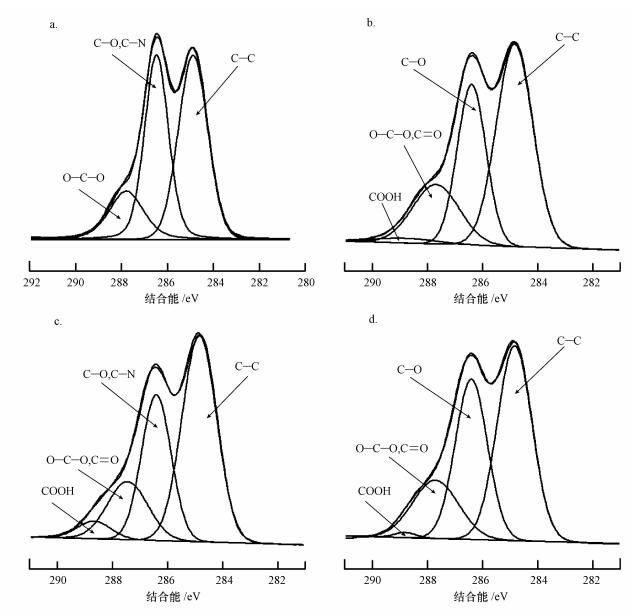 |
| 图 7 PVA/CS小球(a)、腐殖酸-小球(b)吸附铜后及PVA/CS小球(c)、铜-小球(d)吸附腐殖酸后的碳元素光电子能谱 Fig. 7 XPS spectra of PVA/CS beads(a.C 1s for PVA/CS beads after copper adsorption; b.C1s for copper adsorption on HA-beads; c.C1s for PVA/CS beads after HA adsorption; d.C1s for HA adsorption on copper-beads) |
| 表 4 不同类型小球的碳元素的结合能位置及含量 Table 4 Binding energy (BE) and atomic concentration (AC) of C element in different adsorbents |
进一步观察图 7c和7d并结合表 4可以发现, PVA/CS小球和铜-小球在吸附腐殖酸后, 表面的C=O、C—O含量分别由16.3%、29.9%增加到18.2%、35.0%.此外, 吸附了腐殖酸后, 小球表面羧基的含量(4.1%)要小于铜-小球表面的含量(0.8%).这可能是因为一方面, C=O和C—O含量的增加说明铜-小球表面的腐殖酸含量要多于PVA/CS小球表面的含量;另一方面, 羧基含量的减少说明腐殖酸吸附到铜-小球表面主要由腐殖酸上的羧基与其表面的氨基或铜离子发生反应.这也证实了之前推测的一种小球-铜-腐殖酸“三元结构”的存在.连续吸附过程的详细示意见图 8.
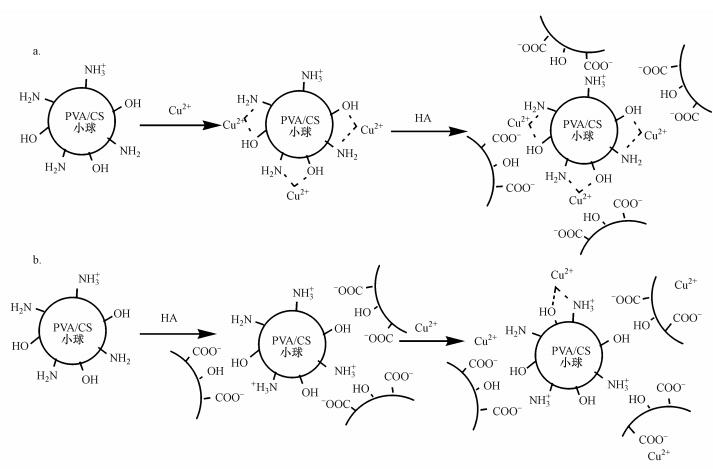 |
| 图 8 腐殖酸吸附到铜-小球(a)及铜离子吸附到腐殖酸-小球上(b)的机理 Fig. 8 Possible adsorption mechanism of HA on copper-beads (a) and copper on HA-beads |
在共存吸附实验中, 考虑到之前文献提到的:重金属会通过络合和静电引力等方式和腐殖酸结合(Alpatova et al., 2004).因此, 只是简单地测量反应前后溶液中重金属和腐殖酸的浓度的意义不大, 也无法真实反映重金属与腐殖酸之间的相互作用.因此, 在本实验中, 测试了不同浓度配比的重金属和腐殖酸在加入壳聚糖球前后的浓度变化情况(腐殖酸和铜离子的浓度关系见表 1), 以探究不同浓度配比及吸附质的加入对腐殖酸和铜离子去除的影响(图 9).图 9a显示, 曲线的总体趋势相似:铜的去除率先快速上升, 在达到一个最大值后开始下降.这说明当铜离子浓度固定时, 在低浓度的腐殖酸溶液中, 一小部分铜会和腐殖酸发生反应使腐殖酸分子团聚、沉降, 导致溶液中游离态的铜离子浓度降低.当腐殖酸的浓度逐渐增大时, 这种团聚现象越来越明显, 并在一定的浓度比值下达到最大, 超过这一最佳浓度比值后, 随着腐殖酸浓度的继续增加, 溶液中的游离态铜反而又开始增多.这主要是因为当铜和腐殖酸络合时, 铜离子会被腐殖酸分子包围, 而当腐殖酸的量过大时, 由于腐殖酸分子之间的相互作用, 导致以铜离子为核的Cu-HA配体间的作用力变弱, 引起配体的解散, 使铜离子又重新被释放到水体中成为游离态.此外, 从图 9a中还能看出, 不同的铜离子浓度对铜离子达到最佳去除条件下的腐殖酸、铜离子浓度比值也有影响:铜离子浓度为20 mg·L-1时, 在C(HA):C(Cu)=1时铜离子去除率最大;铜离子浓度为40 mg·L-1时, 在C(HA):C(Cu)=2时铜离子去除率最大.此外, 浓度还会影响铜离子所能达到的最大去除效率(40 mg·L-1时的最大去除效率为51.2%, 20 mg·L-1时的最大去除效率为23%).这是因为当铜离子浓度增加后, 就需要更多的腐殖酸才能引起Cu-HA络合体的解散, 同时解散过程也会变得更加困难.类似的趋势在以往的文献中也有提及(Alpatova et al., 2004; Haitzer et al., 2003).
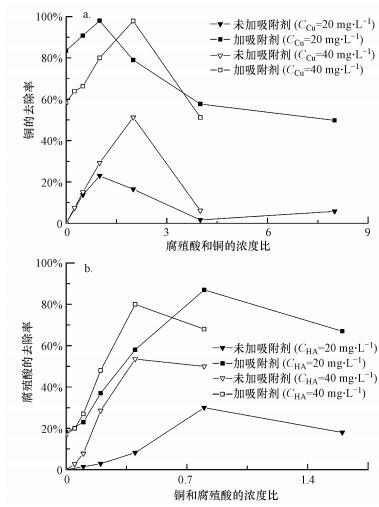 |
| 图 9 腐殖酸和铜离子的浓度比对溶液中铜离子(a)和腐殖酸(b)去除的影响 Fig. 9 Effect of HA to copper ratios on copper removal (a) and copper to HA ratios on HA removal (b) |
在铜和腐殖酸的混合溶液中加入PVA/CS小球后, 铜离子浓度的变化情况也反映在图 9a中.很明显, 其趋势与不加吸附质的变化趋势相似, 但铜离子的去除效率有很大的提升.对于这种结果, 一方面是因为一部分溶液中的游离态铜离子被PVA/CS小球吸附, 而还有另一部分铜离子和腐殖酸一起沉降了.之前提到, 在腐殖酸溶液中腐殖酸会与铜离子竞争PVA/CS小球上的吸附位点, 其次腐殖酸分子会在PVA/CS小球表面形成位阻, 这两方面的因素可以解释为什么在加入PVA/CS小球后, 铜离子的去除效率在高腐殖酸浓度下也出现了下降.
此外, 在腐殖酸-铜离子混合溶液复合体系中加入吸附质后, 观察到在溶液振荡24 h后, 锥形瓶底部出现了大的团聚体(图 10), 这使得上清液中腐殖酸的浓度大大降低.同时, 测量了反应前后上清液(不计团聚体)中腐殖酸浓度的变化(图 9b).观察去除率的曲线发现, 上清液中腐殖酸的减少量与溶液中铜和腐殖酸的浓度比值有很大的关系.因此, 根据前人研究的通过络合-絮凝过程同时去除重金属和腐殖酸(Hankins et al., 2006)可推测, 当加入吸附质后, 溶液中的Cu-HA复合结构被破坏.其原理可能是铜离子既能与腐殖酸中的羧、羟基络合, 又能与PVA/CS小球中的氨基络合, 并且很明显金属与氨基的络合能力要强于与羧基的络合能力.因此, 一旦将PVA/CS小球加到腐殖酸-铜复合体系中, 氨基会与羧基竞争与铜离子的络合, 一些原本与羧基络合的铜离子转而会与氨基络合, 而一旦这些以铜为核的络合体中的铜离子被吸附之后, 会导致原本与它络合的腐殖酸分子的表面电荷失衡, 变得不稳定, 在振荡的过程中会互相聚集, 形成大的团聚体沉降(图 10).
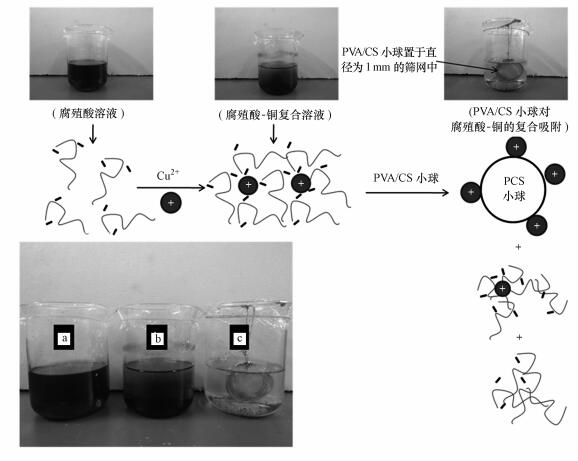 |
| 图 10 复合吸附过程腐殖酸和铜离子的去除机理(a.腐殖酸溶液, b.腐殖酸-铜离子混合溶液, c.混合溶液加入壳聚糖小球后) Fig. 10 The co-adsorption mechanisms of co-HA and copper(a.HA solution, b.HA-copper mixture solution, c.HA-copper solution after PCS beads addition) |
1) 在铜离子和腐殖酸单组分吸附实验中, PVA/CS小球对腐殖酸的吸附受pH影响较大, 并主要通过静电引力的方式相互作用;而PVA/CS小球对铜离子的吸附对pH的敏感度较小, 它们之间的主要作用方式是络合反应.
2) 在连续吸附实验中, PVA/CS小球表面吸附了腐殖酸之后会占用一部分吸附位点, 并形成一定的位阻, 从而会抑制对铜离子的连续吸附;而先吸附了铜离子之后能促进对腐殖酸的连续吸附, 因为它们之间能形成一种小球-Cu-HA的三元桥结构, 这也说明小球作为连续吸附剂是可行的.
3) 在复合吸附的实验中, 溶液中铜和腐殖酸的去除是吸附剂吸附和络合-沉淀共同作用的结果, 并且溶液中这两者的去除效率与腐殖酸和铜离子的浓度比密切相关.首先, 在未加入吸附剂之前, 铜离子就会通过简单络合自发地与溶液中的腐殖酸结合;其次, 加入PVA/CS小球后, 溶液中的铜离子和腐殖酸的去除率增加.这主要是因为一方面壳聚糖小球会吸附溶液中一部分游离的铜离子及一部分原先与腐殖酸结合的铜离子;另一方面, 当原先和腐殖酸结合的铜离子被PVA/CS小球吸附后, 使得腐殖酸因为电荷失衡而变得不稳定, 进而导致腐殖酸彼此之间互相聚集最终形成沉淀.
Alpatova A, Verbych S, Bryk M, et al. 2004. Ultrafiltration of water containing natural organic matter: heavy metal removing in the hybrid complexation-ultrafiltration process[J]. Separation & Purification Technology, 40(2): 155–162.
|
And A L, Gonzalez R D G. 2000. Modeling adsorption of copper(Ⅱ), cadmium(Ⅱ) and lead(Ⅱ) on purified humic acid[J]. Langmuir, 16(8): 3902–3909.
DOI:10.1021/la990607x
|
Chang Y C, Chen D H. 2005. Preparation and adsorption properties of monodisperse chitosan-bound Fe3O4, magnetic nanoparticles for removal of Cu(Ⅱ) ions[J]. Journal of Colloid & Interface Science, 283(2): 446–451.
|
Cho D W, Jeon B H, Chon C M, et al. 2011. Magnetic chitosan composite for adsorption of cationic and anionic dyes in aqueous solution[J]. Journal of Industrial & Engineering Chemistry, 28: 60–66.
|
曹飞丽, 肖蕾, 刘怡, 等. 2014. 白腐菌改性的中药渣对Cr(Ⅵ)的吸附性能[J]. 化工环保, 2014, 34(2): 186–190.
|
Dai J, Yang H, Yan H, et al. 2011. Phosphate adsorption from aqueous solutions by disused adsorbents: Chitosan hydrogel beads after the removal of copper(Ⅱ)[J]. Chemical Engineering Journal, 166(3): 970–977.
DOI:10.1016/j.cej.2010.11.085
|
Deng J H, Zhang X R, Zeng G M, et al. 2013. Simultaneous removal of Cd(Ⅱ) and ionic dyes from aqueous solution using magnetic graphene oxide nanocomposite as an adsorbent[J]. Chemical Engineering Journal, 226(8): 189–200.
|
Ding Z H, Hu X, Morales L, et al. 2014. Filtration and transport of heavy metals in graphene oxide enabled sand columns[J]. Chemical Engineering Journal, 257(8): 248–252.
|
Gong J L, Wang X Y, Zeng G M, et al. 2012. Copper (Ⅱ) removal by pectin-iron oxide magnetic nanocomposite adsorbent[J]. Chemical Engineering Journal, s185-186(1): 100–107.
|
Gong J L, Zhang Y L, Jiang Y, et al. 2015. Continuous adsorption of Pb(Ⅱ) and methylene blue by engineered graphite oxide coated sand in fixed-bed column[J]. Applied Surface Science, 330: 148–157.
DOI:10.1016/j.apsusc.2014.11.068
|
Haitzer M, Aiken G R, Ryan J N. 2003. Binding of mercury(Ⅱ) to aquatic humic substances: influence of pH and source of humic substances[J]. Environmental Science & Technology, 37(11): 2436–2441.
|
Hankins N P, Lu N, Hilal N. 2006. Enhanced removal of heavy metal ions bound to humic acid by polyelectrolyte flocculation[J]. Separation & Purification Technology, 51(1): 48–56.
|
Imyim A, Prapalimrungsi E. 2010. Humic acids removal from water by aminopropyl functionalized rice husk ash[J]. Journal of Hazardous Materials, 184(1): 775–781.
|
Jiang Y, Gong J L, Zeng G M, et al. 2016. Magnetic chitosan-graphene oxide composite for anti-microbial and dye removal applications[J]. International Journal of Biological Macromolecules, 82: 702–710.
DOI:10.1016/j.ijbiomac.2015.11.021
|
Lee S T, Mi F L, Shen Y J, et al. 2001. Equilibrium and kinetic studies of copper(Ⅱ) ion uptake by chitosan-tripolyphosphate chelating resin[J]. Polymer, 42(5): 1879–1892.
DOI:10.1016/S0032-3861(00)00402-X
|
Li J, Zhang S, Chen C, et al. 2016. Removal of Cu(Ⅱ) and fulvic acid by graphene oxide nanosheets decorated with Fe3O4 nanoparticles[J]. Acs Applied Materials & Interfaces, 4(9): 4991.
|
Lin J W, Zhan Y H. 2012. Adsorption of humic acid from aqueous solution onto unmodified and surfactant-modified chitosan/zeolite composites[J]. Chemical Engineering Journal, s200-202(16): 202–213.
|
刘芭. 2013. TiO2光催化杂化超滤膜对水中嗅味物质及腐殖酸去除的研究[D]. 上海: 上海交通大学
http://cdmd.cnki.com.cn/Article/CDMD-10248-1013022816.htm |
Liu Q, Yang B, Zhang L, et al. 2014. Adsorption of an anionic azo dye by cross-linked chitosan/bentonite composite[J]. International Journal of Biological Macromolecules, 72: 1129–1135.
|
Maghsoodloo S, Noroozi B, Haghi A K, et al. 2011. Consequence of chitosan treating on the adsorption of humic acid by granular activated carbon[J]. Journal of Hazardous Materials, 191(1/3): 380–387.
|
Mao L, Young S D, Bailey E H. 2015. Lability of copper bound to humicacid[J]. Chemosphere, 131: 201–208.
DOI:10.1016/j.chemosphere.2015.03.035
|
Moura M R D, Aouada F A, Avena-Bustillos R J, et al. 2009. Improved barrier and mechanical properties of novel hydroxypropyl methylcellulose edible films with chitosan/tripolyphosphate nanoparticles[J]. Journal of Food Engineering, 92(4): 448–453.
DOI:10.1016/j.jfoodeng.2008.12.015
|
Ngah W S W, Endud C S, Mayanar R. 2002. Removal of copper(Ⅱ) ions from aqueous solution onto chitosan and cross-linked chitosan beads[J]. Reactive & Functional Polymers, 50(2): 181–190.
|
Rao G P, Lu C, Su F. 2007. Sorption of divalent metal ions from aqueous solution by carbon nanotubes: A review[J]. Separation & Purification Technology, 58(1): 224–231.
|
Saito T, Koopal L K, van Riemsdijk W H, et al. 2004. Adsorption of humic acid on goethite: isotherms, charge adjustments, and potential profiles[J]. Langmuir, 20(3): 689–700.
DOI:10.1021/la034806z
|
Sheng G, Li J, Shao D, et al. 2010. Adsorption of copper(Ⅱ) on multiwalled carbon nanotubes in the absence and presence of humic or fulvic acids[J]. Journal of Hazardous Materials, 178(1/3): 333–340.
|
Tang W W, Zeng G M, Gong J L, et al. 2012. Simultaneous adsorption of atrazine and Cu (Ⅱ) from wastewater by magnetic multi-walled carbon nanotube[J]. Chemical Engineering Journal, s211-212(22): 470–478.
|
Travlou N A, Kyzas G Z, Lazaridis N K, et al. 2013. Functionalization of graphite oxide with magnetic chitosan for the preparation of a nanocomposite dye adsorbent[J]. Langmuir the Acs Journal of Surfaces & Colloids, 29(5): 1657–1668.
|
Wan N W, Hanafiah M A, Yong S S. 2008. Adsorption of humic acid from aqueous solutions on crosslinked chitosan-epichlorohydrin beads: kinetics and isotherm studies[J]. Colloids & Surfaces B Biointerfaces, 65(65): 18–24.
|
Wang M, Liao L, Zhang X, et al. 2012. Adsorption of low concentration humic acid from water by palygorskite[J]. Applied Clay Science, s 67-68(5): 164–168.
|
Wen Y, Tang Z, Chen Y, et al. 2012. Adsorption of Cr(Ⅵ) from aqueous solutions using chitosan-coated fly ash composite as biosorbent[J]. Chemical Engineering Journal, 175(22): 110–116.
|
Yan W L, Bai R. 2005. Adsorption of lead and humic acid on chitosan hydrogel beads[J]. Water Research, 39(4): 688–698.
DOI:10.1016/j.watres.2004.11.007
|
Yang S, Li L, Pei Z, et al. 2014. Effects of humic acid on copper adsorption onto few-layer reduced graphene oxide and few-layer graphene oxide[J]. Carbon, 75(10): 227–235.
|
Zhang J, Gong J L, Zenga G M, et al. 2016. Simultaneous removal of humic acid/fulvic acid and lead from landfill leachate using magnetic graphene oxide[J]. Applied Surface Science, 370: 335–350.
DOI:10.1016/j.apsusc.2016.02.181
|
Zheng X, Zang W C, Yan Z G, et al. 2015. Species sensitivity analysis of heavy metals to freshwater organisms[J]. Ecotoxicology, 24(7): 1621–1631.
|
Zhu Y H, Hu J, Wang J L. 2014. Removal of Co2+from radioactive wastewater by polyvinyl alcohol (PVA)/chitosan magnetic composite[J]. Progress in Nuclear Energy, 71: 172–178.
DOI:10.1016/j.pnucene.2013.12.005
|
 2017, Vol. 37
2017, Vol. 37


