随着世界各国核电的快速发展,铀矿的需求量越来越大,而铀矿的开采和铀水冶过程中会产生大量的含铀废水(Pinto et al., 2004).含铀废水不仅会污染地表水,还会渗透进入地下污染地下水(Bhalara et al., 2014),同时会进入生物体内,从而造成很大的危害(Gajski et al., 2015),因此,铀污染水体的修复问题亟待研究解决.目前,含铀废水的处理方法主要有化学沉淀法、离子交换法、吸附法等(Song et al., 2012;Jing et al., 2016;Banerjee et al., 2014),但这些修复方法也存在各种问题,如吸附法成本高且不适合处理大量废水,化学沉淀法操作强度较大且易造成二次污染.植物修复作为一种新兴的修复技术,具有投资和维护成本低、环境友好、操作简便等优点(Li et al., 2012).如Pratas等(2012)在葡萄牙中部的含铀地区收集了28种水生植物,并测量了其对铀的吸附量,最后基于铀的浓度、富集量和生物生产量,发现水生植物马水齿的生物富集量最高,达到1948.41 mg·kg-1.Srivastava等(2010)发现,沉水植物黑藻对铀有良好的吸附能力,在100 mg·L-1铀浓度下黑藻中铀的生物富集量(干重)最高可达78 mg·kg-1.Silva等(2009)利用马尾藻吸附废水中的铀,去除率最高可达到64%.Pratas等(2014)研究发现,在初始铀浓度为500 μg·L-1的水培液中进行实验,2周后溶液中铀浓度降到72.3 μg·L-1,其中,水生植物水马齿和篦齿眼子菜对铀的生物富集量分别可达到1567和1588 mg·kg-1.
铀在水中的形态对植物富集水中的铀具有很大的影响(Markich et al., 2002).低pH值条件下,水溶液中铀的主要形态为铀酰离子(UO22+)(Ragnarsdottir et al., 2000),这一形态稳定且容易迁移.当pH值升高,水溶液中的UO22+会趋向于水解成氢氧化复合物UO2(OH)x(Ebbs et al., 1998).Lee和Yang(2010)研究了向日葵和豌豆在不同pH值条件下对应的不同形态铀影响下对含铀地下水的修复能力,发现这两种植物的最大修复效率出现在pH为3~5的条件下,且修复效率超过了90%.如果溶液中存在无机阳离子,如碳酸盐、磷酸盐、天然有机酸等,铀会与之形成配合物,进而影响植物对铀的吸收(Laurette et al., 2012).Greene等(1986)和Nakajima等(1979)的研究表明,当pH值和水的硬度保持不变时,随着碳酸盐浓度的增加,单细胞藻类(C. regularis和C.vulgaris)吸附铀的量逐渐降低;当溶液中存在磷酸盐,其会与铀形成沉淀并导致铀的生物富集量降低(Misson et al., 2009;Mkandawire et al., 2007).
满江红是一种蕨-藻共生的水生植物,由于其具有很强的固氮能力,长期以来作为稻田的绿肥使用(唐龙飞等, 2000).Arora等(2006)和Rai等(2008)研究发现,满江红对水体中的重金属具有很强的富集能力.还有研究表明,满江红对铀同样具有很强的富集能力,例如,胡南等(2012)研究发现,满江红和鱼腥藻的共生体系对水体中的铀具有较好的去除作用.但目前尚未开展满江红对不同形态的铀的吸附行为研究.因此,本文采用Visual MINTEQ 3.1软件模拟不同条件下溶液中铀的形态变化,同时,根据模拟计算的结果,配制UO22+、(UO2)3(OH)5+、UO2(OH)3-、UO2(CO3)34-和UO2PO4- 5种不同形态的含铀溶液,再通过水培实验研究满江红对上述5种不同形态铀的吸附行为,以期为进一步提高满江红去除水中铀的效率提供新的思路和理论依据.
2 材料与方法(Materials and methods) 2.1 满江红的获取从湖南省衡阳市郊外采集回野生满江红(Azolla anabaena),先用自来水冲洗干净,再用去离子水冲洗3遍,然后放入改良的Hoagland培养液(胡南等, 2012)中进行预培养,2周后取出预培养的满江红进行实验.
2.2 水培实验方法水培实验在2 L的烧杯中进行,分为A、B、C、D、E、F共6组,其中,F组为对照组,其他组为实验组.实验组中加的铀是硝酸双氧铀(UO2(NO3)2·6H2O),初始铀浓度为2 mg·L-1,对照组不加铀.实验组和对照组都加入3 g满江红,同时每个组均设定3个平行组,加入溶液体积共1 L.实验使用盐酸和氢氧化钠调节pH,A、B、C 3组的pH分别调整为4.0、6.5和10.5,D、E组中分别加入10 mmol·L-1碳酸钠(Na2CO3)和1 mmol·L-1磷酸氢二钾(K2HPO4).整个培养过程全部在温室中进行,白天温度设定为25 ℃,夜晚设定为22 ℃,光暗周期为12 h:12 h,空气湿度保持在80%左右.实验过程中每隔3 d取一次水样测量水中铀的浓度并计算水中铀的去除率,15 d后取出所有萍体,使用滤纸吸干植物表面水分称其鲜重,计算植株的平均生长抑制率及对铀的生物富集量.
2.3 样品处理方法取得的水样用离心机以3000 r·min-1的转速沉淀水中的悬浮物5 min,取其上清液直接进行铀浓度的测定.
植物样品中铀的检测步骤参照文献(Pan et al., 2016):① 先用自来水冲洗植株体上的水培液,再浸泡在10 mmol·L-1的Na2CO3溶液中12 h,之后用去离子水冲洗5遍,放在室温下风干;② 风干后的样品放入80 ℃的烘烤箱中烘烤72 h后,用研钵磨碎;③ 准确称取0.05 g干重植物样,放入聚四氟乙烯管中进行消解,最后将消解溶液定容至100 mL,待测.植物体内的铀含量以干重(mg·kg-1)计算.
2.4 样品测量方法及试剂水中和植物样品中铀含量的检测按照标准方法(EJ 267. 4-1984) 进行,采用三正辛基氧膦萃取分离、2-(5-溴-2-吡啶偶氮)-5-乙氨基苯酚分光光度法测定样品的铀含量.低浓度含铀样品使用电感耦合等离子体质谱仪(ICP-MS)测量.实验所用试剂均为优级纯.
2.5 不同形态铀溶液的配置为了找到不同形态铀所需要的实验条件,采用Visual MINTEQ 3.1软件模拟计算溶液中不同铀形态所占的比例.首先使用软件模拟计算了初始铀浓度为2 mg·L-1,不同pH条件下溶液中铀的不同形态所占的比例,其变化如图 1所示:在pH<5.0时,溶液中铀的主要形态为UO22+;在pH=5.0~8.5时,溶液中铀的主要形态为(UO2)3(OH)5+;在pH=8.5~12.0时,溶液中铀的主要形态为UO2(OH)3-.由图 1可知,在pH为1.0、6.5、10.5条件下对应的铀形态在溶液中所占比例达到最大,分别为占99.99%(UO22+)、74.73%((UO2)3(OH)5+)和97.2%(UO2(OH)3-).但从pH=2.5、铀浓度为2 mg·L-1条件下进行的水培预实验可知,满江红不能在这一条件下存活超过10 d,而在pH=4.0时,满江红的存活时间大大延长,同时这一条件下溶液中的主要铀形态仍为UO22+,其所占比例也达到94%,与pH=1.0条件下相差不大.因此,选择了3种不同的铀形态作为实验条件,即UO22+、(UO2)3(OH)5+和UO2(OH)3-,其对应的实验条件为pH=4.0、pH=6.5和pH=10.5.
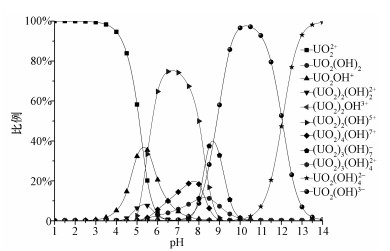 |
| 图 1 去离子水中不同形态铀所占比例随pH值变化的模拟结果(铀浓度2 mg·L-1) Fig. 1 Simulated variation of different species of uranium in deionized water with pH(the total concentration of U is 2 mg·L-1) |
然后,使用软件模拟计算了初始铀浓度2 mg·L-1、pH=7,不同浓度碳酸盐或磷酸盐条件下溶液中铀的不同形态所占的比例.由图 2可知,溶液中各形态铀所占比例随碳酸盐浓度的逐渐升高而不断变化,在10 mmol·L-1碳酸钠条件下,主要铀形态为UO2(CO3)34-,其所占比例达到最高(70.33%);磷酸酸盐浓度在大于0.2 mmol·L-1后,溶液中铀的主要形态为UO2PO4-,其所占比例基本保持不变,最高可达80%以上.因此,选择了2种不同的铀形态作为实验条件,即UO2(CO3)34-和UO2PO4-,其对应的实验条件为pH=7,分别加入10 mmol·L-1的碳酸钠和1 mmol·L-1的磷酸氢二钾.
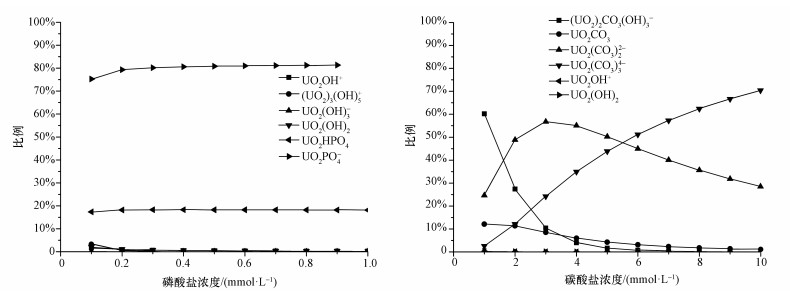 |
| 图 2 模拟加入不同浓度磷酸盐或碳酸盐条件下不同铀形态所占比例的变化(pH=7,铀浓度2 mg·L-1) Fig. 2 Simulated variation of different species of uranium in deionized water at pH=7 with the concentration of phosphate or carbonate(total concentration of U is 2 mg·L-1) |
生物富集量(BW)是单位质量的植物组织(干重)在一定的铀浓度溶液中所富集的铀的质量,它反映的是单位质量的植物所能富集的最大铀的质量.
生物富集系数(BCF)是组织植物(干重)中铀的含量和溶解在水中的轴浓度之比,用来表示植物对一定铀浓度的溶液中铀的富集能力,其计算公式为:
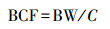
|
(1) |
式中,BW为生物富集量(mg·kg-1),C为水中铀的浓度(mg·L-1).
2.7 生长抑制率生长抑制率(G)是指与对照组相比,铀胁迫组中植株生长所受到的抑制程度,其计算公式如下:
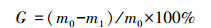
|
(2) |
式中,m0为对照组植株的质量(g),m1为铀胁迫组植株的质量(g).
2.8 统计学分析采用SPSS 18.0软件对数据进行方差分析,p<0.05表示差异显著,试验结果以平均值±标准误差表示.
3 结果与讨论(Results and discussion) 3.1 不同形态铀条件下满江红的生长抑制率实验设置初始铀浓度为2 mg·L-1,在5种不同形态铀的胁迫下,满江红的生长抑制率如图 3所示.从图 3可以看出,在水培条件为pH=4.0、6.5、10.5和碳酸盐时,即在主要铀形态分别为UO22+、(UO2)3(OH)5+、UO2(OH)3-和UO2(CO3)34-时,满江红在铀胁迫下的生长均受到不同程度的抑制.在主要铀形态为UO22+时,满江红生长受到的抑制最大,达到56.87%;其次是主要铀形态为UO2(OH)3-时,达到40.54%;在主要铀形态为(UO2)3(OH)5+时,满江红生长受到的抑制最小,只有11.96%;而主要铀形态为UO2PO4-时,满江红的生长反而受到了促进,达到了28.71%.这是由于溶液中加入磷元素能显著促进满江红的生长(陈坚, 2003).由此可知,满江红在5种不同形态铀条件下的生长抑制率差异显著,UO22+、(UO2)3(OH)5+、UO2(OH)3-、UO2(CO3)34- 4种形态均能抑制满江红的生长,其中,UO22+对满江红的生长抑制率最高,而UO2PO4-可以促进满江红的生长.
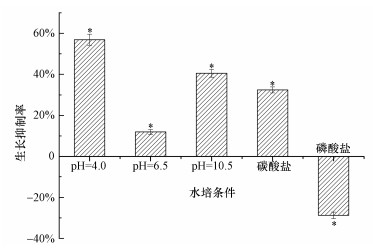 |
| 图 3 满江红在浓度为2 mg·L-1的铀溶液胁迫下的生长抑制率(*p<0.05) Fig. 3 Inhibitory rates on the Azolla anabaena under the stress of uranium solutions with the uranium concentration of 2 mg·L-1 |
在实验初始铀浓度为2 mg·L-1时,投加满江红后,水培条件下5种不同形态铀的浓度变化如图 4所示.由图 4可知,在水培条件为pH=4.0和pH=7.0条件下,即主要铀形态为UO22+和(UO2)3(OH)5+条件下,水培液中铀的浓度在前3 d就降低了大约75%,之后铀浓度的下降趋于平缓.经过15 d的水培实验,水培液中铀浓度降得最低的是在主要铀形态为UO22+条件下,只有143 μg·L-1,满江红对水中铀的去除率达到92.9%.主要铀形态为(UO2)3(OH)5+条件下,水培液中铀的浓度同样降得很低,达到了220 μg·L-1,满江红对水中铀的去除率达到89%.说明主要铀形态为UO22+和(UO2)3(OH)5+条件下,满江红去除水中铀的效果非常好.这可能是由于UO22+和(UO2)3(OH)5+形态均为金属阳离子,容易被植物细胞吸收,而满江红吸附铀的量越大,水中剩余铀的量就越少.
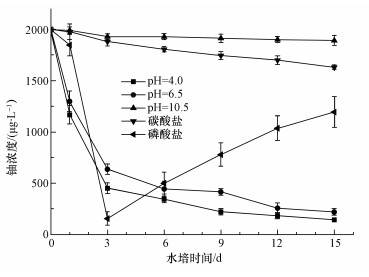 |
| 图 4 投放满江红后不同水培液中铀浓度的变化 Fig. 4 Variation of uranium concentrations in different hydroponic solutions where Azolla anabaena was cultivated |
从图 4可以看出,水培液中pH=10.5和碳酸盐条件下,即主要铀形态为UO2(OH)3-和UO2(CO3)34-条件下铀浓度的下降趋势平缓且最终溶液中的铀浓度都非常高,分别为1892 μg·L-1和1631 μg·L-1,而满江红对水中铀的去除率分别只有5.4%和18.5%.说明主要铀形态为UO2(OH)3-和UO2(CO3)34-条件下,满江红去除水中铀的效率非常低.这是可能是由于UO2(OH)3-和UO2(CO3)34-形态均为含铀金属阴离子,植物细胞不容易吸收,而满江红吸附铀的量越少,水中剩余铀的量就越多.从图 4还可以看出,水培液中加入磷酸盐条件下,即主要铀形态为UO2PO4-时,铀浓度在第3 d就下降到了最低(156 μg·L-1),之后水培液中的铀浓度逐渐增加,15 d后达到1194 μg·L-1.铀浓度之所以在第3 d降到最低是由于磷酸盐与铀形成了沉淀,而在之后铀浓度升高可能是因为满江红在生长过程中根部分泌了有机酸(Huang et al., 2016;Bertin et al., 2003),磷酸盐和铀形成的配合物又重新溶解在溶液中.因此,要提高满江红对水中铀的去除率,应该调控溶液中铀的主要形态为UO22+或(UO2)3(OH)5+,同时降低溶液中碳酸盐和磷酸盐的含量.
3.3 不同形态铀条件下的生物富集量和生物富集系数表 1为满江红对5种不同形态铀(初始铀浓度2 mg·L-1)的生物富集量和生物富集系数.在水培条件为pH=4.0,即铀的主要形态为UO22+的条件下,满江红的生物富集量和生物富集系数最大,分别为3831 mg·kg-1和1916,说明当铀的主要形态为UO22+时满江红富集铀的能力最强.其次是在水培条件为pH=6.5,即铀的主要形态为(UO2)3(OH)5+的条件下,满江红的生物富集量和生物富集系数分别达到了3057 mg·kg-1和1529,这与铀的主要形态为UO22+时的生物富集量和生物富集系数相差不大,说明满江红对这一形态的铀同样具有很强的富集能力.这可能是由于UO22+和(UO2)3(OH)5+均为含铀金属阳离子,易于被植物细胞吸收,从而增加了满江红吸附铀的量.Laurette等(2012)研究了不同形态铀对油菜、向日葵、小麦的影响,发现当铀的主要形态为UO22+时,油菜、向日葵、小麦根部的生物富集量都很大.Du等(2016)研究了当铀的主要形态分别为UO22+、(UO2)3(OH)5+和UO2(OH)3-时两种东南景天植物富集铀的行为,发现植物对这3种不同形态铀的富集有显著差异.其中,变种东南景天在pH=6.5的水培条件下,即铀的主要形态为(UO2)3(OH)5+的条件下,根部生物富集量最高,达到3.7×104 mg·kg-1;而在pH=10.5的水培条件下,即铀的主要形态为UO2(OH)3-的条件下富集铀的能力最差,其生物富集量和生物富集系数最低分别只有122 mg·kg-1和61.在加入10 mmol·L-1碳酸钠,调节pH=7.0的条件下,即铀的主要形态为UO2(CO3)34-条件下,满江红的生物富集量和生物富集系数很低,分别为622 mg·kg-1和311,说明满江红富集铀的能力受到了很大抑制.这可能是由于UO2(OH)3-和UO2(CO3)34-均为含铀金属阴离子,植物细胞不容易吸收,从而减少了满江红吸附铀的量.Du等(2016)的研究表明,UO2(OH)3-和UO2(CO3)34-会抑制两种东南景天富集铀的能力.在加入1 mmol·L-1磷酸氢二钾,调节pH=7.0的条件下,即铀的主要形态为UO2PO4-的条件下,满江红的生物富集量和生物富集系数极低,分别只有132 mg·kg-1和66,说明满江红富集铀的能力受到了极大的抑制.这应该是由于磷酸盐与铀形成了难溶的配合物且UO2PO4-为含铀金属阴离子.Misson等(2009)和Mkandawire等(2007)的研究也表明,磷酸盐会抑制植物富集铀的能力.因此,如果要提高满江红富集铀的量,应该将溶液中铀的主要形态调控为UO22+或(UO2)3(OH)5+,同时要降低溶液中碳酸盐和磷酸盐的含量.
| 表 1 满江红对不同水培液中铀的生物富集量及生物富集系数 Table 1 Bioaccumulation amount and bioaccumulation factor by Azolla anabaena for uranium in different hydroponic solutions |
1) 5种不同形态铀对满江红的生长抑制率有显著差异,UO22+、(UO2)3(OH)5+、UO2(OH)3-及UO2(CO3)34-均能抑制满江红的生长,其中,UO22+对满江红的生长抑制率最高,而UO2PO4-则可以促进满江红的生长.
2) 满江红对UO22+和(UO2)3(OH)5+的吸附效率相对较高,对UO22+的富集量和富集系数分别达到了3831 mg·kg-1和1916,对(UO2)3(OH)5+的富集量和富集系数分别达到了3057 mg·kg-1和1529.
3) 要提高满江红对水中铀的去除率和满江红富集铀的量,应将溶液中铀的形态调控为以UO22+或(UO2)3(OH)5+为主,同时要降低溶液中碳酸盐和磷酸盐的浓度.
Allan D L, Jarrell W M. 1989. Proton and copper adsorption to maize and soybean root cell walls[J]. Plant Physiology, 89(3): 823–832.
DOI:10.1104/pp.89.3.823
|
Arora A, Saxena S, Sharma D K. 2006. Tolerance and phytoaccumulation of chromium by three Azolla species[J]. World Journal of Microbiology and Biotechnology, 22(2): 97–100.
DOI:10.1007/s11274-005-9000-9
|
Banerjee C, Dudwadkar N, Tripathi S C, et al. 2014. Nano-cerium vanadate:A novel inorganic ion exchanger for removal of americium and uranium from simulated aqueous nuclear waste[J]. Journal of Hazardous Materials, 280: 63–70.
DOI:10.1016/j.jhazmat.2014.07.026
|
Bertin C, Yang X, Weston L A. 2003. The role of root exudates and allelochemicals in the rhizosphere[J]. Plant and Soil, 256(1): 67–83.
DOI:10.1023/A:1026290508166
|
Bhalara P D, Punetha D, Balasubramanian K. 2014. A review of potential remediation techniques for uranium(Ⅵ) ion retrieval from contaminated aqueous environment[J]. Journal of Environmental Chemical Engineering, 2(3): 1621–1634.
DOI:10.1016/j.jece.2014.06.007
|
陈坚. 2003. 满江红在不同培养条件下的生产性能及其与营养成分变化的关系[J]. 植物营养与肥料学报, 2003, 9(4): 467–472.
DOI:10.11674/zwyf.2003.0417 |
Du L, Feng X, Huang Z, et al. 2016. The effect of U speciation in cultivation solution on the uptake of U by variant Sedum alfredii[J]. Environmental Science and Pollution Research, 23(10): 9964–9971.
DOI:10.1007/s11356-016-6226-z
|
Ebbs S D, Brady D J, Kochian L V. 1998. Role of uranium speciation in the uptake and translocation of uranium by plants[J]. Journal of Experimental Botany, 49(324): 1183–1190.
DOI:10.1093/jxb/49.324.1183
|
Gajski G, Oreščanin V, Geric' M, et al. 2015. Toxicity assessment of the water used for human consumption from the Cameron/Tuba City abandoned uranium mining area prior/after the combined electrochemical treatment/advanced oxidation[J]. Environmental Science and Pollution Research, 22(1): 516–526.
DOI:10.1007/s11356-014-3376-8
|
Greene B, Henzl M T, Hosea J M, et al. 1986. Elimination of bicarbonate interference in the binding of U(Ⅵ) in mill-waters to freeze-dried Chlorella vulgaris[J]. Biotechnology and Bioengineering, 28(5): 764–767.
DOI:10.1002/(ISSN)1097-0290
|
胡南, 丁德馨, 李广悦, 等. 2012. 五种水生植物对水中铀的去除作用[J]. 环境科学学报, 2012, 32(7): 1637–1645.
|
Huang G, Guo G, Yao S, et al. 2016. Organic acids, amino acids compositions in the root exudates and Cu-accumulation in castor(Ricinus communis L.) Under Cu stress[J]. International Journal of Phytoremediation, 18(1): 33–40.
DOI:10.1080/15226514.2015.1058333
|
Jing C, Li Y L, Landsberger S. 2016. Review of soluble uranium removal by nanoscale zero valent iron[J]. Journal of Environmental Radioactivity, 164: 65–72.
DOI:10.1016/j.jenvrad.2016.06.027
|
Laurette J, Larue C, Llorens I, et al. 2012. Speciation of uranium in plants upon root accumulation and root-to-shoot translocation:A XAS and TEM study[J]. Environmental and Experimental Botany, 77: 87–95.
DOI:10.1016/j.envexpbot.2011.11.005
|
Laurette J, Larue C, Mariet C, et al. 2012. Influence of uranium speciation on its accumulation and translocation in three plant species:oilseed rape, sunflower and wheat[J]. Environmental and Experimental Botany, 77: 96–107.
DOI:10.1016/j.envexpbot.2011.11.007
|
Lee M, Yang M. 2010. Rhizofiltration using sunflower(Helianthus annuus L.) and bean(Phaseolus vulgaris L.var.vulgaris) to remediate uranium contaminated groundwater[J]. Journal of Hazardous Materials, 173(1/3): 589–596.
|
Li J, Zhang Y. 2012. Remediation technology for the uranium contaminated environment:a review[J]. Procedia Environmental Sciences, 13: 1609–1615.
DOI:10.1016/j.proenv.2012.01.153
|
Markich S J. 2002. Uranium speciation and bioavailability in aquatic systems:an overview[J]. The Scientific World Journal, 2: 707–729.
DOI:10.1100/tsw.2002.130
|
Misson J, Henner P, Morello M, et al. 2009. Use of phosphate to avoid uranium toxicity in Arabidopsis thaliana leads to alterations of morphological and physiological responses regulated by phosphate availability[J]. Environmental and Experimental Botany, 67(2): 353–362.
DOI:10.1016/j.envexpbot.2009.09.001
|
Mkandawire M, Vogel K, Taubert B, et al. 2007. Phosphate regulates uranium(Ⅵ) toxicity to Lemna gibba L.G3[J]. Environmental Toxicology, 22(1): 9–16.
DOI:10.1002/(ISSN)1522-7278
|
Nakajima A, Horikoshi T, Sakaguchi T. 1979. Ion effects on the uptake of uranium by Chlorella regularis[J]. Agricultural and Biological Chemistry, 43(3): 625–629.
|
Nie X, Dong F, Liu N, et al. 2014. An investigation on the subcellular distribution and compartmentalization of uranium in Phaseolus vulgaris L.[J]. Journal of Radioanalytical and Nuclear Chemistry, 299(3): 1351–1357.
DOI:10.1007/s10967-013-2859-2
|
Pan C, Hu N, Ding D, et al. 2016. An experimental study on the synergistic effects between Azolla and Anabaena in removal of uranium from solutions by Azolla-anabaena symbiotic system[J]. Journal of Radioanalytical and Nuclear Chemistry, 307(1): 385–394.
DOI:10.1007/s10967-015-4161-y
|
Pratas J, Favas P J, Paulo C, et al. 2012. Uranium accumulation by aquatic plants from uranium-contaminated water in central Portugal[J]. International Journal of Phytoremediation, 14(3): 221–234.
DOI:10.1080/15226514.2011.587849
|
Pratas J, Paulo C, Favas P J C, et al. 2014. Potential of aquatic plants for phytofiltration of uranium-contaminated waters in laboratory conditions[J]. Ecological Engineering, 69: 170–176.
DOI:10.1016/j.ecoleng.2014.03.046
|
Pinto M M S C, Silva M M V G, Neiva A M R. 2004. Pollution of water and stream sediments associated with the Vale De Abrutiga Uranium Mine, Central Portugal[J]. Mine Water and the Environment, 23(2): 66–75.
DOI:10.1007/s10230-004-0041-3
|
Ragnarsdottir K V, Charlet L, Cotter Howells J D, et al. 2000. Uranium Behaviour in Natural Environments//Environmental Mineralogy:Microbial Interactions, Anthropogenic Influences, Contaminated Land and Waste Management[M]. Washington: Mineralogical Society of America: 245–289.
|
Rai P K. 2008. Technical note:Phytoremediation of Hg and Cd from industrial effluents using an aquatic free floating macrophyte Azolla Pinnata[J]. International Journal of Phytoremediation, 10(5): 430–439.
DOI:10.1080/15226510802100606
|
Rauser W E. 1999. Structure and function of metal chelators produced by plants[J]. Cell Biochemistry and Biophysics, 31(1): 19–48.
DOI:10.1007/BF02738153
|
Rodrigues Silva J I, de Melo Ferreira A C, Da Costa A C A. 2009. Uranium biosorption under dynamic conditions:Preliminary tests with Sargassum filipendula in real radioactive wastewater containing Ba, Cr, Fe, Mn, Pb, Ca and Mg[J]. Journal of Radioanalytical and Nuclear Chemistry, 279(3): 909–914.
DOI:10.1007/s10967-008-7366-5
|
Shahandeh H, Hossner L R. 2002. Enhancement of uranium phytoaccumulation from contaminated solis[J]. Soil Science, 167(4): 269–280.
DOI:10.1097/00010694-200204000-00004
|
Song M, Wang Q, Meng Y. 2012. Removal of UO22+ from aqueous solution by plasma functionalized MWCNTs[J]. Journal of Radioanalytical and Nuclear Chemistry, 293(3): 899–906.
DOI:10.1007/s10967-012-1751-9
|
Srivastava S, Bhainsa K C, D'Souza S F. 2010. Investigation of uranium accumulation potential and biochemical responses of an aquatic weed Hydrilla verticillata(L.f.) Royle[J]. Bioresource Technology, 101(8): 2573–2579.
DOI:10.1016/j.biortech.2009.10.054
|
唐龙飞, 黄毅斌, 翁伯奇, 等. 2000. 稻田高效、低耗、低污染的持续农业模式研究[J]. 中国农业科学, 2000, 33(3): 60–66.
|
徐柏森, 张耀丽, 何开跃, 等. 2006. 植物透射电镜样品制备技术探讨[J]. 中国野生植物资源, 2006, 25(3): 41–43.
|
 2017, Vol. 37
2017, Vol. 37


