农作物秸秆如稻草、麦秆和甘蔗渣等富含纤维素作物是一种重要的可再生资源, 全世界每年的秸秆产量约为22亿t(Kim et al., 2004), 我国每年约产农作物秸秆7亿t(徐杰等, 2008).农作物秸秆除小部分用于堆肥和作为畜禽饲料外, 大部分被随意烧毁, 这不仅浪费了宝贵的资源, 而且还污染了环境(Cheng et al., 2013).目前, 微生物法降解农作物秸秆因具有经济、有效的优势而被人们广泛关注(顾文杰等, 2012;张建峰等, 2016).在过去的几十年里, 国内外学者陆续发现了一些能够降解纤维素的微生物, 如真菌类中的毛霉属(文自兰等, 2015)、白腐菌(Doddapaneni et al., 2005)等, 放线菌类中的链霉菌属(邓辉等, 2013;冯红梅等, 2016)、小单胞菌属(Kasusar et al., 2011)等, 以及细菌类中的芽孢杆菌属(王贤丰等, 2015)、假单胞菌属(尚晓瑛等, 2012)等.在微生物降解纤维素的实际应用中, 常采用纤维素降解混合菌群的方式, 以堆肥或沤肥的形式来降解农作物秸秆中的纤维素(梁东丽等, 2009), 该过程周期较长且降解不充分.近年来, 虽然人工诱变和基因修饰(Fujii et al., 2013)等生物工程技术逐渐应用于纤维素降解菌改造中以提高菌株的产纤维素酶能力, 但获得的菌株仍然存在产酶量少、酶活力低等问题.因此, 筛选新型纤维素降解微生物, 寻找最佳纤维素降解途径, 遗传改造已有纤维素降解菌将逐渐成为研究的热点.
基于此, 本研究采用单一碳源的选择性培养基, 通过定向驯化的方法, 从恩施土家族苗族自治区原始森林的腐木中筛选分离得到1株产纤维素酶细菌Arthrobacter oryzae HW-17, 对该细菌进行初步的分类鉴定, 研究环境因子对该菌株产纤维素酶的影响及该菌株对不同纤维素样品降解的效果.此外, 拟通过混合纤维素样品发酵方式提高该细菌产纤维素酶能力, 以期为该菌株实际的应用奠定理论基础.
2 材料与方法(Materials and methods) 2.1 主要培养基基础培养基(g·L-1):羧甲基纤维素钠(CMC-Na)10.0, KH2PO4 2.0, NH4Cl 5.0, MgSO4·7H2O 0.5, pH=7.0~7.2(王贤丰等, 2015).
富集培养基(g·L-1):羧甲基纤维素钠(CMC-Na)10.0, KH2PO4 2.0, 胰蛋白胨5.0, MgSO4·7H2O 0.5, pH=7.0~7.2.
牛肉膏蛋白胨培养基(g·L-1):牛肉膏3.0, 胰蛋白胨10.0, NaCl 5.0, pH=7.0~7.2.
2.2 菌株驯化与群落结构分析剪取少量采集到的腐木, 加入到100 mL基础培养基中, 30 ℃、200 r·min-1下培养7 d.吸取10 mL上述驯化结束后的菌液(NJ-F30), 加入至新的100 mL基础培养基中, 于30 ℃或50 ℃、200 r·min-1下培养7 d, 驯化后的菌液分别记为NJ-S30和NJ-S50.
分别吸取5 mL NJ-F30、NJ-S30和NJ-S50送于上海美吉生物医药科技有限公司进行高通量测序, 以确定来源于腐木的微生物在不同驯化条件下微生物群落结构的变化.
2.3 菌株筛选纯化与鉴定将驯化后的菌液(NJ-S30) 进行梯度稀释, 吸取10-5、10-6、10-7和10-8稀释度的菌液各0.1 mL, 均匀涂布于CMC-Na固体平板上, 然后置于30 ℃下培养2~3 d.挑取平板上透明圈直径较大的单菌落, 划线于CMC-Na固体平板上, 依此挑取单菌落划线传代培养6次.
菌株生理生化试验参照文献(东秀珠等, 2001), 采用TIANGEN DNA提取试剂盒(天根生化科技, 北京)提取细菌总DNA.使用细菌通用引物(Lane, 1991)(27F, 5′-AGA GTT TGA TCC TGG CTC AG-3′; 1492R, 5′-GGT TAC CTT GTT ACG ACT T-3′)来扩增菌株HW-17 16S rDNA基因.PCR产物经纯化后送于武汉擎科创新生物科技有限公司测序.将测得的16S rDNA序列上传至NCBI中与已知的16S rDNA比对, 使用MEGA6(Tamura et al., 2013)软件构建系统进化树.
2.4 菌株纤维素降解能力测定挑取上述纯化的单菌落, 接种于100 mL牛肉膏蛋白胨培养基中, 30 ℃下培养16 h.将菌液于6000 r·min-1下离心10 min, 用无菌水重悬菌株至菌液OD600值为1, 该溶液作为菌株种子菌液备用, 并采取1%的接种率应用于后续实验中.
将菌株种子溶液(OD600=1) 接种至基础培养基中, 30 ℃、200 r·min-1下培养7 d, 每隔1 d测定菌液OD600值与上清液中纤维素酶活, 纤维素酶活的测定采用3, 5-二硝基水杨酸(DNS)法(郝月等, 2005).吸取2 mL菌液, 于12000 r·min-1下离心2 min, 吸取1 mL离心后的上清液, 加入1 mL 0.5% CMC-Na溶液, 于50 ℃下温育30 min后以DNS法测定葡萄糖质量浓度.
纤维素酶活力定义:在50 ℃下, 1 mL酶液每分钟催化底物产生1 μg葡萄糖为1个酶活力单位, 以U·mL-1表示.
2.5 菌株最适生长及产酶条件的确定在探究最适氮源实验中, 分别将胰蛋白胨(Tryptone)、蛋白胨(Peptone)、酵母浸出物、干酪素、NaNO2、KNO3、NH4Cl或甘氨酸按1% (W/V, g/mL)的比例加入到不含NH4Cl的基础培养基中.将菌株接种至上述8种培养基(pH=7) 中, 30 ℃、200 r·min-1下培养24 h;在探究最适碳源实验中, 分别将葡萄糖、蔗糖、淀粉、麦芽糖、海藻糖、D-木糖、甘露醇或山梨醇按1% (W/V, g/mL)的比例加入到基础培养基(pH=7) 中, 30 ℃、200 r·min-1下培养24 h;在探究最适温度实验中, 将菌株接种至富集培养基(pH=7) 中, 分别于15、20、25、30、35、40、45或50 ℃, 200 r·min-1下培养24 h;在探究最适pH实验中, 调节富集培养基初始pH值为3、4、5、6、7、8、9或10, 将菌株接种至富集培养基中, 30 ℃、200 r·min-1下培养24 h;待培养结束后, 测定各培养基菌液OD600值和上清液的纤维素酶活.
2.6 菌株纤维素降解偏好性研究分别取1 g经液氮研磨后的苹果皮、水稻叶、香樟叶、包菜叶或杂木屑加入至基础培养基中作为碳源以取代CMC-Na, 对照组为分别含上述5种未经液氮研磨的纤维素样品.将菌株HW-17接种至上述10种培养基中, 30 ℃、200 r·min-1下培养3 d后测定OD600值和纤维素酶活.
2.7 纤维素样品混合发酵称取20 g烘干的鸡粪或猪粪, 分别加入至盛有20 g磨碎的水稻叶片的锥形瓶中, 1×105 Pa下灭菌20 min.吸取20 mL菌株HW-17种子溶液(OD600=1) 接种至上述样品中并混匀, 然后置于30 ℃下培养.每隔2 d, 收集浸出液, 测定纤维素酶活.此外, 将浸出液进行梯度稀释, 吸取0.1 mL稀释度为10-6的稀释液, 均匀涂布于CMC-Na固体平板上, 30 ℃下培养24 h后确定平板上单菌落数目.
2.8 纤维素酶特性研究吸取100 mL菌株HW-17于基础培养基中培养5 d后的菌液, 离心收集上清液, 于-20 ℃下保存.吸取1 mL发酵上清液于不同试管中, 分别于20、30、40、50、60、70、80或90 ℃下温育30 min.吸取1 mL发酵上清液于不同试管中, 加入1 mL缓冲液, 调节pH至3、4、5、6、7、8、9、10, 于10 ℃下温育30 min.pH=3, 使用1 mol·L -1HCl调节;pH=4~5, 使用50 mmol·L-1 HAc-NaAc缓冲液调节;pH=6~9, 使用50 mmol·L-1 Tris-HCl调节.吸取1 mL发酵上清液于不同试管中, 依次加入0.01 mL 1 mol·L-1的Cu(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)、Mn(Ⅱ)、Pb(Ⅱ)、Fe(Ⅲ)、Mg(Ⅱ)、Zn(Ⅱ)或Li(Ⅰ)溶液, 各混合液于10 ℃下温育30 min, 待温育结束后测定各溶液里纤维素酶活性.
2.9 数据计算与分析酶活力的计算方法见式(1), 相对酶活力的计算方法见式(2).
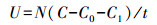
|
(1) |
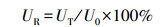
|
(2) |
式中, U为酶活力(U·mL-1), N为酶液稀释倍数, C为温育后溶液中葡萄糖质量浓度(μg·mL-1), C0为0.5% CMC-Na溶液中葡萄糖质量浓度(μg·mL-1), C1为初始溶液中葡萄糖质量浓度(μg·mL-1), t为反应的时间(min), UR为相对酶活力, UT为处理后酶活力(U·mL-1), U0为初始酶活力(U·mL-1).
T检验用于差异性分析, p < 0.05或p < 0.01作为显著性水平.实验中每个处理重复3次, 标准差由Microsoft Excel计算.
3 结果与讨论(Results and discussion) 3.1 微生物群落结构分析如图 1所示, 来源于原始森林腐木的细菌在不同条件下培养7 d后, 微生物群落结构在门分类水平与属分类水平上不同.在门分类水平上(图 1a), 腐木上的菌株在基础培养基中培养7 d后, 变形菌门(Proteobacteria)与厚壁菌门(Firmicutes)为主要的优势门, 相对丰度分别为54.03%与38.32%.将NJ-F30菌液传代至新的基础培养基且在不同条件下生长时, 于30 ℃下驯化7 d后, 培养基(NJ-S30) 中厚壁菌门的相对丰度升高至61.44%, 变形菌门的相对丰度降低至30.87%.然而, 于50 ℃驯化7 d后, 培养基(NJ-S50) 中几乎全为厚壁菌门细菌.在属分类水平上(图 1b), NJ-F30培养基中优势属为类芽孢杆菌属(Paenibacillus)(31.74%)、柠檬酸杆菌属(Citrobacter)(16.22%)和伯克氏菌属(Burkholderia)(14.49)、Cohnella属(4.27%), Pedobacter属、根瘤菌属(Rhizobium)与德沃斯氏菌属(Devosia)等属亦出现在NJ-F30培养基中.NJ-S30培养基中的细菌种类与NJ-F30培养基中的细菌种类大致相同, 各属细菌相对丰度虽有所不同, 但优势属亦为类芽孢杆菌属(Paenibacillus)(46.5%)、伯克氏菌属(Burkholderia)(14.92%)和Cohnella属(13.5%).NJ-S50培养基中Paenibacillaceae属的相对丰度超过70%, 还有少量的类芽孢杆菌属(Paenibacillus)(8.38%).此外, NJ-S50中细菌种类及相对丰度较NJ-F30与NJ-S30中细菌种类及相对丰度有较大差别.该驯化的结果表明, 传代后的菌株在相同条件下培养不会改变优势菌属的种类, 多次传代后优势菌属的相对丰度可能会越来越高, 这为定向筛选某类细菌提供了理论依据.
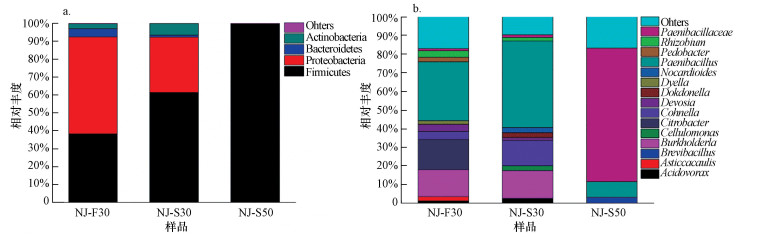 |
| 图 1 16S rDNA基因高通量测序确定不同驯化条件下微生物群落结构(a.门水平, b.属水平) Fig. 1 Microbial community composition in different acclimation conditions as determined by Illumina sequencing of 16S rDNA |
从基础培养基中, 经初筛、复筛和分离纯化获得1株纤维素降解菌, 将其命名为HW-17.该菌株的生理生化结果如表 1所示, 初步认定菌株HW-17为Arthrobacter属.菌株HW-17的16S rDNA序列上传至NCBI中并与已知16S rDNA序列进行比对, 发现该1421 bp的16S rDNA基因序列与已知的菌株Arthrobacter oryzae strain KV-651 (Accession number: NR 041545.1) 的16S rDNA序列显示出99%的相似性, 且两者处在系统进化树的同一支上(图 2).基于生理生化试验和16S rDNA序列分析, 菌株HW-17为Arthrobacter oryzae菌株.
| 表 1 菌株HW-17主要的生理生化特征 Table 1 Main physiological-biochemical properties of strain HW-17 |
 |
| 图 2 基于16S rDNA的系统进化树 Fig. 2 Phylogenetic tree based on 16S rDNA sequences(Numbers at the nodes represented the bootstrap values based on neighbor-joining analyses of 1000 resampled datasets. The scale bar represented 0.5% sequence divergence) |
Soares Jr等(2012)在南极洲极端环境中筛选到一株Arthrobacter属纤维素降解菌;刘佳等(2011)在牛粪与稻草堆肥的过程中发现, 在堆肥高温期检测到Arthrobacter属纤维素降解菌.由此可见, Arthrobacter属细菌在自然界中为纤维素的降解起到了一定的作用.
3.3 纤维素酶活性测定如图 3所示, 菌株HW-17在基础培养基(CMC)中培养5 d后, 生物量达到最大, 此时纤维素酶活达到最大值18.55 U·mL-1;菌株HW-17在含Tryptone的富集培养基(CT)中培养4 d后, 生物量达到最大, 此时纤维素酶活达到最大值4.93 U·mL-1.菌株HW-17在基础培养基中的纤维素酶活性明显高于在CT培养基中的酶活(p < 0.01).
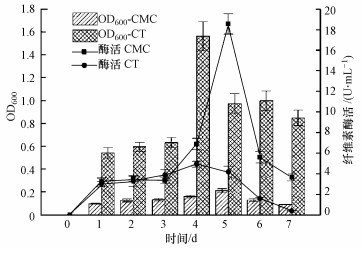 |
| 图 3 菌株HW-17在不同培养条件下的纤维素酶活 Fig. 3 Cellulase activity of strain HW-17 under different culture conditions |
菌株HW-17在以单一碳源CMC-Na为底物时, 其尽可能多地降解底物以维持自身的生长.然而在营养较丰富的富集培养基中, 菌株HW-17优先利用胰蛋白胨而使得CMC-Na利用率低, 因而富集培养基中的最大纤维素酶活低于基础培养基中的最大纤维素酶活.菌株HW-17表达出的纤维素酶活虽远不及混合菌群M-1(冯红梅等, 2016)代谢产生的纤维素酶活(135.9 U·mL-1)和放线菌JSD-1(冯海玮等, 2013)产生的纤维素酶活(59.19 U·mL-1), 但较Bacillus licheniformis S5(王贤丰等, 2015)产生的纤维素酶活(2.80 U·mL-1)高.此外, 菌株HW-17经过基因改造后可能获得更高的产纤维素酶能力.
3.4 环境因子对菌株生长和产酶的影响如图 4a所示, 菌株HW-17在含胰蛋白胨或酵母浸出物培养基中生长较好, 明显优于(p < 0.01) 在含蛋白胨、KNO3、NH4Cl或甘氨酸培养基中的生长, 菌株HW-17在含干酪素或NaNO2培养基中的生长明显较差(p < 0.01).含无机氮源(KNO3或NH4Cl)培养基中的纤维素酶活明显高于(p < 0.01) 含复杂有机氮源(胰蛋白胨、酵母浸出物或蛋白胨)中的酶活, 且含KNO3培养基中的纤维素酶活最大(5.83 U·mL-1).复杂有机氮源较简单有机氮源(干酪素或甘氨酸)或无机氮源更易被菌株HW-17吸收利用.菌株HW-17优先利用含复杂有机氮源培养基中的复杂有机氮源, CMC-Na在培养的初期利用得较少.由此可见, 在这8种氮源中, 胰蛋白胨最适合菌株HW-17的生长, KNO3最适合纤维素酶的发酵.
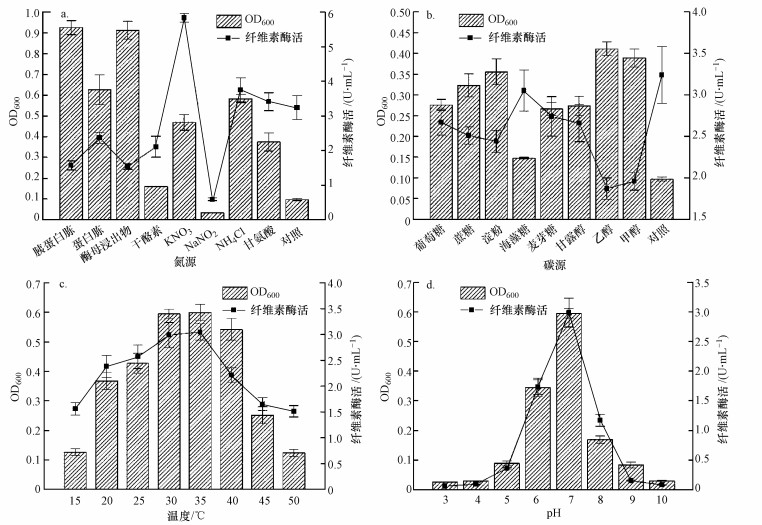 |
| 图 4 菌株HW-17在不同氮源(a)、碳源(b)、温度(c)和pH(d)培养条件下的生物量及纤维素酶活 Fig. 4 The effect of nitrogen source (a), carbon source (b), temperature (c), pH (d) on strain HW-17 biomass and cellulase activity |
如图 4b所示, 菌株HW-17在含乙醇的培养基中的生长明显优于在含葡萄糖、蔗糖、淀粉、麦芽糖、甘露醇或海藻糖(p < 0.01), 以及甲醇(p < 0.05) 培养基中的生长.菌株HW-17在含这8种碳源的培养基中的生长状况排序为:乙醇 > 甲醇 > 淀粉 > 蔗糖 > 葡萄糖 > 甘露醇 > 麦芽糖 > 海藻糖.不同种类的碳源具有不同的组成和底物分解率, 因而决定菌株HW-17对不同种类碳源的吸收利用率不同.当菌株HW-17以海藻糖为底物时, 海藻糖较慢地被菌株HW-17吸收和降解着且细胞处于“饥饿”状态, 因而菌株HW-17为维持基本的代谢而消耗自身的物质和能量.当菌株HW-17以其他7种碳源为底物时, 这些碳源被高效地吸收和降解着而使菌株细胞处于“饱食”状态, 因此, 菌株HW-17能够快速完成生长和增殖而不消耗自身的能量和物质.此外, 含这8种碳源培养基中的纤维素酶活均低于基础培养基(对照组)中的酶活.菌株HW-17优先利用这8种碳源而使得CMC-Na的利用率低.
菌株HW-17能够在较宽温度范围内生长且呈现出不同的生物量(图 4c).菌株HW-17在30 ℃或35 ℃条件下生长得较好, 明显优于在15、20或25 ℃(p < 0.01), 以及40 ℃(p < 0.05) 下的生长.菌株HW-17在培养基pH为7下生长得最好(图 4d), 在pH为6下生长得较好, 在pH为5、8或9下生长得较差(p < 0.01), 在pH为3、4或10下生长得最差(p < 0.01).温度和pH能够影响蛋白质结构、酶促反应速率、细胞渗透压, 进而影响着细菌的生长(尚晓瑛等, 2012).纤维素酶活的变化趋势和菌株HW-17在不同温度或pH下培养生长的趋势一致.由此可见, 菌株HW-17为一种嗜中温的细菌, 30 ℃或35 ℃、pH=7为其生长和产酶的最佳温度和最佳pH.菌株HW-17最适生长温度为30 ℃或35 ℃, 最适生长pH为7, 这与菌珠Pseudomonas sp. B6-15表现出的耐低温性质不同(尚晓瑛等, 2012).
3.5 菌株HW-17纤维素降解偏好性如图 5所示, 菌株HW-17在5种未经研磨的纤维素样品的培养基中呈现出如下的生长顺序:包菜叶 > 水稻叶 > 香樟叶 > 苹果皮 > 杂木屑, 而在5种经液氮研磨的纤维素样品的培养基中呈现出以下生长顺序:苹果皮 > 包菜叶 > 水稻叶 > 香樟叶 > 杂木屑, 且均较对照组的生物量高.此外, 实验组和对照组中的最大纤维素酶活分别为4.79和6.69 U·mL-1, 且两者均在含苹果皮的培养基中取得.研磨含纤维素的样品能够增大样品与菌株的接触面积, 这样有助于菌株更好地降解纤维素.由此可见, 研磨后的纤维素样品更适于菌株HW-17代谢利用, 且产生的纤维素酶活更高.
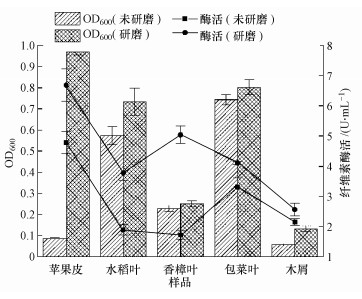 |
| 图 5 不同纤维素样品发酵3 d后纤维素酶酶活 Fig. 5 Cellulase activity of different cellulose samples after fermented for 3 d |
如图 6所示, 菌株HW-17在水稻叶片-鸡粪混合样品中堆肥发酵12 d后, 纤维素酶活最大(9.71 U·mL-1);在水稻叶片-猪粪混合样品中发酵14 d后, 纤维素酶活最大(7.38 U·mL-1).纤维素酶活变化趋势与样品中菌株数量变化趋势一致, 且同一时刻下水稻叶片-鸡粪混合样品中纤维素酶活均高于水稻叶片-猪粪混合样品中纤维素酶活.复合微生物菌剂发酵含鸡粪或猪粪纤维素样品产生的纤维素酶的变化率(梁东丽等, 2009)与该结果一致.此外, 实际观测到的鸡粪和水稻叶片混合样品较猪粪和水稻叶片混合样品降解得更厉害.猪粪和水稻的混合样品(C/N=24.7) 较鸡粪和水稻的混合样品(C/N=19.7) 的碳氮比高, 前者更适于菌株HW-17的代谢.在堆肥发酵的初期, 菌株HW-17优先利用鸡粪或猪粪中的有机物以维持自身的生长和繁殖, 待混合样品营养度降低时, 菌株HW-17开始利用水稻叶片里的纤维素.
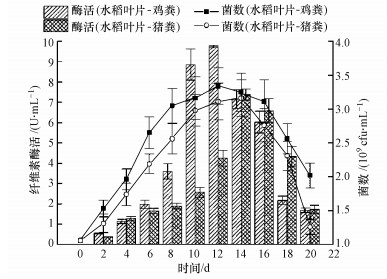 |
| 图 6 混合样品堆腐过程纤维素酶活变化 Fig. 6 Changes of cellulase activity during composting of mixed samples |
菌株HW-17产生的纤维素酶在中温(≤50 ℃)下酶活不受影响(图 7a), 在60 ℃和70 ℃下, 分别能保留81.26%和40.16%的酶活.当温度达到80 ℃以上时, 纤维素酶活明显丧失(p < 0.01).该纤维素酶能在pH为5~7内保持较高的酶活(图 7b), 明显高于(p < 0.01) 在pH为8和4下的酶活.在其他pH下, 该纤维素酶难以维持其酶活.Fe(Ⅲ)、Mg(Ⅱ)或Li(Ⅰ)对该纤维素酶几乎没有影响(图 7c), 在含Ni(Ⅱ)条件下, 该纤维素酶能保留88.36%的酶活.此外, Cu(Ⅱ)、Co(Ⅱ)、Mn(Ⅱ)、Pb(Ⅱ)或Zn(Ⅱ)明显抑制了该纤维素酶的活性.
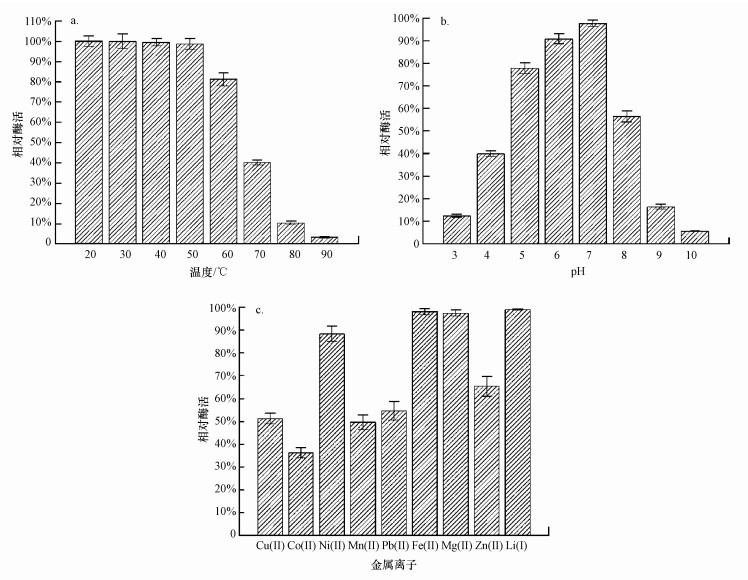 |
| 图 7 不同温度(a)、pH(b)和金属离子共存(c)条件下纤维素相对酶活 Fig. 7 The effect of temperature (a), pH (b), and metal ion (c) on relative enzyme activity of cellulase |
穆春雷等(2013)筛选到一株草酸青霉(Penicillium oxalicum), 其产生纤维素酶的最适pH和最适反应温度分别为pH=5和20 ℃.荧光假单胞菌(Pseudomonas fluorescent)产生的纤维素酶活性亦被Cu(Ⅱ)、Mn(Ⅱ)或Zn(Ⅱ)不同程度地抑制(周俊强等, 2010), 而Cu(Ⅱ)能够促进草酸青霉(Penicillium oxalicum)(穆春雷等, 2013)产生的纤维素酶的活性.
4 结论(Conclusions)1) 利用含单一碳源选择性培养基筛选到1株纤维素降解菌Arthrobacter oryzae HW-17, 在基础培养基中发酵后纤维素酶活最高可达18.55 U·mL-1.
2) 在菌株的驯化过程中, 发现不同驯化温度下微生物群落结构不同.在30 ℃驯化温度下, 培养基中的优势菌属为类芽孢杆菌属、伯克氏菌属和Cohnella属;在50 ℃驯化温度下, Paenibacillaceae属为绝对优势属.
3) 环境因子如pH和温度等影响菌株HW-17的生长和纤维素酶产量.适量增加无机氮源有助于菌株HW-17产纤维素酶, 额外的有机物利于菌株的生长但不利于菌株生产纤维素酶.pH和温度过低或过高会影响菌株HW-17的生长, 进而影响纤维素酶的合成.
4) 菌株HW-17对液氮研磨后的纤维素样品有较好的降解效果, 在鸡粪和水稻叶片的混合样品中产生的纤维素酶活高于在猪粪和水稻叶片混合样品中产生的纤维素酶活.
5) 温度、pH和金属离子能够影响菌株HW-17产生的纤维素酶的活性.在中温条件(≤50 ℃)下, 该纤维素酶活性不受影响; 该纤维素酶在偏酸性(pH=5~7) 条件下能保持较高的酶活; 一些重金属离子如Cu(Ⅱ)或Pb(Ⅱ)等能够抑制该纤维素酶活性.
Cheng Y, Engling G, He K B, et al. 2013. Biomass burning contribution to Beijing aerosol[J]. Atmospheric Chemistry and Physics, 13(15): 7765–7781.
DOI:10.5194/acp-13-7765-2013
|
邓辉, 王成, 吕豪豪, 等. 2013. 堆肥过程放线菌演替及其木质纤维素降解研究进展[J]. 应用与环境生物学报, 2013, 19(4): 581–586.
|
Doddapaneni H, Chakraborty R, Yadav J S. 2005. Genome-wide structural and evolutionary analysis of the P450 monooxygenase genes (P450ome) in the white rot fungus Phanerochaete chrysosporium:evidence for gene duplications and extensive gene clustering[J]. BMC Genomics, 6: 92.
DOI:10.1186/1471-2164-6-92
|
东秀珠, 蔡妙英. 2001. 常见细菌系统鉴定手册[M]. 北京: 科学出版社.
|
冯红梅, 秦永胜, 李筱帆, 等. 2016. 高温纤维素降解菌群筛选及产酶特性[J]. 环境科学, 2016, 37(4): 1546–1552.
|
冯海玮, 周培, 毛亮, 等. 2013. 一株高效纤维素降解菌的筛选及其产酶条件优化[J]. 上海交通大学学报(农业科学版), 2013, 31(2): 24–29.
|
Fujii T, Inoue H, Ishikawa K. 2013. Enhancing cellulase and hemicellulase production by genetic modification of the carbon catabolite repressor gene, creA, in Acremonium cellulolyticus[J]. AMB Express, 3(1): 73–81.
DOI:10.1186/2191-0855-3-73
|
顾文杰, 徐有权, 徐培智, 等. 2012. 酸性土壤中高效半纤维素降解菌的筛选与鉴定[J]. 微生物学报, 2012, 52(10): 1251–1259.
|
郝月, 杨翔华, 张晶, 等. 2005. 秸秆纤维素分解菌的分离筛选[J]. 中国农学通报, 2005, 21(7): 58–60.
|
Kausar H, Sariah M, Mohd Saud H, et al. 2011. Isolation and screening of potential actinobacteria for rapid composting of rice straw[J]. Biodegradation, 22(2): 367–375.
DOI:10.1007/s10532-010-9407-3
|
Kim S, Dale B E. 2004. Global potential bioethanol production from wasted crops and crop residues[J]. Biomass and Bioenergy, 26(4): 361–375.
DOI:10.1016/j.biombioe.2003.08.002
|
Lane D J. 1991. 16S/23S rRNA Sequencing//Stackebrandt E, Goodfellow M.Nucleic Acid Techniques in Bacterial Systematic[M]. New York: John wiley and Sons Inc: 115–175.
|
梁东丽, 谷洁, 秦清军, 等. 2009. 农业废弃物静态高温堆肥过程中纤维素酶活性的变化[J]. 环境科学学报, 2009, 29(2): 323–329.
|
刘佳, 李婉, 许修宏, 等. 2011. 接种纤维素降解菌对牛粪堆肥微生物群落的影响[J]. 环境科学, 2011, 32(10): 3073–3081.
|
穆春雷, 武晓森, 李术娜, 等. 2013. 低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质[J]. 微生物学通报, 2013, 40(7): 1193–1201.
|
Mu C L, Wu X S, Li S N, et al. 2013. Screening and identification of a cold-adapted cellulase-producing strains and characterization of cellulase[J]. Microbiology China, 40(7): 1193–1201.
|
Soares Jr F L, Melo I S, Dias A C F, et al. 2012. Cellulolytic bacteria from soils in harsh environments[J]. World Journal of Microbiology and Biotechnology, 28: 2195–2203.
DOI:10.1007/s11274-012-1025-2
|
尚晓瑛, 程旭艳, 霍培书, 等. 2012. 1株堆肥耐低温纤维素降解菌的筛选、鉴定及生长特性的初步研究[J]. 华中农业大学学报, 2012, 31(5): 558–562.
|
Tamura K, Stecher G, Peterson D, et al. 2013. MEGA6:molecular evolutionary genetics analysis version 6.0[J]. Molecular Biology and Evolution, 30(12): 2725–2729.
DOI:10.1093/molbev/mst197
|
徐杰, 杨谦. 2008. 水稻秸秆降解优良放线菌的筛选和鉴定[J]. 林产化学与工业, 2008, 28(5): 55–58.
|
王贤丰, 单洪伟, 张家松, 等. 2015. 从海水环境分离筛选甘蔗渣纤维素降解菌[J]. 微生物学通报, 2015, 42(6): 981–989.
|
文自兰, 许秀兰, 杨春琳, 等. 2015. 5种优势腐生真菌降解华山松针叶的酶活测定[J]. 微生物学通报, 2015, 42(4): 654–664.
|
张建峰, 苗天瑶, 侯红燕, 等. 2016. 纤维素降解菌T-6的分离鉴定及产酶条件[J]. 吉林农业大学学报, 2016, 38(1)32-37, 44.
|
周俊强, 邱忠平, 韩云平, 等. 2010. 纤维素降解菌的筛选及其产酶性质[J]. 环境工程学报, 2010, 4(3): 705–708.
|
 2017, Vol. 37
2017, Vol. 37


