2. 郑州大学环境政策规划评价研究中心, 郑州 450003
2. Research Center for Environmental Policy Planning & Assessment of Zhengzhou University, Zhengzhou 450003
人工强化生态滤床是根据人工湿地原理建立起来的一项河道旁路净化技术(刘军等,2009),利用河道上下游水位差进行布水,降低运行动力.微生物在生态滤床净化过程中作为污染物转化和去除的主要执行者,其种群结构及活性直接影响净化效果(Ragusa et al., 2004;付融冰等,2005).
微生物群落结构特征描述群落成员的种类、丰度及其在不同环境条件下的更替,是影响其生态功能的决定因素(刘开明等,2010).高通量测序技术(high-throughput sequencing)又称第二代测序技术(next-generation sequencing technology),具有高准确性、高通量、高灵敏度和低运行成本的特点,该测序技术已被应用于多种生态系统的微生物多样性研究,如土壤(Teixeira et al., 2010)、海洋(Gilbert et al., 2008)、肠道(Yatsunenko et al., 2012)、污水处理填料生物膜(赵文莉等,2015)等,它可以同时完成传统基因组学研究(测序和注释)及功能基因组学(基因功能等)的研究,是深入、细致地研究微生物群落结构的新手段(王绍祥等,2014).
目前,高通量测序技术已经在各种污水处理工艺的微生物分析中有较多应用,但针对生态滤床的研究还比较少.本文利用波流式生态滤床对河水进行净化,考察反应器内污染物转化情况,采用高通量技术分析生态滤床中微生物的群落组成和变化,以期解释波流式生态滤床污染物净化机理,为进一步研究利用生态滤床处理河水提供理论依据.
2 材料与方法(Materials and methods) 2.1 试验装置波流式生态滤床小试反应器由有机玻璃制成,体积为43.75 L,长×宽×高= 500 mm×250 mm×350 mm,如图 1所示.
 |
| 图 1 生物滤床小试反应器示意图 Fig. 1 Schematic diagram of bio-filter bed test device |
小试反应器内从左到右依次为溢流槽、反应区(反应区1、反应区2、反应区3) 和出水区,反应器为上部进水,由3根布水管均匀布水,出水槽接上、中、下3根出水管以调节反应器内水位;反应区内设置两道隔板使进水在纵向上形成折流,进水依次经过反应区1、2、3后进入出水区.在3个反应区内铺设通气管以改善反应器内部溶解氧情况,同时便于取水样进行水质分析.图中Y1~Y5指样品采集位置.反应器内基质共分为3层,基质组成如表 1所示.
| 表 1 反应器内基质组成 Table 1 composition of filter Matrix in the reactor |
基质铺设完成以后,有效体积为33.75 L,经测定装置的孔隙率为0.41,通过计量泵进水,控制进水流量为0.6 L·h-1,水力停留时间约24 h.
2.2 试验用水选取郑州市某纳污河流氨氮污染较为严重段的河水作为反应器进水,其水质指标为:氨氮为0.49~10.01 mg·L-1,亚硝态氮为0.06~1.68 mg·L-1,硝态氮为2.59~12.27 mg·L-1,总氮为8.66~17.42 mg·L-1,CODCr 36.96~57.12 mg·L-1,pH 6.88~7.92.试验初期为加快反应器启动速度,在河水中添加硫酸铵提高氨氮浓度为30~50 mg·L-1.
2.3 装置运行及样品采集启动阶段:在河水中添加硫酸铵、葡萄糖配制试验用水,分别设置氨氮浓度为50、30、10 mg·L-1,保证配水C/N为10~20,每个浓度条件运行2 d.一周后进水改用实际河水,每隔2~3 d测定进水和出水COD、氨氮等污染物浓度,并计算氨氮去除率,直至去除效果稳定1周后可认为反应器启动成功.
稳定阶段:小试反应器启动完成以后,每隔5 d分别测定进水、反应区1、反应区2、反应区3和出水中的氨氮、亚硝态氮、硝态氮、总氮、COD和DO浓度,以监测反应器内不同部分的污染物浓度变化.每隔两个月从反应区2中部(图 1中Y3位置)采集样品,共采集3次,依次编号为S1、S2和S3,以分析反应器运行不同时间后微生物群落结构变化.按照河水在反应器内流向,在反应区1上部、反应区1下部、反应区2上部、反应区3中部、反应区3底部与出水槽交界处,沿程采集基质样品,依次编号为Y1~Y5,以分析小试反应器内沿程微生物群落结构变化.
2.4 扫描电镜分析对不同时间采集的基质样品,按照以下步骤进行预处理:① 用0.2 mol·L-1磷酸缓冲液冲洗3次,以洗去样品表面杂质;② 将清洗干净的样品在10%甲醛内浸泡4 h进行固定,以尽量完整的稳定和保存样品的结构;③ 分别用40%、60%、80%和100%的乙醇溶液进行等级系列脱水处理,每一系列的时间间隔为20 min,从而用脱水剂取代样品中的游离水,以便进行下一步干燥处理;④ 置于干燥器内干燥12 h取出.预处理完毕后利用Phenom G2 Pro扫描电镜观察基质上微生物的生长情况.
2.5 高通量测序分析样品采集完成以后,委托生工生物工程(上海)股份有限公司对样品进行高通量测序,根据测序结果,分析各个基质样品中微生物种类和丰度,计算Alpha多样性等.其中基因组提取采用OMEGA土壤提取试剂盒(E.Z.N.A.Soil DNA Kit),PCR所用引物为通用引物341F(CCCTACACGACGCTCTTCCGATC TG(barcode)CCTACGGGNGGCWGCAG)和805R(G ACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTAC HVGGGTATCTAATCC),高通量测序平台为Miseq.
2.6 水质分析方法氨氮的测定采用纳氏试剂分光光度法,亚硝态氮的测定采用N-(1-萘基)-乙二胺分光光度法,硝态氮的测定采用酚二磺酸分光光度法,总氮的测定采用碱性过硫酸钾消解分光光度法,CODCr的测定采用微波快速消解法,pH由便携式pH计测定.
2.7 数据处理方法试验数据的处理采用Microsoft Excel 2013、SPSS 19软件,图表的绘制使用Microsoft Excel 2013、origin 9.0.
3 实验结果与讨论(Results and discussion) 3.1 进出水水质与微生物群落结构随时间变化 3.1.1 进出水水质随时间变化情况波流式生态滤床小试反应器运行期间,反应器氨氮进出水浓度及去除率变化情况如图 2所示.可以看出,反应器对氨氮去除率为35.16%~98.17%.前两个月处于反应器启动期,进水氨氮浓度较高,反应器对氨氮的去除率较低,平均去除率为60.42%.3~4个月时反应器对氨氮的去除率平均较之前有所升高,但波动较大,平均去除率为72.54%.5~6个月时去除率则相对比较稳定,平均去除率为74.83%.
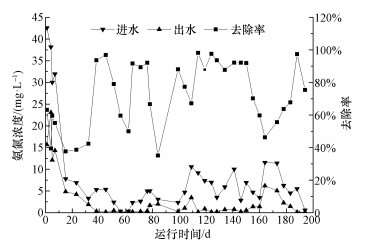 |
| 图 2 反应器进出水氨氮随时间变化情况 Fig. 2 Variation of ammonia concentration in influent and effluent with time |
在反应器运行过程中,取反应器内基质,利用扫描电镜观察吸附微生物的情况,结果如图 3所示.可以看出,对比图 3a,即未放入反应器的空白样品,反应器运行后沸石的内部发生了明显变化,运行1~2个月时,沸石表面吸附了大量污染物,但是基本无微生物生长,见图 3b;随着运行时间增多,3~4个月时可以看到基质上微生物逐渐增多,见图 4c,运行5~6个月时则可以观察到较多的微生物,见图 4d,说明反应器前期以基质吸附作用为主,后期则主要依靠微生物发挥作用.
 |
| 图 3 反应器运行过程中基质表面扫描电镜照片 Fig. 3 Scanning electron microscopy (SEM) photos of matrix during reactor operation |
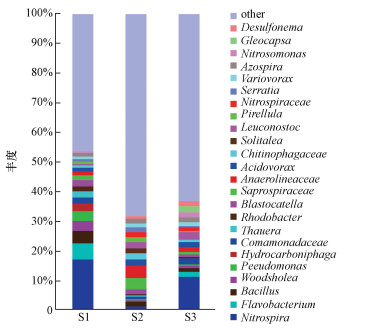 |
| 图 4 属水平下不同时间微生物组成 Fig. 4 Microbial diversity on genus level in the reactor at different time |
一般来讲,微生物的同化和降解作用是湿地脱氮的主要途径,微生物数量与污染物去除效率之间存在相关性(王晓丹等,2009;梁威,2002),植物、基质和氨氮挥发也发挥了一定作用(修海峰,2011).本研究中,初期基质发挥吸附促进氨氮去除,但基质的吸附作用有限,后期随着微生物数量的增多,则主要以微生物发挥作用.
3.1.3 微生物群落结构随时间变化情况微生物组成变化情况:小试反应器运行不同时间后,在同一点位采集样品分析基质上生物膜的微生物组成,发现在门分类水平上,S1、S2和S3样品类群的数量分别为26、31和32,优势类群为变形菌门(Proteobacteria)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)等,为进一步说明群落结构,分析属水平的微生物组成如图 4所示,图中S1~S3分别代表反应器运行2个月、4个月和6个月时的同一位置样品结果.
由图 4可以看出,在属水平上,S1样品优势属为硝化螺菌属(Nitrospira),相对丰度为17.19%,其次黄杆菌属(Flavobacterium)、芽孢杆菌属(Bacillus)、木洞菌属(Woodsholea)、假单胞菌属(Pseudomonas)等也占有一定比例,相对丰度分别为5.34%、4.22%、3.45%和3.23%.S2样品优势属为Anaerolineaceae、Saprospiraceae,相对丰度分别为4.2%和3.59%,其次为嗜酸菌属(Acidovorax)、Solitalea和明串珠菌属(Leuconostoc),相对丰度分别为2.14%、1.95%和1.9%.S3样品优势属为硝化螺菌属(Nitrospira),相对丰度为11.35%,其次为明串珠菌属(Leuconostoc)、丛毛单胞菌科(Comamonadaceae sp.)、亚硝化单胞菌属(Nitrosomonas),相对丰度为2.24%、2.22%和1.94%.可见,在不同时间,反应器内微生物的优势属有较大不同,说明随着水体流动和运行时间的更替,装置内的优势菌种会不断发生变化,与凌云等(2009)研究结果一致.
研究表明水体中氨氮浓度的增加是促进硝化细菌的均匀性和丰富度增高的主要因子(孙寓姣等,2014),进一步分析发现,S1样品中硝化螺菌属(Nitrospira)的丰度最高,可能与装置运行前期氨氮浓度较高有关,这同时也促使氨氮去除率的增高.但S2样品中硝化细菌丰度则相对较低,这可能造成了装置运行3~4个月时对氨氮去除效果不稳定.S3样品中硝化螺菌属(Nitrospira)的丰度有所提高,与去除效果趋于稳定有关.
不同时间微生物多样性分析:Alpha多样性(Alpha diversity)是对单个样品物种多样性的分析.小试反应器运行不同时间后,同一点位基质中细菌高通量Alpha多样性分析指数结果如表 2所示.表中Chao1和ACE表示通过所测样品中OTU数量来预测微生物的数量,也是衡量物种丰度的标准;香农指数(Shannon)和辛普森指数(Simpson)可以反映样品中物种的均匀度和多样性.前面3个指标数值越大,最后一个指标越小,说明样品中物种越丰富.
| 表 2 生物基质中细菌高通量分析指数 Table 2 High-throughput analysis index of microbiol community at different time |
由表 2可以看出,香农指数(Shannon)大小顺序为S2 > S1 > S3,辛普森指数(Simpson)大小顺序为S3 > S1 > S2,说明反应器运行3~4个月时均匀度和多样性最大,5~6个月时均匀度和多样性最小.一般来讲细菌越丰富,污染物的去除效果越好(刘志伟等,2014),S2样品微生物均匀度和多样性好于S1,可能解释了运行3~4个月后对氨氮的去除效果优于前两个月,但5~6个月时均匀度和多样性有所降低,这可能与试验进入冬季有关,温度降低对微生物多样性产生了一定的影响.
3.2 水质与微生物群落结构沿程变化情况 3.2.1 沿程水质变化情况当河水进入反应器后,依次流经反应区1、反应区2、反应区3后,进入出水槽,由出水管流出反应器外,3个反应区对污染物的去除均发挥着重要作用.为了解氨氮的转化情况,测定反应器内不同位置的水质情况,结果如图 5所示.
 |
| 图 5 反应器沿程水质变化情况 Fig. 5 The water quality along the reactor |
对运行期间不同反应区氨氮浓度进行差异性分析发现,经过反应区2之后,水中的氨氮浓度与进水有显著差异(p < 0.5),说明氨氮的去除主要发生在反应区1和2,与图 5沿程氨氮变化情况一致.
反应器稳定运行以后,对NH3-N、NO2--N、TN和COD去除率最高分别可达到96.87%、94.36%、38.01%和28.57%,出水中NO3--N浓度则有所升高.NH3-N和NO2--N在反应区2结束时基本上已去除完毕,反应区1和2对氨氮去除作用基本相当,反应区1对NO2--N去除的贡献明显大于反应区2.NO3--N浓度和TN浓度在经过反应区1作用后分别降低了47.19%和30.42%,反应区1底部溶解氧浓度为0.74 mg·L-1,说明在反应区1内同时发生着硝化与反硝化作用,微生物的硝化作用去除了进水中浓度相对较高的氨氮,消耗了进水和曝气带来的溶解氧,使反应区1处于缺氧状态,促进了反硝化进行,使得NO3--N和TN浓度都有较大幅度降低.反应区2顶部溶解氧浓度为4.02 mg·L-1,浓度相对较高,有利于发生硝化作用去除氨氮,而抑制反硝化作用进行,因此NO3--N浓度有较大升高.反应区3未进行曝气,进入反应区3和出水区后,好氧微生物的作用降解了一部分COD,水中溶解氧浓度降低,有利于反硝化作用进行,因此NO3--N和TN浓度均有所降低.
3.2.2 沿程微生物群落结构变化情况微生物组成变化情况:取样分析反应器内不同位置样品上生物膜的微生物组成,Y1~Y5样品中分别发现了32、28、32、32、31个不同的细菌门类和548、504、589、549、539个不同的属.门分类水平上的微生物组成如图 6所示.
 |
| 图 6 门分类水平反应器内沿程微生物组成 Fig. 6 Microbial diversity on phylum level along the reactor |
可以看出,5个样品中变形菌门(Proteobacteria)的丰度最高,可占41.63%~51.92%,且呈现逐渐升高的趋势,其次为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)、浮霉菌门(Planctomycetes)等.其中,硝化螺旋菌门(Nitrospira)类微生物可以将亚硝酸盐氧化为硝酸盐,在Y1和Y3样品中丰度较高,与这两个位置处于反应器上部,溶解氧较高有一定关系.厚壁菌门(Firmicutes)类微生物在厌氧条件下能够利用硝酸盐进行脱氮作用(Wang et al., 2009;Andrade et al., 2009),在Y3~Y5样品(即反应区3) 中的丰度相对较高,有利于硝酸盐的还原反应.
在属一级进行微生物群落的分类能够进一步了解生态系统微生物群落的功能与作用.属分类水平上的微生物组成如图 7所示.
 |
| 图 7 属分类水平反应器内沿程微生物组成 Fig. 7 Microbial divesity on genus level along the reactor |
可以看出,Y1、Y3、Y4样品中,最具优势的属为硝化螺菌属(Nitrospira),Y2样品中最具优势的属为unclassified aprospiraceae和黄杆菌属(Flavobacterium),Y5样品中最具优势的属为12 up.黄杆菌属(Flavobacterium)具有还原硝酸盐的能力且适宜在低温环境中进行新陈代谢作用(Vela et al., 2007),与总氮的去除有较大关系.氨化细菌、硝化细菌以及亚硝化细菌数量与氨氮转化呈显著的正相关(p < 0.01)(商新利,2012).反应器前端和中部硝化菌优势地位较为明显,为进一步分析氨氮转化规律,统计硝化菌和亚硝化菌丰度,结果如表 3所示.
| 表 3 沿程硝化菌丰度 Table 3 Nitrifying bacteria abundance along reactor |
亚硝化菌和硝化菌的共同作用可以将水中的氨氮氧化为硝酸盐氮,由表 3可以看出,反应器内两类细菌的丰度基本上呈现出上多下少、前多后少的特点,分析原因:反应器进水处溶解氧条件较好,有利于好氧细菌生长,且进水氨氮含量也较高,为硝化菌和亚硝化菌的生长创造了良好条件,因此,硝化和亚硝化细菌丰度比较高,也有利于反应区1中氨氮去除;随着反应进行,溶解氧有所消耗,加之反应器底部无溶解氧补充,造成硝化菌和亚硝化菌的丰度有所下降;反应区2上部增加有曝气手段,且上部与大气接触较多,溶解氧条件改变有利于硝化菌和亚硝化菌生长,也促进了氨氮去除;反应区3和出水槽中两种细菌的丰度则逐渐降低,主要原因为进水经过反应区1和2,大部分氨氮已经被去除,且溶解氧浓度逐渐降低.
沿程微生物Alpha多样性变化情况:反应器沿程样品Alpha多样性指标如表 4所示.表 4中,不同位置样品的香农指数大小为Y4 > Y3 > Y1 > Y2 > Y5;辛普森指数大小为Y5 > Y3 > Y2 > Y1 > Y4,说明Y5样品的均匀度和多样性最小,Y4样品的均匀度和多样性最大,但各样品的差别不大,不同部位样品中细菌香农指数为7.36~7.56,辛普森指数为0.00187~0.00415.
| 表 4 不同位置生物基质中细菌高通量分析指数 Table 4 High-throughput analysis of microbiol communtiy in different positions |
微生物多样性的空间分布特征是其处理有机物效能差异的微生物生态学机理,闻岳等(2009)指出水平潜流人工湿地中微生物种群多样性随着水流方向呈现先增加,到后段减少的趋势,与本研究的结果一致.
4 结论(Conclusions)1) 反应器稳定运行以后,对氨氮平均去除率为74.83%,基质表面可以观察到大量微生物,优势属为硝化螺菌属(Nitrospira),明串珠菌属(Leuconostoc)、丛毛单胞菌科(Comamonadaceae sp.)、亚硝化单胞菌属(Nitrosomonas)等,相对丰度分别为11.35%、2.24%、2.22%和1.94%.滤床基质前期以吸附污染物为主,后期固着了大量微生物,不同时期优势细菌有较大不同.
2) 反应器稳定运行后,反应区1硝化和反硝化作用都比较强烈,对氨氮、NO2--N、NO3--N和TN都具有较好去除作用;反应区2中硝化作用较强烈,对氨氮去除作用较好,而NO3--N浓度升高较多;反应区3主要发挥反硝化作用,NO3--N浓度下降较多,对TN也有一定去除作用.
3) 反应器前部主要发挥硝化作用,中部发挥反硝化作用,通过高通量测序手段对反应器中微生物种类进行分析,发现硝化菌和亚硝化菌的分布呈现上多下少、前多后少的特点,且反应区3中的反硝化菌占有优势,解释了反应器内氨氮的转化规律;反应器中部以黄杆菌属(Flavobacterium)为代表的反硝化菌丰度较高,促进了反硝化作用的发挥,降低了出水中总氮浓度.
Andrade Do Canto C S, Rodrigues J A D, Ratusznei S M, et al. 2008. Feasibility of nitrification/denitrification in a sequencing batch biofilm reactor with liquid circulation applied to post-treatment[J]. Bioresource Technology, 99(3): 644–654.
DOI:10.1016/j.biortech.2006.12.040
|
付融冰, 杨海真, 顾国维, 等. 2005. 人工湿地基质微生物状况与净化效果相关分析[J]. 环境科学研究, 2005, 18(6): 44–49.
|
Gilbert J A, Field D, Huang Y, et al. 2008. Detection of large numbers of novel sequences in the metatranscriptomes of complex marine microbial communities[J]. PloS One, 3(8): e3042.
DOI:10.1371/journal.pone.0003042
|
李剑波. 2008. 强化垂直流-水平潜流组合人工湿地处理生活污水研究[D]. 上海: 同济大学
http://cdmd.cnki.com.cn/Article/CDMD-10247-2008050849.htm |
梁威, 吴振斌, 周巧红, 等. 2002. 构建湿地基质微生物类群与污水净化效果及其相关分析[J]. 中国环境科学, 2002, 22(3): 282–258.
|
凌云, 林静, 徐亚同. 2009. 景观人工湿地微生物群落结构的季节变化[J]. 城市环境与城市生态, 2009, 22(4): 8–10.
|
刘军, 谢丹平, 刘思明, 等. 2009. 自流式复合生态滤床用于城市河道水质净化研究[J]. 中国给水排水, 2009, 25(5): 37–40.
|
刘开朗, 王加启, 卜登攀, 等. 2010. 微生物群落结构与功能多样性研究方法[J]. 生态学报, 2010, 30(4): 1074–1080.
|
刘志伟, 周美修, 宋俊玲, 等. 2014. 复合垂直流人工湿地污染物去除特征及微生物群落多样性分析[J]. 环境工程, 2014, 32(6): 38–42.
DOI:10.11835/j.issn.1005-2909.2014.06.010 |
Ragusa S R, McNevin D, Qasem S, et al. 2004. Indication of biofilm development and activity in constructed wetlands microcosms[J]. Water Research, 38(12): 2865–2873.
DOI:10.1016/j.watres.2004.03.039
|
Teixeira Lia C, Peixoto Raquel S, Cury Juliano C, et al. 2010. Bacterial diversity in rhizosphere soil from Antarctic vascular plants of Admiralty Bay, maritime Antarctica[J]. ISME Journal, 4(8): 989–1001.
DOI:10.1038/ismej.2010.35
|
商新利. 2012. 不同类型人工湿地中微生物分布及去除效果相关性研究[D]. 哈尔滨: 哈尔滨工业大学
http://cdmd.cnki.com.cn/Article/CDMD-10213-1013038969.htm |
孙寓姣, 赵轩, 王蕾, 等. 2014. 沣河水系脱氮微生物群落结构研究[J]. 生态环境学报, 2014, 23(9): 1451–1456.
|
Vela A I, Fernandez A, Sanchez-Porro C, et al. 2007. Flavobacterium ceti sp nov., isolated frombeaked whales (Ziphius cavirostris)[J]. International Journal of Systematic and Evolutionary Microbiology, 57(11): 2604–2608.
DOI:10.1099/ijs.0.65154-0
|
王绍祥, 杨洲祥, 孙真, 等. 2014. 高通量测序技术在水环境微生物群落多样性中的应用[J]. 化学通报, 2014, 77(3): 196–203.
|
Wang Q, Feng C, Zhao Y, et al. 2012. Denitrification of nitrate contaminated groundwater with a fiber-based biofilm reactor[J]. Bioresource Technology, 100(7): 2223–2227.
|
闻岳, 周琪, 蒋玲燕, 等. 2007. 水平潜流人工湿地对污水中有机物的降解特性[J]. 中国环境科学, 2007, 27(4): 508–512.
|
修海峰. 2011. 水平潜流人工湿地氮循环微生物效应及生态模型研究[J]. 上海: 同济大学
|
Yatsunenko T, Rey F E, Manary M J, et al. 2012. Human gut microbiome viewed across age and geography[J]. Nature, 486(7402): 222–227.
|
赵文莉, 郝瑞霞, 王润众, 等. 2015. 复合碳源填料反硝化脱氮及微生物群落特性[J]. 中国环境科学, 2015, 35(10): 3003–3009.
DOI:10.3969/j.issn.1000-6923.2015.10.017 |
 2017, Vol. 37
2017, Vol. 37


