2. 中国人民解放军防化研究院, 北京 102205;
3. 首都师范大学化学系, 北京 100048;
4. 清华大学环境与健康传感技术研究中心, 北京 100084
2. People's Liberation Army Institute of Chemical Defense, Beijing 102205;
3. Department of Chemistry, Capital Normal University, Beijing 100048;
4. Center for Sensor Technology of Environment and Health, Tsinghua University, Beijing 100084
金属铀作为放射性金属元素之一, 是核工业的重要原料, 目前以铀为基础的核电设施在各国发电设施中所占比重逐渐增大.《中国核电发展十三五规划研究报告》指出, 截止到2030年, 我国核电装机容量预计可达1.2~1.5亿千瓦, 较目前提高约5倍(苏罡, 2016;汪永平等, 2005).据统计, 每生产1 t金属铀, 会产生至少900 t的放射性废物(郝卿, 2013).含有金属铀的放射性废物在自然作用下, 会逐渐渗入水体、土壤等环境介质, 最终进入生物圈系统, 进而对人和生态系统造成极大损害, 导致巨大的生态灾难(Taylor et al., 1997;杨新兴等, 2015).金属铀的放射毒性及化学毒性极强, 半衰期可达数亿年, 会对生物体的免疫、生殖、造血等系统造成持久的紊乱和伤害(Gouget, 2011; Melo et al., 2011).目前, 多个国家已将金属铀列为优先控制的环境污染物(郝卿, 2013).
天然水中只有四价铀和六价铀的化合物才是稳定的, 水体中的铀一般以铀酰离子(UO22+)、铀离子(U4+)及水化物等形式存在, 并以铀酰离子形态为主(李希村等, 1963).目前针对铀的检测技术手段主要包括物理方法和化学方法两种(Rathore, 2008).其中, 物理方法主要针对放射性进行检测, 前处理简单, 检测速度快, 不过易受其他放射性物质的干扰, 造成测量的误差(Hou et al., 2008).化学方法主要针对元素的化学性质进行测量, 主要有离子色谱法(Shaw et al., 2000)、原子吸收光谱法(Abbasi, 1989)、电感耦合等离子体质谱法(Gonzalez et al., 2008)等.离子色谱法检测时间短、运行成本较低, 但灵敏度不高(Shaw et al., 2004).原子吸收光谱法及电感耦合等离子体法具有高灵敏度和高准确度的优点, 但仪器价格昂贵、运行成本高, 不适合现场快速检测, 并需要较为复杂的前处理步骤(Rani et al., 2013; Lorber et al., 1996).
功能核酸是一类由指数富集配体系统进化技术(SELEX)筛选得到的具有特定生物功能的核酸分子(Wilson et al., 1999), 能够与靶标物发生特异性亲和及反应, 包括脱氧核酶及核酸适配体等(Liu et al., 2009; Navani et al., 2006).功能核酸在环境监测领域应用广泛, 检测对象包括重金属离子、抗生素、细菌等, 具有操作简单、灵敏度高、成本低廉等优点(Li et al., 2009).Lee等(2008) 建立了一种基于铀酰离子特异性脱氧核酶和纳米金颗粒聚集的比色方法检测铀酰离子.Tang等(2013) 发展了基于二茂铁标记的脱氧核酶检测铀酰离子的电化学检测技术.目前利用功能核酸检测铀酰离子多偏重于方法学的构建和研究, 对于干扰因素的考察及实际水样的检测应用研究较少.而真实的环境水体中由于大量重金属的存在, 会导致缓冲液离子强度改变或由于重金属离子的淬灭作用导致荧光变弱(Liu et al., 2007), 均会对检测结果造成影响.基于此, 本研究利用能与铀酰离子特异反应的脱氧核酶, 结合荧光分光光度法, 建立一套可快速灵敏检测铀酰离子的技术方法, 并进行干扰金属离子的影响考察及实际水样加标回收率实验, 以期为实际水样中铀酰离子的检测提供支持.
2 材料与方法(Materials and methods) 2.1 仪器与试剂仪器:日立F-7000荧光光谱仪、RO-DI型超纯水发生器、梅特勒pH计、日立CF16RXⅡ离心机、HCH-300恒温金属浴.
试剂:2-(N-吗啉)乙磺酸一水合物(MES, 纯度99.5%)购自麦克林试剂公司;醋酸酰铀(优级纯);氯化钠、氯化镁、氯化锰、氯化铬均为优级纯, 购自麦克林试剂公司;铜、铅、汞、砷(Ⅴ)标准液(100 μg·mL-1)由国家有色金属及电子材料分析测试中心提供;氯化铁、硫酸钛均为分析纯, 购自国药化学试剂公司;浓硝酸、氢氧化钠均为分析纯, 购自北京化工厂.
底物链DNA序列为5′-Cy3-ACTCACTAT rA GGAAGAGATG -BHQ2-3′(以下简称SDNA), 酶链DNA序列为5′-CATCTCTTCAGTCGGGTAGTTAAA CCGACCTTCAGACATAGTGAGT-BHQ2-3′(以下简称EDNA), 以上核酸均由上海生工生物工程公司合成.Cy3为荧光基团, BHQ2为淬灭基团.
DNA分装:将装有SDNA与EDNA固体的PCR管放入离心机中离心, 用相应体积的超纯水溶解DNA粉末, SDNA与EDNA的浓度为100 μmol·L-1.
2.2 缓冲溶液及标准溶液配制MES缓冲液:3.9 g MES, 7.02 g NaCl, 400 mL高纯水, 即50 mmol·L-1 MES, 300 mmol·L-1 NaCl, NaOH溶液调pH至5.5.
铀酰离子标准溶液:醋酸酰铀溶于10 mmol·L-1稀硝酸制得, 浓度分别为0、5、10、15、20、25、50、75、100、125、250、375、500 nmol·L-1.
2.3 实验原理如图 1所示, SDNA的5′端标记Cy3荧光基团, 3′端标记BHQ2淬灭基团, EDNA的3′端标记BHQ2淬灭基团, 取适量SDNA与EDNA混合, 放入金属浴中加热退火, 完成SDNA与EDNA的杂交.基于荧光共振能量转移(FRET)原理, 在SDNA 5′端标记的Cy3荧光基团和EDNA 3′端标记的BHQ2淬灭基团, 实现荧光基团分子间和分子内淬灭, 使荧光背景信号降低到最低.在体系中加入UO22+后, EDNA的活性被激发, SDNA在酶切位点被切断, 带有荧光标记的短链从SDNA上脱落, 荧光基团得到释放, 荧光恢复, 荧光信号强度与加入的UO22+成正比关系.
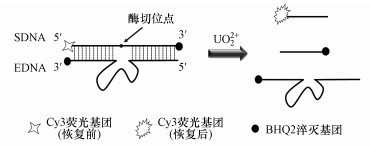 |
| 图 1 基于脱氧核酶荧光方法检测铀酰离子的原理图 Fig. 1 Scheme of the DNAzyme-based fluorescent method for the detection of UO22+ |
控制SDNA的反应终浓度为100 nmol·L-1, SDNA与EDNA的比例分别设置为1:0.4、1:1、1:1.5、1:2、1:2.5、1:5, 测量每个比例在不添加UO22+时的荧光值, 比较淬灭效果.以SDNA与EDNA比例为1:0.4为例:① 取1 μL 100 μmol·L-1的SDNA与0.4 μL 100 μmol·L-1的EDNA混合, 加入缓冲液至200 μL, SDNA浓度为500 nmol·L-1, EDNA浓度为200 nmol·L-1;② 将混合物放入金属浴中加热至90 ℃, 保持3 min, 自然冷却至室温;③ 取40 μL上述混合液与160 μL缓冲液(DNA与测量样品比例为1:4) 充分振荡混匀, SDNA终浓度为100 nmol·L-1, EDNA终浓度为40 nmol·L-1, 放入荧光仪中测量荧光信号, 每个比例重复3次.
2.4.2 SDNA与EDNA的浓度优化在SDNA与EDNA比例为1:2的条件下, 设置SDNA的终浓度分别为20、50、100、200、500 nmol·L-1, 体系中加入100 nmol·L-1 UO22+, 反应时间控制为6 min, 参照2.4.1节中的步骤, 测量在不同浓度SDNA条件下反应体系的荧光值, 每个浓度重复3次.
2.4.3 酶切反应时间优化在SDNA与EDNA比例为1:2, SDNA终浓度为100 nmol·L-1的条件下, 体系中分别加入20、40、100、400 nmol·L-1 UO22+, 参照2.4.1节中的实验步骤, 测量体系荧光值随时间的变化, 每个浓度重复3次.
2.5 检测限与线性范围确定在SDNA与EDNA比例为1:2, SDNA终浓度为100 nmol·L-1的条件下, 体系中分别加入不同浓度UO22+, 反应时间控制在6 min, 参照2.4.1节中的实验步骤, 记录荧光信号随铀酰离子浓度的变化, 每个浓度重复3次.
2.6 选择性测试选取As5+、Ca2+、Cd2+、Cu2+、Hg2+、Mg2+、Mn2+、Pb2+、Fe3+、Ti4+等金属离子进行选择性测试, 并设置空白对照, 实验中, 干扰金属离子的浓度设置为10 μmol·L-1, UO22+的浓度设置为100 nmol·L-1, 反应时间控制在6 min, 参照2.4.1节中的实验步骤, 记录加入不同金属离子情况下体系荧光强度的变化, 每种金属离子重复3次.
2.7 实际水样加标回收率测试选取饮用水和自来水进行加标回收率实验, 使用两种水样配制10、20、40 nmol·L-1的UO22+标准液, 为保证离子强度不变, 本次实验中所用缓冲液MES与NaCl浓度提高1倍, DNA样品与水样按1:1比例混合(与DNA溶液混合后UO22+的终浓度依次为5、10、20 nmol·L-1).参照2.4.1节中的实验步骤, 记录不同水样各个浓度样品加入后荧光信号的变化, 两种水样每个浓度均重复3次.
3 结果与讨论(Results and analysis) 3.1 反应条件优化讨论该检测方法是加入铀酰离子后, SDNA与EDNA双链体系发生酶切反应, SDNA断裂, 荧光短链被释放, 通过比较反应前后体系荧光值的差异定量铀酰离子, 因而背景信号的强弱将直接影响实验结果, 实验中通过在EDNA的3′端标记淬灭基团降低背景信号, SDNA与EDNA的比例不同, 背景信号会有较大差异.实验中, SDNA与EDNA设置了1:0.4、1:1、1:1.5、1:2、1:2.5、1:5共6组比例, 考察底物链与酶链在不同比例条件下, 体系背景信号的强弱.从图 2中可以看到, 随着EDNA与SDNA比例的不断增大, 背景信号值逐渐降低, 说明淬灭基团的淬灭作用在逐渐增强, 当SDNA与EDNA的比例达到1:2时, 进一步增大EDNA与SDNA比例后, 信号下降幅度明显减小.综合经济因素比较, 将SDNA与EDNA最适比例设置为1:2.
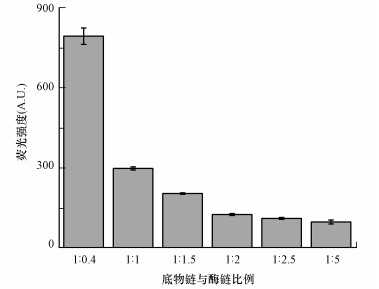 |
| 图 2 底物链与酶链的比例对荧光信号的影响 Fig. 2 Effect of the ratio between substrate strand and DNAzyme strand on the intensity of the fluorescence signal |
底物链与酶链的浓度对于酶切反应的进行同样至关重要, 链的浓度过低, 会导致酶切反应速度过慢, 检出信号过低, 链的浓度过高, 会导致检出信号过高, 甚至超出仪器的检出限, 而且并不经济.实验中, 固定底物链与酶链的比例为1:2, 选取了底物链的浓度为20、50、100、200、500 nmol·L-1进行考察, 通过比较体系加入100 nmol·L-1UO22+后信号强度的异同, 来确定最适浓度.如图 3和表 1所示, 随着底物链和酶链浓度的增加, 荧光信号不断增强, 如使用20 nmol·L-1 SDNA时, 对应的荧光信号为585.1, 而增大SDNA到500 nmol·L-1, 则对应的检测信号可上升至3614.3.尽管使用高浓度底物链和酶链可以获得较好的信号强度, 从而得到较高的灵敏度, 但综合考虑性价比, 当SDNA浓度从20 nmol·L-1升高至500 nmol·L-1, 浓度提高25倍, 信号值仅提高约6倍, 若选择500 nmol·L-1作为底物链的浓度, 这将带来高的成本, 不利于该技术应用化.鉴于上述原因, 使用100 nmol·L-1 SDNA不但可以获得较高的信号值, 而且性价比也较为合适, 因此, 随后的研究选择100 nmol·L-1作为底物链SDNA的最适浓度.
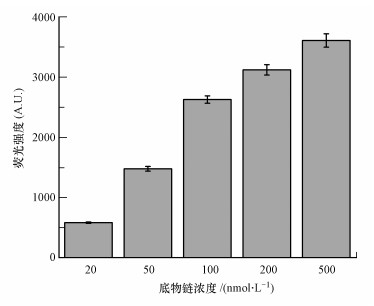 |
| 图 3 100 nmol·L-1UO22+条件下底物链与酶链的浓度对荧光信号的影响 Fig. 3 Effect of the concentration of substrate strand and DNAzyme strand on the intensity of the fluorescence signal upon challenging with 100 nmol·L-1UO22+ |
| 表 1 底物链浓度和荧光信号强度之间的关系 |
选择合适的酶切反应时间对于实现定量检测至关重要.酶切反应时间过短, 体系反应不够充分, 检出信号偏低, 误差较大, 反应时间过长, 底物均充分反应, 信号趋于一致.通过考察体系中加入不同浓度(20、40、100、400 nmol·L-1)的铀酰离子, 观察荧光信号随时间的变化进而确定最适反应时间.图 4显示,当反应时间达到300 s, 即6 min时, 各个浓度下的信号值差别最大, 因而根据实验结果, 设置6 min为最适反应时间.
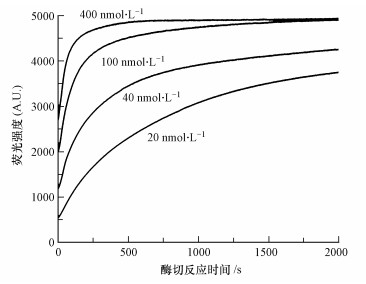 |
| 图 4 不同浓度铀酰离子酶切反应荧光信号随反应时间的变化 Fig. 4 Fluorescence intensity changes over time in the presence of at UO22+different concentrations |
在底物链与酶链的比例为1:2, 底物链浓度为100 nmol·L-1, 反应时间为6 min的最适反应条件下, 通过加入4~400 nmol·L-1等12个浓度的铀酰离子考察检测方法的线性范围与检测限.如图 5所示, 随着铀酰离子浓度的增加, 荧光信号值逐渐增强, 当铀酰离子浓度达到100 nmol·L-1后, 信号上升的幅度明显减小, 逐渐趋于平衡, 此时酶切反应进行得较为完全.由图 6可知, 该检测方法的荧光信号值在铀酰离子浓度为4~20 nmol·L-1时呈现良好的线性关系, 线性回归方程为Y=55.76X+356.91, 可决系数为0.9438, 根据基质空白产生的背景信号平均值加上3倍的均数标准差的方法(Shrivastava et al., 2011), 确定检测限为0.7 nmol·L-1.如表 2所示, 本研究方法与离子色谱等常规检测方法相比, 检测限具有显著的对比优势, 这是由于功能核酸的酶切反应中, UO22+可以重复利用, 即一个UO22+可参与多个底物链断裂的酶切反应(Li et al., 2009), 从而保证该方法具有更高的灵敏度.而与共振光散射法等同类型生物传感技术相比, 由于检测策略中设计底物链与酶链同时标记淬灭基团, 通过分子间和分子内的共同淬灭效应, 进一步提高了检测灵敏度(Liu et al., 2003).
 |
| 图 5 不同浓度铀酰离子酶切反应对应的荧光光谱图 Fig. 5 Fluorescence spectra in the presence of UO22+at different concentrations |
 |
| 图 6 本研究开发的检测方法的校正曲线 Fig. 6 Calibration curve of this detection method |
| 表 2 本研究开发的检测方法与其他方法的性能比较 Table 2 Performance comparison between this detection method and other methods |
为了确保该检测方法能选择性识别及测定水中的铀酰离子, 考察了加入100倍于铀酰离子浓度(10 μmol·L-1)的As5+、Ca2+、Cd2+、Cu2+、Hg2+、Mg2+、Mn2+、Pb2+、Fe3+、Ti4+等金属离子后体系的荧光信号变化.从图 7观察得到, 除了加入Pb2+及Hg2+后体系荧光值出现些许上升外, 其他金属离子几乎不会引起体系荧光信号的增强, 说明常见的金属离子不会干扰UO22+的测定, 该检测方法对于UO22+具有较好的选择性.
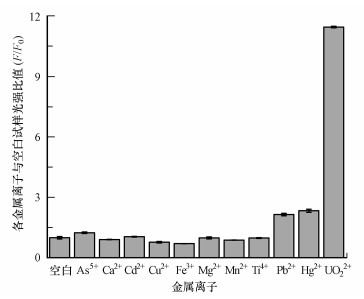 |
| 图 7 本研究开发的检测方法选择性测试 Fig. 7 Selectivity tests of this detection method |
为了验证该方法对实际水样检测的可行性, 利用清华大学饮用水和自来水分别进行加标回收率实验, 结果如表 3所示.饮用水中铀酰离子的回收率为98.0%~107.8%, 相对标准偏差最大为2.20%, 自来水中铀酰离子的回收率为90.0%~108.0%, 相对标准偏差最大为3.56%.相比之下, 饮用水的加标回收率实验结果好于自来水, 且更加稳定, 很可能是由于饮用水制作工艺中包含多层膜过滤处理, 其含有更少的有机物质, 对于检测的影响更小.两种水样的实验结果表明该方法可用于实际水样的检测.
| 表 3 加标水样检测结果 Table 3 Detection of UO22+spiked in water samples |
本研究基于DNAzyme在分子水平上对于铀酰离子的高特异性识别原理, 结合荧光分光光度法, 建立了检测铀酰离子的新方法, 该方法可实现对于铀酰离子的快速、灵敏检测, 检测时间仅为6 min, 线性范围为4~20 nmol·L-1, 检测限可达0.7 nmol·L-1.该方法对于铀酰离子具有高的选择性, 不受其他金属离子的干扰.该方法成功实现了在实际水样中样品的加标回收实验, 在饮用水和自来水中铀酰离子的回收率分别为98.0%~107.8%和90.0%~108.0%.基于这些特点, 该方法为实际水样中铀酰离子的快速、灵敏、特异检测提供了技术支撑, 展现了利用功能核酸检测金属铀在环境监测领域的应用潜力.
Abbasi S A. 1989. Atomic-absorption spectrometric and spectrophotometric trace analysis of uranium in environmental-samples with n-para-methoxyphenyl-2-furylacrylohydroxamic acid and 4-(2-pyridylazo) resorcinol[J]. International Journal of Environmental Analytical Chemistry, 36(3): 163–172.
DOI:10.1080/03067318908026869
|
Gonzalez J J, Oropeza D, Mao X, et al. 2008. Assessment of the precision and accuracy of thorium (Th-232) and uranium (U-238) measured by quadrupole based inductively coupled plasma-mass spectrometry using liquid nebulization, nanosecond and femtosecond laser ablation[J]. Journal of Analytical Atomic Spectrometry, 23(2): 229–234.
DOI:10.1039/B702754K
|
Gouget B. 2011. Uranium:Toxicity to Renal Cells and Osteoblasts[M]. Burlington: Elsevier: 534–540.
|
Hou X, Roos P. 2008. Critical comparison of radiometric and mass spectrometric methods for the determination of radionuclides in environmental, biological and nuclear waste samples[J]. Analytica Chimica Acta, 608(2): 105–139.
DOI:10.1016/j.aca.2007.12.012
|
郝卿. 2013. 核废料处理方法及管理策略研究[D]. 北京: 华北电力大学
|
李希村, 陆茂修. 1963. 关于地下水中铀的存在形式及其以UO2形式沉淀的条件[J]. 铀矿地质, 1963(2): 28–33.
|
Lee J H, Wang Z, Liu J, et al. 2008. Highly sensitive and selective colorimetric sensors for uranyl (UO22+):development and comparison of labeled and label-free dnazyme-gold nanoparticle systems[J]. Journal of the American Chemical Society, 130(43): 14217–14226.
DOI:10.1021/ja803607z
|
Liu J, Cao Z, Lu Y. 2009. Functional nucleic acid sensors[J]. Chemical Reviews, 109(5): 1948–1998.
DOI:10.1021/cr030183i
|
Liu J, Lu Y. 2007. A DNAzyme catalytic beacon sensor for paramagnetic Cu2+ ions in aqueous solution with high sensitivity and selectivity[J]. Journal of the American Chemical Society, 129(32): 9838–9839.
DOI:10.1021/ja0717358
|
Liu J, Lu Y. 2003. Improving fluorescent DNAzyme biosensors by combining inter-and intramolecular quenchers[J]. Analytical Chemistry, 75(23): 6666–6672.
DOI:10.1021/ac034924r
|
Li Y, Lu Y. 2009. Functional Nucleic Acids for Analytical Applications[M]. New York: Springer.
|
Lorber A, Karpas Z, Halicz L. 1996. Flow injection method for determination of uranium in urine and serum by inductively coupled plasma mass spectrometry[J]. Analytica Chimica Acta, 334(3): 295–301.
DOI:10.1016/S0003-2670(96)00278-4
|
Melo D, Burkart W. 2011. Uranium:Environmental Pollution and Health Effects[M]. Burlington: Elsevier: 526–533.
|
Navani N K, Li Y. 2006. Nucleic acid aptamers and enzymes as sensors[J]. Current Opinion in Chemical Biology, 10(3): 272–281.
DOI:10.1016/j.cbpa.2006.04.003
|
Rani A, Mehra R, Duggal V, et al. 2013. Analysis of uranium concentration in drinking water samples using icpms[J]. Health Physics, 104(3): 251–255.
DOI:10.1097/HP.0b013e318279ba05
|
Rathore D P. 2008. Advances in technologies for the measurement of uranium in diverse matrices[J]. Talanta, 77(1): 9–20.
DOI:10.1016/j.talanta.2008.06.019
|
Shaw M J, Haddad P R. 2004. The determination of trace metal pollutants in environmental matrices using ion chromatography[J]. Environment International, 30(3): 403–431.
DOI:10.1016/j.envint.2003.09.009
|
Shaw M J, Hill S J, Jones P, et al. 2000. Determination of uranium in environmental matrices by chelation ion chromatography using a high performance substrate dynamically modified with 2, 6-pyridinedicarboxylic acid[J]. Chromatographia, 52(9/10): 695–700.
|
Shrivastava A, Gupta V B. 2011. Methods for the determination of limit of detection and limit of quantitation of the analytical methods[J]. Chronicles of Young Scientists, 2(1): 21–25.
DOI:10.4103/2229-5186.79345
|
苏罡. 2016. 中国核能科技"三步走"发展战略的思考[J]. 科技导报, 2016, 34(15): 33–41.
|
Tang Q, Yuan Y, Xiao X, et al. 2013. DNAzyme based electrochemical sensors for trace uranium[J]. Microchimica Acta, 180(11/12): 1059–1064.
|
Taylor D M, Taylor S K. 1997. Environmental uranium and human health[J]. Reviews on Environmental Health, 12(3): 147–157.
|
Wilson D S, Szostak J W. 1999. In vitro selection of functional nucleic acids[J]. Annual Review of Biochemistry, 68: 611–647.
DOI:10.1146/annurev.biochem.68.1.611
|
汪永平, 赵守峰, 袁玉俊, 等. 2005. 2020年中国核能发展战略研究[J]. 中国核科技报告, 2005(1): 154–163.
|
杨新兴, 李世莲, 尉鹏, 等. 2015. 环境中的放射性污染及其危害[J]. 前沿科学, 2015, 9(1): 4–15.
|
Zhou B, Shi L, Wang Y, et al. 2013. Resonance light scattering determination of uranyl based on labeled DNAzyme-gold nanoparticle system[J]. Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy, 110: 419–424.
DOI:10.1016/j.saa.2013.03.036
|
 2017, Vol. 37
2017, Vol. 37


