2. 曲阜师范大学地理与旅游学院, 日照 276826;
3. 中国科学院教育部水土保持与生态环境研究中心, 杨凌 712100;
4. 中国科学院大学, 北京 100049
2. College of Geography and Tourism, Qufu Normal University, Rizhao 276826;
3. Research Center of Soil and Water Conservation and Ecological Environment, Chinese Academy of Sciences and Ministry of Education, Yangling 712100;
4. University of Chinese Academy of Sciences, Beijing 100049
废弃农作物无限制地焚烧, 不仅造成了农村生态破坏、环境污染等问题, 也极大地浪费了生物质资源(陈温福等, 2011).近年来, 废弃农作物秸秆在热解条件下制备的生物炭已经成为农业、环境和能源资源等领域的研究热点之一(McHenry et al., 2011;Yuan et al., 2011;武玉等, 2014).生物炭陈化是指存在于变动环境(温度、湿度等)中的生物炭, 其物理和化学性质会随着时间的延长而改变的过程, 比如生物炭在土壤环境中的生物和非生物的氧化还原作用, 微生物的溶解作用, 土壤中有机质、矿物质和溶质的相互作用等(鞠文亮等, 2016).研究发现, 自然界的风雨侵蚀和冻融循环等均会改变滞留在土壤中的生物炭的物理结构, 且随着滞留时间的延长, 生物炭表面逐渐发生氧化等反应, 其pH值、表面化学元素组成和非芳香烃结构等性质发生变化(Heitkötter et al., 2015;Mukherjee et al., 2014;文方园等, 2016).
国内外对生物炭短期效应的研究甚多, 而对长期效应的研究还缺乏理论基础, 尤其是对陈化生物炭理化性质的研究理论较少.为进一步丰富陈化生物炭理化性质的研究成果, 本研究采用国内主要废弃农作物棉花秸秆为原料, 在不同热解温度下制备生物炭, 通过冻融、干湿两种方式加速生物炭陈化过程, 分析生物炭主要理化性质在陈化前后的变化规律, 探索陈化处理对生物炭理化性质的影响机制, 为生物炭陈化研究以及长期合理高效利用生物炭提供理论依据.
2 材料与方法(Materials and methods) 2.1 供试材料 2.1.1 供试土壤和秸秆土壤取自山东省日照市东港区(35°30′N, 119°16′E)棉花田地10~20 cm表层土, 待其自然风干, 挑出石子等杂物, 研磨过0.150 mm筛供陈化处理试验用.供试土壤类型为棕壤, 其pH为6.06, 持水量为23.05%.试验秸秆(2015年8月收割的新鲜棉花秸秆)取自同处, 自然风干后, 剪碎(3 cm)供生物炭制备使用.
2.1.2 供试生物炭风干后的棉花秸秆(cotton straw)经研磨式粉碎机(RT-34, 中国台湾)粉碎, 秸秆粉末填满于瓷坩埚中, 压实排除坩埚内的空气, 密闭置于人工智能电炉(KSY-12D-16, 中国龙口)中.生物炭的制备采用缺氧控温慢速热裂解法(Yakkala et al., 2013), 加热前先以5 L·min-1的速率充氮, 待炉内完全充满氮气后, 分别缓慢升温至350、500和650 ℃, 并保持氮气流通状态(0.5 L·min-1)热解30 min.待冷却至室温取出样品, 过0.150 mm筛, 装袋标记, 储存于干燥器中备用.将3个不同热解温度梯度的棉花秸秆生物炭样品分别标记为C-350、C-500、C-650.
2.2 陈化处理方法 2.2.1 冻融(freeze-thaw)试验处理参照并改进苗微(2014)的冻融陈化方法, 定制直径为5 cm, 高为30 cm的PVC圆柱管, 圆柱管下端装石英砂2 cm, 石英砂上面装10 cm高土壤(取自山东省日照市棕壤, pH=6.06), 土壤上面装入15 cm生物炭样品, 石英砂、土壤柱和生物炭分别用玻璃纱网布和0.075 mm尼龙网隔开.在冻融试验进行之前, 设计一次淋溶, 淋溶量按照山东省日照市的年降水量(63 mm)计算, 然后将装有生物炭的PVC圆柱管放置在恒温恒湿箱(GDWJS-250, 中国上海)中进行冻融试验, 冻融时间为60 d, 其中-15 ℃/30 d, 45 ℃/30 d.冻融试验结束后, 将生物炭样品取出, 在60 ℃左右干燥, 且过0.150 mm筛.将冻融处理得到的陈化棉花秸秆生物炭分别标记为CF-350、CF-500、CF-650, 储存于干燥器中备用.
2.2.2 干湿(dry-wet)试验处理参照并改进苗微(2014)和Guo等(2014)的干湿陈化方法, 试验采用长30 cm, 宽15 cm和高20 cm的透明硬质塑料盒, 装入15 cm高土壤(同上棕壤).用0.075 mm的尼龙网装置生物炭样品, 按照14 t·hm-2的比例添加到土壤中, 且水平放置在土壤中间层.室温下在人工气候箱(ZRQ-400, 中国上海)里进行干湿试验, 干湿时间为40 d, 其中30%/20 d, 90%/20 d.干湿试验结束后, 样品处理和冻融陈化后生物炭样品处理方式等同, 将干湿处理得到的陈化棉花秸秆生物炭分别标记为CD-350、CD-500、CD-650.
2.3 理化性质的测定方法 2.3.1 产率、灰分和pH值生物炭产率、灰分和pH值的测定分别参照《木质活性炭试验方法》GB/T17664、GB/T12496.3和GB/T12496.7(1999).用电子天平(AUX220, 日本)称量秸秆热解前后的干重, 计算不同热解温度梯度下的生物炭产率.称取过0.150 mm的干燥生物炭样品1.00 g, 置于坩埚中, 然后放置于人工智能电炉中800 ℃灰化4 h, 待灰化样品冷却后称重, 灰化前后质量之比即为灰分含量.称取过0.150 mm的生物炭样品2.50 g, 置于100 mL的锥形瓶中, 加入50 mL去离子水, 振荡, 加热, 冷却至室温后过滤, 用pH计(PHS-3C, 中国上海)测定样品pH值, 所得数据基于重复测量, 显示平均值±标准偏差的形式.
2.3.2 元素含量采用C、N、H元素分析仪(EA3000, 意大利)测定生物炭样品的元素含量.选用C、N、H元模式, 在燃烧炉980 ℃、还原炉850 ℃条件下测量空白、标准样品和生物炭样品的C、N、H元峰, 建立标准曲线后计算出生物炭样品中C、N和H元素的准确含量.生物炭样品的O含量通过差减法(O%=100%-C%-N%-H%-灰分%)计算得出(Zhang et al., 2015).
2.3.3 比表面积及孔径首先在环境温度25 ℃下对生物炭样品进行预处理, 在电子天平上准确称量样品管的质量(多次称量取平均值), 把待测样品置于样品管中, 把装有样品的样品管在100 ℃的真空下干燥4 h, 再称量样品管的质量.然后以氮气为介质, 采用比表面积及孔径分析仪(V-Sorb 2800P, 中国北京)在77 K(液氮)的温度下测试生物炭样品的比表面积及孔径.
2.3.4 表面官能团利用傅立叶变化红外光谱仪(tensor27, 德国)分析检测生物炭样品, 光谱扫描波数4000~400 cm-1, 扫描64次, 分辨率为4 cm-1.采用软件Origin 9.0对数据进行分析处理并作图, 根据生物炭样品的红外光谱图定性分析生物炭所含的表面官能团, 判断生物炭对应的化学结构.
2.3.5 表面形态生物炭样品先在液氮冷冻拗断裂面喷铂金进行预处理, 然后采用冷场发射扫描电子显微镜(JSM-6700F, 日本)对生物炭样品的表观形貌进行观察.冷场发射扫描电子显微镜对生物炭样品的扫描条件是加速电压5.0 kV, 放大倍数2000倍, 多次扫描, 采用效果清晰的扫描图.
3 结果与讨论(Results and discussion) 3.1 生物炭产率、灰分和pH值生物炭产率、灰分和pH值的测定结果见表 1.棉花秸秆在热解温度为350、500和650 ℃时制备的生物炭的产率、灰分含量和pH值分别介于28.10%~43.54%、3.98%~8.81%和7.39~9.73之间.随着热解温度的升高, 秸秆生物炭产率由43.54%降低到28.10%, 这主要是由于棉花秸秆的主要成分中含有大量的有机质(纤维素、半纤维素和木质素等), 这些有机质容易被高温分解和转化, 且温度越高分解地越彻底(Keiluweit et al., 2010).灰分是生物质燃烧后的残留物, 在生物炭的理化性质、修复土壤和作为吸附剂等方面起到关键作用(王群等, 2013).随着热解温度的升高, 秸秆生物炭的灰分含量由3.98%增加到8.81%, 这主要是由于棉花秸秆中的有机物逐渐损失, 挥发分大量析出(Cao et al., 2010).随着热解温度的升高, 秸秆生物炭的pH值由7.39增加到9.73, 这主要是由于生物炭表面碱性官能团的增加导致(Ahmad et al., 2012).研究还发现, 生物炭中含有的灰分含量越多, 其pH值越大, 灰分含量也是影响生物炭pH值的主要因素(Novak et al., 2009).随着热解温度的升高, 生物炭的产率与热解温度呈负相关, 而灰分含量和pH值与热解温度呈正相关, 本研究结果与国内外文献报道结果相符(Recari et al., 2014;Uchimiya et al., 2011;王章鸿等, 2015).
| 表 1 生物炭产率、灰分和pH值 Table 1 Yield, ash and pH of biochars |
如表 1所示, 冻融和干湿陈化处理后, 350 ℃生物炭的pH值从7.39分别下降到7.37和7.26;500 ℃生物炭的pH值从8.43分别下降到8.35和7.80;650 ℃生物炭的pH值从9.73分别下降到8.93和8.70.冻融陈化处理的350、500和650 ℃生物炭, 其pH值分别下降了0.27%、0.95%和8.22%;干湿陈化处理的350、500和650 ℃生物炭, 其pH值分别下降了1.76%、7.47%和10.59%.350 ℃新鲜生物炭的pH值受陈化处理的影响较小, 而650 ℃新鲜生物炭的pH值受陈化处理的影响较大, 这可能是由于热解温度较低时秸秆处于未完全热解状态(秸秆粉末少和秸秆生物炭多的混合体), 这种混合状态较稳定, 受陈化处理的影响较小(Zhao et al., 2015).
经过冻融和干湿陈化处理后, 棉花秸秆生物炭的pH值下降, 其主要原因可能是生物炭表面发生氧化反应, 随着氧化时间的延长, 生物炭表面对环境介质中氧气和水分等物质的非生物化学吸附增强, 其表面酸度增加, 进而导致生物炭的pH值下降, 本研究结果与许多文献报道结果基本相符(Hale et al., 2011;Mukherjee et al., 2014;Zhao et al., 2015).还有一些学者认为陈化生物炭pH下降的原因可能是由于生物炭中含有的某些基本物质(如碳酸盐、氢氧化物等)的溶解等(Yao et al., 2010).因此, 学者对于陈化处理影响生物炭pH值的反应机理并没有统一的标准, 普遍认同的是表面氧化反应.
3.2 元素含量生物炭及陈化生物炭的元素含量结果见表 2.同一热解温度制备的棉花秸秆生物炭的元素含量中C>O>H>N.随着热解温度的升高, 生物炭的C和灰分含量增加, H和O含量却减少.(N+O)/C、H/C和O/C的比值可分别表征生物炭的极性、芳香性和亲水性的大小, 三者比值越大分别表示极性越大、芳香性越低和亲水性越强(Krull et al., 2009).从原子比值大小可知, 随着热解温度的升高, H/C和O/C逐渐下降, 生物炭的芳香性越来越高, 而亲水性越来越弱, 这主要是由于有机物热转化为碳化有机物和含有稠环碳的结构, 如芳香环结构等(Keiluweit et al., 2010;Qian et al., 2014).由于O/C比值还可以表征生物炭的阳离子交换量(CEC), O/C越小则CEC越小(Shaaban et al., 2014), 所以, 随着热解温度的升高, 生物炭的CEC逐渐降低.
| 表 2 生物炭和陈化生物炭的元素组成 Table 2 Elements of fresh and aged biochars |
生物炭经过冻融和干湿陈化处理后, 其元素含量和原子比发生了明显的变化.总体看来, 具体表现为:陈化生物炭的C含量明显减少, O含量明显增加, N和H含量变化不明显, 灰分含量变化无规律可循;(N+O)/C和O/C比值明显升高, H/O比值变化不明显.陈化生物炭的O含量明显增加, C含量明显减少, 这主要归因于冻融和干湿陈化处理加速生物炭表面发生氧化反应, 这种现象和反应机理与许多文献报道基本相符(Cheng et al., 2009;Nguyen et al., 2009).陈化生物炭的O/C比值明显升高, 说明本研究所采用的陈化处理可以显著地提高生物炭的CEC, 进而影响生物炭的吸附能力(Shaaban et al., 2014), 这种研究结果已经被证实(Lin et al., 2012).研究还发现, 陈化处理对生物炭元素含量的影响, 不仅与陈化方法和陈化时间相关, 还与陈化生物炭类型相关(Cheng et al., 2009;Mukherjee et al., 2014).
3.3 比表面积及孔径采用BET法计算棉花秸秆生物炭样品的比表面积和孔体积, BJH法计算孔径, 其结果见表 3.由表 3数据可知, 生物炭及陈化生物炭的比表面积、孔体积和孔径有着较明显的差异.在相同原料(棉花秸秆)下, 不同热解温度(350、500和650 ℃)制备的生物炭其比表面积、孔体积和孔径都存在差异.就单点BET比表面积代表来看, C-650>C-500>C-350说明随着热解温度的升高, 生物炭的单点BET比表面积增加, 且在500~650 ℃之间变化较大, 多点BET比表面积和孔体积也有相同的变化趋势.由孔径分析来看, 随着热解温度的升高, 生物炭的单点总孔吸附平均孔直径和BJH中孔吸附平均孔直径逐渐减小, 而BJH中孔脱附平均直径却先减小后增加.总体来看, 随着热解温度的升高, 生物炭的比表面积和孔体积逐渐增加, 而孔径却减小.这主要是由于热解温度的升高, 促使秸秆的裂解程度加剧, 生物质挥发分的析出, 孔隙结构逐渐发育, 微孔数量和体积增加(Ding et al., 2014;Uchimiya et al., 2010).
| 表 3 生物炭及陈化生物炭的表面特征测定结果 Table 3 The surface characteristics of fresh and aged biochar |
生物炭经过陈化处理后, 其比表面积、孔体积和孔径发生明显地变化.就多点BET比表面积为代表来看, 陈化生物炭的多点BET比表面积增大, 且温度越高的生物炭增大效果越明显, 比如C-350与CF-350和CD-350的多点BET比表面积分别相差1.445和3.516, 而C-650与CF-650和CD-650的多点BET比表面积却分别相差72.828和111.518.单点BET比表面积和孔体积也有相同的变化趋势.一些文献报道发现, 陈化处理可以使生物炭中无机物溶解和再沉淀, 导致生物炭孔隙被堵塞, 或者土壤中微生物覆盖于生物炭表面, 进而降低生物炭的比表面积(Hale et al., 2011;Mukherjee et al., 2014).然而, 本研究结果却发现陈化处理可以导致生物炭的比表面积和孔体积增大, 这种现象与苗微(2014)的研究结果基本相似, 究其原因, 可能是因为本研究的陈化时间与Hale等(2011)和Mukherjee等(2014)相比较短, 在此陈化期间使生物炭表面孔结构的发育程度大于生物炭孔隙的堵塞程度.比表面积对生物炭的吸附性能有一定的贡献(王章鸿等, 2015), 因此, 陈化处理导致生物炭比表面积的变化必然会影响其吸附能力.
孔径<2 nm的为微孔;孔径介于2~50 nm之间的为介孔(中孔);孔径>50 nm的为大孔.根据表 3孔径测定结果, 采用BJH法得到生物炭样品的孔径分布曲线图, 如图 1所示.孔径分布曲线图变化率越大说明该直径范围内孔数量相对较多, 孔径结构越易区分.由图 1可以明显发现, 生物炭样品(除了CD-500外)孔体积变化率在2~50 nm孔径范围内较大, 说明这些生物炭样品孔径分布集中于介孔, 介孔结构丰富(王彤彤等, 2017).CD-500孔体积变化率在>50 nm孔径范围内较大, 孔径分布集中于大孔, 这可能由于干湿陈化处理对500 ℃的棉花秸秆生物炭的孔隙结构影响较大造成的.总体看来, 热解温度、热解时间和热解材料是决定生物炭比表面积及孔径的主要因素, 且陈化环境(温度、湿度)和陈化时间可以改变生物炭比表面积及孔径, 其改变程度需综合所有因素分析.
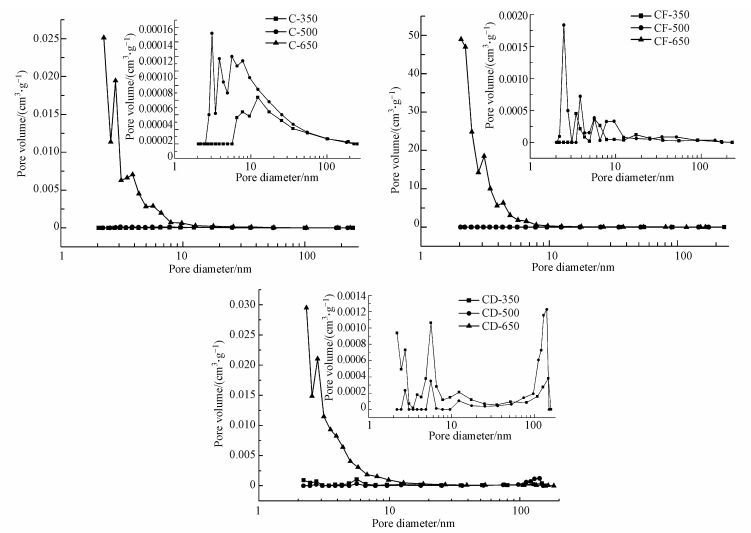 |
| 图 1 生物炭及陈化生物炭的BJH孔径分布图 Fig. 1 BJH pore size distributions of fresh and aged biochars |
生物炭及陈化生物炭的FTIR见图 2.由棉花秸秆生物炭的红外谱图可知:3400 cm-1处的吸收峰为羟基的O—H伸缩振动, 且随着热解温度的升高, 羟基的伸缩振动减弱;1590 cm-1处的吸收峰为芳环的CC、CO伸缩振动(Chen et al., 2008;Lee et al., 2013), 且随着热解温度的升高, 芳环的CC、CO伸缩振动减弱甚至消失;1430 cm-1处的吸收峰为—COOH和—CHO的伸缩振动, 且随着热解温度的升高, —COOH和—CHO的伸缩振动逐渐减弱;1030 cm-1处的吸收峰为羟基和羧基的C—O伸缩振动(Sing et al., 2012);780 cm-1处的吸收峰为杂环或芳香环的C-H伸缩振动(Hossain et al., 2011).从红外谱图中吸收峰的伸缩振动变化可知, 随着热解温度的升高, 生物炭酸性官能团和脂肪族含量减少, 芳香族含量较多, 这主要是由于棉花秸秆生物炭中有机质(纤维素和木质素)大量分解, H和O元素大量损失, 同时也证明了随着热解温度的升高, 生物炭碱性增强, 性质趋于稳定这一现象(Keiluweit et al., 2012;Peng et al., 2011;常春等, 2016).
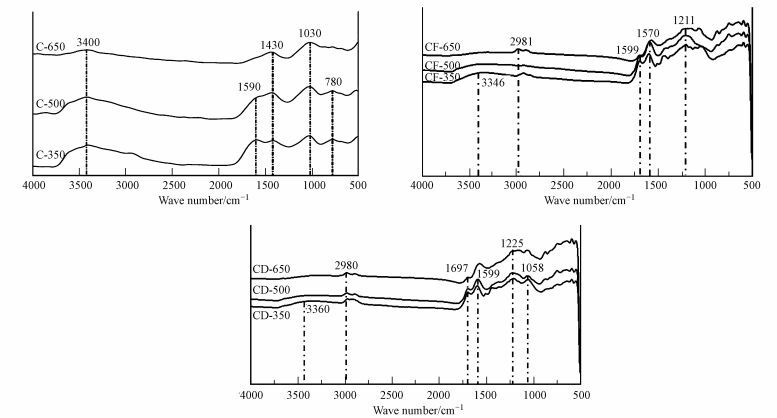 |
| 图 2 生物炭及陈化生物炭的红外谱图 Fig. 2 FTIR spectra of fresh and aged biochars |
对比陈化生物炭与生物炭的FTIR可知, 陈化生物炭的表面官能团发生明显的变化.陈化生物炭的FTIR图中3346 cm-1和3360 cm-1处的吸收峰为羟基的O—H伸缩振动;2980 cm-1附近的吸收峰为脂肪族的C—H伸缩振动;1697 cm-1处的吸收峰为羧酸的CO伸缩振动;1599 cm-1和1570 cm-1处的吸收峰为芳香性CO伸缩振动(Lee et al., 2013);1225 cm-1和1211 cm-1处的吸收峰为脂肪族C—O伸缩振动;1058 cm-1处的吸收峰为有机硅化合物Si—O伸缩振动(Li et al., 2015).总体而言, 棉花秸秆生物炭经过陈化后, 陈化生物炭的表面官能团数目和含量相对增加;陈化生物炭表面的羟基含量减少, 脂肪族化合物和有机硅化物含量增加;陈化生物炭表面的酸性官能团(如羧酸)含量增加, 进而导致陈化生物炭碱性的下降, 这也证明了本研究得出的陈化可以降低生物炭碱性这一现象.有文献报道发现, 生物炭在陈化处理过程中, 生物炭表面经历了脱羧和羟基化过程, 形成的羟基和酯基抵消了脱羧过程中的氧原子损失, 甚至增加了生物炭表面的总氧含量, 同时也发现了脂肪族化合物的出现等现象(Guo et al., 2014;Qian et al., 2014;Zhao et al., 2015).
3.5 表面形态生物炭的SEM图像比较直观形象地表征生物炭的表面形态和孔隙结构变化, 棉花秸秆生物炭及其陈化生物炭的SEM图像见图 3.不同热解温度下制备的棉花秸秆生物炭(C-350、C-500和C-650) 的表面形态有相似之处, 但也存在着差异.棉花秸秆生物炭表面光滑度C-350>C-500>C-650, 表面微孔数及清晰度C-650>C-500>C-350.随着热解温度的升高, 棉花秸秆生物炭的表面变得粗糙, 表面微孔数目增加, 孔隙结构更加清晰, 孔隙的孔径相对变大等, 这主要原因可能是秸秆中含有大量的有机质(纤维素、木质素等), 这些有机质高温分解, 挥发分会释放较大的内压, 从而形成较多的孔隙结构(潘萌娇等, 2014).随着热解温度的升高, 生物炭表面的孔隙结构相对增加, 进而增加生物炭的比表面积, 这一研究结果与简敏菲等(2016)的研究结果基本相符.
 |
| 图 3 生物炭和陈化生物炭的SEM图像 Fig. 3 Scanning electron microscope images of fresh and aged biochars |
棉花秸秆生物炭经过冻融、干湿陈化处理后, 其表面形态和孔隙结构发生改变, 主要表现在:350、500和650 ℃棉花秸秆生物炭较完整的管状结构被破坏, 变成破碎的片状结构(Zhao et al., 2015);陈化生物炭的表面光滑度下降, 表面变得粗糙, 如光滑度C-650>CF-650>CD-650, 这可能是由于陈化过程中土壤中矿物颗粒等物质的覆盖于生物炭表面, 而不是生物炭孔隙中(Lin et al., 2012;Mukherjee et al., 2014);陈化生物炭的表面微孔数增加, 微孔结构逐渐发育变大, 陈化可以增大生物炭比表面积, 这与Trigo等(2014)的研究结果基本相符.本研究陈化处理对生物炭表面形态的影响不是很显著, 这可能是由于陈化材料的差异性和陈化时间较短导致的.
4 结论(Conclusions)1) 热解温度是影响生物炭理化性质的主要因素之一.生物炭的产率与热解温度呈负相关, 灰分、pH与热解温度呈正相关;生物炭的元素组成中C含量随热解温度的升高而增加, O和H含量随热解温度的升高而减少;随着热解温度的升高, 生物炭的芳香性、比表面积及孔体积增大, CEC和孔径则下降;生物炭表面的酸性官能团随着热解温度的升高而减少, 性质趋于稳定;生物炭表面的光滑度随着热解温度的升高而下降, 表面微孔数逐渐增加.
2) 陈化处理可以促进生物炭表面的氧化反应, 增加生物炭表面的酸性物质, 进而导致生物炭的pH下降;陈化处理可以明显地减少生物炭的C含量, 增加O含量, 导致生物炭极性和亲水性明显增加, 然而对生物炭的芳香性影响微弱;湿度对生物炭比表面积及微孔体积的影响效果大于温度;陈化处理可以增加生物炭表面的孔隙数量, 进而增加生物炭的比表面积, 陈化生物炭的孔隙结构以介孔为主;陈化处理还可以增加生物炭表面的酸性官能团, 导致生物炭碱性的减弱.
3) 陈化可以明显地改变生物炭理化性质, 其中陈化温度和湿度是生物炭陈化的主要影响因素.由于生物炭的理化性质受到较多因素的综合影响, 且陈化温度和湿度对生物炭的理化性质产生不同的影响效果, 因此, 不同陈化处理对生物炭理化性质的影响机制应具体分析.
Ahmad M, Lee S S, Dou X, et al. 2012. Effects of pyrolysis temperature on soybean stover-and peanut shell-derived biochar properties and TCE adsorption in water[J]. Bioresource Technology, 118: 536–544.
DOI:10.1016/j.biortech.2012.05.042
|
Cao X, Harris W. 2010. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation[J]. Bioresource Technology, 101(14): 5222–5228.
DOI:10.1016/j.biortech.2010.02.052
|
常春, 王胜利, 郭景阳, 等. 2016. 不同热解条件下合成生物炭对铜离子的吸附动力学研究[J]. 环境科学学报, 2016, 36(7): 2491–2502.
|
Chen B L, Zhou D D, Zhu L Z, et al. 2008. Sorption characteristics and mechanisms of organic contaminant to carbonaceous biosorbents in aqueous solution[J]. Science in China Series B: Chemistry, 51(5): 464–472.
DOI:10.1007/s11426-008-0041-4
|
陈温福, 张伟明, 孟军, 等. 2011. 生物炭应用技术研究[J]. 中国工程科学, 2011, 13(2): 83–89.
|
Cheng C H, Lehmann J. 2009. Ageing of black carbon along a temperature gradient[J]. Chemosphere, 75(8): 1021–1027.
DOI:10.1016/j.chemosphere.2009.01.045
|
Ding W, Dong X, Ime I M, et al. 2014. Pyrolytic temperatures impact lead sorption mechanisms by bagasse biochars[J]. Chemosphere, 105: 68–74.
DOI:10.1016/j.chemosphere.2013.12.042
|
Guo Y, Tang W, Wu J, et al. 2014. Mechanism of Cu (Ⅱ) adsorption inhibition on biochar by its aging process[J]. Journal of Environmental Sciences, 26(10): 2123–2130.
DOI:10.1016/j.jes.2014.08.012
|
Hale S E, Hanley K, Lehmann J, et al. 2011. Effects of chemical, biological, and physical aging as well as soil addition on the sorption of pyrene to activated carbon and biochar[J]. Environmental Science & Technology, 45(24): 10445–10453.
|
Heitkötter J, Marschner B. 2015. Interactive effects of biochar ageing in soils related to feedstock, pyrolysis temperature, and historic charcoal production[J]. Geoderma, 245: 56–64.
|
Hossain M K, Strezov V, Chan K Y, et al. 2011. Influence of pyrolysis temperature on production and nutrient properties of wastewater sludge biochar[J]. Journal of Environmental Management, 92(1): 223–228.
DOI:10.1016/j.jenvman.2010.09.008
|
简敏菲, 高凯芳, 余厚平. 2016. 不同裂解温度对水稻秸秆制备生物炭及其特性的影响[J]. 环境科学学报, 2016, 36(5): 1757–1765.
|
鞠文亮, 荆延德, 刘兴. 2016. 生物炭陈化的研究进展[J]. 土壤通报, 2016, 47(3): 751–757.
|
Keiluweit M, Nico P S, Johnson M G, et al. 2010. Dynamic molecular structure of plant biomass-derived black carbon (biochar)[J]. Environmental Science & Technology, 44(4): 1247–1253.
|
Krull E S, Baldock J A, Skjemstad J O, et al. 2009. Characteristics of biochar: organo-chemical properties[J]. Biochar for environmental management: Science and technology. Earthscan, London: 53–65.
|
Lee Y, Ryu C, Park Y K, et al. 2013. Characteristics of biochar produced from slow pyrolysis of Geodae-Uksae 1[J]. Bioresource Technology, 130: 345–350.
DOI:10.1016/j.biortech.2012.12.012
|
Li R Y, Chen D, Li L Q, et al. 2015. Adsorption of Pb (Ⅱ) and Cd (Ⅱ) in aqueous solution by biochars derived from different crop residues[J]. Journal of Agro-Environment Science, 34(5): 1001–1008.
|
Lin Y, Munroe P, Joseph S, et al. 2012. Nanoscale organo-mineral reactions of biochars in ferrosol: an investigation using microscopy[J]. Plant and Soil, 357(1/2): 369–380.
|
McHenry M P. 2011. Soil organic carbon, biochar, and applicable research results for increasing farm productivity under Australian agricultural conditions[J]. Communications in Soil Science and Plant Analysis, 42(10): 1187–1199.
DOI:10.1080/00103624.2011.566963
|
苗微. 2014. 生物炭陈化对土壤养分和水稻生长的影响[D]. 沈阳: 沈阳农业大学
http://cdmd.cnki.com.cn/Article/CDMD-10157-1014295071.htm |
Mukherjee A, Zimmerman A R, Hamdan R, et al. 2014. Physicochemical changes in pyrogenic organic matter (biochar) after 15 months of field aging[J]. Solid Earth, 5(2): 693.
DOI:10.5194/se-5-693-2014
|
Nguyen B T, Lehmann J, Kinyangi J, et al. 2009. Long-term black carbon dynamics in cultivated soil[J]. Biogeochemistry, 92(1/2): 163–176.
|
Novak J M, Busscher W J, Laird D L, et al. 2009. Impact of biochar amendment on fertility of a southeastern coastal plain soil[J]. Soil Science, 174(2): 105–112.
DOI:10.1097/SS.0b013e3181981d9a
|
潘萌娇, 孙姣, 贺强, 等. 2014. 热解终温和加热速率对棉杆热解生物炭的影响研究[J]. 河北工业大学学报, 2014(5): 60–66.
|
Peng X, Ye L L, Wang C H, et al. 2011. Temperature-and duration-dependent rice straw-derived biochar: Characteristics and its effects on soil properties of an Ultisol in southern China[J]. Soil and Tillage Research, 112(2): 159–166.
DOI:10.1016/j.still.2011.01.002
|
Qian L, Chen B. 2014. Interactions of aluminum with biochars and oxidized biochars: implications for the biochar aging process[J]. Journal of Agricultural and Food Chemistry, 62(2): 373–380.
DOI:10.1021/jf404624h
|
Recari J, Berrueco C, Abelló S, et al. 2014. Effect of temperature and pressure on characteristics and reactivity of biomass-derived chars[J]. Bioresource Technology, 170: 204–210.
DOI:10.1016/j.biortech.2014.07.080
|
Shaaban A, Se S M, Dimin M F, et al. 2014. Influence of heating temperature and holding time on biochars derived from rubber wood sawdust via slow pyrolysis[J]. Journal of Analytical and Applied Pyrolysis, 107: 31–39.
DOI:10.1016/j.jaap.2014.01.021
|
Sing S R, Sing A P. 2012. Treatment of water containg chromium(Ⅵ) using rice husk carbon as a newlow cost adsorbent[J]. International Journal of Environmental Reasearch, 6(4): 917–924.
|
Trigo C, Spokas K A, Cox L, et al. 2014. Influence of soil biochar aging on sorption of the herbicides MCPA, nicosulfuron, terbuthylazine, indaziflam, and fluoroethyldiaminotriazine[J]. Journal of Agricultural and Food Chemistry, 62(45): 10855–10860.
DOI:10.1021/jf5034398
|
王群, 李飞跃, 曹心德, 等. 2013. 植物基与固废基生物炭的结构性质差异[J]. 环境科学与技术, 2013, 36(8): 1–5.
|
Uchimiya M, Lima I M, Thomas Klasson K, et al. 2010. Immobilization of heavy metal ions (CuⅡ, CdⅡ, NiⅡ, and PbⅡ) by broiler litter-derived biochars in water and soil[J]. Journal of Agricultural and Food Chemistry, 58(9): 5538–5544.
DOI:10.1021/jf9044217
|
Uchimiya M, Wartelle L H, Klasson K T, et al. 2011. Influence of pyrolysis temperature on biochar property and function as a heavy metal sorbent in soil[J]. Journal of Agricultural and Food Chemistry, 59(6): 2501–2510.
DOI:10.1021/jf104206c
|
王彤彤, 王晓琳, 任志胜, 等. 2017. 不同原料制备的生物炭形貌结构及表面特性研究[J]. 环境科学与技术, 2017, 40(1): 42–48.
|
王章鸿, 郭海艳, 沈飞, 等. 2015. 热解条件对生物炭性质和氮、磷吸附性能的影响[J]. 环境科学学报, 2015, 35(9): 2805–2012.
|
文方园, 陈建, 田路萍, 等. 2016. 过氧化氢氧化对生物炭表面性质的改变及其对双酚A吸附的影响[J]. 生态毒理学报, 2016, 11(2): 628–635.
|
武玉, 徐刚, 吕迎春, 等. 2014. 生物炭对土壤理化性质影响的研究进展[J]. 地球科学进展, 2014, 29(1): 68–79.
DOI:10.11867/j.issn.1001-8166.2014.01-0068 |
Yakkala K, Yu M R, Roh H, et al. 2013. Buffalo weed (Ambrosia trifida L. var. trifida) biochar for cadmium (Ⅱ) and lead (Ⅱ) adsorption in single and mixed system[J]. Desalination and Water Treatment, 51(40/42): 7732–7745.
|
Yao F X, Arbestain M C, Virgel S, et al. 2010. Simulated geochemical weathering of a mineral ash-rich biochar in a modified Soxhlet reactor[J]. Chemosphere, 80(7): 724–732.
DOI:10.1016/j.chemosphere.2010.05.026
|
Yuan J H, Xu R K, Zhang H. 2011. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 102(3): 3488–3497.
DOI:10.1016/j.biortech.2010.11.018
|
Zhang M, Jia M Y, Bian Y R, et al. 2015. Sorption kinetics and mechanism of Naphthalene corn-stalk-derived biochar with different pyrolysis temperature[J]. Acta Pedologica Sinica, 52(5): 1106–1115.
|
Zhao R, Coles N, Wu J. 2015. Carbon mineralization following additions of fresh and aged biochar to an infertile soil[J]. Catena, 125: 183–189.
DOI:10.1016/j.catena.2014.10.026
|
 2017, Vol. 37
2017, Vol. 37


