2. 中国科学院城市环境研究所城市污染物转化重点实验室, 厦门 361021;
3. 福州大学环境与资源学院, 福州 350108
2. Key Laboratory of Urban Pollutant Conversion, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen 361021;
3. College of Environment and Resources, Fuzhou University, Fuzhou 350108
目前, 很多国家的地表水和地下水均遭到不同程度的有机氯化物污染(Shen et al., 2012; 刘菲等, 2010), 其中氯仿(CHCl3)和三氯乙烯(TCE)在水环境和饮用水中的污染比较常见(Moran et al., 2007; 高存荣等, 2012).由于有机氯化物不仅具有累积性的生物毒性而且其化学性质稳定, 所以一旦它们进入环境水体将会对人类健康和生态环境造成长期的危害(Karami et al., 2012).
Gillham等提出地下水原位修复的零价铁技术(Gillham et al., 1994; Orth et al., 1996), 为含氯有机污染物的处理提供了一种新的途径, 即采用化学还原法脱除含氯有机物中的氯元素, 以达到使其变成无毒或低毒的降解产物的目的.但Fe0对氯代芳香烃等有机氯化物反应活性较差, 脱氯半衰期长, 还会生成其他含氯副产物;此外, 随着反应进行, 金属铁表面会逐渐形成一层钝化层, 降低铁的反应活性(罗斯等, 2009).Muftikia等(1995)最先将Pd/Fe用于还原脱氯, 结果发现双金属大大促进了还原脱氯的速率.因此, 纳米双金属对氯仿和三氯乙烯降解近些年倍受关注(Tee et al., 2009; Zhou et al., 2016).但传统的液相还原法(高园园等, 2013)制备的纳米材料容易团聚, 而且暴露在有氧环境时易被氧化.因此, 通过负载其他有机聚合物的方式(如瓜尔胶、藻酸盐、淀粉等)来分散纳米颗粒, 减少团聚并提高纳米颗粒的稳定性(Nikroo et al., 2016).但负载后的铁镍双金属纳米材料增加了粒径, 损失了表面积, 很难彻底降解氯仿和三氯乙烯(Elliott et al., 2001; Schrick et al., 2002).因此, 为了提高氯代有机物的降解效率, 本文采用可溶性淀粉作为分散剂, 负载纳米材料, 通过双金属掺杂, 制备出淀粉负载铁镍铜三金属纳米复合材料.并与零价铁、淀粉负载零价铁、淀粉负载铁镍双金属复合材料等进行降解效果对比, 进而考察影响淀粉负载铁镍铜三金属复合材料降解效果的主要因素.以期为该技术实际用于土壤和地下水中氯代有机物的修复提供新的方法和理论依据.
2 材料与方法(Materials and methods) 2.1 试剂与仪器可溶性淀粉、硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4)、无水乙醇(CH3CH2OH)、氯仿、氯化钠、硫酸钠、硝酸钠均购自国药集团化学试剂有限公司产品;氯化镍(NiCl2·6H2O)(上海盈元化工有限公司), 三氯乙烯(上海阿拉丁生化科技股份有限公司), 所用试剂均为分析纯, 水为超纯水(18.25 MΩ·cm-1).
采用荷兰帕纳科公司的X′Pert Powder多功能粉末X射线衍射仪对样品进行物相组成分析;采用美国ASAP 2020M+C全自动比表面积仪用于测试材料的比表面积和微孔孔隙;采用日本Hitachi公司的S-4800型扫描电子显微镜观察颗粒形貌;采用荷兰帕纳科公司的Axios-MAX X射线荧光光谱仪进行半定量分析材料中金属含量;采用美国安捷伦公司的7890A气相色谱仪(FID检测器)进行降解效果分析.
2.2 复合材料制备称取1.39 g FeSO4·7H2O和一定量的淀粉溶解于100 mL的无氧水中, 放入三口烧瓶, 通N2搅拌15 min;用分液漏斗将100 mL 0.8 mol·L-1的NaBH4溶液缓慢滴加到Fe2+溶液中, 滴加反应过程中产生大量的气体, 持续通N2, 并搅拌将产生的H2及时赶走;观察反应至不产生气泡, 加入0.237 g的NiCl2·6H2O到三口烧瓶, 置换0.001 mol的Fe, 反应15 min后, 停止反应, 得到含有理论质量为0.224 g的Fe、0.058 g的Ni的ZVI-Ni双金属, 其中铁镍物质的量的比为4:1.淀粉与双金属质量比为8:1, 用无水乙醇冲洗3次, 放置于70 ℃的真空干燥箱中烘干12 h, 得到完全干燥的铁镍双金属复合样品用于后续实验.
采用同时加入NiCl2·6H2O和CuSO4·5H2O的方法, 重复上述步骤用于制备铁镍铜三金属催化剂.通过调整FeSO4·7H2O和CuSO4·5H2O的投加量, 制备出不同铁镍铜摩尔比的淀粉负载铁镍铜复合材料.
2.3 氯代烃降解实验分别配制30 mg·L-1的三氯乙烯和氯仿溶液, 量取40 mL分别装入100 mL的血清瓶中;然后称取ZVI 0.45 g、淀粉/ZVI 0.45 g、淀粉/ZVI-Ni 0.45 g、淀粉/ZVI-Ni-Cu 0.45 g, 分别投入装有三氯乙烯或氯仿溶液的血清瓶中, 每组降解实验做3个平行样, 3组空白样.反应一定时间后, 取样进行气相色谱测试, 分析三氯乙烯和氯仿的残余浓度.气相色谱条件:H2流速50 mL·min-1、N2流速20 mL·min-1、空气流速500 mL·min-1, 分流比2:1, 进样口温度200 ℃, 检测器温度220 ℃.
3 结果与讨论(Results and discussion) 3.1 淀粉/ZVI-Ni和淀粉/ZVI-Ni-Cu复合材料的表征分析淀粉、淀粉/ZVI、淀粉/ZVI-Ni和淀粉/ZVI-Ni-Cu复合材料的XRD图谱见图 1.从图 1可以看出, 淀粉在17°和18°附近的衍射峰为相连的双峰, 在20°附近有较强的衍射峰, 这些都是A、B混合晶型淀粉的特征峰(满建民等, 2012).复合后, 淀粉/ZVI、淀粉/ZVI-Ni和淀粉/ZVI-Ni-Cu复合材料中淀粉的特征峰变弱直至消失, 说明复合过程能使淀粉非晶化, 淀粉的晶型结构被破坏, 只有无定型的淀粉存在, 具有非晶化现象.由图可知, 淀粉/ZVI和淀粉/ZVI-Ni中都没能观察到Fe和Ni的特征峰, 而淀粉/ZVI-Ni-Cu复合材料在44°、51°和78°出现了明显的衍射峰, 此为铁镍合金的特征峰;在18°、21°、30°、34°、36°、42°和46°出现了明显的CuxFe1-x纳米合金的衍射峰.这都说明了淀粉有效的负载和分散了纳米金属.
 |
| 图 1 不同材料XRD谱图 Fig. 1 X-ray diffraction patterns of different materials |
复合材料外观呈黑色, 磁性强.其扫描电镜结果如图 2所示.由图可以看出, 负载后, 淀粉的晶型结构被破坏, 光滑的淀粉表面负载着凸凹不平的颗粒, 这也证明了金属成功地负载在淀粉颗粒的表面, 从表面颗粒的分布可以看出, 淀粉能使纳米金属具有更好的分散性.BET测试结果分析表明:淀粉/ZVI-Ni的比表面积为2.59 m2·g-1, 淀粉/ZVI-Ni-Cu的比表面积为4.37 m2·g-1, 由于第3种金属Cu的掺杂, 使得复合材料的比表面增加了1.69倍.
 |
| 图 2 SEM图淀粉(a)、淀粉/ZVI(b)、淀粉/ZVI-Ni(c)、淀粉/ZVI-Ni-Cu(d) Fig. 2 SEM images of starch(a), starch/ZVI(b), starch/ZVI-Ni(c) and starch/ZVI-Ni-Cu(d) |
EDS测试结果如图 3所示.由图可知, 淀粉/ZVI-Ni和淀粉/ZVI-Ni-Cu这两种复合材料中均检测到了所负载的双金属或者三金属.进一步采用X射线荧光光谱仪(XRF)对复合材料进行半定量分析, 测试结果表明:淀粉/ZVI-Ni复合材料铁镍质量比为3.80, 基本等于制备时铁镍质量比的理论值3.82;淀粉/ZVI-Ni-Cu复合材料铁镍铜的质量比为3.2:0.72:1, 接近制备时铁镍铜质量比的理论值3.5:0.92:1, 说明实现了双金属和三金属的成功负载.
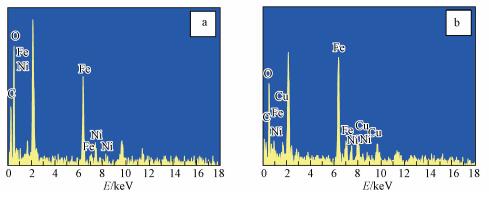 |
| 图 3 淀粉/ZVI-Ni(a)和淀粉/ZVI-Ni-Cu(b)EDS图 Fig. 3 EDS images of starch/ZVI-Ni(a) and starch/ZVI-Ni-Cu(b) |
纳米材料的稳定性研究, 如图 4所示.由图可以看出, 经过1年的储存, 纳米零价铁已经全部被氧化变色, 磁性全部消失.而复合材料在淀粉的保护下, 淀粉负载可以增加纳米铁的稳定性, 而且随着双金属和三金属的掺杂, 复合材料的稳定性明显增强, 这就说明淀粉负载和金属掺杂都在一定程度上提高了纳米铁的抗氧化性.
 |
| 图 4 纳米材料的稳定性(储存时间1年) Fig. 4 Stability of nano-composites after 1 year |
ZVI、淀粉/ZVI、淀粉/ZVI-Ni和淀粉/ZVI-Ni-Cu 4种材料在相同的条件下, 对CHCl3和TCE的降解效果, 如图 5所示.由图可知, 这4种材料对CHCl3和TCE的降解率由高到低顺序依次为:淀粉/ZVI-Ni-Cu>淀粉/ZVI-Ni>淀粉/ZVI >ZVI.零价铁基复合材料降解有机氯化物, 是复合材料的吸附和零价铁的还原联合作用的结果, 降解反应主要发生在金属表面的活性位点.由于复合材料所用的载体为淀粉, 淀粉颗粒属于微米级, 复合材料的比表面积小于一般的纳米材料, 但添加了淀粉后的复合材料降解效果明显高于单纯的纳米铁, 这是因为微米级淀粉能有效地分散纳米金属, 不仅可以防止纳米晶的聚集, 增大了金属活性位点与污染物的接触面积, 而且由于淀粉本身具有还原作用, 能有效地保护零价铁被氧化, 提高了材料的抗氧化性.
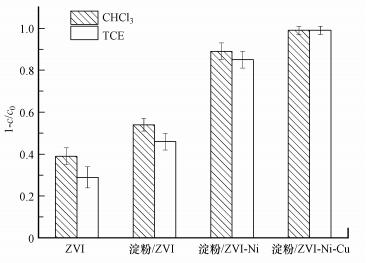 |
| 图 5 4种材料对氯仿和三氯乙烯的降解(投加量11.25 g·L-1) Fig. 5 Degradation of CHCl3 and TCE by ZVI、starch/ZVI、Starch/ZVI-Ni and Starch/ZVI-Ni-Cu |
对比金属掺杂后复合材料对污染物的降解效果发现, 掺杂金属镍的复合材料对CHCl3和TCE的降解率分别为89%和85%;通过进一步掺杂第3种金属Cu, 反应48 h后, 其对CHCl3和TCE的降解率可进一步提高到99%, 基本上实现对CHCl3和TCE的完全降解.ZVI对含氯烃的降解, 主要是通过零价铁对含氯烃的还原作用, 而ZVI-Ni是由于金属Ni是产氢的有效催化剂, Ni能有效吸附H2及污染物, 因此可加快ZVI表面氢的移除, 提高ZVI的腐蚀速度(产生电子过程), 从而加快含氯烃的还原降解过程, 提高降解效率.而对于ZVI-Ni-Cu, 可能是由于Fe-Cu与Fe-Ni的协同作用, Fe-Cu能形成原电池, 其标准电池电位为0.78 V, 明显高于Fe相对于氢的标准电位0.44 V.
全燮等(1998)提出零价铁降解氯代烃的历程是通过脱氯完成的:①Fe和水反应生成H2;②产生的H2和氯代烃在金属表面吸附, 并形成过渡络合物;③H2攻击过渡络合物发生加氢反应, 氯原子脱落形成Cl-;④Cl-脱附离开催化剂进入溶液;⑤Fe被氧化成Fe(OH)3沉淀, 因此零价铁降解氯代烃的总反应方程式为Fe + RCl + H+ =Fe2+ + RH + Cl-.为了考察ZVI、淀粉/ZVI-Ni、淀粉/ZVI-Ni-Cu对CHCl3和TCE的脱氯效果, 通过离子色谱测试反应48 h后, 溶液中氯离子的浓度变化, 用溶液中实际测得的氯离子浓度与完全降解氯离子理论生成量和与氯代烃降解率计算所得部分降解氯离子理论生成量相比, 计算出降解脱氯率和总脱氯率, 结果如表 1所示.由表可知, 淀粉/ZVI-Ni-Cu和淀粉/ZVI-Ni降解的CHCl3和TCE明显高于ZVI和ZVI-Ni, 且污染物一旦降解, 就发生脱氯反应, 从而降解脱氯率和总脱氯率均高.对于未负载淀粉的ZVI和ZVI-Ni, 不但对CHCl3和TCE的降解率未超过50%, 而且降解不彻底, 导致降解脱氯率低于90%, 说明还有一部分以中间产物形式存在.因此也更好地说明了双金属或三金属成功负载在淀粉上, 增强了抗氧化性, 不仅表现出对氯代烃有较高的降解效率, 而且基本可实现氯的完全脱除.
| 表 1 4种材料对CHCl3和TCE的脱氯率 Table 1 Dechlorination of TCE and CHCl3 by ZVI、ZVI-Ni、starch/ZVI-Ni and starch/ZVI-Ni-Cu |
在pH 5.5的条件下, 污染物浓度均为30 mg·L-1, 考察复合材料不同投加量下, 不同Cu掺杂量的复合材料对CHCl3和TCE的降解效果, 如图 6所示.总体来看, 随着复合材料投加量的增加, 其对氯代烃的降解效率也随之增加, 后趋于稳定;随着Cu掺杂量的增加, 复合材料对氯代烃的降解效率先稍微下降然后明显升高;观察不同Cu掺杂量下的曲线可知, 铁镍铜3种金属物质的量的比4:1:1为最佳物质的量比;掺杂第3种金属Cu后, 两种污染物的降解效果都显著提高;氯仿较三氯乙烯更容易被铁基材料降解, 因为在氯代程度相同的条件下, 烷烃较烯烃更易降解.未掺杂Cu, 只有在投加量为14.5 g·L-1时, 淀粉/ZVI-Ni对三氯乙烯和氯仿的降解效率才能达到95%以上;而掺杂第3种金属Cu后, 在铁镍铜3种金属最佳物质的量的比4:1:1的条件下, 仅投加5 g·L-1的淀粉/ZVI-Ni-Cu的复合材料对三氯乙烯和氯仿降解效果就可高达96%和97%, 明显高于未引入Cu时(仅为64%和76%);增加催化剂Cu的掺杂量, 当铁镍铜3种金属物质的量的比为4:1:2时, 复合材料对三氯乙烯和氯仿的降解效率都有所增加, 这是因为催化剂Cu可以生成更多的H, 与C形成C—H键, 使得降解效果增加.其次由于Cu的引入, 复合材料的比表面积相比未引入Cu时增加了1倍, 从而使金属分布更均匀, 与污染物接触更加充分;再者, 加入第2种催化剂Cu, 能与催化剂Ni进行协同作用, 形成Fe-Cu原电池, 有效给出电子, 而Ni可有效促进Fe的产氢反应, 从而促进氯代烃的还原, 提高降解效率.
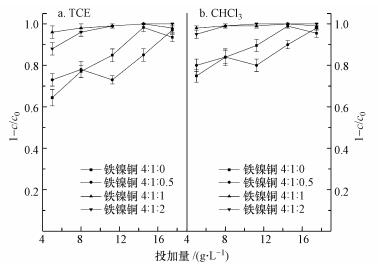 |
| 图 6 不同投加量下、不同物质的量的比的复合材料降解三氯乙烯和氯仿 Fig. 6 Degradation of TCE and CHCl3 at different dosages and molar ratios of starch/ZVI-Ni-Cu |
考察不同pH条件下, 投加量为11.25 g·L-1条件下, 淀粉/ZVI-Ni-Cu复合材料(铁镍铜物质的量的比为4:1:1)对氯仿和三氯乙烯的降解效果, 如图 7所示.由图可知, 淀粉/ZVI-Ni-Cu复合材料对CHCl3和TCE的降解效果, 随着pH值的升高先降低再升高;当pH值为5.5时, 降解效果最好, 但pH升高为7.0, 降解效果最差;然后pH为弱碱性7.5时, 降解效果稍微升高, 但pH继续升高到8.5, 降解效果又急剧降低.这是由于铁基还原剂机理中关键的一步就是H在催化剂表面的富集, 当pH较高时, 容易形成氧化铁及氢氧化铁沉淀;当pH较低时, 可以提供足量的H形成C—H键;抑制沉淀的生成, 从而提供更多的反应活性位点(刘文娟, 2012).同时, 由于铁基材料降解的机理中还包括铁的腐蚀产氢, pH的降低可以加速铁的腐蚀产氢过程, 使降解反应加快.Liu等(2006)通过研究pH在6.5~8.9之间TCE的降解情况, 发现pH=6.5时TCE的降解效率是pH=8.9时的1倍多.因此, 越低的pH值, 铁基复合材料降解效果越好.
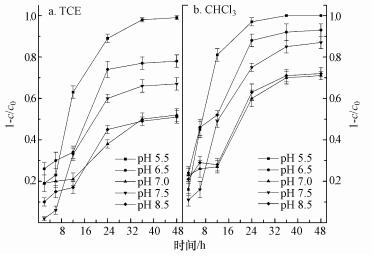 |
| 图 7 不同pH值下复合材料降解效率 Fig. 7 Degradation of CHCl3 and TCE by starch/ZVI-Cu-Ni under different pH |
在pH为5.5, 复合材料投加量为11.25 g·L-1条件下, 分别考察水中NO3-、Cl-、SO42-这3种常见的离子对降解效率的影响, 结果如图 8所示.由图可知, 未添加其它离子时, 当反应达到平衡, 三氯乙烯和氯仿的降解效率高达98%和99%, 而当NO3-存在时, 降解率仅为21%和5%.根据Liu等(2007)报道可知, 硝酸根会严重地钝化金属表面, 同时严重阻碍产氢反应;而且硝酸根还会和氯代物竞争金属表面的活性位点, 导致反应活性位点减少, 从而降低降解效果.氯离子对降解效率的影响仅次于硝酸根, 当反应达到平衡时, 三氯乙烯和氯仿的降解效率分别为38%和62%, 明显低于未添加其他离子时的降解效率.这是因为氯离子的存在, 阻碍了C—Cl键的断裂, 从而阻碍了反应的进行, 影响了反应的平衡(全燮等, 1998).相比较而言, 硫酸根在相对高的浓度下, 对降解效率的影响较小.当反应达到平衡时, 三氯乙烯和氯仿的降解效率分别为87%和93%, 这是因为硫酸根虽然会与氯代物形成一定的竞争关系, 但同时也会促进铁基材料表面的腐蚀作用(Vatankhah et al., 1998), 由于其对产氢过程影响较小(Liu et al., 2007), 所以硫酸根的存在对氯代物降解影响较小, 稍微低于添加其他离子时的降解效率.
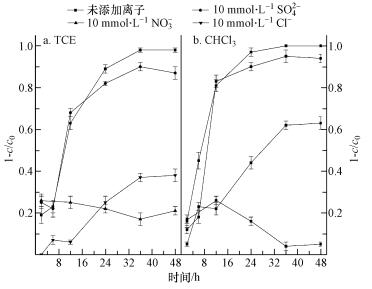 |
| 图 8 不同离子存在下复合材料降解效率 Fig. 8 Effect of different ions on the degradation of CHCl3 and TCE by starch/ZVI-Ni-Cu |
1) 淀粉作为载体, 不仅实现了金属纳米材料的成功负载, 使材料与污染物接触更加充分;而且淀粉负载防止零价铁被氧化, 提高纳米材料稳定性, 从而也提高了复合材料对氯代烃的降解效果.
2) 复合材料对氯代烃的降解效果优于纳米零价铁, 通过添加催化剂Ni提高了降解效率;掺杂第3种金属Cu反应48 h内, 基本可以实现对氯仿和三氯乙烯的完全降解.
3) 增加复合材料的投加量可以提高氯代烃的降解效率;使用铁基复合材料, 氯仿相较于三氯乙烯更容易降解.
4) 当复合材料中Cu和Ni等量时, 材料性能达到最佳;酸性条件有利于氯代烃的降解, 溶液中常见的几种离子对于氯代烃的降解影响由强到弱依次为NO3->Cl->SO42-.
Elliott D W, Zhang W X. 2001. Field Assessment of nanoscale bimetallic particles for groundwater treatment[J]. Environmental Science & Technology, 35(24): 4922–4926.
|
高存荣, 王俊桃. 2012. 中国69个城市地下水挥.发性卤代烃污染检测与特征研究[J]. 地球科学与环境学报, 2012, 34(1): 66–71.
|
高园园, 周启星. 2013. 纳米零价铁在污染土壤修复中的应用与展望[J]. 农业环境科学学报, 2013, 32(3): 418–425.
|
Gillham R W, Ohannesin S F. 1994. Enhanced Degradation of Halogenated Aliphatics by Zero-Valent Iron[J]. Ground Water, 32(6): 958–967.
DOI:10.1111/gwat.1994.32.issue-6
|
Karami S. 2012. Occupational trichloroethylene exposure and kidney cancer risk: a meta-analysis[J]. Occupational and Environmental Medicine, 69(12): 858–867.
DOI:10.1136/oemed-2012-100932
|
刘菲, 王苏明, 陈鸿汉. 2010. 欧美地下水有机污染调查评价进展[J]. 地质通报, 2010, 29(6): 907–917.
|
刘文娟. 2012. 纳米Ni-Fe双金属对三氯乙烯的催化脱氯研究[D]. 北京: 北京化工大学
http://cdmd.cnki.com.cn/Article/CDMD-10010-1012414499.htm |
Liu Y Q, Lowry G V. 2006. Effect of particle age (Fe-o content) and solution pH on NZVI reactivity: H-2 evolution and TCE dechlorination[J]. Environmental Science & Technology, 40(19): 6085–6090.
|
Liu Y, Phenrat T, Lowry G V. 2007. Effect of TCE concentration and dissolved groundwater solutes on NZVI-Promoted TCE dechlorination and H2 evolution[J]. Environmental Science & Technology, 41(22): 7881–7887.
|
罗斯, 王晓栋, 高树梅, 等. 2009. 纳米双金属体系催化降解有机氯化物研究进展[J]. 环境科学与技术, 2009, 32(2): 72–75.
|
满建民, 蔡金文, 徐斌, 等. 2012. 作物淀粉晶体结构的波谱分析[J]. 作物学报, 2012, 38(4): 691–698.
|
Moran M J, Zogorski J S, Squillace P J. 2007. Chlorinated solvents in groundwater of the United States[J]. Environmental Science & Technology, 41(1): 74–81.
|
Muftikian R, Fernando Q, Korte N. 1995. A method for the rapid dechlorination of low molecular weight chlorinated hydrocarbons in water[J]. Water Research, 29(10): 2434–2439.
DOI:10.1016/0043-1354(95)00102-Q
|
Nikroo R. 2016. Evaluation of trichloroethylene degradation by starch supported Fe/Ni nanoparticles via response surface methodology[J]. Water Science and Technology, 73(4): 935–946.
|
Orth W S, Gillham R W. 1996. Dechlorination of trichloroethene in aqueous solution using Fe0[J]. Environmental Science & Technology, 30(1): 66–71.
|
全燮, 刘会娟, 杨凤林, 等. 1998. 二元金属体系对水中多氯有机物的催化还原脱氯特性[J]. 中国环境科学, 1998, 18(4): 46–49.
|
Schrick B. 2012. Hydrodechlorination of trichloroethylene to hydrocarbons using bimetallic Nickel-Iron nanoparticles[J]. Chemistry of Materials, 14(12): 5140–5147.
|
Shen H, Wilson J T, Lu X X. 2012. A tracer test to characterize treatment of TCE in a permeable reactive barrier[J]. Ground Water Monitoring and Remediation, 32(4): 32–41.
DOI:10.1111/gwmr.2012.32.issue-4
|
Tee Y H, Bachas L, Bhattacharyya D. 2009. Degradation of trichloroethylene by Iron-Based bimetallic nanoparticles[J]. The Journal of Physical Chemistry C, 113(22): 9454–9464.
DOI:10.1021/jp809098z
|
Vatankhah G. 1998. Electrodissolution of iron in sodium sulfate and sodium bicarbonate solutions at pH 8[J]. Journal of Applied Electrochemistry, 28(2): 173–183.
|
Zhou Z M, Ruan W J, Shen C H, et al. 2016. Fabrication and characterization of Fe/Ni nanoparticles supported by polystyrene resin for trichloroethylene degradation[J]. Chemical Engineering Journal, 283: 730–739.
DOI:10.1016/j.cej.2015.07.076
|
 2017, Vol. 37
2017, Vol. 37


