2. 南京信息工程大学环境科学与工程学院, 江苏省大气环境与装备技术协同创新中心, 南京 210044
2. Jiangsu Collaborative Innovation Center of Atmospheric Environment and Equipment Technology (AEET), School of Environmental Science and Engineering, Nanjing University of Information & Technology, Nanjing 210044
附泥藻类是底栖藻类的一种类型, 存在于沉积物-水界面及淤泥下数毫米深度处, 它与浮游藻类一样是浅水湖泊生态系统的初级生产者, 不仅为水生生物提供食物资源, 而且对湖泊生态系统中营养元素循环产生重要影响(Azim et al., 2005;Şahin, 2008;张强等, 2010;宋玉芝等, 2016).目前有关附泥藻类的研究主要集中在流水生态系统, 如小溪和河流, 有关湖泊底栖藻类的研究较少(Aloisie et al., 2008;Vadeboncoeur et al., 2008;裴国凤等, 2011;Zhang et al., 2013).已有的研究表明, 浅水湖泊生态系统有利底栖藻类发展, 并随着水体富营养化, 底栖藻类大量繁殖, 底栖藻类的种群和数量发生着剧烈的变化(秦伯强等, 2004;裴国凤等, 2011).对于不同湖泊, 环境营养水平及其它条件存在着差异, 底栖藻类生物量及种群组成无疑会存在着差异(秦伯强等, 2004;裴国凤等, 2011).太湖作为一个大型浅水湖泊, 其周边的河网密布, 流域土地利用类型多样, 水质和生态类型存在着较大的空间异质性(秦伯强等, 2004;金颖薇等, 2015).这为研究不同水质条件下底栖附泥藻类生长状况提供了理想的研究场所.目前, 对于太湖中不同区域底栖藻类分布情况的研究, 主要集中在以沉水植物和人工介质为附着基质的藻类(袁信芳等, 2006;丁娜等, 2015), 对于太湖附泥藻类的研究仅在研究蓝藻复苏时作为藻源有所涉及(陶益, 2005;李大命等, 2012), 针对太湖底栖附泥藻类生物量的空间分布特征的研究未见报道.因此, 本文对太湖进行高密度布点采样, 探讨附泥藻类生物量及环境营养元素的空间分布特征及其相互关系.研究结果不仅有助于了解不同营养类型的湖泊中底栖附泥藻类的分布状况, 也为进一步了解附泥藻类在太湖生态系统中功能, 以及深入探求太湖富营养化治理途径提供一定的理论依据.
2 材料与方法(Materials and methods) 2.1 样品的采集及预处理2015年6月9—15日, 按照图 1采样点进行采样, 每个采样点用GPS定位, 并用5 L有机玻璃采水器直接在水面下约50 cm处采集太湖原水, 装入事先灭菌的聚乙烯水桶, 然后用皮德森采泥器采集底泥表层沉积样, 立即装入聚乙烯自封袋, 密封后连同水样一起低温带回实验室进行分析.每个采样点采集3个平行样, 全湖共设76个采样点.
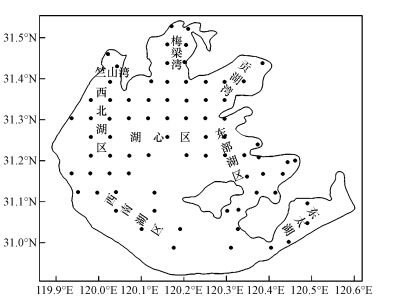 |
| 图 1 太湖采样点示意图 Fig. 1 Locations of the sampling sites in Lake Taihu |
太湖水质分析指标主要有pH、总氮(TN)、总磷(TP)、溶解性总氮(TDN)、溶解性总磷(TDP)、氨态氮(NH4+-N)、磷酸盐(PO43-)、叶绿素a(Chla).测定可溶性营养盐的水为原水经Whatman玻璃纤维滤纸膜GF/F过滤后的水, 水质指标采用《水和废水监测分析方法》中的方法进行测定(国家环境保护总局《水和废水监测分析方法》编委会, 2002).取部分泥样真空冷冻干燥, 以玛瑙研钵研磨过100目筛, 于干燥器中保存用于测定沉积物总氮(TN)、总有机碳(TOC)、沉积物总磷(TP)及不同形态磷.沉积物TN、TOC用德国ELEMENTAR公司的Vario ELIII型元素分析仪测定(孙萱等, 2014), 沉积物总磷(TP)含量的测定采用消解钼锑抗分光光度法(金相灿等, 1990), 沉积物中各形态磷的提取采用欧洲标准测试委员会框架下发展起来的SMT法(Ruban et al., 2001).
2.3 太湖附泥藻类生物量的测定附泥藻类生物量用表层沉积物叶绿素含量表示(Sundbäck et al., 1988).将样品从冰箱中取出, 化冻后称取约10 g左右放在15 mL离心管中, 加入90%丙酮10 mL, 避光低温放置8~10 h.然后在5000 r·min-1下离心2~3 min, 过滤于25 mL棕色容量瓶中, 再向离心管中加入90%丙酮5 mL, 反复萃取3次, 每次离心液过滤到容量瓶中, 最后用90%丙酮定容至25 mL, 摇匀备用.取容量瓶中待测液测定叶绿素的吸光度, 样品在500~800 nm波长范围进行扫描, 扫描间隔1 nm, 以90%丙酮为空白, 可得紫外可见吸收光谱曲线.由于在666 nm处有叶绿素特征峰, 从曲线上读取该吸收峰的吸光值A, 由以下公式可计算叶绿素的浓度C(μg·g-1)(瞿文川等, 1995):
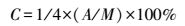
|
式中, M为样品中有机质含量(g·kg-1).
2.4 数据分析采用Excel2007进行数据处理, surfer13.0软件进行画图, 用SPSS软件进行相关分析.
3 结果与分析(Results and analysis) 3.1 附泥藻类空间分布由表 1可知, 太湖表层沉积物叶绿素含量平均值为0.34 μg·g-1, 变化范围为0.07~1.66 μg·g-1, 由此可见, 太湖表层沉积物叶绿素含量在空间上表现出明显的异质性.以2015年6月9—15日所获得的太湖76个采样点表层沉积物叶绿素含量作为数据节点, 利用surfer13.0作叶绿素含量空间分布等直线图.从图 2可看出, 在太湖西南沿岸区到湖心区, 表层沉积物叶绿含量较低, 在0.29 μg·g-1以下;贡湖湾及太湖东部沿岸区, 沉积物叶绿素含量相对较高, 在0.29 μg·g-1以上;东太湖和太湖西北部沿岸带及竺山湾, 表层沉积物叶绿素含量较高, 在太湖西北部沿岸带可高达1.66 μg·g-1.由此可见, 太湖附泥藻类生物量具有明显的空间分布特征, 在东太湖及太湖西北部湖区, 附泥藻类生物量较高, 尤其是沿岸带, 而在太湖西南部湖区及湖心区附泥藻类生物量较低(图 2).
| 表 1 沉积物表层叶绿素含量及营养盐含量 Table 1 Values of chlorophyll and nutrient indexes in surface sediment |
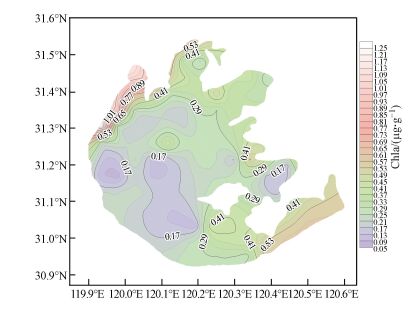 |
| 图 2 附泥藻类生物量的空间分布 Fig. 2 Spatial distribution of epipelic algal biomass |
从表 1可看出, 太湖表层沉积物中总有机碳(TOC)空间分布变化较大, 含量为4.21×103~21.96×103 mg·kg-1, 平均值为8.61×103 mg·kg-1.从空间分布等直线图可看出, 太湖沉积物中TOC分布总体趋势由四周向湖心及南太湖中心递减, 在竺山湾、胥口湾、东太湖, 以及东部湖区及沿岸带, TOC含量较高, 其次是梅梁湾、贡湖湾及太湖西南部沿岸带, 湖心至南太湖中心区域TOC含量最低(图 3a).太湖沉积物中总氮(TN)含量平均值为918.90 mg·kg-1, 其变化范围在435~2350 mg·kg-1之间, 空间分布差异较为显著(表 1), 其分布特征与TOC空间分布特征类似, 即由四周向湖心及偏南区域呈递减的变化趋势;西北部湖区、东部湖区及沿岸带比较高, 3个高值区分别在竺山湾、梅梁湾与东太湖, 而西部湖区相对较低, 且低于平均值(图 3b).太湖沉积物中总磷(TP)含量在268.30~886.10 mg·kg-1之间, 全湖平均值为386.06 mg·kg-1, 其空间分布特征表现为西北部入湖河口TP含量高, 与TOC、TN分布相比, 虽说北部竺山湾TP含量较高且最高值也出现在该区域, 但另一个高值区域出现在太湖西南部湖区(图 3c).而在东太湖、胥口湾及太湖东部大部分湖区, 沉积物TP的含量低于全湖的平均值.
 |
| 图 3 表层沉积物总有机碳(TOC)(a)、总氮(TN)(b)、总磷(TP)(c)、无机磷(IP)(d)、有机磷(OP)(e)、铁铝磷(Fe/Al-P)(f)和钙磷(Ca-P)(g)含量的空间分布 Fig. 3 Spatial distribution of TOC(a), TN(b), TP(c), IP(d), OP(e), Fe/Al-P(f) and Ca-P (g)in the surface sediment |
太湖沉积物中各种形态磷表现出不同的赋存特点(图 3d~3g).图 3f中可以看出, Fe/Al-P的高值主要集中于富营养化较重的西北部河口区及竺山湾, 其次是梅梁湾、贡湖湾及南部湖心区, 其他湖区相差不大;太湖西南部湖区及东太湖的Ca-P含量较高, 高于全湖的均值166.94 mg·kg-1(表 1), 竺山湾及太湖的西北部, 其值接近于均值, 其它大部分区域沉积物Ca-P含量相对较低(图 3g).竺山湾及太湖西北部和太湖西南部沿岸带, 无机磷(IP)较高, 大多数高于全湖的均值(图 3d).有机磷(OP)在太湖西北部及竺山湾相对较高, 其次是太湖南部湖区及北部湖区, 东太湖及太湖中部湖区及太湖东部胥口湾较低(图 3e).
3.3 水体叶绿素及营养盐的空间分布太湖水体叶绿素浓度变化范围为1.721~527.645 μg·L-1, 其空间差异比较大(表 2).水体叶绿素a浓度较大值分布于北部湖区, 绝大多数区域都大于22 μg·L-1;其次是湖心偏西南区域, 东部湖区包括东太湖、胥口湾等水体中的叶绿素a浓度普遍偏低(图 4a).太湖水质参数在空间差异明显(表 2), 太湖上覆水中的TN(W)、TP(W)、TDN、TDP、NH4+-N及PO43-P的变化范围分别为0.79~7.86、0.01~0.68、0.62~3.46、0.007~0.182、0.085~0.917、0.001~0.140 mg·L -1.从图 4b~4g可看出, 以西部洑东镇沿岸至梅梁湾为界, 西北部湖区包括竺山湾, 水体氮、磷浓度显著高于东部湖区及南部湖区, 且变化梯度大, 东部及南部大部分湖区氮、磷浓度相对较低, 且变化梯度小, 尤其是NH4+-N及PO43-P(图 4f~4g).根据国内外湖泊水体富营养化的分级标准(金相灿等, 1990), 除了太湖西南部及东部湖区少数采样点总氮、总磷浓度小于2 mg·L -1及0.02 mg·L-1外, 其它大部分湖区水质已处于富营养化状态.
| 表 2 水体叶绿素含量及水体营养盐指标 Table 2 Values of chlorophyll and nutrient indexes in the overlying water of LakeTaihu |
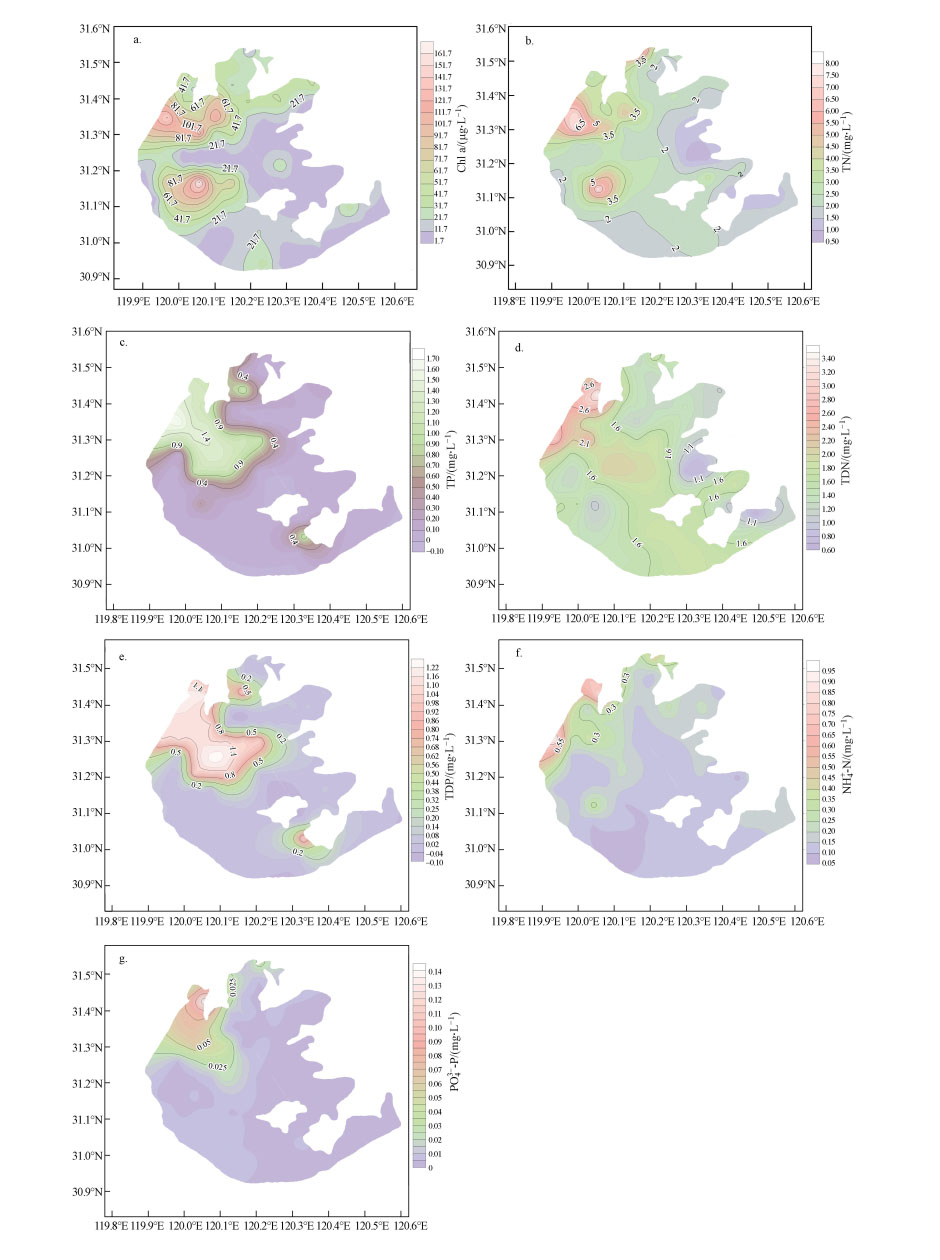 |
| 图 4 水体叶绿素(Chla)(a)、总氮(TN)(b)、总磷(TP)(c)、总溶解性氮(TDN)(d)、总溶解性磷(TDP)(e)、氨氮(NH4+-N)(f)、正磷酸盐(PO43--P)(g)浓度的空间分布 Fig. 4 Spatial distribution of Chla(a), TN(b), TP(c), TDN(d), TDP(e), NH4+-N(f), PO43--P(g) in water |
Pearson相关分析结果表明, 附泥藻类生物量与环境中的氮、磷等营养盐有显著的相关性(表 3).从表 3可看出, 附泥藻类生物量(Bio.)与沉积物TP、IP、Fe/Al-P、TOC及水体TP(W)、TDN、NH4+-N、TDP、PO43--P存在显著的相关关系(r≥0.34, p<0.01), 与沉积物TN、OP及水体TN(W)也存在着显著相关性(r≥0.25, p<0.05), 但与沉积物Ca-P及水体Chla之间的关系并不显著(p>0.05).沉积物TP含量除了与沉积物中不同形态磷含量及TOC含量相关外, 还与水体的营养元素(TN(W)除外)呈显著相关性(r≥0.25, p<0.05).沉积物不同形态磷(Ca-P除外)含量与水体营养元素(水体中TN(W)及TP(W)除外)均呈显著相关关系(r≥0.35, p<0.01).
| 表 3 附泥藻类生物量(Bio.)与环境营养盐的Pearson相关系数 Table 3 Pearson correlation coefficients of epipelic algal biomass and environmental nutrients |
目前, 关于氮、磷等营养盐对底栖藻类的影响多集中在水体氮、磷浓度的影响.研究表明, 随着氮、磷等营养盐浓度的增加, 底栖附泥藻类生物量会显著增加(Pizarro et al., 2002;Quinlan et al., 2008).Pizarro等(2002)通过比较不同营养状态湖泊中的附着藻类现存量发现, 随着水体营养盐浓度的升高, 湖泊中附着藻类生物量增大, 附着藻类生物量与水体氮、磷等营养盐含量之间存在显著的相关关系.然而, 已有的研究也发现, 在水体营养盐浓度较低的情况下, 也存在附泥藻类生物量较高的现象(Hansson, 1992;Dodds, 2003).裴国凤(2006)通过对云南高原湖及长江中游平原湖沿岸带底栖藻类的调查发现, 底栖藻类现存量和水体总磷、总氮浓度之间没有显著的相关关系, 且湖泊之间差异较大(1.01~40.82 μg·cm-2).这可能与底栖藻类代谢活动及沉积物可利用氮、磷等营养元素含量密切相关(Dodds, 2003;张强等, 2010).已有的研究表明, 底栖藻类的代谢活动影响沉积物的氧化还原条件, 进而影响元素存在形态、微生物活动, 以及环境中可利用的氮、磷等元素, 从而对底栖藻类的生长产生影响(Dodds, 2003;张强等, 2010).Hansson(1992)研究发现, 在水体氮、磷浓度较低的湖泊中, 沉积物间隙磷浓度越高, 沉积物上底栖藻类现存量越大.本文的研究结果表明, 太湖附泥藻类生物量与水体氮、磷含量及沉积物的氮、磷水平之间均存在显著的相关性.这说明在本研究的采样季节, 附泥藻类的发展既受水体氮、磷浓度的影响, 也受沉积物氮、磷水平的影响.此外, 太湖沉积物上的附泥藻类生物量空间分布呈现明显的空间异质性, 这与太湖氮、磷等营养元素分布的空间异质性密切相关.
太湖环境中氮、磷等营养盐含量的空间分布存在显著的空间异质性.从水体营养盐含量来看, 竺山湾、梅梁湾及太湖西岸与入湖河道相连, 大量的工业废水和生活污水从这些区域排入湖体, 再加上农业面源污染, 使这些湖区成为全太湖水体氮、磷等营养盐浓度较高的水域(韩晓霞等, 2014;吴筱清, 2015;张琼华等, 2016), 每年藻类大量繁殖, 是典型的藻型湖区.然而, 水体氮、磷等营养元素含量受外源污染和内部因素共同的影响.在太湖东部如胥口湾和东太湖, 以及南部湖区, 由于水生植物, 尤其是沉水植物占优势, 属于草型湖区(韩晓霞等, 2014;吴筱清, 2015;张琼华等, 2016).由于水生植物生长会从水体中吸收大量的氮、磷等元素(黄亮等, 2010), 使得这一区域的水体氮、磷等元素含量相对较低.沉积物中总磷及各种形态磷含量的空间分布特征与水体中生源要素空间分布规律类似, 即在太湖的西北部(包括竺山湾)较高, 其它区域相对较低, 但沉积物总氮与水体中生源要素空间分布规律有一定的差异.太湖沉积物总氮与总有机碳的含量空间分布特征一致, 在太湖西北部(包括竺山湾)、梅梁湾、东部湖区包括东太湖和胥口湾含量较高, 在西南部湖心区较低.从沉积物TN及TOC的Pearson相关分析结果不难发现, TOC与TN的相关系数为0.87, 呈显著的正相关关系(p<0.01), 这可能是由于沉积物中绝大多数氮的来源与有机物有密切的关系(黄亮等, 2010;倪兆奎等, 2011;吴筱清, 2015).虽然有研究表明, 磷元素可以随着外源有机物共同沉积到湖底, 沉积物中有机物对磷在沉积物中的累积也有一定促进作用(冯峰, 2006), 但磷在沉积物中的迁移转化是一个复杂的过程, 由许多因素共同作用而成.因此, 表层沉积物中TOC与TP的含量虽呈显著的正相关关系(r=0.25, p<0.05), 但相对于TOC与TN的相关性(r=0.87, p<0.01)来说, 相关性较低, 这一结果与前人的研究结果一致(袁和忠等, 2010).此外, 本文的研究结果还表明, 太湖沉积物中, 无机磷在总磷中占有的比例较大, 平均为71%, 最高可高达93%;Fe/Al-P在无机磷中占有的比例为44%(平均值), 虽低于Ca-P, 但Fe/Al-P受环境变化要比Ca-P敏感, 被认为是重要的潜在可被藻类利用的磷源(袁和忠等, 2010).太湖沉积物中这些形态磷的含量的空间分布都具有显著的异质性(图 3c~3g).由此可见, 太湖水体和沉积物中氮、磷等营养盐含量, 以及沉积物不同形态磷含量在空间上具有显著异质性, 而环境中氮、磷等营养元素的空间异质性是影响附泥藻生物量空间异质性的重要因素.本研究表明, 沉积物上附着藻类生物量与沉积物中氮、磷含量密切相关, 其中, 与沉积物中Fe/Al-P(r=0.59, p<0.01)的含量呈显著相关, 说明沉积物中的氮、磷含量尤其内源磷释放对附泥藻类生长有重要意义.本文进一步分析附泥藻类与浮游藻类生物量之间的关系发现, 浮游藻类与附着藻类生物量没有显著的相关关系(r=0.09, p>0.05), 这说明沉积物中的藻类来源于浮游藻类的可能性比较小.
5 结论(Conclusions)1) 在本研究采样期间, 太湖附泥藻类生物量空间异质性显著, 在太湖西北部(包括竺山湾)及东太湖较高, 其次是贡湖湾、梅梁湾及东部沿岸, 在西南部湖心区较低.
2) 太湖水体及沉积物营养元素含量在空间上呈现明显的异质性分布, 水体中生源要素在竺山湾、梅粱湾及太湖西部的浓度明显高于其他湖区;沉积物中总磷及各种形态磷含量的空间分布特征与水体中生源要素类似, 在太湖的西北部(包括竺山湾)较高, 其它区域相对较低.沉积物总氮及总有机碳的含量在太湖西北部(包括竺山湾)、梅梁湾、东部湖区包括东太湖和胥口湾含量较高, 在西南部湖心区较低.
3) 太湖附泥藻类生物量既受水体氮、磷浓度的影响, 也受沉积物氮、磷水平的影响, 具体表现为附泥藻类生物量与水体及沉积物的氮、磷含量及不同形态磷(Ca-P除外)含量呈显著正相关(r≥0.18, p<0.05), 尤其是沉积物中Fe/Al-P含量和水体中NH4+-N及TDP浓度显著相关(r≥0.59, p<0.01), 但与水体浮游藻类生物量(Chla)之间没有显著的相关关系(r=0.09, p>0.05).
致谢: 在采样及分析过程中得到中国科学院南京地理与湖泊研究所工作人员邵克强博士及胡杨、许浩等同学的帮助, 江苏太湖湖泊生态系统国家野外科学观测研究站薛静琛也给予了帮助, 在此深表感谢!
Aloisie P, Petr H, Monika L, et al. 2008. The ecology of freshwater epipelic algae:An update[J]. Phycologia, 47(5): 437–450.
DOI:10.2216/07-59.1
|
Azim M E, Verdegem M C J, Van Dam A A, et al. 2005. Periphyton:Ecology Exploitation and Management[M]. Wallingford: CABI Publishing.: 1–8.
|
Dodds W K. 2003. The role of periphyton in phosphorus retention in shallow freshwater aquatic systems[J]. Journal of Phycology, 39: 840–849.
DOI:10.1046/j.1529-8817.2003.02081.x
|
丁娜, 徐东坡, 刘凯, 等. 2015. 太湖五里湖着生藻类群落结构特征分析[J]. 江西农业大学学报, 2015, 37(2): 346–352.
|
冯峰. 2006. 沉积物中碳氮磷形态含量、微生物量的垂向分布及其相关性研究[D]. 北京: 中国科学院水生生物研究所. 43-49
http://cdmd.cnki.com.cn/Article/CDMD-80119-2006130519.htm |
国家环境保护总局《水和废水监测分析方法》编委会. 2002. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社: 243–280.
|
韩晓霞, 朱广伟, 许海, 等. 2014. 太湖夏季水体中尿素的来源探析[J]. 环境科学, 2014, 35(7): 2547–2556.
|
黄亮, 吴乃成, 唐涛, 等. 2010. 水生植物对富营养化水系统中氮、磷的富集与转移[J]. 中国环境科学, 2010, 30(S1): 1–6.
|
Hansson L A. 1992. Factors regulating periphytic algal biomass[J]. Limnology and Oceanography, 37: 322–328.
DOI:10.4319/lo.1992.37.2.0322
|
金相灿, 屠清瑛. 1990. 湖泊富营养化调查规范(第2版)[M]. 北京: 中国环境科学出版社: 162–164.
|
金颖薇, 朱广伟, 许海, 等. 2015. 太湖水华期营养盐空间分异特征与赋存量估算[J]. 环境科学, 2015, 36(3): 936–945.
|
李大命, 于洋, 张民, 等. 2012. 太湖表层底泥中产毒蓝藻群落结构和种群丰度的时空变化[J]. 环境科学学报, 2012, 32(11): 2827–2835.
|
倪兆奎, 李跃进, 王圣瑞, 等. 2011. 太湖沉积物有机碳与氮的来源[J]. 生态学报, 2011, 31(16): 4661–4670.
|
裴国凤. 2006. 淡水湖泊底栖藻类的生态学研究[D]. 武汉: 中国科学院水生生物研究所
http://cdmd.cnki.com.cn/Article/CDMD-80119-2006130495.htm |
裴国凤, 刘国祥. 2011. 长江中游湖泊沿岸带的底栖藻类群落结构特征[J]. 湖泊科学, 2011, 23(2): 239–245.
DOI:10.18307/2011.0212 |
Pizarro H, VinocurA, Tell G. 2002. Periphyton on artificial substrata from three lakes of different trophic status at Hope Bay (Antarctica)[J]. Polar Biology, 25: 169–179.
|
Quinlan E L, PhlipsE, Donnelly K A, et al. 2008. Primary producers and nutrient loading in Silver Springs, FL, USA[J]. Aquatic Botany, 88: 247–255.
DOI:10.1016/j.aquabot.2007.11.003
|
秦伯强, 罗潋葱. 2004. 太湖生态环境演化及其原因分析[J]. 第四纪研究, 2004, 24(5): 561–568.
|
瞿文川, 潘红玺, 苏晨伟. 1995. 紫外可见分光光度法对湖泊沉积物中的色素测定[J]. 分析测试技术与仪器, 1995, 1(4): 36–39.
|
Ruban V, López-Sánchez J F, Pardo P. 2001. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments-A synthesis of recent works[J]. Fresenius' Journal of Analytical Chemistry, 370(2): 224–228.
|
宋玉芝, 张亚冬, 郑建伟, 等. 2016. 淡水湖泊附着藻类生态学研究进展[J]. 生态学杂志, 2016, 35(2): 534–541.
|
孙萱, 宋金明, 于颖, 等. 2014. 元素分析仪快速测定海洋沉积物TOC和TN的条件优化[J]. 海洋科学, 2014, 38(7): 14–19.
DOI:10.11759/hykx20130801001 |
Şahin B. 2008. Species composition and diversity of epipelic algae in Limni Lake (Gümüşhane Turkey)[J]. ActaBotanica Hungarica, 50(3): 397–405.
|
Sundbäck K, Graneli W. 1988. Influence of microphytobenthos on the nutrient flux between sediment and water:a laboratory study[J]. Marine Ecology Progress, 43(1/2): 293–300.
|
陶益. 2005. 太湖底泥中蓝藻复苏的生态阈值研究[D]. 南京: 南京大学
http://www.cqvip.com/QK/97421X/200503/20050661.html |
Vadeboncoeur Y, Peterson G, Van Der Zanden M J, et al. 2008. Benthic algal production across lake size gradients:Interactions among morphometry, nutrients, and light[J]. Ecology, 89(9): 2542–2552.
DOI:10.1890/07-1058.1
|
吴筱清. 2015. 太湖水环境特征及沉积物有机质来源识别[D]. 南京: 南京大学. 47-48
http://cdmd.cnki.com.cn/Article/CDMD-10284-1015317265.htm |
袁和忠, 沈吉, 刘恩峰, 等. 2010. 太湖水体及表层沉积物磷空间分布特征及差异性分析[J]. 环境科学, 2010, 31(4): 954–960.
|
袁信芳, 施华宏, 王晓蓉. 2006. 太湖着生藻类的时空分布特征[J]. 农业环境科学学报, 2006, 25(4): 1035–1040.
|
Zhang X, Liu Z, Gulati R D, et al. 2013. The effect of benthic algae on phosphorus exchange between sediment and overlying water in shallow lakes:a microcosm study using 32P as a tracer[J]. Hydrobiologia, 710(1): 109–116.
DOI:10.1007/s10750-012-1134-9
|
张强, 刘正文. 2010. 附着藻类对太湖沉积物磷释放的影响[J]. 湖泊科学, 2010, 22(6): 930–934.
|
张琼华, 王晓昌, 王倩, 等. 2016. 太湖西岸宜兴城市水系污染物时空分布特征[J]. 环境工程学报, 2016, 10(8): 4343–4350.
DOI:10.12030/j.cjee.201510070 |
 2017, Vol. 37
2017, Vol. 37


