2. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006
环境水体污染与能源危机日趋严重, 亟需发展新型能量转换装置将污水中的可回收能量直接转化为电能, MFC技术为此提供了新契机(Logan et al., 2012; Dong et al., 2013).然而, 目前还存在很多因素阻碍该技术往预期的方向进一步发展, 如功率密度低、启动过程冗长繁琐、阳极生物膜挂膜周期长、阳极与阴极的高氧化还原性能不相匹配等, 这些限制因素使得该技术很难满足人类社会高效、快速、稳定的电能输出要求(Logan, 2010).
已有大量研究致力于电极材料、催化剂、产电微生物及整个生物电化学系统的配置, 在阳极改性及整合方面能人们通过硝酸-PPy/AQDS(polypyrrole/anthraquinone-2, 6-disulphonic disodium salt)联合处理极大地提高了阳极性能(沈伟航等, 2010), 但涉及阳极生物膜预培养对于MFC整体性能影响的研究却比较少(Entcheva-Dimitrov et al., 2004), 同时, 探究如何获取更加成熟的阳极生物膜及阳极生物量调控方法的研究也十分稀少.Yuan等(2009)提出了一种简便高效的细菌固定化方法, 该研究用聚四氟乙烯乳液作为粘合剂将细菌固定在碳纳米颗粒材料上作为MFC阳极, 碳纳米颗粒和聚四氟乙烯乳液可形成微型阵列将细菌包裹在其中, 加速电子传递过程.Liu等(2008)研究表明, 以生活污水中的混合菌作为接种物, 通过简易连续的生物电化学筛选步骤可大幅提升MFC阳极的生物电化学催化性能.
基于外界选择压力的生物富集正逐渐成为阳极生物膜驯化培养的重要方法.然而, 为了在阳极表面形成较为成熟的生物膜还涉及到更换培养基质和营养液, 以及反复驯化培养等一系列的繁冗、复杂的重复性劳动(Logan et al., 2006c).阳极形成稳定均一的生物膜需数日到数月不等, 因菌种和操作条件的不同而异.另外一个需要重点关注的是阳极生物膜厚度, 从理论上来讲, 可以通过优化调控阳极挂膜过程来获取更强的生物响应电流(Aelterman et al., 2008).假如阳极生物膜过厚, 电子从胞内到达阳极表面需要经过更长的距离, 克服更多的阻力;与之相反, 阳极生物膜过薄会导致阳极生物量过低, 没有足够的产电微生物参与胞外电子传递过程, 无法形成稳定的输出电流(Borole et al., 2011).
目前有关MFC阳极生物膜预培养的研究信息较少而且相对分散, 涉及阳极生物膜预培养方法效果对比的研究也鲜有报道.本文针对阳极生物膜预培养方面研究的缺失, 对比分析阳极生物膜恒电流预培养方法的优劣, 以求明确生物膜阳极预培养的效果与可行性, 用生物膜预培养阳极代替传统阳极并入MFC系统, 加速MFC技术的商业化进程.本研究旨在提供一些关于阳极预培养方面的关键信息:例如, 是否能够通过阳极生物膜预培养来提升阳极性能?恒电流预培养阳极是否能取代正常启动阳极?以期激发广大研究者在MFC阳极生物膜预培养方面进行更多的思考与讨论, 从而加速MFC技术从实验室走向工业化生产的进程.同时, 本研究评估了不同外界电化学选择压力对阳极生物膜的生长速度及电化学活性的影响, 通过分析不同恒电流预培养阳极生物膜的表面形貌、厚度、三维结构尺寸、生物量密度及电化学性能, 评估恒流预培养阳极生物膜的可行性与效果.
2 材料与方法(Material and methods) 2.1 外加恒电流阳极预培养利用电化学工作站(CHI 660上海辰华)在100 mL圆柱三电极电解池中进行恒电流控制, 操作在30 ℃的恒温培养箱中进行, 采用三电极体系:2 mol·L-1硝酸处理的3 cm×3 cm碳毡作为工作电极(Zhu et al., 2011), 银/氯化银电极为参比电极, 铂片作为对电极.生物膜阳极预培养的简要步骤为:养猪污水厌氧沼气池污泥经5 d预培养后的上清液与营养底物基质(具体配方见表 1)各50 mL均匀混合后加入到100 mL的密闭的电解池中, 控制不同预培养电流, 在线监控并采集生物电催化电流及电势(Liu et al., 2008; Wei et al., 2010).
| 表 1 营养底物基质 Table 1 Formula of glucose solution |
将4个相同的硝酸处理的碳毡阳极分别装入4个盛放好100 mL污泥上清液和底物的相同的电解池当中, 并分别施以0.5、1、2和4 A·cm-2的恒定电流密度, 加速阳极生物膜的生长.4 d之后同时取出4个电解池中的工作电极, 作为恒时-不同恒定电流的生物膜预培养阳极, 并将这些电极装配在对应的单室空气阴极反应器中.这4个电极分别标记为:CF-0.5i、CF-1i、CF-2i和CF-4i, 并且对应的微生物燃料电池分别命名为MFC-0.5i、MFC-1i、MFC-2i和MFC-4i.
此外, 设置未施加外界选择压力的空白对照组, 通过不断更换营养液和上清液使得阳极在MFC系统中自然挂膜实现启动过程, 对照组阳极标记为CF-0, 对应微生物燃料电池标记为MFC-0(Erable et al., 2009).
2.2 MFCs组装运行本研究使用的是单室无膜空气阴极反应器, 反应器的主体结构是边长为2.5 cm, 长度为3 cm的横向长方体, 有效容积约为18.75 mL, 电极间距3 cm, 阴极开半径为1 cm的圆孔, 阴极面积均为3.14 cm2, 材质为PC聚碳酸酯板, 阳极用盲板和硅胶片固定, 不同条件下的4个预培养阳极分别装配在4个反应器当中, 阴极采用防水碳布上负载Pt/C催化剂(10%, 0.5 mg·cm-2 Pt), 组装好的电池在30 ℃条件下运行.所有电池电压均通过数据采集系统采集.在电池的最大可重复输出电压稳定后, 利用可变直流电阻箱从10000~100 Ω依次调节外回路外阻, 采集相应输出电压, 并求得相应电流密度, 绘制极化曲线, 并推算出最大功率密度.最大功率密度的计算公式为:P=U2/(RS), 其中, U为输出电压(V), R为外回路电阻(Ω), S为电极面积(m2).在MFCs腔内阴、阳极等距位置插入参比电极来监测阳极电势, 阴极电势则由阳极电势与电池输出电压加和而得(Logan et al., 2006a).
2.3 阳极测试及表征 2.3.1 阳极生物膜生长及代谢结构分析实验所用反应器启动和阳极生物膜预培养的接种物均采用养猪污水厌氧沼气池污泥, 从广东温氏集团新兴县某养猪场采集, 去除杂物后于4 ℃保存, 驯化5 d, 驯化液的营养组分为:葡萄糖1 g·L-1, NH4Cl 0.08 g·L-1, KH2PO4 0.08 g·L-1, 酵母浸膏0.48 g·L-1, 此外, 每升驯化液还需添加5 mL微量元素(Logan, 2008).污泥经预培养后变得黑亮, 待预培养结束, 不同阳极分别组装至相应MFC中, 此后仅添加营养液不再添加污泥上清液, 继续培养30个周期(一个周期为由最低电压升至最高电压再下降到0.01 V及以下的时间);同时, 对照组电池一直采用上述混合液培养至MFC输出电压超过100 mV, 再继续用营养液培养(不再添加污泥上清液), 当输出电压低于50 mV时更换培养液, 同样重复培养30个周期.
采用激光共聚焦显微镜观测不同阳极生物膜的三维结构尺寸及活细胞与死细胞的比例.阳极生物膜用荧光试剂染色盒进行染色, 具体操作如下:将碳毡阳极生物膜样品从电极上取出并用过量的50 mmol·L-1的PBS冲洗去除阳极表面残留的培养液基质, 随后用LIVE/DEAD® BacLightTM Bacterial Viability Kit的组分A和组分B混合均匀, 在避光条件下, 将各阳极生物膜样品同时染色20 min, 随后继续用PBS冲洗样品去除多余的SYTO 9染料.用载玻片盛放浸泡在PBS中的不同阳极样品, 在CLSM下依次观察活细胞与死细胞的比例, 并用ZEN 2009 Light Edition软件拟合碳毡阳极表面生物膜的三维结构尺寸(Sun et al., 2015).
2.3.2 预培养阳极的电化学分析阳极生物膜的电化学性能表征主要采取循环伏安法、电化学阻抗谱及塔菲尔曲线法, 电化学表征在电化学工作站的两电极或三电极体系中进行, 预培养阳极、阴极及银/氯化银电极分别作为该系统的工作电极、对电极及参比电极.CV(循环伏安法)的测试条件为:-1~0.8 V, 10 mV·s-1, 50 mmol·L-1 PBS, pH=8.0, 10 mV·s-1扫描20圈.电化学阻抗谱测试条件为:初始电压为0 V vs.OCV(开路电压), 频率范围为105~10-2 Hz, 正弦扰动振幅为5 mV.塔菲尔曲线测试条件为:测试不同预培养阳极的开路电势并定义为0 V, 以1 mV·s-1的速率在0~100 mV的过电势范围内匀速扫描.
2.3.3 场发射扫描电镜分析用场发射扫描电子显微镜(Field Emission Scanning Electron Microscopy, FE-SEM)来观察不同预培养阳极的表面结构及微生物生长情况, 用FE-SEM拍摄样品高分辨率图像之前应对样品进行预处理:将从MFC中取出的阳极剪成小块并在2.5%戊二醛溶液中固定, 然后用磷酸盐缓冲液(0.1 mol·L-1, pH=7.2)清洗干净;接着将阳极分别用梯度浓度乙醇进行脱水, 最后用叔丁醇置换, 置换后的阳极放入冷冻干燥器中干燥.观察前, 样品需进行喷金处理, 加速电压为0.02~30 kV.
3 结果与分析(Results and analysis) 3.1 不同恒电流预培养阳极的循环伏安和奈奎斯特曲线对于阳极生物膜恒时-不同电流预培养, 如图 1所示, 在较小的恒定预培养电流密度(1 A·m-2以下)时在面积上大于对照组, 并未出现新的氧化峰;但随着预培养电流密度的进一步增大(2 A·m-2以上), 出现了明显的氧化峰, 且该氧化峰的峰值电流在0.006 A左右, 此时的电位为0.7 V左右, 这可能因为只有当外界刺激电流达到某一阈值且持续相当一段时间后, 才会有较多的电化学活性微生物在电极上富集, 表现出较为明显的电化学活性(Aelterman et al., 2008; Borole et al., 2011; Fan et al., 2012).CV峰的响应电流强度的变化趋势与预培养电流密度的变化有线性相关的关系, 随着预培养电流密度的增强, CV曲线氧化峰的峰值电流按以下顺序依次增大, 即CF-4i(0.713 V, 0.0066 A) > CF-2i(0.747 V, 0.00631 A)> CF-1i(0.349 V, 0.00192 A)> CF-0.5i(0.187 V, 0.00145 A)> CF-0(无).上述规律符合电活性物质表面控制模型, 表明氧还原峰均来自于固定电极表面的生物膜(Hindatu et al., 2017).电活性生物膜的CV图谱与硫还原地杆菌的生物膜图谱类似, 表明CV图谱中的氧还原峰主要来自于电化学活性生物膜中含有的硫还原地杆菌类微生物种群(Entcheva-Dimitrov et al., 2004).由上可知, 当恒流电流密度大于2 A·m-2时恒流预培养对于峰值电流的提升较为明显.
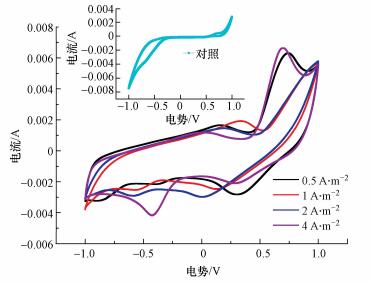 |
| 图 1 不同预培养阳极的循环伏安曲线 Fig. 1 Cyclic voltammograms of different anodes |
对于不同恒电流预培养而言, 如图 2所示, 未预培养的阳极欧姆内阻为98 Ω, 传质内阻为400 Ω, 预培养阳极欧姆内阻及传质阻力随预培养电流密度的增强而同步减小, 基本符合CF-4i < CF-2i < CF-1i < CF-0.5i的变化规律, 在0.5、1、2、2 A·m-2的预培养电流下, 欧姆内阻依次为92、89、84、82 Ω, 传质阻力依次为128、94、73、52 Ω.但值得注意的是, 阳极预培养可以减小欧姆内阻, 但减小的幅度不大, 对传质阻力的影响较大, 随着预制电流密度的增强, 传质内阻从对照组的400 Ω逐步降低到4 A·m-2预培养组的52 Ω, 电子传递阻力的减小也说明阳极恒流预制能加速产电菌与阳极之间的传质过程.电化学阻抗谱的表征结果说明了阳极预培养能够降低电极的电阻, 其机理可简要的概括为:基于外界电化学选择压力筛选出的产电微生物通过自身的新陈代谢利用葡萄糖并释放出H+和e-, 电子通过微生物本身合成的细胞色素传递给核黄素电子穿梭体, 并最终传递给阳极碳纤维, 依靠其强导电性与电子传递能力向外回路传输电子, 在这个过程中, 电子转移和利用效率得到大幅改善, 使得阳极性能整体性能得到提升(Liao et al., 2015; Franks et al., 2009).整体而言, 恒流预培养可降低电池的内阻, 提升电池的效率.
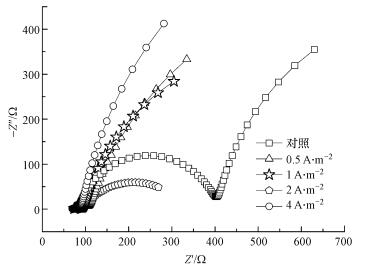 |
| 图 2 恒流预培养阳极的奈奎斯特曲线 Fig. 2 EIS curves of different anodes obtained under chronopotentiometry control |
由不同恒电流预培养的Tafel曲线表征结果(图 3)可知, 随着电流密度的增大, E-logi曲线的斜率也是逐渐增大的(Vaszilcsin et al., 2009), Tafel曲线顺着坡度作切线与纵轴的交点即为交换电流密度, 通过拟合计算, 对照组的交换电流密度为2.51×10-6 A·m-2, 在电流密度0.5.、1、2、4 A·m-2预培养条件下的阳极交换电流密度分别为1.99×10-5、2.53×10-5、5.62×10-5、1.52×10-4 A·m-2, 交换电流密度随着预培养电流密度的增大而增大, 符合CF-0.5i < CF-1i < CF-2i < CF-4i的变化规律, 交换电流密度越大说明阳极具有更好的电子转移速率从而表明阳极性能更好(Liao et al., 2015), 随着预培养电流的增大, 高电化学活性的微生物富集使阳极具备更好的导电性和更高的电子电子转移能力(Sun et al., 2015), 基本与之前的CV、EIS表征测试结果一致.从图中可以看出, 曲线中间有一个较明显的上升期, 后期变化并不明显.整体而言, 恒电流预培养能提升阳极生物膜交换电流密度.
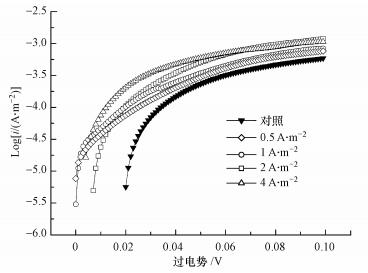 |
| 图 3 恒流预培养阳极的塔菲尔曲线(扫描速率为1 mV·s-1, η=0~100 mV, 其中η表示阳极开路电势) Fig. 3 Tafel plots of the various anodes under chronopotentiometry control(The scan rate is 1 mV·s-1, from η= 0~100 mV, where η is the open circuit potential) |
利用恒时-不同电流密度驯化阳极电化学活性生物膜的电势-时间响应曲线如图 4所示, 曲线选取的是不同电流密度驯化第4 d(由于第4 d预培养效果最好)的电压随时间变化情况.由图可知, 0.5 A·m-2电流密度条件下驯化的4 d内, 响应电势从2.2 V逐渐下降到1.9 V, 随后又上升至0.22 V;电势出现上下波动的原因在于微生物对该电流密度的适应性较差, 经过短暂的适应调整期之后, 电势值恢复平稳状态;1 A·m-2电流密度条件下, 响应电势从2.5 V逐渐下降到2.3 V;2 A·m-2电流密度条件下, 响应电势从1.29 V逐渐下降到1.18 V;4 A·m-2电流密度条件下, 响应电势从1.32 V逐渐下降到1.28 V.可以发现, 随着预培养电流密度的加大, 响应电势逐步降低, 但从2 A·m-2到4 A·m-2的变化过程中电势下降的幅度并不明显, 由于生物膜的附着会导致电极内阻下降, 从而在同等电流密度下会呈现出更低的电势(Du et al., 2007).基于上述实验结果与事实, 一方面可以推断, 较强的电流密度刺激更加有利于阳极生物膜的附着与生长, 降低阳极电阻;另一方面可以得知, 当电流密度超过2 A·m-2后, 继续通过提高电流密度刺激阳极生物膜生长, 效果不再明显.这是由于微生物对电流密度有一个适应及耐受范围, 过大的电流密度会破坏微生物自身新陈代谢系统的稳定性(Janicek et al., 2015; Renslow et al., 2013; Rabaey et al., 2003).因此, 电流密度超过一定范围以后, 可尝试更换其他的外界刺激压力以继续加速阳极生物膜的生长过程.
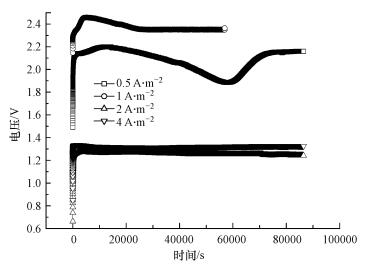 |
| 图 4 恒流预培养的电势-时间曲线 Fig. 4 The U-t plots of the preincubated anodes in chronopotentiometry control |
将不同恒电流预培养阳极装配至相同的MFC系统中检验同种方法不同预培养条件下对应阳极的性能差异.就启动时间和最大输出电压而言, 预培养阳极显示出了比对照组阳极更好的电压输出性能, 预培养过的阳极可以在更短的时间内达到更大的输出电压, 不同电流密度预培养4 d的阳极优于空白阳极, 如图 5所示, 在低电流密度(0.5、1、2 A·m-2)的刺激下, 电池的启动时间较空白(220 h)均有大幅缩短, 0.5、1和2 A·m-2的电流密度下启动时间基本都缩短至100 h左右, 但当电流密度提升至4 A·m-2时, 电池的启动却再次出现延滞, 需要140 h才可以实现稳定电压输出.恒流条件下预培养的阳极在最大输出电压上的差异性并不明显, 预培养阳极仅仅是略高于空白阳极.由此推测, 较小的电流密度刺激有利于阳极生物膜的形成和电化学性能强化, 但过高的电流却会起到反作用, 导致启动时间的延长, 这可能是由于过大电流刺激破坏了部分产电微生物新陈代谢的正常进行(Sun et al., 2015; Li et al., 2014; Ketep et al., 2013).综上可知, 预培养阳极装配成的MFC系统更为高效, 预培养阳极表面的生物膜的适应性和电化学性能更强, 这导致了启动过程的加快和最大输出电压的提升, 但持续过大电流刺激不利于大部分微生物的代谢, 会阻碍MFC的启动过程.
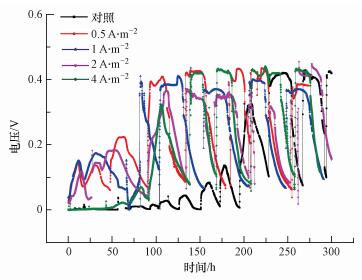 |
| 图 5 恒流预培养的电压-时间曲线 Fig. 5 The U-t plots of the preincubated anodes in chronopotentiometry control |
对于恒时-不同预培养电流而言, 如图 6所示, 空白阳极的最大功率密度仅为382.56 mW·m-2, 经0.5、1、2和4 A·m-2的恒定电流预培养4 d后, 对应的阳极产生的最大功率密度分别提升了73.8%、100%、116%和153.1%, 分别达到664.98、765.13、826.34和968.20 mW·m-2.这些结果清晰地表明, 加大恒时预培养电流密度能够通过提高阳极性能来有效地提高MFC输出功率性能, 且该高功率密度可在极短的时间内实现, 这与之前的许多研究结果保持一致(Liu et al., 2008; Kiely et al., 2010; Kim et al., 2004; Tang et al., 2015).整体而言, 恒流预培养在一定条件下可同时实现MFC的即时启动和高功率密度.
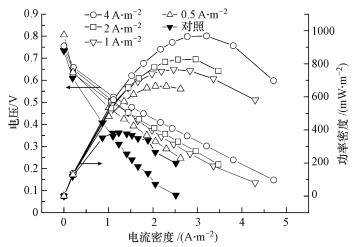 |
| 图 6 不同阳极装配的MFCs的电池性能和极化曲线图 Fig. 6 Performance of the MFCs equipped with various anodes and polarization curves of the MFCs with different anodes |
图 7为恒流预培养阳极装配电池运行30个周期后的扫描电镜图, 阳极表面占主导地位的微生物是链球菌和杆菌.不同预培养电流密度条件下阳极的微生物表面形态有很大的差异性.首先, 预培养组的阳极生物量(图 7b~e)明显高于未预培养组(图 7a), 表现为阳极生物膜较对照组而言更加密实;其次, 随着电流密度的增大, 对应MFC的阳极上的微生物都要明显比没有预培养的阳极上的微生物更多, 4 A·m-2下预培养4 d(图 7e), 2 A·m-2下预培养4 d(图 7 d), 以及1 A·m-2下预培养4 d(图 7c)的阳极单位视野内的微生物数量明显大于0.5 A·m-2下预培养4 d(图 7b)的阳极, SEM图中显示的不同电流密度下预培养阳极表面的细菌量与之前的功率密度、EIS及极化曲线结果一致.因此, 阳极表面生物量的多少直接影响着整个生物阳极的电子转移速率与功率输出, 即CF-4i> CF-2i> CF-1i> CF-0.5i> CF-0.这说明恒流预培养可以促进微生物在阳极表面的附着和生长, 且在一定范围内, 电流密度随阳极的生物量的提升而增大.
 |
| 图 7 恒流预培养阳极运行30个周期后阳极放大5000倍的扫描电镜图(a.未预培养阳极, b.0.5 A·m-2恒流预培养4 d的阳极, c.1 A·m-2恒流预培养4 d的阳极, d.2 A·m-2恒流预培养4 d的阳极, e.4 A·m-2恒流预培养4 d的阳极) Fig. 7 SEM images of each anode after inoculation of 30 cycles under chronopotentiometry control (×5000)(a.SEM image of the blank carbon felts, b.SEM image of the preincubated carbon felts CF-0.5i, c.SEM image of the preincubated carbon felts CF-1i, d.SEM image of the preincubated carbon felts CF-2i, e.SEM image of the preincubated carbon felts CF-4i) |
采用激光共聚焦显微镜观测不同阳极生物膜的三维结构尺寸及活细胞与死细胞的比例, 阳极生物膜用荧光试剂染色盒进行染色, 染色后红色部分为死细胞, 绿色部分为活细胞.样品在CLSM下依次观察活细胞与死细胞的比例, 并用ZEN 2009 Light Edition软件拟合碳毡阳极表面生物膜的三维结构尺寸.如图 8所示, 所有类型的预培养阳极生物膜结构均有一个共同特点:外部的活细胞长在内部死细胞层之上, 这种结构分布表明, 阳极生物膜中的活细胞部分绝大多数都分布于生物膜的外侧, 而不是均布于整个阳极生物膜中, 同时这也表明不是整个阳极生物膜都具有新陈代谢活性.有研究表明, 活细胞数量在靠近电极表面的位置相对稀少, 不是因为染料没有渗入细胞膜的内层细胞, 而是因为死细胞层在整个生物膜生长阶段是始终存在的(Sun et al., 2015).该研究通过实时监控阳极生物膜的厚度变化并进行荧光染色观察, 发现即便在很薄的初生阳极生物膜内部依然可以看到死细胞层.
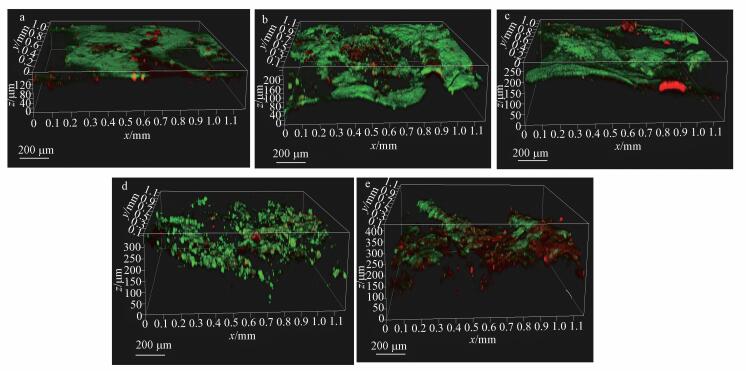 |
| 图 8 恒流预培养阳极运行30个周期后阳极共聚焦显微镜图(a.未预培养阳极, b.0.5 A·m-2恒流预培养4 d的阳极, c.1 A·m-2恒流预培养4 d的阳极, d.2 A·m-2恒流预培养4 d的阳极, e.4 A·m-2恒流预培养4 d的阳极) Fig. 8 Three-dimensional metabolic-structure images of anode biofilms operated with different applied voltage (Biofilms were LIVE/DEAD viability staining, and observed by CLSM.Live cells were imaged as green, whereas dead cells were imaged here as red. a.CLSM image of the blank carbon felts, b.CLSM image of the preincubated carbon felts CF-0.5i, c.CLSM image of the preincubated carbon felts CF-1i, d.CLSM image of the preincubated carbon felts CF-2i, e.CLSM image of the preincubated carbon felts CF-4i) |
如表 2所示, 对于恒流预培养而言, 同样预培养4 d的条件下, 随着预培养电流密度的增大, 阳极生物膜的厚度由对照对照组的163 μm提升至0.5 A·m-2预培养的246 μm, 再提升至1 A·m-2预培养的266 μm和2 A·m-2预培养的387 μm, 最后提升至4 A·m-2预培养的412 μm.与之前的表征结果类似, 共聚焦显微镜的表征结果说明了恒流预培养可以有效地提升阳极生物膜的厚度.
| 表 2 不同恒电流预培养条件下对应的阳极生物膜厚度 Table 2 Biofilms dimension of different anodes obtained under potentiostatic/chronopotentiometry control |
死细胞附着在电极与生物膜的界面上形成的死细胞-活细胞双层结构使得阳极生物膜具备持久的新陈代谢活性, 死细胞堆积形成的特殊中介体使得远离阳极表面的活细胞代谢不受导电性低的限制(Renslow et al., 2013; Malvankar et al., 2012).死细胞层的存在也说明了阳极生物膜中实际参与胞外电子传递过程的只是那些远离电极表面的活细胞, 但电子必须通过死细胞层才能传递至阳极表面, 研究表明, 这些死细胞对化学物质进出活细胞膜的过程没有任何阻碍作用(Renslow et al., 2013).无论是在新生的薄片阳极生物膜, 还是在较厚的生物膜或者是在更加成熟的阳极生物膜当中都可以观察到死-活双细胞层(Sun et al., 2015).研究表明, 由G.anodireducens形成的阳极生物膜的活细胞层的极限厚度约为10~15 μm, 再往后活细胞层厚度基本保持不变, 死细胞层将会从15 μm继续增厚至30 μm, 随着细胞膜的进一步成熟, 死细胞层的厚度由35 μm增厚至80 μm(Sun et al., 2015; Kiely et al., 2010; Jung et al., 2007; Katuri et al., 2010).本研究结果与之类似, 随着恒流预培养的进行, 虽然阳极生物膜的厚度在不断增加, 但阳极生物膜中的活细胞层厚度改变却不大, 死细胞层的增厚是阳极生物膜厚度增加的主要原因.死细胞层的增厚可以解释为什么通常MFC的输出电流或电压在达到峰值后会降低至一个较低的稳定值.由于死细胞层的电导性低于活细胞层, 并且死细胞层增厚之后, 活细胞产生的电子传递至电极表面需要经过更长的距离, 所以峰值电流或电压之后必然会伴随着一段稳定的低值过程.
与之前的研究类似, 死-活细胞双层结构厚度及比例的差异主要源于生物电化学系统中阳极电流密度、菌种及阳极生物膜是否利用阴极产生的氢气3个方面(Malvankar et al., 2011; Franks et al., 2010; Santoro et al., 2015).其中, 形成死-活细胞双层结构的最关键因素是阳极电流密度, 以G.sulfurreducens为接种物, 在同等条件下, 高阳极电流密度(3.5 A·m-2)的条件下, 整个石墨棒电极上附着的几乎都是活细胞(Franks et al., 2010).但在较低阳极电流密度的条件下(0.85~1.85 A·m-2), 可以看到电极表面出现了死-活细胞双层结构(Reguera et al., 2006; Nevin et al., 2008).有研究通过外界施加更高的电压或减小阳极面积来改变阳极电流密度, 进而探究更高的阳极电流密度是否会对阳极生物膜的代谢结构产生影响(Sun et al., 2015; Reguera et al., 2006; Nevin et al., 2008; Ramasamy et al., 2008; Wagner et al., 2010), 结果表明, 在0.7 V的电压下, G.sulfurreducens和混合菌产生的生物膜对应的阳极电流密度分别为2.1和2.6 A·m-2, 当外界电压提升至0.9 V, 阳极电流密度相应分别提升至3.8和5.2 A·m-2.在该变化过程中, 整个约10 μm厚的G.sulfurreducens生物膜基本都是活细胞, 并没有死细胞层出现.对于混合菌, 在同样条件下, 虽然死细胞没有完全消失, 但活细胞在整个细胞膜中所占的比例得到大幅提升.
高的阳极电流密度对于提高活细胞在整个阳极生物膜中占的比例和形成更加稳定、均一的生物膜至关重要.较高预制电流会淘汰大量微生物导致死细胞层增厚, 但经过4 A·m-2的强电流密度筛选, 虽然有大量的细胞会死亡, 但筛选下来的是适应能力和产电能力强的产电微生物.虽然活细胞比例低, 但能力强、成熟度高、稳定性更好, 抵抗外界干扰的能力就更强, 产电性能相应也更好.这从侧面证明了缺少扩散限制是阳极生物膜产生死细胞膜层的本质原因(Qiao et al., 2010;Kim et al., 2005; Parot et al., 2008).高电流意味着阳极生物膜在单位时间和单位面积上产生更多的电子, 这也进一步说明了高电流密度下的生物膜中活细胞比例更大, 电化学活性更高(Jung et al., 2007; Richter et al., 2009).
4 讨论(Discussion)本研究通过三电极体系下外加恒定电流对微生物燃料电池阳极进行预培养, 实验结果表明, 在恒定时间内, 外加恒定电流能提升阳极性能、缩短微生物燃料电池的启动时间.
从CV、EIS、Tafel、扫描电镜、共聚焦显微镜的表征结果来看, 预培养阳极CF-4i有着最大的峰值电流、最低的传质阻力及最粗糙的阳极表面.由于CV曲线的氧化还原峰的峰值电流大小与电极氧化还原活性物质的量及界面传质效率密切相关(Dong et al., 2013), 因此, 预培养阳极CF-4i具有最高的电化学活性表面及最快的固、液相界面传质效率.同时, 就EIS曲线结果而言, 随着预培养电流的加大, 传质阻力相应地大幅减小, 这表明阳极恒电流预培养提升了固液相之间的电子传输及电化学反应的动力学过程(Dong et al., 2013).根据Tafel曲线结果也可以看出, 随着预培养电流的增大, 阳极的交换电流密度也随之增大, 相比于对照组, 预培养阳极的交换电流密度都明显大于对照阳极, 但随着预培养阳极电流增大到一定程度, 预培养阳极的交换电流密度的增加趋势趋于平缓, 主要是由于过大的电流密度影响了阳极生物膜微生物的正常生长代谢从而影响了电子传质过程(Sun et al., 2015; Ketep et al., 2013).同时根据共聚焦显微镜观察结果, 在一定的预培养电流强度下, 预培养电流越高生物膜的厚度越大, 电化学活性越高.
本研究证实, 预培养阳极能极大地缩短微生物燃料电池的启动时间, 相比于对照组的220 h, 恒电流预培养的时间都在100 h左右, 然而当预培养电流达到4 A·m-2时, 电池启动达到稳定电压需要140 h以上.主要原因是较小的电流密度刺激有利于阳极生物膜的成型和电化学性能强化, 但过高的电流却会起到反作用, 导致启动时间的延长, 其中, 主要是由于过大电流刺激影响了产电微生物正常新陈代谢的进行(Sun et al., 2015; Li et al., 2014)
本研究的实验证明, 在恒流4 A·m-2条件下预培养4 d可形成电化学性能稳定、结构均一的阳极生物膜, 该预培养条件下的阳极各方面的性能优于未预培养的阳极.值得注意的是, 本实验探讨了基于电化学选择压力下的阳极生物膜生长状况, 但外界选择压力及刺激还有很多种, 比如, 外界光照强度刺激、外界磁场刺激、阳极液的扰动刺激等一系列的因素对阳极生物膜的生长影响仍有待探讨;再次, 基于电化学选择压力的预培养与复配高效产电微生物直接固定化在阳极上(Yuan et al., 2009)的尝试, 以及该方法与本文方法的效果对比的工作仍有待开展;最后, 恒流预培养可促进阳极生物膜的生长, 但外界电化学选择压力促进阳极生物膜生长的本质原因却没有涉及, 因此, 基于外界选择压力的阳极生物膜机理研究及阳极生物膜的生长模型构建(Katuri et al., 2010; Logan et al., 2006b; Patil et al., 2011; Richter et al., 2008; Marsili et al., 2010)也是阳极生物膜研究发展的重要方向之一.
5 结论(Conclusions)1) 在较低的阳极电流下, 阳极生物膜中会形成死-活双层细胞膜结构, 生物膜生长过程中, 负责产电的活细胞层会达到一个相对固定的厚度, 死细胞则会继续在电极表面累积, 作为电子传递的中介体.恒流条件下电流密度的增大均会提升预培养阳极的性能, 阳极挂膜启动过程可大大加快, 基本可实现MFC即需即用.
2) 恒流预培养相比对照组呈现出更多的细菌附着、更厚的生物膜、更大的输出电压及更大的功率密度.
3) 恒电流预培养的MFC-4i能产生968.20 mW·m-2的功率密度, 是对照组的2.53倍.
4) 恒流条件下电流密度的增大均会提升预培养阳极的性能, 阳极挂膜启动过程可大大加快, 基本可实现MFC即需即用, 为微生物燃料电池的实际及扩大化应用提供了新思路.
Aelterman P, Freguia S, Keller J, et al. 2008. The anode potential regulates bacterial activity in microbial fuel cells[J]. Applied Microbiology and Biotechnology, 78(3): 409–418.
DOI:10.1007/s00253-007-1327-8
|
Borole A P, Reguera G, Ringeisen B, et al. 2011. Electroactive biofilms:current status and future research needs[J]. Energy & Environmental Science, 4(12): 4813–4834.
|
Dong H, Yu H, Wang X, et al. 2013. Carbon-supported perovskite oxides as oxygen reduction reaction catalyst in single chambered microbial fuel cells[J]. Journal of Chemical Technology and Biotechnology, 88(5): 774–778.
DOI:10.1002/jctb.3893
|
Du Z, Li H, Gu T. 2007. A state of the art review on microbial fuel cells:a promising technology for wastewater treatment and bioenergy[J]. Biotechnology Advances, 25(5): 464–482.
DOI:10.1016/j.biotechadv.2007.05.004
|
Entcheva-Dimitrov P, Spormann A M. 2004. Dynamics and control of biofilms of the oligotrophic bacterium Caulobacter crescentus[J]. Journal of Bacteriology, 186(24): 8254–8266.
DOI:10.1128/JB.186.24.8254-8266.2004
|
Fan Y, Han S, Liu H. 2012. Improved performance of CEA microbial fuel cells with increased reactor size[J]. Energy & Environmental Science, 5(8): 8273–8280.
|
Franks A E, Nevin K P, Glaven R H, et al. 2010. Microtoming coupled to microarray analysis to evaluate the spatial metabolic status of Geobacter sulfurreducens biofilms[J]. The ISME Journal, 4(4): 509–519.
DOI:10.1038/ismej.2009.137
|
Franks A E, Nevin K P, Jia H, et al. 2009. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities:monitoring the inhibitory effects of proton accumulation within the anode biofilm[J]. Energy & Environmental Science, 2(1): 113–119.
|
He Z, Mansfeld F. 2009. Exploring the use of electrochemical impedance spectroscopy (EIS) in microbial fuel cell studies[J]. Energy & Environmental Science, 2(2): 215–219.
|
Hindatu Y, Annuar M, Subramaniam R, et al. 2017. Medium-chain-length poly-3-hydroxyalkanoates-carbon nanotubes composite anode enhances the performance of microbial fuel cell[J]. Bioprocess and Biosystems Engineering, 40(6): 1–10.
|
Janicek A, Fan Y, Liu H. 2015. Performance and stability of different cathode base materials for use in microbial fuel cells[J]. Journal of Power Sources, 280: 159–165.
DOI:10.1016/j.jpowsour.2015.01.098
|
Jung S, Regan J M. 2007. Comparison of anode bacterial communities and performance in microbial fuel cells with different electron donors[J]. Applied Microbiology and Biotechnology, 77(2): 393–402.
DOI:10.1007/s00253-007-1162-y
|
Katuri K P, Kavanagh P, Rengaraj S, et al. 2010. Geobacter sulfurreducens biofilms developed under different growth conditions on glassy carbon electrodes:insights using cyclic voltammetry[J]. Chemical Communications, 46(26): 4758–4760.
DOI:10.1039/c003342a
|
Ketep S F, Bergel A, Bertrand M, et al. 2013. Lowering the applied potential during successive scratching/re-inoculation improves the performance of microbial anodes for microbial fuel cells[J]. Bioresource Technology, 127: 448–455.
DOI:10.1016/j.biortech.2012.09.008
|
Kiely P D, Call D F, Yates M D, et al. 2010. Anodic biofilms in microbial fuel cells harbor low numbers of higher-power-producing bacteria than abundant genera[J]. Applied Microbiology and Biotechnology, 88(1): 371–380.
DOI:10.1007/s00253-010-2757-2
|
Kim B H, Park H S, Kim H J, et al. 2004. Enrichment of microbial community generating electricity using a fuel-cell-type electrochemical cell[J]. Applied Microbiology and Biotechnology, 63(6): 672–681.
DOI:10.1007/s00253-003-1412-6
|
Li W, Yu H, He Z. 2014. Towards sustainable wastewater treatment by using microbial fuel cells-centered technologies[J]. Energy & Environmental Science, 7(3): 911–924.
|
Liao Q, Zhang J, Li J, et al. 2015. Increased performance of a tubular microbial fuel cell with a rotating carbon-brush anode[J]. Biosensors and Bioelectronics, 63: 558–561.
DOI:10.1016/j.bios.2014.08.014
|
Liao Z H, Sun J Z, Sun D Z, et al. 2015. Enhancement of power production with tartaric acid doped polyaniline nanowire network modified anode in microbial fuel cells[J]. Bioresource Technology, 192: 831–834.
DOI:10.1016/j.biortech.2015.05.105
|
Liu Y, Harnisch F, Fricke K, et al. 2008. Improvement of the anodic bioelectrocatalytic activity of mixed culture biofilms by a simple consecutive electrochemical selection procedure[J]. Biosensors and Bioelectronics, 24(4): 1006–1011.
DOI:10.1016/j.bios.2008.08.001
|
Logan B E. 2008. Microbial Fuel Cells[M]. John Wiley & Sons.
|
Logan B E. 2010. Scaling up microbial fuel cells and other bioelectrochemical systems[J]. Applied Microbiology and Biotechnology, 85(6): 1665–1671.
DOI:10.1007/s00253-009-2378-9
|
Logan B E, Hamelers B, Rozendal R, et al. 2006a. Microbial fuel cells:methodology and technology[J]. Environmental Science & Technology, 40(17): 5181–5192.
|
Logan B E, Regan J M. 2006b. Electricity-producing bacterial communities in microbial fuel cells[J]. Trends in Microbiology, 14(12): 512–518.
DOI:10.1016/j.tim.2006.10.003
|
Logan B E, Regan J M. 2006c. Microbial fuel cells-challenges and applications[J]. Environmental Science & Technology, 40(17): 5172–5180.
|
Logan B E, Rabaey K. 2012. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies[J]. Science, 337(6095): 686–690.
DOI:10.1126/science.1217412
|
Malvankar N S, Tuominen M T, Lovley D R. 2012. Biofilm conductivity is a decisive variable for high-current-density Geobacter sulfurreducens microbial fuel cells[J]. Energy & Environmental Science, 5(2): 5790–5797.
|
Malvankar N S, Vargas M, Nevin K P, et al. 2011. Tunable metallic-like conductivity in microbial nanowire networks[J]. Nature Nanotechnology, 6(9): 573–579.
DOI:10.1038/nnano.2011.119
|
Marsili E, Sun J, Bond D R. 2010. Voltammetry and growth physiology of Geobacter sulfurreducens biofilms as a function of growth stage and imposed electrode potential[J]. Electroanalysis, 22(7/8): 865–874.
|
Nevin K P, Richter H, Covalla S F, et al. 2008. Power output and columbic efficiencies from biofilms of Geobacter sulfurreducens comparable to mixed community microbial fuel cells[J]. Environmental Microbiology, 10(10): 2505–2514.
DOI:10.1111/j.1462-2920.2008.01675.x
|
Parot S, Délia M, Bergel A. 2008. Forming electrochemically active biofilms from garden compost under chronoamperometry[J]. Bioresource Technology, 99(11): 4809–4816.
DOI:10.1016/j.biortech.2007.09.047
|
Patil S A, Harnisch F, Koch C, et al. 2011. Electroactive mixed culture derived biofilms in microbial bioelectrochemical systems:the role of pH on biofilm formation, performance and composition[J]. Bioresource Technology, 102(20): 9683–9690.
DOI:10.1016/j.biortech.2011.07.087
|
Qiao Y, Bao S, Li C M. 2010. Electrocatalysis in microbial fuel cells-from electrode material to direct electrochemistry[J]. Energy & Environmental Science, 3(5): 544–553.
|
Rabaey K, Lissens G, Siciliano S D, et al. 2003. A microbial fuel cell capable of converting glucose to electricity at high rate and efficiency[J]. Biotechnology Letters, 25(18): 1531–1535.
DOI:10.1023/A:1025484009367
|
Ramasamy R P, Ren Z, Mench M M, et al. 2008. Impact of initial biofilm growth on the anode impedance of microbial fuel cells[J]. Biotechnology and Bioengineering, 101(1): 101–108.
DOI:10.1002/bit.v101:1
|
Renslow R S, Babauta J T, Dohnalkova A C, et al. 2013. Metabolic spatial variability in electrode-respiring Geobacter sulfurreducens biofilms[J]. Energy & Environmental Science, 6(6): 1827–1836.
|
Richter H, McCarthy K, Nevin K P, et al. 2008. Electricity generation by Geobacter sulfurreducens attached to gold electrodes[J]. Langmuir, 24(8): 4376–4379.
DOI:10.1021/la703469y
|
Richter H, Nevin K P, Jia H, et al. 2009. Cyclic voltammetry of biofilms of wild type and mutant Geobacter sulfurreducens on fuel cell anodes indicates possible roles of OmcB, OmcZ, type IV pili, and protons in extracellular electron transfer[J]. Energy & Environmental Science, 2(5): 506–516.
|
Santoro C, Babanova S, Artyushkova K, et al. 2015. Influence of anode surface chemistry on microbial fuel cell operation[J]. Bioelectrochemistry, 106: 141–149.
DOI:10.1016/j.bioelechem.2015.05.002
|
Sun D, Cheng S, Wang A, et al. 2015. Temporal-spatial changes in viabilities and electrochemical properties of anode biofilms[J]. Environmental Science & Technology, 49(8): 5227–5235.
|
Tang J, Yuan Y, Liu T, et al. 2015. High-capacity carbon-coated titanium dioxide core–shell nanoparticles modified three dimensional anodes for improved energy output in microbial fuel cells[J]. Journal of Power Sources, 274: 170–176.
DOI:10.1016/j.jpowsour.2014.10.035
|
Vaszilcsin N, Nemes M. 2009. Introduction to Electrochemistry by Problems[M]. Timisoara: Politehnica Publishing House.
|
沈伟航, 朱能武, 尹富华, 等. 2016. 硝酸-PPy/AQDS联合处理改善阳极性能的分析表征[J]. 环境科学, 2016, 37(9): 3488–3497.
|
Wagner R C, Call D F, Logan B E. 2010. Optimal set anode potentials vary in bioelectrochemical systems[J]. Environmental Science & Technology, 44(16): 6036–6041.
|
Wei J, Liang P, Cao X, et al. 2010. A new insight into potential regulation on growth and power generation of Geobacter sulfurreducens in microbial fuel cells based on energy viewpoint[J]. Environmental Science & Technology, 44(8): 3187–3191.
|
Yuan Y, Jeon Y, Ahmed J, et al. 2009. Use of carbon nanoparticles for bacteria immobilization in microbial fuel cells for high power output[J]. Journal of the Electrochemical Society, 156(10): 1238–1241.
DOI:10.1149/1.3190477
|
Zhu N, Chen X, Zhang T, et al. 2011. Improved performance of membrane free single-chamber air-cathode microbial fuel cells with nitric acid and ethylenediamine surface modified activated carbon fiber felt anodes[J]. Bioresource Technology, 102(1): 422–426.
DOI:10.1016/j.biortech.2010.06.046
|
 2017, Vol. 37
2017, Vol. 37


