2. 中国科学院陆地表层格局与模拟重点实验室, 北京 100101;
3. 中国科学院大学, 北京 100049
2. Key Laboratory of Land Surface Pattern and Simulation, Chinese Academy of Sciences, Beijing 100101;
3. University of Chinese Academy of Sciences, Beijing 100049
多环芳烃(PAHs)在土壤/沉积物上的赋存、迁移转化规律及生物有效性是矿物组分和土壤有机质共同作用的结果(Meleshyn et al., 2011; Tremblay et al., 2005; Hwang et al., 2003).PAHs的疏水性特征使其更易于吸附在固体的有机组分中, 因此, 土壤有机质是PAHs在土壤中吸附的主要影响因素, 而矿物成分对PAHs的吸附主要依靠范德华力及各种化学键力产生的物理吸附, 这种吸附作用与有机质相比, 常常可以忽略.前人研究指出, 土壤中超过70%~80%的PAHs和PCBs与土壤中的腐殖质结合(Tremblay et al., 2005; Chiou et al., 1998; Bi et al., 2007; Kohl et al., 1998).腐殖质根据其在酸、碱中的溶解性, 可进一步分为富里酸、胡敏酸和胡敏素, 富里酸可溶于酸碱, 胡敏酸溶于碱不溶于酸, 胡敏素在酸碱溶液中均不溶.与胡敏酸分子结构相比, 富里酸分子量小, 含较多羧基和酚羟基, 其分子结构中含有的碳较少, 氧较多, O/C原子比较高(李维福等, 2008; Stevenson et al., 1994; Koivula et al., 2001).
吸附过程和解吸过程是决定土壤中有机污染物行为的关键过程, 因此, 理解有机污染物在腐殖质上的吸附解吸机制能够为有机污染土壤修复提供更为深入的视角.有机污染物在土壤不同有机质组分的分配过程是污染物在土壤上的吸附过程和封锁过程, 该过程称为双模型过程(Bogan et al., 2003; Weber et al., 1992).具体过程为: PAHs进入土壤后会先进入土壤大孔隙中, 吸附在各种有机或无机表面、非水相液体及土壤有机质的橡胶态非刚性结构(胡敏酸和富里酸)中(Bosma et al., 1997; Weber et al., 1992); 随着老化时间的延长, PAHs会继续向土壤小颗粒微孔内分布, 慢慢地扩散到土壤微生物、组织及其它生物体无法进入的微孔内或转移进入土壤有机质的玻璃态刚性结构(胡敏素)中, 即封锁; 封锁后, 随着时间的延长, 土壤中PAHs的生物有效性和可提取性逐渐降低.因此, 封锁的PAHs的毒性值同分配到溶解相和弱吸附的PAHs将会有很大差异.
化学氧化修复技术是有机污染场地最常用的修复技术之一, 具有反应强度大、修复效率高、反应迅速、对污染物性质和浓度不敏感等特点(Usman et al., 2014; Deng et al., 2015).化学氧化修复技术成功应用的前提在于合适的氧化剂选择, 目前常用的化学氧化制剂有过氧化氢、芬顿试剂、高锰酸钾、过硫酸钠等.关于不同氧化剂的适应条件, 已有一些相关研究(Liao et al., 2011; 王春艳, 2012).目前, 针对土壤中总PAHs的去除率研究较多, 但对土壤不同组分(胡敏素、富里酸、胡敏素)中PAHs的去除效果研究还未有相关报道(Brown et al., 2003; Jonsson et al., 2006; 燕启社等, 2008; 赵丹等, 2011).
本文通过研究不同老化时间下PAHs在不同腐殖酸组分(胡敏酸、富里酸、和胡敏素)中的赋存特征, 比较过硫酸钠、高锰酸钾、芬顿试剂和过氧化氢4种氧化剂对胡敏酸、富里酸、胡敏素中PAHs的氧化降解规律及去除效率, 并分析PAHs在氧化修复过程中的去向, 以期为化学氧化修复多环芳烃污染场地提供科学依据.
2 材料与方法(Materials and methods) 2.1 供试材料胡敏素:土壤经风干后, 研磨过60目的筛子, 参考国际腐殖质协会(IHSS)的酸碱提取法提取胡敏素, 然后将其冷藏于4 ℃冰箱内, 备用.
PAHs溶液的配置:取10 g焦油, 充分溶解在1 L的二氯甲烷中, 混匀, 取5 mL测定其中PAHs的浓度.16种PAHs的基本性质如表 1所示.
| 表 1 16种PAHs的名称缩写及环数 Table 1 Abbreviations and rings of polycyclic aromatic hydrocarbons |
试剂:硫酸亚铁、过氧化氢、高锰酸钾、过硫酸钠、二氯甲烷、正己烷均为分析纯, 胡敏酸(纯度为70%)、富里酸(纯度为95%).
仪器:气相色谱-质谱联用仪(7890-5975)、磁力搅拌器(HJ-6型)、高速离心机(Thermo D-37520型).
2.3 试验设计称量胡敏酸、富里酸、胡敏素各200 g置于三角瓶中, 分别加入200 mL PAHs污染溶液, 充分混匀后置于通风厨中, 待二氯甲烷完全挥发后密闭瓶口使其老化30 d.其中, 每隔2 d取一次样, 每次取样品2 g, 测定胡敏酸、富里酸、胡敏素中PAHs的含量.
氧化实验共设12个处理, 涉及4种氧化制剂, 分别是过氧化氢、芬顿试剂、高锰酸钾、过硫酸钠, 每个处理重复3次, 具体见表 2.
| 表 2 实验处理 Table 2 Experimental treatments |
取老化30 d后的胡敏酸、富里酸、胡敏素各20 g, 装入250 mL三角瓶中, 按试验处理中设定的量加入去离子水(使其与氧化剂的总体积达到100 mL), 将三角瓶放在磁力搅拌器上, 密封后使其充分搅拌均匀形成泥浆, 搅拌2 h左右, 使氧化剂与腐殖酸组分中的污染物充分接触, 进而反应完全.反应48 h后, 将泥浆转移到离心管中, 3000 r·min-1离心10 min, 保留上清液及离心后的沉淀, 分别测定上清液和沉淀中PAHs的浓度.
2.4 样品分析固相:分别取2 g冷冻干燥后胡敏酸、富里酸和胡敏素, 按照液固比5:1的比例加入10 mL二氯甲烷, 于50 mL离心管中超声提取1 h后, 离心, 取2 mL上清液过硅胶柱(正己烷+二氯甲烷), 用100 mL茄形瓶盛装, 然后在旋转蒸发仪上蒸至约0.5 mL, 用正己烷定容至1 mL(气相小瓶)待测.
液相(上清液):采用液液萃取法进行提取, 即取5 mL上清液, 置于玻璃离心管中, 加入5 mL正己烷, 在300 r·min-1条件下振荡2 h, 然后取有机相1 mL进气相色谱进行测定.
PAHs采用气相色谱AGILENT6890N进行测定(Liao et al., 2011).分析条件: HP-5MS 30 m×0.25 mm毛细色谱柱, 载气为氦气, 柱前压0.03 MPa, 线速度37 cm·s-1, 进样口温度300 ℃, 初始温度60 ℃, 以5 ℃·min-1速度升至300 ℃, 保留20 min至样品完全流出.
2.5 数据分析应用Origin8.6软件和Excel 2003软件分别进行制图和数据处理.氧化制剂对腐殖酸组分中多环芳烃的去除效率通过公式(1)计算而得.
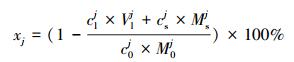
|
(1) |
式中, xj为某污染物的去除效率; clj为氧化后上清液中某污染物的浓度(mg·L-1); Vlj为氧化后上清液的体积(L); csj为氧化后腐殖酸组分中某污染物的含量(mg·kg-1); Msj为氧化后土壤的质量(kg); cj0为氧化前腐殖酸组分中某污染物的含量(mg·kg-1); Mj0为氧化前腐殖酸组分的质量(kg).
3 结果与分析(Results and analysis) 3.1 多环芳烃在胡敏酸、富里酸、胡敏素中的老化规律总PAHs在胡敏酸、富里酸、胡敏素中的老化过程如图 1所示.由图可知, 一定时间内, 不同组分腐殖质中PAHs的含量随着老化时间的增加而增大.其中, 胡敏酸和富里酸中PAHs含量在前10 d内急速增加, 10~20 d内增速减缓, 随后趋于平衡; 而胡敏素中PAHs含量在老化前20 d内持续增加, 随后趋于稳定.虽然老化前期胡敏素中PAHs的吸附速率较慢导致其吸附量较少, 但其在老化后期出现了吸附量的反超, 因此, 胡敏素、胡敏酸和富里酸中PAHs的最终吸附量并没有明显差异.
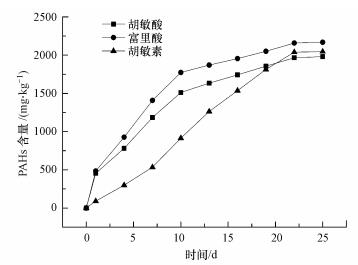 |
| 图 1 不同腐殖酸组分中总PAHs含量随老化时间的动态变化 Fig. 1 Dynamic change of total PAHs concentration in the humic acid components at different aging time |
胡敏酸、富里酸和胡敏素中16种PAHs的老化规律如图 2所示.以BaP(高环PAH)和Phe(低环PAH)为例进行分析.对于胡敏酸和富里酸, Phe含量的增长趋势和BaP基本一致.而胡敏素在老化前7 d, BaP的含量增长缓慢, 基本保持不变, 老化7 d后增长幅度略微上升.总的来说, 高环多环芳烃在胡敏素、胡敏酸和富里酸中的吸附速率和最终吸附量远低于低、中环多环芳烃, 且其在胡敏素上存在吸附滞后现象.
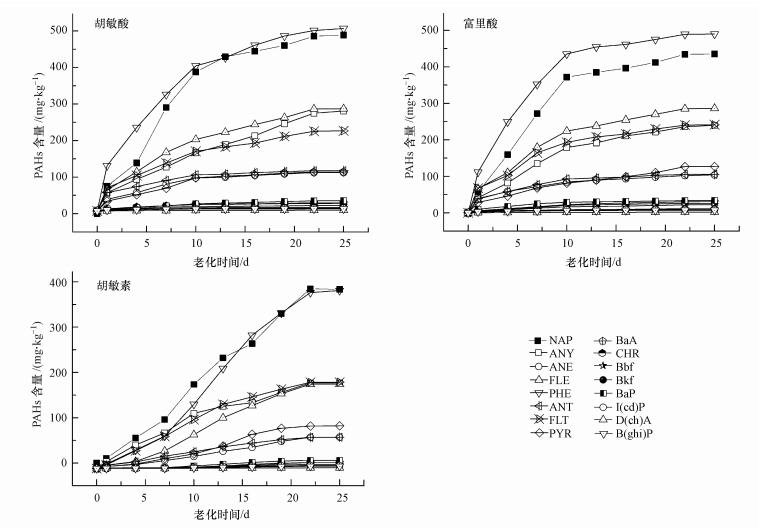 |
| 图 2 不同腐殖酸组分中16种PAHs含量随老化时间的动态变化 Fig. 2 Dynamic change of 16 kinds of PAHs concentration in the humic acid components at different aging time |
不同氧化处理下胡敏酸、富里酸、胡敏素中16种PAHs的分布情况如图 3~5所示, 其中, 残留量指经氧化处理后腐殖酸组分和上清液中PAHs的含量.
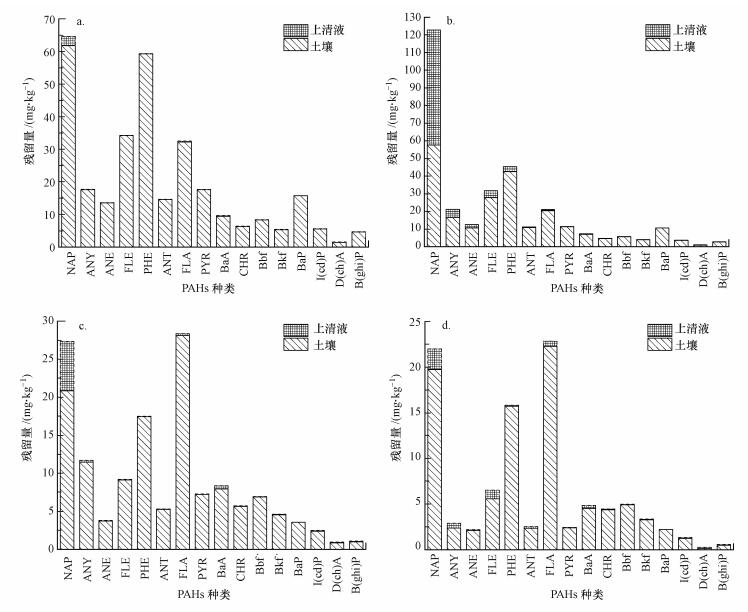 |
| 图 3 不同氧化剂处理后胡敏酸中16种PAHs的分布(a.过氧化氢, b.芬顿试剂, c.高锰酸钾, d.过硫酸钠) Fig. 3 Distribution of 16 kinds of PAHs in the humic acid by various oxidation treatments |
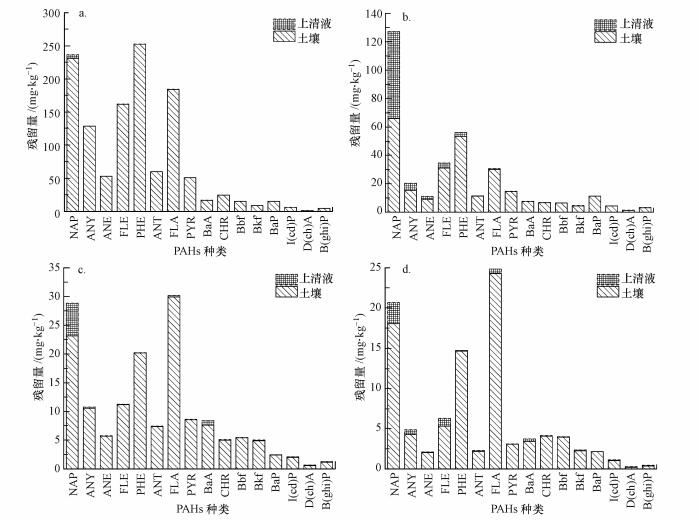 |
| 图 4 不同氧化剂处理后富里酸中16种PAHs的分布(a.过氧化氢, b.芬顿试剂, c.高锰酸钾, d.过硫酸钠) Fig. 4 Distribution of 16 kinds of PAHs in the fulvic acid by various oxidation treatments |
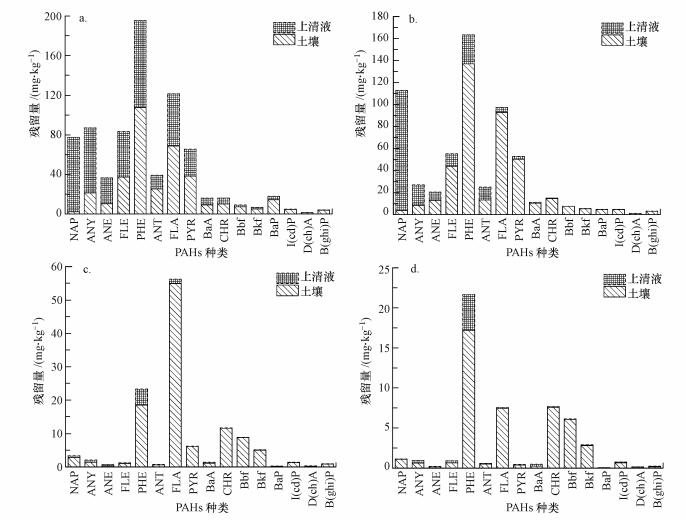 |
| 图 5 不同氧化剂处理后胡敏素中16种PAHs的分布(a.过氧化氢, b.芬顿试剂, c.高锰酸钾, d.过硫酸钠) Fig. 5 Distribution of 16 kinds of PAHs in the humin by various oxidation treatments |
由图 3可知, 经氧化处理后胡敏酸中PAHs含量都显著下降, 4中氧化剂氧化处理后胡敏酸中PAHs的残留量由低至高依次为:过硫酸钠 < 高锰酸钾 < 芬顿试剂 < 过氧化氢, 残留量分别为93.83、135.96、236.81和307.59 mg·kg-1.经计算, 氧化后仅有少量PAHs转移至上清液中, 但相比于其他3种氧化剂, 芬顿试剂氧化后上清液中PAHs残留量较高, 可达80.39 mg·kg-1.
图 4所示为不同氧化剂处理后富里酸中16种PAHs的分布, 其规律与胡敏酸中PAHs分布情况基本一致.其中, 过硫酸钠氧化后富里酸中PAHs残留量最低(91.13 mg·kg-1), 高锰酸钾次之(145.57 mg·kg-1), 芬顿试剂的降解效果较好, PAHs残留量为275.92 mg·kg-1, 而过氧化氢的氧化降解PAHs效果最差, 处理后PAHs的残留量达1215.50 mg·kg-1, 超过了初始值的1/2.过硫酸钠、高锰酸钾和过氧化氢氧化降解后转移至上清液中PAHs较少, 而芬顿试剂氧化后上清液中PAHs残留量最高(76.59 mg·kg-1).
对于胡敏素中的PAHs, 过硫酸钠和高锰酸钾都能达到较好的去除效果, 残留在胡敏素中的PAHs分别为45.75 mg·kg-1和114.73 mg·kg-1; 而芬顿试剂和过氧化氢氧化效果明显较差, 处理后PAHs残留量分别为412.51 mg·kg-1和367.57 mg·kg-1, 且上清液中PAHs含量较高, 分别达到194.38 mg·kg-1和414.91 mg·kg-1(图 5).
3.3 不同氧化剂对胡敏酸、富里酸和胡敏素中多环芳烃的去除效率不同氧化剂对胡敏酸中16种PAHs的氧化降解规律如图 6a所示.由图可知, 过硫酸钠、高锰酸钾对PAHs的去除率最高也最稳定, 芬顿试剂和过氧化氢对PAHs的去除规律基本呈现随着PAHs分子量的增加去除率逐渐降低的趋势.4种氧化剂对胡敏酸中低环PAHs和中环PAHs(除BaA和CHR外)均具有较好去除效果, 其中, 过硫酸钠和高锰酸钾效果最佳, PAHs平均去除效率均超过95%, 芬顿试剂和过氧化氢的去除率在81%~93%之间.4种氧化剂对高环PAHs的去除效果差异显著, 去除效率从大到小依次为过硫酸钠>高锰酸钾>芬顿试剂>过氧化氢.其中, 过硫酸钠对高环PAHs(除Bbf和Bkf)去除效率在81%~91%之间, 而高锰酸钾对不同种类高环PAHs的去除效率波动较大(46%~85%), 芬顿试剂对高环PAHs的去除效率仅为50%左右, 过氧化氢效果最差.
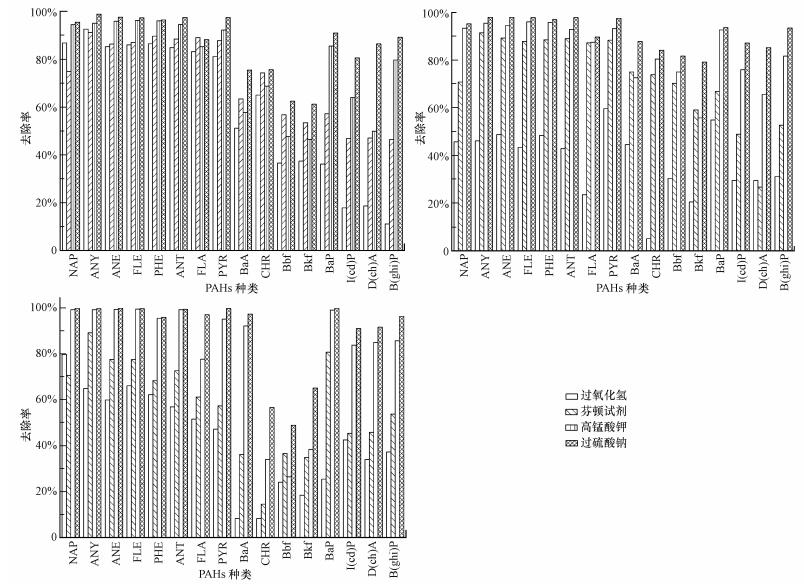 |
| 图 6 不同氧化剂对胡敏酸(a)、富里酸(b)和胡敏素(c)中16种PAHs的去除效率 Fig. 6 Removal efficiencies of 16 kinds of PAHs in the humic acid (a), fulvic acid (b) and humin (c) by various oxidation treatments |
不同氧化剂对富里酸中16种PAHs的氧化降解规律如图 6b所示.其中, 过硫酸钠氧化效率最高, 高锰酸钾次之, 且对16种PAHs的去除效果较稳定, 平均去除效率分别为91%和81%.对于过氧化氢而言, 低环PAHs的去除率比较稳定, 均为45%左右, 而中环PAHs的去除率变化较大, PYR的去除率最高, 为59.68%, CHR的最低, 仅为5.07%.不同氧化剂对低环PAHs(NAP)去除效率差异显著, 由高至低依次为过硫酸钠>高锰酸钾>芬顿试剂>过氧化氢, 去除效率分别为95%、93%、71%和46%.相比于其他种类中环PAHs, FLA、BaA和CHR的氧化降解效果较差.
在胡敏素中, 过硫酸钠和高锰酸钾对大部分PAHs的去除效率在95%以上, 只有CHR、Bbf、Bkf这3种PAHs的去除率比较低.对于芬顿试剂和过氧化氢, 低环PAHs的去除率高于中、高环PAHs, 而中环PAHs中的BaP相比同环数的其他PAHs易被去除.
综上所述, 比较不同氧化剂的氧化能力可知, 过硫酸钠和高锰酸钾对不同组分腐殖酸中PAHs的去除效果最好, 去除率分别在95.27%~97.77%和93.14%~94.39%之间; 芬顿试剂对3种腐殖酸组分中总PAHs的氧化效果次之, 去除率在79.36%~88.05%之间浮动; 而过氧化氢虽能较好地去除胡敏酸和胡敏素中的PAHs, 但仅能去除富里酸中43.96%的PAHs.分析不同种类PAHs的降解效率可知, 低环PAHs比中、高环PAHs更易被去除, 且大多数情况下, 中环中的PLA和PYR、高环中的BaP相比同环数的其他PAHs降解效率更高; 而对于CHR、Bbf、Bkf这几种PAHs, 4种氧化剂的去除效果均较差.
4 讨论(Discussion)老化前期, PAHs在胡敏酸和富里酸中吸附速率明显快于胡敏素, 在一定程度上限制了PAHs向胡敏素中迁移, 使其呈现出吸附滞后现象.这是因为胡敏酸和富里酸是溶解性有机质(Dissolved Organic Matter, DOM)的重要组成部分, 其性质活跃, 对有机污染物有明显的增溶作用, 能改变疏水性有机污染物在土壤-水环境中的分配, 影响有机污染物在土壤中的吸附和解吸行为, 进而改变自身的化学活性和生物可利用性(Johson et al., 1995; 罗雪梅等, 2005).而PAHs的水溶性低且有机碳-水分配系数(Koc)高, 在老化过程中, PAHs更易进入胡敏酸和富里酸中, 其内部的疏水部分会强烈吸附土壤中的PAHs, 进而影响其迁移与转化行为(Hong et al., 2003).有机污染物在胡敏素上的吸附存在滞后现象, 而在胡敏酸和富里酸中的吸附没有观察到滞后现象.分析不同腐殖酸的组分差异性可知, 胡敏素是刚性、多小空隙的结构, 所以分子量小的PAHs更易进入胡敏素中, 且一旦进入玻璃质的胡敏素中, PAHs的扩散受到限制, 其吸附在胡敏素上是不可逆吸附(Chiou et al., 2000).而含有刚性三维结构、极性比腐殖质弱的黑炭是胡敏素的主要组成成分, 而其在胡敏酸和富里酸中的含量很少, 由此推断黑炭物质是造成污染物吸附滞后现象的主要原因.Chiou等(2000)通过开展非极性有机污染物与极性有机污染物在胡敏酸(不含或含很少量的黑炭)和胡敏素(含有丰富的黑炭)上的吸附研究发现, 污染物在黑炭上的表面吸附是非极性有机污染物吸附的主要原因, 而黑炭与土壤有机质中的某些基团的相互作用是导致极性有机污染物产生非线性吸附的关键因素.此外, 双相反应模型认为土壤中有机碳包括多孔性、柔性及聚合度低的软碳(橡胶质)和刚性、聚合度高的硬碳(玻璃质), 其中, 腐殖酸富含软碳, 而胡敏素则多硬碳.由于胡敏素是刚性、多小空隙的结构, 故PAHs会优先与胡敏酸和富里酸结合, 且分子量较大的PAHs更易吸附在胡敏酸和富里酸表面, 其在胡敏素上更容易发生吸附滞后现象(Hu et al., 2000; Yuan et al., 2001).
化学氧化修复不能完全氧化降解土壤中PAHs等疏水性有机污染物, 污染物可能会随着氧化剂溶液的加入由土壤固相转移至液相中.本文研究了不同氧化处理后胡敏酸、富里酸、胡敏素中多环芳烃的分布, 其中, 芬顿试剂和过氧化氢氧化处理后扩散到水相中的PAHs比例较高, 而过硫酸钠和高锰酸钾氧化过程中仅有少量PAHs转移至液相中, 该现象在胡敏素中PAHs的氧化过程最为突出.研究表明, 芬顿试剂氧化污染物的过程会导致土壤中有机质的含量和结构组成改变, 污染物在土壤中的分配系数随之变化, 进而改变污染物在不同有机质组分中的分配(燕启社等, 2008).此外, Fe2+的添加也会在一定程度上促进PAHs从土壤中解吸出来, 使其向水相中迁移(Saison et al., 2004).而高锰酸钾和过硫酸钠氧化过程中对PAHs的吸附解吸影响较小(Chen et al., 2009; 赵丹, 2013).综上, 从环境安全的角度考虑, 过硫酸钠和高锰酸钾是修复PAHs类有机污染土壤的最适氧化剂, 能够降低修复过程对周围环境及地下水产生的二次风险.
不同腐殖酸组分中16种PAHs的氧化降解效率与氧化剂的性质(氧化还原电位、氧化特性等)和污染物的性质(水溶性、辛醇-水分配系数、电子亲和力、苯环数量等)密切相关.本研究中, 芬顿试剂和过氧化氢可以将胡敏酸中的低环PAHs和部分中环PAHs基本去除, 但对高环PAHs, 环数越高去除效果越差, 这是因为PAHs分子量和辛醇-水分配系数同PAHs去除效果成反比, 2~3环PAHs具有较高的水溶性, 其辛醇-水分配系数低、反应活性强, 更易于被氧化降解, 这与本研究结果相一致(Bogan et al., 2003; Jonsson et al., 2007).而随着苯环数量增加, PAHs的分子量增加、毒性增强而活性变差, 其性质稳定, 需要更长的时间扩散吸附至腐殖酸, 因此, 被氧化时间也相应较长, 导致氧化效率逐渐降低(Rivas, 2006; Huang et al., 2007; Freearese et al., 2008).过硫酸钠和高锰酸钾能够将胡敏酸、富里酸、胡敏素3种组分中的大部分PAHs去除掉, 但对于CHR、Bbf、Bkf等PAHs的去除效果较差, 尤其在胡敏酸和胡敏素中体现的更为明显, 这是因为虽然苯并荧蒽(Bbf、Bkf)和苯并芘(BaP)的分子量和辛醇-水分配系数基本相同, 但苯并荧蒽有一个5-C环, 而苯并芘只有芳香环.过硫酸钠和高锰酸钾对胡敏素中PAHs的去除效果较好, 而芬顿试剂和过氧化氢对胡敏素中PAHs的去除效果相对较差, 由于土壤中胡敏素占一大部分, 因此, 要想更彻底地除去PAHs, 选择过硫酸钠和高锰酸钾可能更好.
5 结论(Conclusions)1) 胡敏素中的PAHs存在吸附滞后现象, 但在老化后期发生吸附量的反超, 导致PAHs在胡敏酸、富里酸和胡敏素的最终吸附量无显著差异.
2) 对于不同性质PAHs, 高环PAHs在不同组分腐殖酸中的吸附速率和吸附量比低环、中环PAHs低得多; 但在氧化过程中, 低环和中环PAHs更易被去除, 4种氧化剂对CHR、Bbf、Bkf 3种PAHs的去除效果均较差.
3) 过硫酸钠是最佳的氧化剂, 能够有效氧化降解胡敏酸、富里酸和胡敏素中的PAHs, 且氧化过程中极少有PAHs转移至液相中; 高锰酸钾的去除效果次之; 芬顿试剂和过氧化氢对PAHs的去除效率较低.
Bavel B. 2006. Comparison of Fenton's reagent and ozone oxidation of polycyclic aromatic hydrocarbons in aged contaminated soils[J]. Journal of Soils and Sediments, 6(4): 208–214.
DOI:10.1065/jss2006.08.179
|
Bi E, Schmidt T C, Haderlein S B. 2007. Environmental factors influencing sorption of heterocyclic aromatic compounds to soil[J]. Environmental Science & Technology, 41(9): 3172–3178.
|
Bogan B W, Trbovic V. 2003. Effect of sequestration on PAH degradability with Fenton's reagent:roles of total organic carbon, humin, and soil porosity[J]. Journal of Hazardous Materials, 100(1): 285–300.
|
Bogan B W, Trbovic V, Paterek J R. 2003. Inclusion of vegetable oils in Fenton's chemistry for remediation of PAH-contaminated soils[J]. Chemosphere, 50(1): 15–21.
DOI:10.1016/S0045-6535(02)00490-3
|
Bosma T N P, Middeldorp P J M, Schraa G, et al. 1996. Mass transfer limitation of biotransformation:quantifying bioavailability[J]. Environmental Science & Technology, 31(1): 248–252.
|
Brown G S, Barton L L, Thomson B M. 2003. Permanganate oxidation of sorbed polycyclic aromatic hydrocarbons[J]. Waste Management, 23(8): 737–740.
DOI:10.1016/S0956-053X(02)00119-8
|
Chen W, Hou L, Luo X, et al. 2009. Effects of chemical oxidation on sorption and desorption of PAHs in typical Chinese soils[J]. Environmental Pollution, 157(6): 1894–1903.
DOI:10.1016/j.envpol.2009.01.027
|
Chiou C T, Kile D E, Rutherford D W. 2000. Sorption of selected organic compounds from water to a Peat soil and its humic-acid and humin fraction:Potential sources of the sorption nonlinearity[J]. Environmental Science & Technology, 34(7): 1254–1258.
|
Chiou C T, McGroddy S E, Kile D E. 1998. Partition characteristics of polycyclic aromatic hydrocarbons on soils and sediments[J]. Environmental Science & Technology, 32(2): 264–269.
|
Ferrarese E, Andreottola G, Oprea I A. 2008. Remediation of PAH-contaminated sediments by chemical oxidation[J]. Journal of Hazardous Materials, 152(1): 128–139.
DOI:10.1016/j.jhazmat.2007.06.080
|
Hong L, Ghosh U, Mahajan T, et al. 2003. PAH sorption mechanism and partitioning behavior in lampblack-impacted soils from former oil-gas plant sites[J]. Environmental Science & Technology, 37(16): 3625–3634.
|
Huang S J, Jiang S J. 2007. Degradation of polycyclic aromatic hydrocarbons (PAHs) in contaminated soils by Fenton's reagent:a multivariate evaluation of the importance of soil characteristics and PAH properties[J]. Journal of Hazardous Materials, 149(1): 86–96.
DOI:10.1016/j.jhazmat.2007.03.057
|
Hwang S, Cutright T J. 2003. Statistical implications of pyrene and phenanthrene sorptive phenomena:effects of sorbent and solute properties[J]. Archives of Environmental Contamination and Toxicology, 44(2): 152–159.
DOI:10.1007/s00244-002-2007-4
|
Hu W G, Mao J, Xing B, et al. 2000. Poly (methylene) crystallites in humic substances detected by nuclear magnetic resonance[J]. Environmental Science & Technology, 34(3): 530–534.
|
Johson W P, Amy G L. 1995. Facilitated transport and enhanced desorption of PAHs by natural organic in aquifer sediments[J]. Environmental Science & Technology, 29(5): 807–817.
|
Jonsson S, Persson Y, Frankki S, et al. 2007. Degradation of polycyclic aromatic hydrocarbons (PAHs) in contaminated soils by Fenton's reagent:a multivariate evaluation of the importance of soil characteristics and PAH properties[J]. Journal of Hazardous Materials, 149(1): 86–96.
DOI:10.1016/j.jhazmat.2007.03.057
|
Kohl S D, Rice J A. 1998. The binding of contaminants to humin:a mass balance[J]. Chemosphere, 36(2): 251–261.
DOI:10.1016/S0045-6535(97)10005-4
|
Liao X Y, Zhao D, Yan X L. 2011. Determination of potassium permanganate demand variation with depth for oxidation-remediation of soils from a PAHs-contaminated coking plant[J]. Journal of Hazardous Materials, 193: 164–170.
DOI:10.1016/j.jhazmat.2011.07.045
|
罗雪梅, 杨志峰, 何孟常, 等. 2005. 土壤/沉积物中天然有机质对疏水性有机污染物的吸附作用[J]. 土壤, 2005, 37(1): 25–31.
|
Meleshyn A, Tunega D. 2011. Adsorption of phenanthrene on Na-montmorillonite:A model study[J]. Geoderma, 169: 41–46.
DOI:10.1016/j.geoderma.2010.09.018
|
Mader B T, Uwe-Goss K, Eisenreich S J. 1997. Sorption of nonionic, hydrophobic organic chemicals to mineral surfaces[J]. Environmental Science & Technology, 31(4): 1079–1086.
|
Koivula N, Hänninen K. 2001. Concentrations of monosaccharides in humic substances in the early stages of humification[J]. Chemosphere, 44(2): 271–279.
DOI:10.1016/S0045-6535(00)00167-3
|
Rivas F J. 2006. Polycyclic aromatic hydrocarbons sorbed on soils:a short review of chemical oxidation based treatments[J]. Journal of Hazardous Materials, 138(2): 234–251.
DOI:10.1016/j.jhazmat.2006.07.048
|
Saison C, Perrin-Ganier C, Amellal S, et al. 2004. Effect of metals on the adsorption and extractability of 14 C-phenanthrene in soils[J]. Chemosphere, 55(3): 477–485.
DOI:10.1016/j.chemosphere.2003.10.059
|
Schlautman M A, Morgan J J. 1993. Effects of aqueous chemistry on the binding of polycyclic aromatic hydrocarbons by dissolved humic materials[J]. Environmental Science & Technology, 27(5): 961–969.
|
Stevenson F J. 1994. Humus Chemistry:Genesis, Composition, Reactions[M]. New York: John Wiley & Sons.
|
Tremblay L, Kohl S D, Rice J A, et al. 2005. Effects of temperature, salinity, and dissolved humic substances on the sorption of polycyclic aromatic hydrocarbons to estuarine particles[J]. Marine Chemistry, 96(1): 21–34.
|
王春艳. 2012. PAHs污染土壤的化学氧化修复技术研究[D]. 北京: 北京化工大学
|
Yuan G, Xing B. 2001. Effects of metal cations on sorption and desorption of organic compounds in humic acids[J]. Soil Science, 166(2): 107–115.
DOI:10.1097/00010694-200102000-00004
|
燕启社, 孙红文, 周长波, 等. 2008. 类Fenton氧化在污染土壤修复中的应用[J]. 生态环境, 2008, 17(1): 216–220.
|
赵丹. 2013. 过硫酸盐氧化修复多环芳烃污染场地的关键机理及其生态环境风险[D]. 北京: 中国科学院大学
http://d.wanfangdata.com.cn/Thesis/Y2333654 |
赵丹, 廖晓勇, 阎秀兰, 等. 2011. 不同化学氧化剂对焦化污染场地多环芳烃的修复效果[J]. 环境科学, 2011, 32(3): 857–863.
|
郑立臣, 李维福, 解宏图. 2008. 土壤有机质分组方法研究进展[J]. 农业系统科学与综合研究, 2008, 24(3): 38–343.
|
 2017, Vol. 37
2017, Vol. 37


