2. 南昌工程学院 江西省退化生态系统修复与流域生态水文重点实验室, 南昌 330099
2. Jiangxi Key Laboratory for Restoration of Degraded Ecosystems & Watershed Ecohydrology, Nanchang Institute of Technology, Nanchang 330099
TIAN Shengni, E-mail:tian7173@163.com
土壤线虫是土壤中丰富的后生动物, 广泛分布于各种生境的土壤中, 数量可达7.6×105~2.9×107 m-2 (宋敏等, 2015; Zhou et al., 2012).土壤食细菌线虫除了自身的代谢活动外(如形成pH较高的微域环境、分泌排泄有机物), 还可通过取食细菌, 直接或间接的影响微生物的数量、活性和群落结构, 从而参与土壤的多种生态过程(梁文举等, 2001; 吴纪华等, 2007; Fu et al., 2005; Gebremikael et al., 2014; Xiao et al., 2014).Xiao等(2010)通过DGGE分析土壤微生物群落结构, 发现食细菌线虫能改变氨化细菌群落组成, 显著提高土壤矿化和硝化作用; 井永苹等(2010)发现, 接种食细菌线虫显著提高了土壤中过氧化氢酶、FDA水解酶及细菌的活性, 理论上有助于促进土壤中菲的降解; Zhou等(2011; 2012; 2013)发现食细菌线虫(Cephalobus Bastian)通过取食细菌提高土壤微生物的活性, 从而加速了土壤中的外源污染物扑草净的降解.研究也表明土壤线虫广泛存在于石油污染土壤中, 其中食细菌线虫是优势类群(肖能文等, 2011a; 2011b; Wang et al., 2009).肖能文等(2011a; 2011b)发现各油井土壤(除油井Ⅳ外)均以食细菌线虫数量最多, 且各油井土壤的线虫通路比值(NCR, 表示土壤有机质的分解途径)均大于0.8, 说明油井土壤有机质分解途径主要为细菌分解, 细菌是污染土壤中分解石油的主要功能类群.刘五星等(2007)研究表明石油污染使土壤有机质含量增加, 刺激了土壤中微生物的生长, 使土壤中微生物增加, 故使食细菌线虫增多.
鉴于食细菌线虫的生态功能及其与细菌强烈的相互作用, 并且在石油污染土壤中有机质分解途径主要为细菌分解, 因而有理由推测食细菌线虫在石油污染土壤修复过程中有着重要作用, 食细菌线虫可以通过调控土著微生物的活性、数量及群落结构而影响石油的降解.但有关石油污染土壤中食细菌线虫的功能及其与微生物之间的相互作用对土壤石油降解的影响还不明确, 本试验通过在石油污染土壤中接种不同密度的食细菌线虫, 研究在有无食细菌线虫作用下石油的降解及微生物数量和活性的变化; 在此基础上分析污染土壤石油降解与食细菌线虫及微生物数量和活性变化之间的相关关系, 为发掘和利用有益于石油污染修复的土壤生物提供初步的科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料供试土壤:土壤采自于安徽省和县, 挑出土壤中大颗粒物质, 剔除石子、砂砾、植物残体, 过2 mm筛备用.该土壤成土母质为长江冲积物, 其基本理化性质如下: pH 5.48, 有机质含量18.08 g·kg-1, 全氮0.58 g·kg-1, 全磷4.22 g·kg-1, 速效磷11.24 g·kg-1; 颗粒组成如下:粗砂(1~0.25 mm)含量84.57%, 细砂(0.25~0.05 mm)含量0.44%, 粉砂(0.05~0.02 mm)含量4.48%, 粉粒(0.02~0.002 mm)含量9.14%, 黏粒( < 0.002 mm)含量1.37%.
杀灭线虫土壤:将上述过筛土壤采用反复冻融法去除土壤里的土著线虫.具体操作如下:将土壤放入-26 ℃冰箱冷冻3 d, 再转入22 ℃生化培养箱中培养一个星期, 反复冻融5~7次.用浅盘法分离土壤中的线虫, 直到无线虫为止.
供试石油:石油来源于中国石化金南油田.其地面相对密度为871.4 kg·m3 (25 ℃), 地面黏度为18.7 mPa·s (60 ℃), 凝固点为26.8 ℃, 蜡质含量24.7%, 胶质、沥青质总含量8.4%.
5.0 g·kg-1石油污染土壤的制备:根据《土壤环境质量标准-GB15618—2008》, 选择土壤有机污染物的环境质量的第二级标准值之工业用地标准石油烃总量5000 mg·kg-1作为本实验的石油污染土壤浓度值.根据试验设计称取适量石油, 将其用丙酮完全溶解, 缓缓加入上述部分杀灭线虫土壤中, 充分混匀, 放置于通风橱里, 不停搅拌, 待丙酮完全挥发后, 再向已污染土壤中逐渐添加适量杀灭线虫土壤并充分混匀, 使最终污染土壤石油浓度为5.0 g·kg-1干土.
供试线虫:本试验利用实验室保存的模式食细菌线虫(Caenorhabditis elegans)为研究对象.先分离模式线虫并进行表面灭菌, 消毒液为0.002%放线菌酮和0.1%硫酸链霉素的抗菌素混合(周际海, 2011), 避免线虫自带的微生物进入污染土壤而对实验造成影响.
2.2 试验设计本实验共设6个处理:高温蒸汽灭菌石油污染土壤(FSP), 杀灭线虫土壤(S), 分别作为对照处理1和2;石油污染土壤(SP)、石油污染土壤+ 5条线虫/g干土(SPN5)、石油污染土壤+ 10条线虫/ g干土(SPN10)、石油污染土壤+ 20条线虫/ g干土(SPN20).
根据实验设计, 将杀灭线虫土壤、石油污染土壤分装于250 mL三角瓶中, 共计168个三角瓶, 每瓶装土量相当于120 g干土重, 含水量调至饱和含水量的50%.全程无菌操作, 按照上述实验设计添加各处理的模式线虫数量, 用无菌封口膜封住瓶口, 22 ℃下恒温培养(此温度是线虫活性最适宜温度).分别于第0、7、14、28、56、112、168 d进行破坏性采样, 每个处理随机取4个三角瓶作为4个重复.分析测定土壤线虫数量、土壤石油残留浓度、土壤微生物量碳、FDA水解酶活性和脱氢酶活性.
2.3 测定方法土壤线虫分离采用浅盘法(周际海, 2011); 土壤微生物量碳的测定采用CHCl3熏蒸-K2SO4浸提法, 用TOC仪分析测定(Vance et al., 1987); 土壤FDA水解酶活性测定采用优化的FDA (荧光素双乙酸脂)水解方法测定, 以每小时每克土荧光素的生成量表示, 单位为(mg·g-1·h-1); 脱氢酶采用TTC还原法, 以24 h后每克干土中TTC的还原产物三苯甲臜(TPF)的生成量来表示, 单位为(μg·g-1·d-1) (关松荫, 1987); 土壤石油残留浓度采用超声萃取-酶标仪微量法测定, 具体提取测定方法如下:准确称取2.00 g风干土样放入50 mL特氟仑离心管中, 加入石油醚8 mL, 振荡混合均匀, 进行超声萃取(功率100 W), 超声时间为20 min, 超声萃取后, 4000 r·min-1离心, 然后将上清液倒入比色管中; 重复上述步骤, 提取残余在污染土壤中的石油, 并将提取液与第一次提取液合并, 最后用无水乙醇定容至50 mL.吸取200 μL提取液加入微孔板中, 用酶标仪在304 nm波长下测量吸光值.利用标准曲线进行计算分析, 得出石油残留浓度(Zhou et al., 2017).
2.4 数据分析数据采用SPSS 22.0软件分析, 采用EXCEL 2003软件绘图.采用单因素方差(ANOVA)分析土壤线虫数量、石油残留量、微生物生物量碳、酶活性等的差异.在SPSS中采用双变量Pearson分析比较土壤线虫数量、石油残留量、微生物量碳和酶活性之间的相关性.
3 结果与分析(Results and analysis) 3.1 不同密度的食细菌线虫在石油污染土壤中的定殖情况在整个培养期内, 未接种线虫处理未分离出线虫, 接种线虫处理线虫数量(以干土计)变化见图 1.从图 1可以看出各处理线虫数量在整个培养期内呈先减少后增加再减少的趋势, 在0~14 d内各接种线虫处理线虫数量变化趋势基本一致, 即SPN20>SPN10>SPN5;第28 d时, 线虫数量表现为处理SPN10>SPN20>SPN5, 各处理间存在显著差异(p < 0.05);第112 d和第168 d时, 各处理线虫数量变化趋势基本一致, 即SPN5>SPN10>SPN20, 且处理间存在显著性差异(p < 0.05), 其中在第112 d时处理SPN5的线虫数量达到初始接种量的4.1~6.1倍, 其它处理线虫数量也有一定增加.
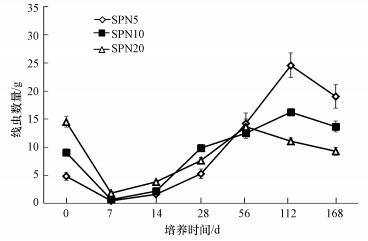 |
| 图 1 培养期内石油污染土壤中模式线虫数量变化 Fig. 1 Dynamic of Caenorhabditis elegans in petroleum contaminated soil |
在整个培养期内, 污染土壤的石油残留浓度表现为逐渐降低的趋势, 且不同处理降低的程度不同(图 2).第0 d和7 d时, 各处理间无显著差异; 第14 d时, 处理SP与处理FSP无显著差异, 但处理SPN5、SPN10、SPN20与处理FSP开始出现显著差异(p < 0.05);第28 d时, 处理SP、SPN10与处理FSP无显著差异(p < 0.05), 而处理SPN5、SPN20与处理FSP有显著差异(p < 0.05);第56 d和112 d时, 各处理与处理FSP均有显著差异(p < 0.05), 且处理SPN5比其它处理石油残留浓度低; 在整个试验培养结束时, 石油残留浓度为处理FSP>SP>SPN10>SPN20>SPN5, 处理SP、SPN5、SPN10和SPN20的土壤石油残留含量比处理FSP降低约43.60%、70.68%、52.34%和50.45%, 处理SPN5、SPN10和SPN20土壤石油残留含量比处理SP降低约48.00%、15.48%和12.15%.
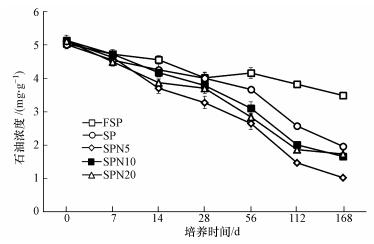 |
| 图 2 不同密度模式线虫对石油污染土壤修复效果的影响 Fig. 2 Effect of different densities of Caenorhabditis elegans on petroleum degradation in contaminated soil |
不同处理的土壤微生物量碳随培养时间的增加呈先上升后下降的趋势(图 3).第0 d时, 处理SP、SPN5、SPN10和SPN20的土壤微生物量碳无显著差异, 但均略低于处理S; 第7 d时, 土壤微生物量碳含量表现为处理SP>SPN10>SPN20>SPN5>S, 处理SP、SPN5、SPN10和SPN20的土壤微生物量碳比处理S分别增加约28.79%、3.18%、17.60%和5.27%, 且处理SP与SPN5、SPN20间有显著差异(p < 0.05);第14 d时, 处理SPN10和SPN20与处理S有显著差异, 而处理SP、SPN5及处理S间无显著差异(p < 0.05);第28 d时, 除处理SPN20与处理S无显著差异外, 其它处理均与处理S有显著差异(p < 0.05);第56 d时, 除处理SPN20微生物量碳显著高于其它处理外(p < 0.05), 其它处理间无显著差异; 第112 d和168 d时, 处理SPN10的土壤微生物量碳最高, 而其它处理间无显著差异.
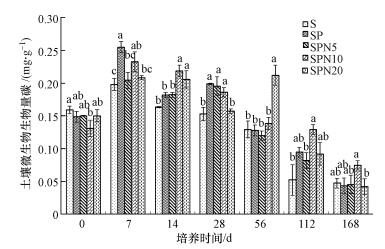 |
| 图 3 不同密度模式线虫对微生物生物量碳的影响(不同字母表示处理间存在显著差异, p < 0.05.下同) Fig. 3 Effects of different densities of Caenorhabditis elegans on microbial biomass carbon (The data with different letters are significant differences at p < 0.05 level. The same below) |
FDA水解酶活性在培养期内表现为先上升后降低再上升再降低的趋势(图 4a).第0 d时, 处理SP、SPN5、SPN10和SPN20间FDA水解酶活性无显著差异, 但均显著低于处理S (p < 0.05);第7 d和第14 d时, 处理SP、SPN5、SPN10和SPN20的FDA水解酶活性仍无显著差异, 但却反增为显著大于处理S; 第28、56、112 d时, 各处理FDA水解酶活性与处理S无显著差异, 但呈现出总体增高的趋势; 第168 d时, FDA水解酶活性总体降低, 表现为S>SPN10>SPN5>SP>SPN20, 除处理SPN20与处理S有显著差异外(p < 0.05), 其它各处理与对照S无显著差异.
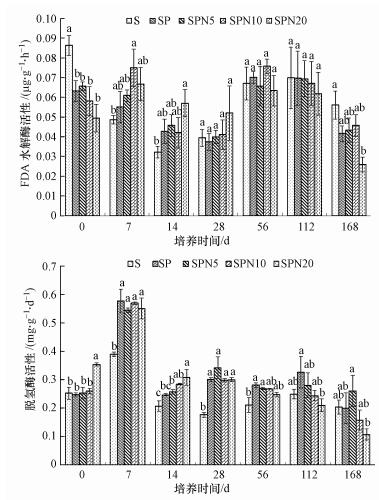 |
| 图 4 不同密度模式线虫对FDA水解酶(a)和脱氢酶(b)活性的影响 Fig. 4 Effects of different densities of Caenorhabditis elegans on FDA (a) and dehydrogenase(b) activity |
在整个培养期内, 脱氢酶活性大体表现为先上升后下降的趋势(图 4b).石油污染处理SP及石油污染并接种线虫处理SPN5、SPN10、SPN20的脱氢酶活性总体上高于处理S.第0 d时, 除处理SPN20脱氢酶活性显著高于其它处理外(p < 0.05), 其它处理间无显著差异; 第7 d时, 各处理脱氢酶活性都显著高于处理S (p < 0.05);第14 d时, 各处理脱氢酶活性均降低, 但处理SP、SPN5、SPN10和SPN20的脱氢酶活性仍比处理S分别增加约19.19%、24.35%、37.32%和48.75%, 且接种线虫处理SPN5、SPN10和SPN20的脱氢酶活性比石油污染处理SP分别增加约5.16%、18.13%和29.56%;第28 d和第56 d时, 各处理脱氢酶活性基本显著高于处理S; 第112 d时, 除处理SP脱氢酶活性显著高于处理SPN20外, 其它处理间无显著差异; 第168 d时, 除处理SPN5脱氢酶活性显著高于处理SPN20外, 其它处理间无显著差异.
3.5 石油污染土壤中线虫数量、石油残留量、微生物量碳和酶活性的相关性分析由表 1可以得出, 在培养试验中, 石油残留量、微生物量碳及脱氢酶活性均与线虫数量显著负相关, 说明接种线虫可有效减少石油残留量, 促进石油降解, 同时可以调控微生物数量及相关酶活性.石油残留量与微生物量碳及脱氢酶活性之间显著正相关, 说明石油污染可有效刺激微生物的增殖和土壤相关酶活性的提高.
| 表 1 线虫数量、石油残留量、微生物量碳和酶活性的相关性分析 Table 1 Pearson correlation coefficients between variables |
随着经济快速发展, 石油及其产品用量增多, 引发严重的土壤石油污染问题, 土壤石油污染治理刻不容缓(黄荣霞等, 2016).目前土壤污染修复方法主要包括物理修复、化学修复及生物修复, 但由于物理修复, 化学修复方法成本较高、易造成二次污染等, 而生物修复技术因绿色环保等特性, 更符合未来发展趋势.本研究通过向石油污染土壤中添加食细菌线虫, 旨在利用食细菌线虫与土壤微生物之间的互作关系促进污染土壤石油的降解, 可为石油污染的生物修复提供理论基础.
本试验结果表明, 食细菌线虫接种进入石油污染土壤后, 先要经历一个适应阶段, 然后才能增殖, 数量达到一定阶段之后又开始减少(图 1), 这与周际海等(2011)研究线虫在扑草净污染土壤中的定殖过程基本一致, 主要可归因为在培养初期各接种食细菌线虫处理土壤微生物较多, 可为食细菌线虫的繁殖提供足够的食物来源, 从而促进食细菌线虫数量的增加, 而培养后期土壤微生物数量减少会导致食细菌线虫因食物不足数量减少.此外, 研究结果也表明线虫接种量多的处理SPN20、SPN10的线虫数量及其增加程度均小于接种线虫量少的处理SPN5, 这与李贺勤等(2014)的研究结果是相似的.一方面可能是线虫的捕食存在密度调节, 密度过大可能导致线虫捕食过多, 微生物数量减少; 另一方面可能是因为食细菌线虫具有取食偏好性(周际海, 2011), 培养初期接种线虫数量过多可能导致某些微生物被过度捕食而减少, 使得后期线虫的食物数量受限, 线虫数量的增加程度反而少于接种线虫少的处理.表 1的相关性分析也证明了该结论, 即线虫数量与微生物量碳存在显著负相关.在整个试验培养结束时, 处理SPN5、SPN10和SPN20土壤石油残留含量比处理SP分别降低约48%、15.48%和12.15%, 其中处理SPN5降低污染土壤的石油浓度效果最佳, 说明接种线虫对去除污染土壤的石油有较好效果, 且线虫数量与石油残留浓度存在显著负相关(图 2, 表 1), 即线虫数量增多有利于污染土壤石油的去除.
土壤微生物量碳与土壤微生物数量直接相关(Giller et al., 1998), 本研究发现所有含石油污染处理在实验初期微生物量碳略有升高, 可能是因为土壤中添加的石油可为部分能够分解利用石油的微生物提供碳源, 从而刺激了该部分微生物的生长, 使微生物量碳增加; 在培养中后期微生物量碳呈现了下降趋势, 可能是因为易被微生物利用的石油成分减少, 微生物因可利用碳源减少而数量下降, 导致处理SP、SPN5、SPN10、SPN20土壤微生物量碳降低.这与程坤等(2017)研究石油原油、铅镉及其复合污染胁迫对土壤微生物量碳的影响是基本一致的, 即微生物量碳在整个培养期内呈先上升后下降的趋势.相关性分析表明线虫数量与土壤微生物量碳存在显著负相关(表 1), 即线虫数量越多, 微生物量碳越低, 反之则越高, 说明接种线虫可以调控土壤微生物的繁殖.
土壤酶是土壤中一切生物化学过程的主要参与者, 是生态系统物质循环和能量流动等过程中最活跃的生物活性物质(陈书涛等, 2016; 关松荫, 1987).由于土壤酶活性测定简便、快捷、准确, 其活性受土壤污染状况和理化性质共同影响, 其作为监测指标优势明显, 已成为土壤环境质量监测的重要研究方向(陈书涛等, 2016; Olga, 2006).FDA水解酶在土壤质量评价中已被广泛应用, 能够很好地反映土壤微生物的总体活性, 被认为是土壤健康质量的生物学指标之一(王校常等, 2006; Bandick and Dick, 1999; Dick et al., 1996; Nsabimana et al., 2004).本研究中FDA水解酶活性在培养期内的变化趋势总体上是先上升后降低再上升, 可能是由于添加的石油初期抑制了大部分微生物的活性, 之后由于某些可利用石油作为碳源的微生物大量繁殖, 从而使FDA水解酶活性显著增高.第0 d时, 含石油污染处理的FDA水解酶活性均显著低于处理S, 这与石油污染初期可能对大部分土壤微生物有抑制作用有关; 而在培养后期, 由于微生物对石油污染的适应及能分解利用石油的微生物的繁殖增多, 导致FDA水解酶的活性增强; 同时也发现接种线虫处理在培养初期总体上增加了FDA水解酶活性, 而在培养后期一定程度上降低了FDA水解酶的活性, 说明接种食细菌线虫可以调控石油污染土壤微生物的活性.土壤脱氢酶在土壤有机质的降解转化中起催化脱氢作用, 是表征土壤生态功能的重要指标(刘爱菊等, 2013).在大多情况下, 微生物对石油污染物的降解或转化从脱氢开始, 因此, 可用脱氢酶活性来反映与石油降解相关微生物的活性, 进而评价降解性能(李广贺等, 2002).本研究中脱氢酶活性大体表现为先上升后下降的趋势, 这与王华金等(2013)的研究结果基本一致, 可能是在培养初期石油烃的氢原子活化并传递给特定的受氢体, 实现石油烃的氧化和转化, 导致石油污染土壤脱氢酶活性增高; 在培养后期污染土壤中石油烃中易于分解的氢原子已基本氧化和转化, 可转化的氢原子数量减少, 导致脱氢酶活性下降.此外, 接种线虫处理的脱氢酶活性与线虫数量呈显著负相关(表 1), 说明线虫也可以调控脱氢酶活性进而影响石油降解, 在整个实验结束时, 接种线虫处理SPN5脱氢酶活性最高(图 4b), 表明处理SPN5最利于石油污染的降解.
5 结论(Conclusions)1) 试验培养结束时, 土壤石油残留浓度为处理FSP>SP>SPN10>SPN20>SPN5, 其中处理SPN5的石油残留量最低, 比处理FSP降低约70.68%, 比处理SP降低约48%, 说明接种模式线虫可以促进污染土壤石油的降解, 且以5条线虫/g干土的接种量促进污染土壤石油降解的效果最好.
2) 石油污染处理及接种线虫处理在总体上增加了FDA水解酶及脱氢酶活性, 同时在一定程度上促进了土壤微生物量碳的增加, 说明石油污染及接种食细菌线虫可以调控土壤酶活性及土壤微生物数量.
Bandick A K, Dick R P. 1999. Field management effects on soil enzyme activities[J]. Soil Biology & Biochemistry, 31: 1471–1479.
|
陈书涛, 桑琳, 张旭, 等. 2016. 增温及秸秆施用对冬小麦田土壤呼吸和酶活性的影响[J]. 环境科学, 2016, 37(2): 703–709.
|
程坤, 周际海, 金志农, 等. 2017. 土壤微生物活性对石油原油、铅镉及其复合污染的响应[J]. 环境科学学报, 2017, 37(5): 1976–1982.
|
Dick R P, Breakwell D P, Turco R. 1996. Soil enzyme activities and biodiversity measurements as integrative microbiological indicators[M]//Doran J W, Jones A J. Handbook of methods for assessing soil quality. Madison: Soil Science Society America
|
Fu S L, Ferris H, Brown D H, et al. 2005. Does the positive feedback effect of nematodes on the biomass and activity of their bacteria prey vary with nematode species and population size?[J]. Soil Biology & Biochemistry, 37: 1979–1987.
|
Gebremikael M T, Buchan D, De Neve S. 2014. Quantifying the influences of free-living nematodes on soil nitrogen and microbial biomass dynamics in bare and planted microcosms[J]. Soil Biology & Biochemistry, 70: 131–141.
|
Giller K E, Witter E, Mcgrath S P. 1998. Toxieity of heavy metals to microorganisms and microbial porcesses in agricultural soils: a review[J]. Soil Biology & Biochemistry, 30(10/11): 1389–1414.
|
关松荫. 1986. 土壤酶及其研究方法[M]. 北京: 农业出版社.
|
黄荣霞, 周际海, 袁颖红, 等. 2016. 石油污染土壤修复研究进展[J]. 南昌工程学院学报, 2016, 35(3): 48–54.
|
井永苹, 陈小云, 刘满强, 等. 2010. 土壤食细菌线虫对菲降解的影响[J]. 土壤, 2010, 42: 372–377.
|
李广贺, 张旭, 卢晓霞. 2002. 土壤残油生物降解性与微生物活性[J]. 中国地质大学学报, 2002, 27(2): 181–185.
|
李贺勤, 张林林, 刘奇志, 等. 2014. 接种食细菌线虫对连作草莓幼苗生长及其根际土壤酶活性和矿质氮含量影响的研究[J]. 中国生物防治学报, 2014, 30(3): 355–360.
|
梁文举, 葛亭魁, 段玉玺. 2001. 土壤健康及土壤动物生物指示的研究与应用[J]. 沈阳农业大学学报, 2001, 32(1): 70–72.
|
刘爱菊, 刘敏, 李梦红, 等. 2013. Cu、抗生素协同污染对土壤微生物活性的影响[J]. 生态环境学报, 2013, 22(11): 1825–1829.
DOI:10.3969/j.issn.1674-5906.2013.11.014 |
刘五星, 骆永明, 滕应, 等. 2007. 石油污染土壤的生态风险评价和生物修复Ⅱ.石油污染土壤的理化性质和微生物生态变化研究[J]. 土壤学报, 2007, 44(5): 848–853.
DOI:10.11766/trxb200606020511 |
Nsabimana D, Haynes R J, Wallis F M. 2004. Size, activity and catabolic diversity of the soil microbial biomass as affected by land use[J]. Applied Soil Ecology, 26: 81–92.
DOI:10.1016/j.apsoil.2003.12.005
|
Olga M. 2006. Effects of heavy metals on some soil biological parameters[J]. Journal of Geochemical Exploration, 88(1/3): 220–223.
|
宋敏, 刘银占, 井水水. 2015. 土壤线虫对气候变化的响应研究进展[J]. 生态学报, 2015, 35(20): 6857–6876.
|
Vance E D, Brookes P C, Jenkinson D S. 1987. An extraction method for measuring soil microbial biomass[J]. Soil Biology & Biochemistry, 19(6): 703–707.
|
王华金, 朱能武, 杨崇, 等. 2013. 石油污染土壤生物修复对土壤酶活性的影响[J]. 农业环境科学学报, 2013, 32(6): 1178–11843.
|
王校常, 陆琴, 李腊梅, 等. 2006. 太湖地区典型水稻土FDA水解酶活性的剖面分布特征[J]. 植物营养与肥料学报, 2006, 12(6): 834–839.
DOI:10.11674/zwyf.2006.0613 |
吴纪华, 宋慈玉, 陈家宽. 2007. 食微线虫对植物生长及土壤养分循环的影响[J]. 生物多样性, 2007, 15: 124–133.
DOI:10.3321/j.issn:1005-0094.2007.02.003 |
Wang Y, Chen H, Chen H, et al. 2009. Influences of chronic contamination of oil field exploitation on soil nematode communities at the Yellow River Delta of China[J]. Frontiers of Biology in China, 4(3): 376–383.
DOI:10.1007/s11515-009-0030-9
|
肖能文, 谢德燕, 李俊生, 等. 2011a. 胜利油田油井开采时间对土壤线虫群落的影响[J]. 环境科学研究, 2011a, 24(9): 1008–1015.
|
肖能文, 谢德燕, 王学霞, 等. 2011b. 大庆油田石油开采对土壤线虫群落的影响[J]. 生态学报, 2011b, 31: 3736–3744.
|
Xiao H, Griffiths B, Chen X, et al. 2010. Influence of bacterial-feeding nematodes on nitrification and the ammonia-oxidizing bacteria (AOB) community composition[J]. Applied Soil Ecology, 45: 131–137.
DOI:10.1016/j.apsoil.2010.03.011
|
Xiao H, Li G, Li D, et al. 2014. Effect of different bacterial-feeding nematode species on soil bacterial numbers, activity, and community composition[J]. Pedosphere, 24: 116–124.
DOI:10.1016/S1002-0160(13)60086-7
|
周际海. 2011. 线虫与微生物相互作用及其对污染土壤扑草净降解影响的研究[D]. 南京: 南京农业大学
|
Zhou J H, Hu F, Jiao J G, et al. 2012. Effects of bacterial-feeding nematodes and prometryne-degrading bacteria on the dissipation of prometryne in contaminated soil[J]. Journal of Soils and Sediments, 12(4): 576–585.
DOI:10.1007/s11368-012-0473-5
|
Zhou J H, Li X, Jiang Y, et al. 2011. Combined effects of bacterial-feeding nematodes and prometryne on the soil microbial activity[J]. Journal of Hazardous Materials, 192(3): 1243–1249.
DOI:10.1016/j.jhazmat.2011.06.035
|
Zhou J H, Sun X W, Jiao J G, et al. 2013. Dynamic changes of bacterial community under the influence of bacterial-feeding nematodes grazing in prometryne contaminated soil[J]. Applied Soil Ecology, 64: 70–76.
DOI:10.1016/j.apsoil.2012.11.005
|
Zhou J H, Huang R X, Yuan Y H, et al. 2017. Microtitration assay of total petroleum hydrocarbons in contaminated soils using ultrasonic extraction and multiskan spectrum[J]. Spectroscopy and Spectral Analysis, 37(11): 3647–3652.
|
 2017, Vol. 37
2017, Vol. 37


