2. 西安市政设计研究院有限公司, 西安 710068
2. Xi'an Municipal Engineering Design & Research Institute Co., Ltd, Xi'an 710068
金属及金属化合物纳米颗粒因其独特的光电性质、良好的稳定性及高效的催化活性, 在环境、催化、能源、生物等众多领域有广泛的应用(Sharma et al., 2017; Schroefel et al., 2014; 雷立等, 2016).纳米颗粒的化学合成过程往往会引入有毒有害物质(Azim et al., 2009; Sau et al., 2009), 容易造成环境污染问题.因此, 随着材料制备的绿色化研究日趋活跃, 生物合成的方法因其对环境无污染、成本低廉、合成条件温和等优点, 越来越受到研究人员的关注(De et al., 2008; 刘志进等, 2017; 沈娥等, 2015).目前据报道, 细菌(Bacteria)、酵母菌(Yeast)、真菌(Fungi)等多种微生物能够合成多种金属或者金属化合物的纳米颗粒, 如金、银、四氧化三铁等(Saif et al., 2016; Siddiqi et al., 2016; Tidke et al., 2014).
在众多金属化合物的纳米颗粒中, 硒化银作为一种新型功能材料, 目前已成为国内外材料学研究的热点之一.硒化银纳米材料具有许多特殊性能, 因而在众多领域具有非常大的应用潜力, 如光电电池、光学器件、离子选择电极, 以及作为光敏剂应用于感光材料等(杨秀清等, 2009).目前, 制备硒化银的方法主要有固相合成法、微波烧结法、水热法、室温合成法、化学沉降法(邓宗伟, 2008).由于生物合成方法的优势, 研究人员展开了在生物合成硒化银领域的探索, 但主要是仿生物还原的方法, 利用生物大分子蛋白质等还原合成硒化银.Gu等(2012)利用谷胱甘肽、NADPH和谷胱甘肽还原酶合成近红外硒化银;Yan等(2014)以巯基乙酸(TGA)和甘氨酸为稳定剂, 利用硼氢化钠还原, 最终合成硒化银纳米颗粒.但目前利用生物细胞体合成硒化银的纳米颗粒研究较少.Cui等(2009)利用酵母细胞原位合成了硒化镉纳米颗粒, 证明了硒化物纳米颗粒的生物合成的可能性.
菌株Pantoea sp.IMH是本实验室在高砷地区发现的砷抗性菌, 能够还原高浓度的砷(Wu et al., 2013).在进一步的研究中发现其对贵金属金、银、钯, 以及硒具有很好的还原作用.基于此, 本研究以菌株Pantoea sp.IMH作为目标菌株合成硒化银纳米颗粒, 尝试合成复合纳米材料.同时, 通过多种表征技术(HRTEM、EDX-mapping、XRD等)对所合成的纳米颗粒进行表征, 研究不同浓度比例对硒化银纳米颗粒的影响, 从而进行合成优化, 并探索硒化银纳米颗粒对不同电性的染料分子的吸附去除应用.
2 材料与方法(Materials and methods) 2.1 材料与试剂氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾、硝酸银、亚硒酸钠、亚甲基蓝均购自国药集团化学试剂(北京)有限公司;胰蛋白胨(Tryptone, LP0042)、酵母粉(Yeast Extract)购自Oxoid公司;靛蓝、日落黄购自东京化成工业株式会社.染料分子亚甲基蓝、日落黄、靛蓝的分子结构式见图 1(刘宇, 2013; 姚继明等, 2013; 梁波等, 2015).实验中将硝酸银、亚硒酸钠配制成浓度为100 mmol·L-1的储备液, 将亚甲基蓝、日落黄、靛蓝配成5 mmol·L-1的储备液, 储备液均4 ℃保存备用.
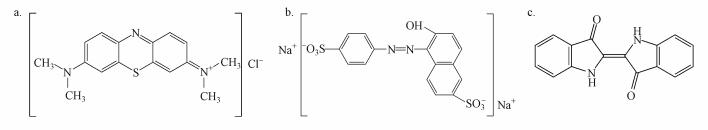 |
| 图 1 亚甲基蓝(a)、日落黄(b)、靛蓝(c)分子的结构式 Fig. 1 The structure of methylene blue(a), sunset yellow(b), indigo(c) |
将冷冻保存的菌株IMH接入Luria-Bertani(LB)培养基中, 30 ℃下培养生长到晚对数期后, 5000 r·min-1(Eppendorf 5424, Hamburg, Germany)离心5 min收集菌体, 并用新鲜培养基清洗3次.之后将菌体接种到新配制的LB培养基中, 150 r·min-1振荡培养12 h.
2.3 菌株合成合金纳米颗粒将对数期菌液在5000 r·min-1下离心5 min, 收集菌体.随后将菌体分散至无NaCl的LB培养基中, 先加入Ag(I)至溶液终浓度为2 mmol·L-1, 后加入Se(IV)至溶液终浓度为2 mmol·L-1, 振荡培养12 h.培养结束后, 10000 r·min-1离心5 min, 收集菌体沉淀.
将对数期菌液在5000 r·min-1下离心5 min, 收集菌体.随后将菌体分散至无NaCl的LB培养基中, 先加入Ag(I)至溶液终浓度为1 mmol·L-1, 然后根据不同物质的量比(Ag:Se=1:1、1:5、1:10), 加入Se(IV), 振荡培养12 h.培养结束后, 10000 r·min-1离心5 min, 收集菌体沉淀.
2.4 纳米颗粒的表征 2.4.1 透射电子显微镜-选区电子衍射-能谱(HRTEM-SAED-EDS)表征将合成的纳米颗粒滴加在带有碳膜的铜网表面, 待其完全干燥, 放入透射电镜(HRTEM, JEM-2010)样品台拍摄有代表性的图像, 通过电镜照片观察颗粒形貌及粒径, 利用其ED和EDS附件表征纳米颗粒的晶格和元素组成.
2.4.2 场发射扫描电子显微镜(FE-SEM)进行表征将合成的纳米颗粒冷冻干燥后溶于酒精中, 滴加在硅片表面, 待其完全干燥后, 进行FE-SEM(Hitachi SU8020, Tokyo, Japan)观察.
2.4.3 X射线粉末衍射(XRD)表征将冷冻干燥后的纳米颗粒使用X射线粉末衍射仪(X′Pert PRO MPD, Netherlands)表征.样品置于单晶硅片上铺平, 厚度约为0.5 mm, 扫描范围为10°~90°, 扫描步长为0.026°.数据分析使用MDI Jade 5软件, 利用粉末衍射联合会国际数据中心(JCPDS-ICDD)提供的各种物质标准粉末衍射资料(PDF)进行对照分析.
2.5 纳米颗粒对不同染料分子的吸附性能研究 2.5.1 纳米颗粒的氮气吸附脱附实验称取100 mg合成的纳米颗粒, 利用比表面积测试仪(ASAP2046, 美国麦克仪器公司)进行氮气吸附脱附实验, 测定其比表面积.
2.5.2 不同pH条件下纳米颗粒对不同染料的吸附性能将合成的纳米颗粒分别对不同电性的染料分子亚甲基蓝(阳性)、日落黄(阴性)、靛蓝(中性)进行吸附, 探索其吸附性能.将合成的纳米颗粒溶于5 mL无菌水混合均匀, 取2 mL悬浮液分别加入到20 mL浓度为0.05 mmol·L-1的3种染料溶液中进行吸附.取2.2节中得到的2 mL纯菌液加入到20 mL的染料溶液中作为空白对照.在旋转培养器(WH-962, 华利达实验设备公司)上旋转反应2 h后10000 r·min-1离心3 min, 取上清液用分光光度计分别在664、481、711 nm(染料分子的紫外可见光吸收光谱见图 2)(Sun et al., 2016; 刘志进等, 2017; 李成杨等, 2015)处测亚甲基蓝、日落黄、靛蓝反应前后的吸光度, 吸附率X由式(1)得到.
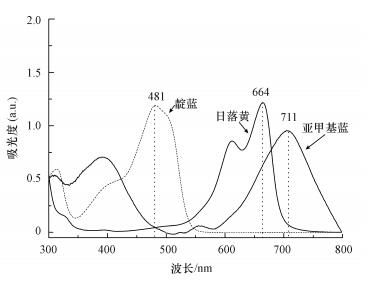 |
| 图 2 亚甲基蓝、日落黄和靛蓝的紫外吸收光谱 Fig. 2 UV-vis absorption spectra of methylene blue, sunset yellow and indigo |
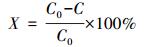
|
(1) |
式中, C0为溶液中染料在其最大吸光度值对应的波长处的吸光度值, C为吸附平衡后溶液中剩余染料在其最大吸光度值对应的波长处的吸光度值.
2.5.3 不同pH条件下硒化银对不同染料的饱和吸附量将合成的纳米颗粒溶于5 mL无菌水混合均匀, 取2.5 mL悬浮液分别加入到25 mL不同浓度(0.025、0.05、0.1、0.25、0.5、0.75、1、1.5、2、2.5、3、3.5 mmol·L-1)的3种染料溶液中进行吸附.期间控制pH基本不变, 吸附4 h后取样10000 r·min-1离心3 min, 取上清液用分光光度计分别在664、481、711 nm处测亚甲基蓝、日落黄、靛蓝反应前后的吸光度, 以探究硒化银纳米颗粒的饱和吸附容量.
2.5.4 不同pH条件下硒化银的吸附稳定性将合成的纳米颗粒溶于5 mL无菌水混合均匀, 取10 mL悬浮液分别加入到100 mL浓度为0.05 mmol·L-1的3种染料溶液中进行吸附.在旋转培养器(WH-962, 华利达实验设备公司)上旋转反应, 分别在反应10 min、30 min、45 min、1 h、1.5 h、2 h、4 h、6 h、8 h时取样, 取样后10000 r·min-1离心3 min, 取上清液用分光光度计分别在664、481、711 nm处测亚甲基蓝、日落黄、靛蓝反应前后的吸光度, 以探究硒化银纳米颗粒具体的吸附过程及吸附稳定性.
3 结果与讨论(Results and discussion) 3.1 生物合成的硒化银纳米颗粒的表征分析经菌株与Ag(I)和Se(IV)共培养后, 所合成的颗粒利用高分辨透射电子显微镜(HR-TEM, 点分辨率0.24 nm, 最高加速电压200 kV)对其进行观察表征, 结果如图 3所示.从图 3a可以看出, 纳米颗粒分散在细胞上, 且纳米颗粒的主要粒径尺寸为10~20 nm, 另有少量纳米颗粒的粒径达到了50~60 nm.另外, 细胞内有少量团聚, 这可能是由于离心过程中发生的少许团聚.图 3b为对粒径为15 nm颗粒进行观察的结果, 可以看出其纳米颗粒的晶面间距为0.225 nm, 对应于Ag2Se的(031)晶面(JCPDS card NO.24-1041), 利用HRTEM的电子衍射(ED)附件对此纳米颗粒进行观察分析(图 3c), 得出其纳米颗粒的衍射环对应的标准Ag2Se晶面为(013)、(031)和(113)面(PDF#24-1041).这与此前很多化学合成硒化银的研究结果相同(Dong et al., 2013; Gu et al., 2012; Cao et al., 2010).用X射线能谱分析(EDS)对硒化银纳米颗粒的成分进行分析, 结果如图 3d所示.由元素分析结果可知, 此纳米颗粒由元素Ag和Se构成, 图中C、O元素均来自于细胞成分.
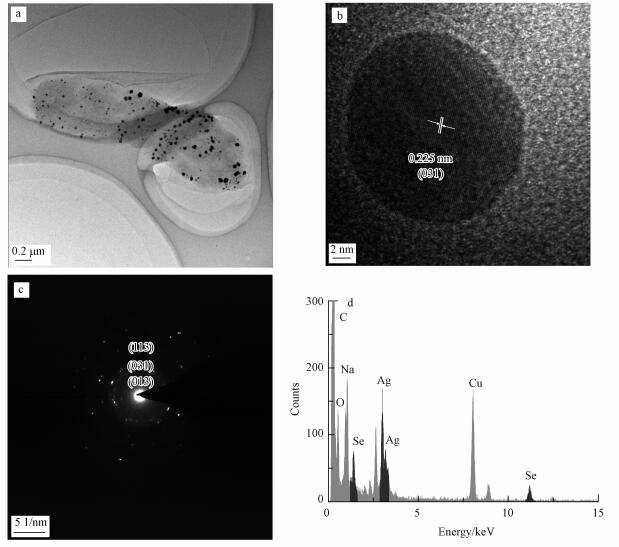 |
| 图 3 硒化银纳米颗粒的透射电镜图(a)、高分辨透射电镜图(b)、选区电子衍射图(c)和X射线能谱图(d) Fig. 3 TEM(a), HR-TEM(b), selected area electron diffraction(SAED)(c) and EDS(d) image of silver selenide nanoparticles synthesized by Pantoea sp.IMH |
为进一步证明硒化银纳米颗粒的合成, 对硒化银纳米颗粒进行能谱成像分析.如图 4所示, 元素Se(图 4c)和元素Ag(图 4d)分布基本重合, 其EDX结果(图 4e)说明此区域元素组成为Ag、Se、C、O和Cu.其中, Cu来自于铜网, 而C、O元素来自细胞.元素含量分析结果表明, Ag含量约占76.19%, Se含量约占23.81%, 比Ag2Se化学计量比2:1的比值要略大, 说明可能存在单质Ag.同时从图 4d也可看出, 存在Ag聚集区域, 而这些区域与图 4b中的大颗粒位置重合.这说明在硒化银合成过程中, 存在单质Ag合成的现象.而大量分布的小颗粒(即尺寸为10~20 nm)均为硒化银纳米颗粒, 这与文献报道的化学合成的硒化银纳米颗粒的尺寸一致(Narayanan et al., 2010; Dong et al., 2013).说明细胞在与Ag(I)和Se(IV)共培养过程中, 生成粒径为10~20 nm的硒化银纳米颗粒, 同时也生成了少量粒径为50~60 nm的银纳米颗粒.
 |
| 图 4 硒化银纳米颗粒的TEM低倍选区电子电镜(a)、TEM高倍选区电子电镜(b)、元素Se分布图(c)和元素Ag分布图(d)及EDS能谱图(e) Fig. 4 TEM low rate selective electron microscopy (a), TEM high rate selective electron microscopy (b), elemental Se distribution (c), elemental Ag distribution (d) and EDS energy spectrum (e) of silver selenide nanoparticles synthesized by Pantoea sp.IMH |
通过对硒化银纳米颗粒的SEM结果(图 5, 电压5000 V, 样品间距3.6 mm, 放大倍数为60000倍, 比例尺为500 nm)观察可以看出, 硒化银纳米颗粒呈米粒状, 说明硒化银纳米颗粒在细胞表面出现团聚.Cao等(2010)利用C4H4Se作为硒源, 与AgNO3在240 ℃水中反应合成Ag2Se, 之后所合成的Ag2Se发生团聚形成33 nm厚的板状聚合物;另外, Jafari等(2013)利用苯甲酸银作为Ag(I)的前驱体, 来合成硒化银纳米颗粒, 同样观察到出现颗粒之间团聚的现象.这说明硒化银纳米颗粒较易发生团聚.
 |
| 图 5 硒化银纳米颗粒扫描电子显微镜(SEM)图 Fig. 5 SEM image of silver selenide nanoparticles |
同时对硒化银纳米颗粒利用XRD进行表征(图 6), 结果表明, 位于27.15°、32.89°和46.64°的衍射峰分别对应于标准Ag2Se的(111)、(112)和(004)晶面(JCPDS card No. 24-1041).
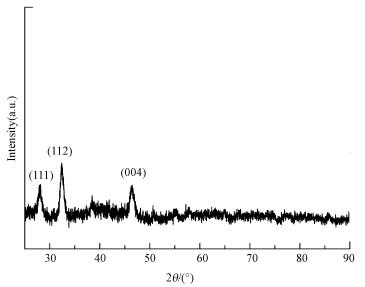 |
| 图 6 硒化银纳米颗粒X射线粉末衍射谱图 Fig. 6 X-ray diffraction pattern of silver selenide nanoparticles |
目前, 尚未见有关生物合成硒化银纳米颗粒的研究报道, 根据Gu等(2014)报道, 推测菌株IMH合成硒化银纳米颗粒的机制可能为:首先IMH体内的谷胱甘肽(GSH)还原Na2SeO3形成GSSeSG的中间产物, 然后GSSeSG与还原型辅酶NADPH反应形成GSSeH的Se(II)的前驱体, 而Ag(I)与丙氨酸(Alanine)形成Ag+-Ala的复合产物作为Ag(I)的前驱物, 二者在细胞环境下形成硒化银纳米颗粒.
3.3 不同物质的量比(Ag(I):Se(IV))对硒化银纳米颗粒合成的影响根据以上结果, 对所合成的硒化银纳米颗粒进行优化.由于过高浓度的Ag(I)易在细胞的作用下形成Ag纳米颗粒, 因此, 通过提高Se(IV)的浓度可优化硒化银纳米颗粒的合成, 即提高硒化银纳米颗粒的纯度, 减少Ag纳米颗粒的生成.因此, 降低Ag(I)的浓度为1 mmol·L-1, 并将Ag(I)与Se(IV)的物质的量比分别设为1:1、1:5、1:10, 与细胞共培养后, 结果如图 7所示.随着Ag(I)与Se(IV)物质的量比从1:1升至1:10, 所合成的硒化银纳米颗粒的尺寸分别从(2.0 ± 0.6)、(2.8 ± 0.5) nm增加至(3.7±0.9) nm.因为用于初始合成的Ag(I)和Se(IV)浓度从2 mmol·L-1下降至1 mmol·L-1, 所以合成的硒化银纳米颗粒粒径尺寸从10 nm下降至2 nm左右.同时, 随着Se(IV)物质的量浓度的增加, 其粒径尺寸不断增加, 这是因为IMH对Se的还原能力很强, Se(IV)浓度增加使得Se和Ag有更多机会接触反应, 易形成纳米粒子聚集, 团聚之后粒子之间的相互吸引力随着质量的增加而增大, 从而最终导致纳米颗粒粒径变大(Sibiya et al., 2014).同时, 通过降低初始Ag(I)浓度所合成的硒化银纳米颗粒的尺寸均在5 nm以下.其中, 当Ag(I)与Se(IV)的物质的量比为1:5时, 所合成的硒化银纳米颗粒分散性最好, 可用于应用探索.
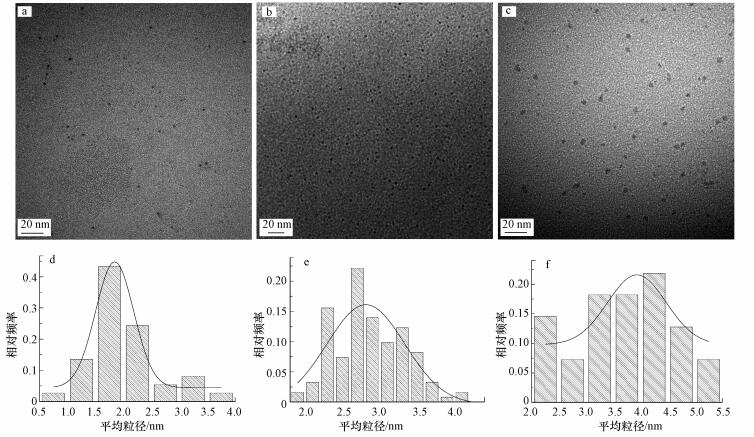 |
| 图 7 不同比例下的硒化银纳米颗粒的TEM图像和粒度分布直方图(物质的量比分别为1:1(a, d)、1:5(b, e)、1:10(c, f)) Fig. 7 TEM image and size distribution histograms of silver selenide(molar ratio(Ag:Se) is 1:1(a, d), 1:5(b, e), 1:10(c, f), respectively) |
将合成的硒化银纳米材料进行氮气吸附脱附实验表征, 从图 8a中可看出, 此等温线属IUPAC分类中的IV型, H1滞后环, 即中孔毛细凝聚型.其吸附等温线图低压端略偏向Y轴, 说明材料与氮有较强作用力, 在中压段(p/p0=0.45~0.60)吸附量平缓增加, 此时N2分子以单层到多层吸附在介孔的内表面, 在高压段(p/p0=0.7~1.0左右)吸附量有突增, 测量得到其比表面积为354.647 m2·g-1.
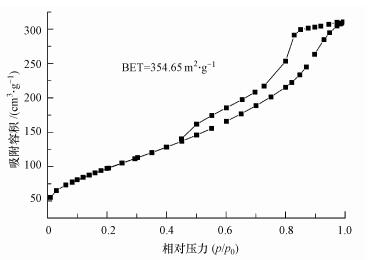 |
| 图 8 硒化银纳米材料的氮气吸附脱附图 Fig. 8 Nitrogen adsorption and desorption of silver selenide nanomaterials |
将合成的纳米颗粒分别对不同电性的染料分子亚甲基蓝(阳性)、日落黄(阴性)、靛蓝(中性)进行吸附, 探索其吸附性能.由图 9可知, 对于亚甲基蓝和靛蓝, 在不同pH条件下, 硒化银纳米颗粒的吸附去除效果均高于对照组(BK), 且随着pH增大其吸附效果逐渐增加.而对于日落黄分子, pH条件的改变对其吸附效果影响不大.通过对硒化银纳米颗粒进行Zeta电位的测定发现, 纳米颗粒的Zeta电位在pH=5下约为-11.8 mV, 在pH=7和pH=9下约为-13.0 mV.说明硒化银纳米颗粒在不同pH条件下均带负电荷, 以阳性染料亚甲基蓝为例, 其在水中带正电荷, 通过异性电荷相互吸引使得亚甲基蓝极易吸附到硒化银表面, 而硒化银在pH=9时表面带有更多的负电荷, 所以在pH=9时纳米颗粒对亚甲基蓝吸附得更多.总而言之, 硒化银纳米颗粒对阳性染料亚甲基蓝和中性染料靛蓝有较好的吸附效果, 对阴性染料日落黄吸附效果差.
 |
| 图 9 不同pH下IMH介导合成的硒化银纳米颗粒对不同染料的吸附去除(a.亚甲基蓝, b.日落黄, c.靛蓝, d.3种不同染料的吸附对比) Fig. 9 Removal of different dyes of silver selenide nanoparticles by IMH mediated synthesis under different pH(a. methylene blue, b. sunset yellow, c. indigo, d.adsorption contrast of three different dyes) |
硒化银纳米颗粒对亚甲基蓝具有良好的吸附效果.图 10是在3种不同pH条件下利用Langmuir吸附等温线拟合模型拟合所得的吸附容量.随着pH的升高, 硒化银纳米颗粒对亚甲基蓝的吸附容量逐渐增高, 在pH=5、7、9的条件下其对亚甲基蓝饱和吸附量分别为130、150、182 mg·g-1, 与之前推断一致, 说明硒化银对阳性染料的吸附量随pH升高而提高.对阴性染料日落黄的吸附量随pH升高而降低, 在pH=7和9时, 其吸附容量只有25 mg·g-1左右.而对于中性染料靛蓝, pH的变化对其影响未见明显规律.
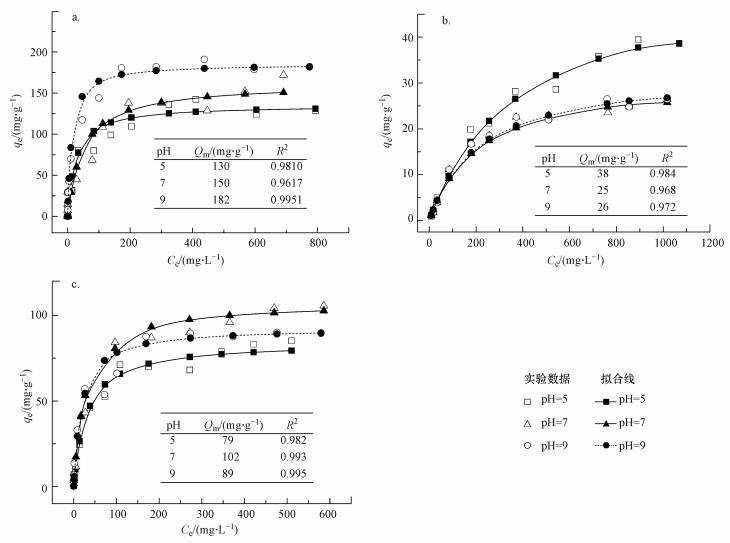 |
| 图 10 不同pH下硒化银对不同染料的饱和吸附量(a.亚甲基蓝, b.日落黄.c.靛蓝) Fig. 10 Changes of saturated adsorption of silver selenide to different dyes under different pH(a.methylene blue, b.sunset yellow, c.indigo) |
在硒化银纳米颗粒浓度为1 g·L-1的条件下对浓度为0.05 mmol·L-1的不同染料进行吸附, 发现在此浓度条件下, 硒化银对染料的吸附速率很快, 在10 min左右吸附已经基本达到基本平衡, 其对亚甲基蓝的吸附速率最快, 吸附完溶液呈无色透明, 而对靛蓝有一定吸附, 对日落黄吸附极少(图 11).在经过2 h吸附平衡后, 延长吸附时间至8 h, 发现其吸附稳定, 染料分子浓度随时间变化不大, 日落黄和靛蓝浓度略有回升, 而亚甲基蓝依旧吸附稳定.
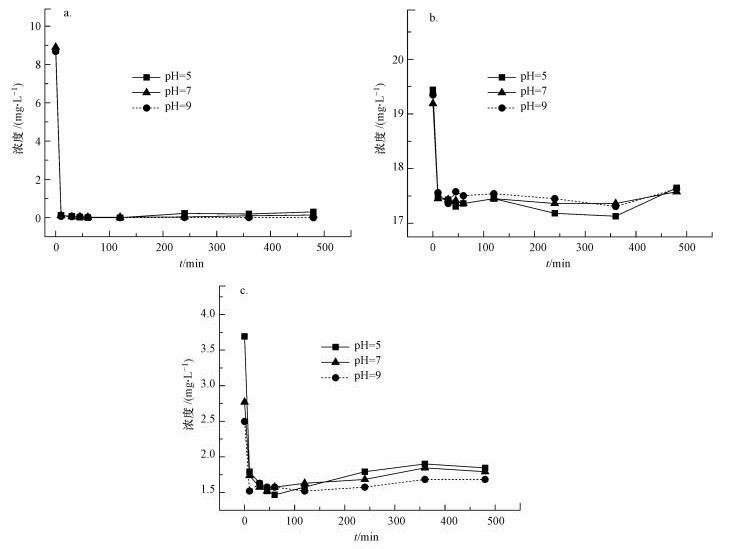 |
| 图 11 不同pH下硒化银对不同染料的稳定性(a.亚甲基蓝, b.日落黄, c.靛蓝) Fig. 11 Stability of silver selenide to different dyes under different pH(a. methylene blue, b.sunset yellow, c.indigo) |
本研究利用菌株Pantoea sp.IMH合成硒化银纳米颗粒, 并运用多种表征手段(HRTEM、EDX-mapping、XRD和SEM等)对其纳米颗粒进行表征.结果表明, 菌株IMH能够实现生物合成硒化银纳米颗粒.通过调整银和硒离子的浓度能够对所合成的硒化银纳米颗粒进行优化, 从而合成粒径较小且分散性好的纳米颗粒.同时, 探索了硒化银纳米颗粒对染料分子的吸附去除应用, 实验表明, 硒化银纳米颗粒对阳性和中性染料分子有较好的吸附去除效果.
Azim A, Davood Z, Ali F, et al. 2009. Synthesis and characterization of gold nanoparticles by tryptophane[J]. American Journal of Applied Sciences, 6(4): 691–695.
DOI:10.3844/ajassp.2009.691.695
|
Cao H Q, Xiao Y J, Lu Y X, et al. 2010. Ag2Se complex nanostructures with photocatalytic activity and superhydrophobicity[J]. Nano Research, 3(12): 863–873.
DOI:10.1007/s12274-010-0057-x
|
Cui R, Liu H H, Xie H Y, et al. 2009. Living yeast cells as a controllable biosynthesizer for fluorescent quantum dots[J]. Advanced Functional Materials, 19(15): 2359–2364.
DOI:10.1002/adfm.v19:15
|
De M, Ghosh P S, Rotello V M. 2008. Applications of nanoparticles in biology[J]. Advanced Materials, 20(22): 4225–4241.
DOI:10.1002/adma.v20:22
|
邓宗伟. 2008. 线性正磁电阻材料硒化银的制备及其机理研究[D]. 武汉: 华中科技大学
http://cdmd.cnki.com.cn/Article/CDMD-10487-2009144415.htm |
Dong B, Li C, Chen G, et al. 2013. Facile synthesis of highly photoluminescent Ag2Se quantum dots as a new fluorescent probe in the second near-infrared window for in vivo imaging[J]. Chemistry of Materials, 25(12): 2503–2509.
DOI:10.1021/cm400812v
|
Gu Y P, Cui R, Zhang Z L, et al. 2012. Ultrasmall near-infrared Ag2Se quantum dots with tunable fluorescence for in vivo imaging[J]. Journal of the American Chemical Society, 134(1): 79–82.
DOI:10.1021/ja2089553
|
Jafari M, Salavati-Niasari M, Mohandes F. 2013. Synthesis and characterization of silver selenide nanoparticles via a facile sonochemical route starting from a novel inorganic precursor[J]. Journal of Inorganic and Organometallic Polymers and Materials, 23(2): 357–364.
DOI:10.1007/s10904-012-9784-7
|
梁波, 关杰. 2015. 吸附法处理亚甲基蓝研究[J]. 工业用水与废水, 2015, 46(1): 6–11, 31.
|
雷立, 李学钊, 晋银佳, 等. 2016. 温和水热法合成钛酸盐纳米管及其对水中重金属离子的吸附研究[J]. 环境科学学报, 2016, 36(5): 1663–1671.
|
李成杨, 庄泽超, 金晓英, 等. 2015. 氧化石墨烯对亚甲基蓝和铜离子的共吸附行为研究[J]. 环境科学学报, 2015, 35(10): 3163–3169.
|
刘宇. 2013. 食用合成色素日落黄和胭脂红的分析方法研究[D]. 西安: 西北大学
http://cdmd.cnki.com.cn/Article/CDMD-10697-1013254763.htm |
刘志进, 段晋明, 王莉瑛. 2017. 红球菌LSJ-6介导的金纳米颗粒的合成及其对亚甲基蓝的吸附去除[J]. 环境科学学报, 2017, 37(6): 2092–2098.
|
Narayanan K B, Sakthivel N. 2010. Biological synthesis of metal nanoparticles by microbes[J]. Advances in Colloid and Interface Science, 156(1/2): 1–13.
|
Saif S, Tahir A, Chen Y. 2016. Green synthesis of iron nanoparticles and their environmental applications and implications[J]. Nanomaterials, 6(11): 209.
DOI:10.3390/nano6110209
|
Schroefel A, Kratosova G, Safarik I, et al. 2014. Applications of biosynthesized metallic nanoparticles-A review[J]. Acta Biomaterialia, 10(10): 4023–4042.
DOI:10.1016/j.actbio.2014.05.022
|
Sharma G, Kumar D, Kumar A, et al. 2017. Revolution from monometallic to trimetallic nanoparticle composites, various synthesis methods and their applications:A review[J]. Materials Science & Engineering C-Materials for Biological Applications, 71: 1216–1230.
|
沈娥, 刘紫嫣, 周豪, 等. 2015. Cupriavidus metallidurans SHE好氧还原Se(IV)合成硒纳米颗粒的特性研究[J]. 环境科学学报, 2015, 35(10): 3065–3070.
|
Sibiya P N, Moloto M J. 2014. Effect of precursor concentration and pH on the shape and size of starch capped silver selenide(Ag2Se) nanoparticles[J]. Chalcogenide Letters, 11(11): 577–588.
|
Siddiqi K S, Husen A. 2016. Fabrication of metal nanoparticles from fungi and metal salts:Scope and application[J]. Nanoscale Research Letters, 11: 98–98.
DOI:10.1186/s11671-016-1311-2
|
Sun H Z, Zhang F, Wei H T, et al. 2013. The effects of composition and surface chemistry on the toxicity of quantum dots[J]. Journal of Materials Chemistry B, 1(47): 6485–6494.
DOI:10.1039/c3tb21151g
|
Sau T K, Rogach A L. 2010. Nonspherical noble metal nanoparticles:colloid‐chemical synthesis and morphology control[J]. Advanced Materials, 22(16): 1781–1804.
DOI:10.1002/adma.v22:16
|
Tidke P R, Gupta I, Gade A K, et al. 2014. Fungus-mediated synthesis of gold nanoparticles and standardization of parameters for its biosynthesis[J]. Ieee Transactions on Nanobioscience, 13(4): 397–402.
DOI:10.1109/TNB.2014.2347803
|
Wu Q, Du J, Zhuang G, et al. 2013. Bacillus sp SXB and Pantoea sp IMH, aerobic As(V)-reducing bacteria isolated from arsenic-contaminated soil[J]. Journal of Applied Microbiology, 114(3): 713–721.
DOI:10.1111/jam.2013.114.issue-3
|
Yan S G, Zhang L C, Tang Y R, et al. 2014. Synthesis of water-soluble Ag2Se QDs as a novel resonance Rayleigh scattering sensor for highly sensitive and selective ConA detection[J]. Analyst, 139(17): 4210–4215.
DOI:10.1039/C4AN00579A
|
姚继明, 吴远明. 2013. 靛蓝染料的生产及应用技术进展[J]. 精细与专用化学品, 2013, 21(4): 13–18.
|
杨秀清, 马中军, 刘海霞, 等. 2009. Ag2Se纳米材料的制备方法[J]. 化学通报, 2009, 72(2): 112–116.
|
 2017, Vol. 37
2017, Vol. 37


