利用厌氧消化制备甲烷是一种能够实现有机废弃物能源化利用、反应条件温和、能耗低、二次污染小的生物处理技术(Aiyuk et al., 2006; Pham et al., 2006), 但厌氧消化也存在不足.单相消化会造成酸累积抑制产甲烷过程的发生;两相消化则因酸化和甲烷化两阶段分别在两串联反应器中而导致抗冲击负荷能力较弱.另外, 厌氧消化的速度和效率相对较低, 尤其在没有接种外源微生物时更加明显(Guo et al., 2013).此外, 厌氧消化在处理低浓度有机废水时的表现也不尽如人意(Villano et al., 2013).同时, 通过厌氧消化制备的甲烷中一般会含有30%~50%的CO2和其他杂质(Zeppilli et al., 2016).CO2的存在会降低甲烷品质, 并且不利于甲烷的压缩和运输.而去除主要杂质CO2的甲烷可以作为生物天然气用于发电和天然气汽车(Persson, 2003).目前, 提高甲烷品质的方法主要集中于利用化学或物理手段去除混合气中的CO2, 而在这个过程中会造成CH4的损失(Persson, 2003).如在原位减少CO2含量, 则不仅可以提高CH4品质, 还能降低纯化带来的CH4损失.
新兴的微生物电解池技术(microbial electrolysis cell, MEC)已被证实能够实现氢气(Batlle-Vilanova et al., 2014; Chookaew et al., 2014; Farhangi et al., 2014; Jiang et al., 2014; Kuntke et al., 2014; Xu et al., 2014)和/或甲烷制备(Hou et al., 2015; Sangeetha et al., 2016; Villano et al., 2016; Zeppilli et al., 2015; Zhen et al., 2015).Jiang等(2014)利用以碳毡为阴极、碳刷为阳极的双室微生物电解池成功制取H2.外加电压在0.3~0.5 V时, H2生成速度达到1.21~1.49 mol H2/mol COD.Villano等(2013)则利用双室MEC对连续进水制取CH4进行了研究.研究发现在稳定期, 利用阴极噬氢甲烷菌还原CO2产生CH4的速度可以达到0.28 LMet·d-1·LR-1.Jiang等(2013)在利用BES以CO2为底物合成CH4的研究中发现阴极电势对产物存在较大影响.当阴极电势在-850~-950 mV时, 产物中只有H2和CH4.当阴极电势超过-950 mV时, CH3COOH开始生成.阴极电势达到-1150 mV时, CH4和CH3COOH产率达到最高, 分别为129.32 mL·d-1和94.73 mg·d-1.另外, 有文献报道某些具有电化学活性的产甲烷菌能直接从电极接受电子并用于CH4合成(Cheng et al., 2009).而且通过电化学方法可以加强双室厌氧发酵产甲烷的效果(Sasaki et al., 2010).
本研究以MEC实现CH4制备为基础, 在厌氧消化(anaerobic digestion, AD)中引进MEC系统制成电辅助厌氧发酵系统(AD-MEC), 在考察外加电场对乙酸去除、甲烷生成、微生物组成和活性等影响的同时, 验证电辅助厌氧发酵系统可以实现原位提高CH4纯度, 并对提高有机物出去效率和CH4纯度可能的原理进行分析.
2 材料和方法(Materials and methods) 2.1 反应器构建与操作反应器罐体由直径和高均为10 cm有机玻璃圆筒构成.阴阳极由过滤精度为60 μm的SUS304型不锈钢毡构成, 并组成同心圆结构.阴阳极尺寸(长×高)分别为22 cm × 7 cm和28 cm × 7 cm.饱和氯化钾/银/氯化银电极(218型, 上海雷磁)作为参比电极.罐底设有排液口, 顶部设有进气/液口和排气口.反应器结构示意图见图 1.试验共3个反应器, 厌氧发酵命名为AD, 另两个分别由直流电源(GPD-4303S, 台湾)施加0.4 V和1.0 V电压, 命名为MEC(0.4 V)和MEC(1.0 V)
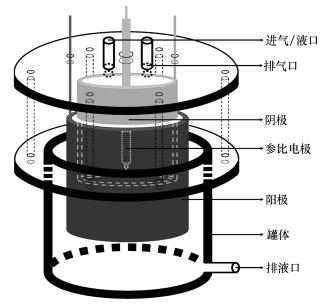 |
| 图 1 反应器结构示意图 Fig. 1 Schematic of the reactor |
启动时所有罐体装入500 mL含有7.3 g·L-1乙酸且pH为7.0的营养液(Liu et al., 2004)和10 g厌氧污泥(TSS = 8.25 × 104 mg·L-1, VSS = 6.42 × 104 mg·L-1).厌氧污泥来自于实验室稳定运行的厌氧消化系统.启动时反应器工作条件与正式试验条件一致.每5 d更换1次营养液和厌氧污泥.逐渐减少厌氧污泥用量, 直至不再加入厌氧污泥.产气稳定后启动完成, 开始正式试验.正式试验所用营养液与启动时相同, 不加厌氧污泥.反应器启动与正式试验均不搅拌.所有操作重复3次, 文中报道的数据为3次重复的平均值.为保证反应器处在厌氧条件, 加装营养液后吹入15 min氮气.吹脱结束, 稳定30 min后接通电源开始试验.产生的气体利用排水法收集到集气瓶中, 通过排出液体体积确定气体体积.在收集气体和对气体进行测试时均保持气体压强处在1.01×105 Pa, 且温度保持在(25 ± 2) ℃.各成分体积由各成分含量和总气体体积确定.
2.2 测试方法气体成分测定参考Jiang等(2013);乙酸浓度测定参考Yin等(2016).DNA提取使用宝生物工程(大连)有限公司的细菌基因组DNA小量纯化试剂盒(TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0)进行.提取获得的DNA交由生工生物工程(上海)股份有限公司进行高通量测序, 并按要求提供分析报告.气体样品每3 h测定1次;乙酸浓度每12 h测定1次.任何反应器的乙酸浓度达到平稳后结束试验, 更换营养液.
循环伏安扫描(cyclic voltammetry, CV)在单室电解池中进行, 使用电化学工作站(E550, 武汉高仕睿联科技有限公司)对参数进行控制.试验前在50 mL大小的电解池中装入40 mL新鲜营养液.反应器的生物电极做工作电极, 铂丝做对电极, 饱和氯化钾Ag/AgCl电极做参比电极.所有工作电极的大小均为1 cm2.CV扫描的范围为-0.8~0.4 V, 扫描速度为1.0 mV·s-1.扫描前对电解池进行曝气处理, 以除去溶液和顶空中的氧气, 一般吹入10 min氮气.吹脱结束, 稳定2 h后进行扫描.连续扫描10次, 以平均值作图.LSV扫描的工作电极为1 cm2的SUS304不锈钢毡, 扫描范围为-1.6~-0.5 V.其他操作和扫描参数与CV扫描相同.
3 结果与讨论(Results and discussion) 3.1 乙酸去除与气体生成从图 2可以看出在施加电压后, 乙酸的去除速度明显快于AD.去除速度从AD的(56.37 ± 0.56) mg·L-1·h-1上升到MEC(0.4 V)的(167.30 ± 0.71) mg·L-1·h-1和MEC(1.0 V)的(135.13 ±13.99) mg·L-1·h-1, 分别是AD去除速度的2.97倍和2.40倍.比较MEC(0.4 V)和MEC(1.0 V)的乙酸去除速度发现, 0.4 V更有利于乙酸的去除, 其去除速度比1.0 V高23.81%.虽然去除速度存在差异, 但两种电压下72 h乙酸去除效率均从AD的56.51%上升到接近100%.这表明通过外加电压可以缩短水力停留时间, 提高运行负荷.这与Ding等的研究发现在一定电压范围内随电压升高有机物除去速度和去除率都随之升高, 但电压过高后会引起效果降低是基本一致的(Ding et al., 2016).另外, 试验结果还说明电辅助厌氧发酵系统能有效消耗反应后期低浓度乙酸, 弥补了传统厌氧发酵对低浓度有机物利用不足的缺点.
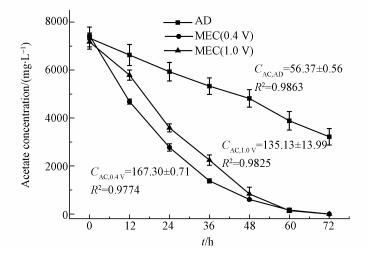 |
| 图 2 乙酸盐浓度随时间变化曲线 Fig. 2 Acetate concentrations with time |
通过对气体进行分析发现, 施加电压后CH4含量明显高于AD, 且随电压升高含量逐渐增加(表 1).这表明实验装置具有制备纯度较高甲烷的能力.另外, 施加电压后甲烷生成速度也明显高于AD((0.35 ± 0.07) LMet·d-1·LR-1), MEC(0.4 V)和MEC(1.0 V)分别达到(1.08 ± 0.08) LMet·d-1·LR-1和(1.18 ± 0.04) LMet·d-1·LR-1, 比AD提高了206.53%和235.51%.上述实验结果表明电辅助厌氧发酵系统可以实现甲烷的快速制备和甲烷品质提升.
| 表 1 各气体组分含量 Table 1 Gas composition |
在电化学系统中, 阴极是发生甲烷化作用的主要场所(Hou et al., 2015; Sangeetha et al., 2016; Villano et al., 2016), 因此, 对阴极微生物群落结构进行了高通量分析研究.从图 3可以明显看出, 嗜氢产甲烷菌的含量随着外加电压的升高, 比例不断增加.从最初AD中的18.04%升高到MEC(0.4 V)中的33.11%和MEC(1.0 V)中的78.87%.
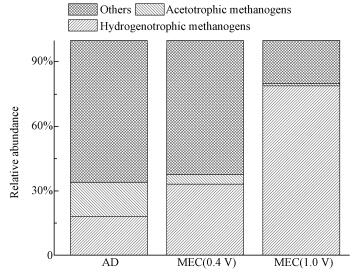 |
| 图 3 功能微生物相对含量 Fig. 3 Relative abundances of functional microbes |
表 2更清楚的反映了各种产甲烷菌比例的变化.噬氢甲烷菌Methanospirillum、Methanobacterium和Methanobrevibacter的比例随电压的升高出现较明显的上升趋势.其中Methanospirillum尤为显著, 从AD中的2.33%, 上升到MEC(0.4 V)中的15.98%和MEC(1.0 V)中的68.38%.另外, 有文献报道Methanobacterium可以从电极直接获得电子, 利用H+将CO2还原成CH4(Cheng et al., 2009).但有些嗜氢产甲烷菌的比例随电压升高出现了下降, 如Methanolinea和Methanoregula.Methanocorpusculum则呈现出先增加后减小的趋势.不同嗜氢产甲烷菌呈现不同变化趋势可能与能否适应电刺激以及能否在外加电压下获得能量用于生命代谢有关, 这需要在以后进一步研究.但大量噬氢甲烷菌为CO2消耗提供了生物学基础.
| 表 2 产甲烷菌种类和在阴极微生物中比例 Table 2 Abundances of methangens at genus level on the cathode |
外加电压还对乙酸型产甲烷菌的比例造成了影响.实验中发现的两种乙酸型产甲烷菌Methanosaeta和Methanosarcina均随电压升高而降低.乙酸型产甲烷菌从AD中的15.91%下降到MEC(0.4 V)中的4.49%和MEC(1.0 V)中的1.04%.乙酸型产甲烷菌的减少对降低CO2产量是有帮助.这是因为乙酸型产甲烷菌在产生CH4的同时会释放同样体积的CO2, 其比例的降低会使该途径释放的CO2减少.
另外, 在微生物群落中还检测到了产电微生物(表 3).产电微生物可以利用乙酸产生CO2、H+和e-(Logan et al., 2006).MEC(0.4 V)中大量产电微生物的存在对有机物的消耗有很大帮助.这也可能是MEC(0.4 V)乙酸去除速度高于MEC(1.0 V)的原因之一.但产电微生物存在与乙酸型产甲烷菌类似的问题, 即在消耗有机物的同时会释放CO2其含量在MEC(1.0 V)中明显降低对该途径CO2的减少有所帮助.
| 表 3 产电微生物群落结构分析 Table 3 Analysis of consortium construction of exoelectrogens |
正是由于施加电压后微生物种群结构的变化使得消耗CO2微生物(嗜氢产甲烷菌)比例增加和生成CO2微生物(乙酸型产甲烷菌和产电微生物等)比例下降, 才让电辅助厌氧发酵系统具有了甲烷快速发生和原位品质提升的生物学基础.
3.3 阴极微生物活性变化在对微生物种群进行分析后, 为对快速乙酸消耗和甲烷制备有更进一步的认识对施加电压后微生物活性变化进行了研究.从图 4可以看出MEC(0.4 V)和MEC(1.0V)的响应电流强度和范围明显高于AD, 这表明MEC(0.4 V)和MEC(1.0V)中的微生物与电极间的电子交换速度加快, 微生物代谢活性被提高.在乙酸代谢过程中, 微生物实际起到的是催化剂的作用, 微生物活性越强, 催化活性也就越高, 单位时间内转化乙酸的能力也就越强(Natarajan, 1992), 反映出的外在表现就是施加电压后电辅助厌氧发酵系统具有更快的乙酸消耗速度.这与有关研究表明外加电压能从整体上提高微生物活性也是相一致的(Ding et al., 2016).
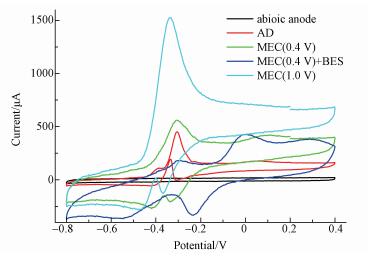 |
| 图 4 阳极CV扫描 Fig. 4 CV scanning for bioelectrodes |
而甲烷的生成速度主要取决于产甲烷菌的活性.为了解外加电压是否有助于提高甲烷菌的活性, 向溶液中加入甲烷抑制剂2-溴乙基磺酸钠(2-BES), 并使其浓度达到50 mmol·L-1.该浓度可以将产甲烷的两个基本途径, 即乙酸产甲烷和嗜氢产甲烷过程全部抑制(Gunsalus et al., 1978).而理论上, 甲烷抑制剂不会对其他微生物活性造成影响(Zinder et al., 1984).于是, 通过比较同一生物电极在投加甲烷抑制剂前后CV扫描图的变化就可以获知与产甲烷菌有关的峰.从图 4可以明显看出MEC(0.4 V)中的阴极做CV扫描时加入2-BES后, -0.3 V处的峰明显降低, 表明该峰所代表的微生物活性被抑制.因甲烷抑制剂只能影响产甲烷菌活性, 据此认为该峰高低可以代表甲烷菌活性.对图 4进行重新观察发现随外加电压升高, -0.3 V处峰的响应电流随之增加, 这说明甲烷菌的活性被外加电压提高.而较高的甲烷菌活性为电辅助厌氧发酵系统快速制取CH4提供了前提条件.另外, 有研究证实阴极电势越高, 越有利于甲烷生成(Zhen et al., 2015).实际测量发现MEC(1.0 V)的阴极电势比MEC(0.4 V)高出了29.4%, 这也是MEC(1.0 V)产甲烷效果优于MEC(0.4 V)的重要原因.观察图 4还发现在添加甲烷抑制剂后, 0 V和-0.1 V处的峰得到加强.在试验条件下尚无法确定其代表的反应和意义, 需要进一步的深入研究.
3.4 外源H2供给从微生物种群结构中嗜氢甲烷菌含量增加可以推测在气体发生过程中应该有H2的发生.从图 5可以看出在AD中没有任何H2积累, MEC(0.4 V)中的H2积累最大量只有0.08 mL, 但MEC(1.0 V)中的H2得到明显积累, 最高时可以达到6.78 mL.H2的存在有利于嗜氢甲烷菌的生存, MEC(1.0 V)中更多H2的生成为维持高比例嗜氢甲烷菌提供了物质基础.
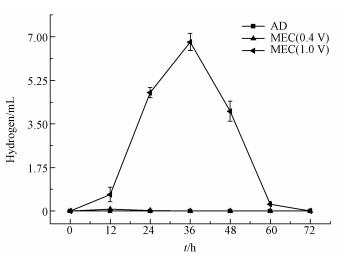 |
| 图 5 反应器中的氢气积累 Fig. 5 Hydrogen accumulation in reactors |
H2的生成可能与微生物代谢乙酸产生H+, 而后其在阴极被还原成H2有关.另外, 有文献报道SUS316不锈钢可以使HPOO42-和H2POO42-脱去H+并释放H2(Da Silva et al., 2004; Munoz et al., 2010).但试验中使用的不锈钢为SUS304, 于是利用线性伏安扫描(linear sweep voltammetry, LSV)对SUS304不锈钢-磷酸缓冲液脱氢进行了研究.
从图 6可以看出SUS304在营养液和氯化钠溶液中分别进行LSV扫描时形成的曲线在形状上存在较大差异.在营养液中, 当不锈钢的电势达到-1.25~-0.8 V时曲线上会存在一个明显的峰, 但在氯化钠溶液中没有观察的该峰的存在.另外, SUS304不锈钢在营养液中扫描时形成的曲线具有与SUS316相同形状(Da Silva et al., 2004), 这表明试验中使用的SUS304不锈钢毡也可引起磷酸盐脱氢并释放H2.而且MEC(0.4 V)和MEC(1.0 V)的阴极电势稳定时达到-0.85 V和-1.1 V, 符合SUS304不锈钢毡使磷酸缓冲液脱氢的要求.因此, 试验所用的电辅助厌氧发酵系统中不锈钢毡-磷酸缓冲液脱氢体系成为另一个氢气可能来源.
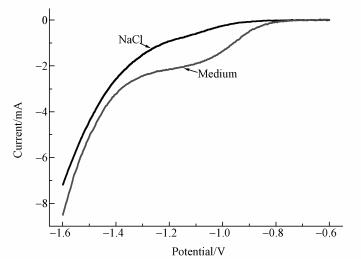 |
| 图 6 SUS304不锈钢毡的LSV扫描曲线 Fig. 6 LSV scanning for SUS304 stainless steel felt |
此外, 由于磷酸属于中强酸, 生成的PO43-和HPO42-又会发生下列水解反应:

|
(1) |

|
(2) |
于是, 发生在不锈钢上的磷酸盐脱氢反应可表达为:
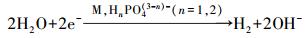
|
(3) |
从反应式可以看出不锈钢和磷酸盐在反应过程中实际起到的是令H2O分解成H2和OH-的催化剂的作用.而且在此过程中不会有O2生成, 不会对厌氧产甲烷菌活性产生影响.但大量OH-的生成会使溶液的pH值升高, 这与试验中观察到的出水pH升高是一致的.与AD出水pH为7.11±0.02相比MEC(0.4 V)和MEC(1.0 V)的出水pH分别升高到7.99±0.07和8.89±0.05.这也间接证明SUS304不锈钢可使磷酸缓冲液脱氢.正是由于电辅助厌氧发酵系统中有H2生成, 使甲烷品质原位提高成为可能.另外, 从试验分析来看, 在施加外加电压后电辅助厌氧发酵系统中的主要产甲烷过程可用方程式(4)、(5)表达.但不能排除乙酸产甲烷过程存在, 但其所占比例可能非常低.
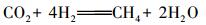
|
(4) |
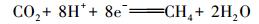
|
(5) |
试验条件下外加电压越高, CH4发生速度和含量提高越显著.MEC(1.0V)中的甲烷含量和生成速度分别达到最高值96.98%和1.18 LMet·d-1·LR-1.但有机物去除速度的最高值却出现在MEC(0.4 V)中, 其数值为167.30 mg·L-1·h-1.另外, 外加电压还能引起微生物菌群结构和活性的变化.试验中随着电压的升高噬氢甲烷菌的含量明显增加(AD:18.04%;MEC(0.4 V):33.11%;MEC(1.0 V):78.87%), 而这与反应系统引起H2发生有密切关系.除部分H2来自于H+还原外, 试验中不锈钢电极使磷酸缓冲液脱氢也是一个H2的来源.此外, 微生物的代谢活性也因适当的外加电压而变的更加活跃, 为有机物快速去除和甲烷快速生成提供了基础.总之, 电辅助厌氧发酵系统能够实现乙酸快速消耗、甲烷快速制备和原位品质提升与外加电压引起微生物活性和种群变化及氢气发生存在直接关系.
5 展望(Advances)虽然研究取得了一定成果, 但还存在值得进一步关注的问题.研究中使用的是典型的碳水化合物和蛋白质发酵的终产物乙酸, 但实际的发酵过程极为复杂, 产物也多种多样.该技术能否对复杂的发酵液起到同样效果, 最终在厌氧发酵产甲烷过程中起到提高甲烷含量作用还需进一步研究.此外, 研究虽然发现外加电压能够引起微生物活性提高, 但其分子机制上不明确, 无法从根本上解释这一现象.这也需要科学工作者在将来利用分子生物学技术从机理上对其进行阐明, 这也将有利于从根本上理解外加电场的作用机理, 为类似研究提供理论基础.再次, 微生物分析不够全面, 没有对阳极微生物和溶液中的微生物做全面细致的分析.只有对反应器中微生物做出详细分析, 才能全面了解外加电场对微生物的影响.同时, 各反应因素, 如不锈钢毡过滤精度、最适外加电压大小等也需要在今后的研究中进一步优化, 最终得到最优反应参数组合.另外, 如何解决pH值剧烈变化, 维持反应环境处在产甲烷菌最适pH值范围也是研究的重要方向.生物电化学技术才刚刚兴起, 还有很多瓶颈和未知领域需要科研工作者努力探索, 而通过系统、细致地研究可以利用该技术对现有技术的不足进行弥补, 发挥各自优势为人类服务.
Aiyuk S, Forrez I, Van Haandel A, et al. 2006. Anaerobic and complementary treatment of domestic sewage in regions with hot climates—A review[J]. Bioresource Technology, 97(17): 2225–2241.
DOI:10.1016/j.biortech.2005.05.015
|
Batlle-Vilanova P, Puig S, Gonzalez-Olmos R, et al. 2014. Assessment of biotic and abiotic graphite cathodes for hydrogen production in microbial electrolysis cells[J]. International Journal of Hydrogen Energy, 39(3): 1297–1305.
DOI:10.1016/j.ijhydene.2013.11.017
|
Cheng S A, Xing D F, Call D F, et al. 2009. Direct biological conversion of electrical current into methane by electromethanogenesis[J]. Environmental Science & Technology, 43(10): 3953–3958.
|
Chookaew T, Prasertsan P, Ren Z J. 2014. Two-stage conversion of crude glycerol to energy using dark fermentation linked with microbial fuel cell or microbial electrolysis cell[J]. New Biotechnology, 31(2): 179–184.
DOI:10.1016/j.nbt.2013.12.004
|
Da Silva S, Basséguy R, Bergel A. 2004. Electrochemical deprotonation of phosphate on stainless steel[J]. Electrochimica Acta, 49(26): 4553–4561.
DOI:10.1016/j.electacta.2004.04.039
|
Demirel B, Scherer P. 2008. The roles of acetotrophic and hydrogenotrophic methanogens during anaerobic conversion of biomass to methane: a review[J]. Reviews in Environmental Science and Bio/Technology, 7(2): 173–190.
DOI:10.1007/s11157-008-9131-1
|
Ding A, Yang Y, Sun G D, et al. 2016. Impact of applied voltage on methane generation and microbial activities in an anaerobic microbial electrolysis cell (MEC)[J]. Chemical Engineering Journal, 283: 260–265.
DOI:10.1016/j.cej.2015.07.054
|
Farhangi S, Ebrahimi S, Niasar M S. 2014. Commercial materials as cathode for hydrogen production in microbial electrolysis cell[J]. Biotechnol Letters, 36(10): 1987–1992.
DOI:10.1007/s10529-014-1565-7
|
Gunsalus R P, Romesser J A, Wolfe R S. 1978. Preparation of coenzyme M analogs and their activity in the methyl coenzyme M reductase system of Methanobacterium thermoautotrophicum[J]. Biochemistry, 17(12): 2374–2377.
DOI:10.1021/bi00605a019
|
Guo X S, Liu J X, Xiao B Y. 2013. Bioelectrochemical enhancement of hydrogen and methane production from the anaerobic digestion of sewage sludge in single-chamber membrane-free microbial electrolysis cells[J]. International Journal of Hydrogen Energy, 38(3): 1342–1347.
DOI:10.1016/j.ijhydene.2012.11.087
|
Hou Y P, Zhang R D, Luo H P, et al. 2015. Microbial electrolysis cell with spiral wound electrode for wastewater treatment and methane production[J]. Process Biochemistry, 50(7): 1103–1109.
DOI:10.1016/j.procbio.2015.04.001
|
Jiang L J, Huang L P, Sun Y L. 2014. Recovery of flakey cobalt from aqueous Co(Ⅱ) with simultaneous hydrogen production in microbial electrolysis cells[J]. International Journal of Hydrogen Energy, 39(2): 654–663.
DOI:10.1016/j.ijhydene.2013.10.112
|
Jiang Y, Su M, Zhang Y, et al. 2013. Bioelectrochemical systems for simultaneously production of methane and acetate from carbon dioxide at relatively high rate[J]. International Journal of Hydrogen Energy, 38(8): 3497–3502.
DOI:10.1016/j.ijhydene.2012.12.107
|
Kumar R, Singh L, Wahid Z A, et al. 2015. Exoelectrogens in microbial fuel cells toward bioelectricity generation: a review[J]. International Journal of Energy Research, 39(8): 1048–1067.
DOI:10.1002/er.v39.8
|
Kuntke P, Sleutels T H J A, Saakes M, et al. 2014. Hydrogen production and ammonium recovery from urine by a microbial electrolysis cell[J]. International Journal of Hydrogen Energy, 39(10): 4771–4778.
DOI:10.1016/j.ijhydene.2013.10.089
|
Liu H, Logan B E. 2004. Electricity generation using an air-cathode single chamber microbial fuel cell in the presence and absence of a proton exchange membrane[J]. Environmental Science & Technology, 38(14): 4040–4046.
|
Logan B E, Hamelers B, Rozendal R, et al. 2006. Microbial fuel cells: methodology and technology[J]. Environmental Science & Technology, 40(17): 5181–5192.
|
Munoz L D, Erable B, Etcheverry L, et al. 2010. Combining phosphate species and stainless steel cathode to enhance hydrogen evolution in microbial electrolysis cell (MEC)[J]. Electrochemistry Communications, 12(2): 183–186.
DOI:10.1016/j.elecom.2009.11.017
|
Natarajan K A. 1992. Effect of applied potentials on the activity and growth of Thiobacillus ferrooxidans[J]. Biotechnology and Bioengineering, 39(9): 907–913.
DOI:10.1002/(ISSN)1097-0290
|
Pham T H, Rabaey K, Aelterman P, et al. 2006. Microbial fuel cells in relation to conventional anaerobic digestion technology[J]. Engineering in Life Sciences, 6(3): 285–292.
DOI:10.1002/(ISSN)1618-2863
|
Sangeetha T, Guo Z, Liu W, et al. 2016. Cathode material as an influencing factor on beer wastewater treatment and methane production in a novel integrated upflow microbial electrolysis cell (Upflow-MEC)[J]. International Journal of Hydrogen Energy, 41(4): 2189–2196.
DOI:10.1016/j.ijhydene.2015.11.111
|
Sasaki K, Sasaki D, Morita M, et al. 2010. Bioelectrochemical system stabilizes methane fermentation from garbage slurry[J]. Bioresource Technology, 101(10): 3415–3422.
DOI:10.1016/j.biortech.2009.12.076
|
Villano M, Ralo C, Zeppilli M, et al. 2016. Influence of the set anode potential on the performance and internal energy losses of a methane-producing microbial electrolysis cell[J]. Bioelectrochemistry, 107: 1–6.
DOI:10.1016/j.bioelechem.2015.07.008
|
Villano M, Scardala S, Aulenta F, et al. 2013. Carbon and nitrogen removal and enhanced methane production in a microbial electrolysis cell[J]. Bioresource Technology, 130: 366–371.
DOI:10.1016/j.biortech.2012.11.080
|
Xu Y, Jiang Y, Chen Y, et al. 2014. Hydrogen production and wastewater treatment in a microbial electrolysis cell with a biocathode[J]. Water Environment Research, 86(7): 649–653.
DOI:10.2175/106143014X13975035525500
|
Yin Q, Zhu X, Zhan G, et al. 2016. Enhanced methane production in an anaerobic digestion and microbial electrolysis cell coupled system with co-cultivation of Geobacter and Methanosarcina[J]. Journal of Environmental Sciences, 42: 210–214.
DOI:10.1016/j.jes.2015.07.006
|
Zeppilli M, Lai A, Villano M, et al. 2016. Anion vs cation exchange membrane strongly affect mechanisms and yield of CO2 fixation in a microbial electrolysis cell[J]. Chemical Engineering Journal, 304: 10–19.
DOI:10.1016/j.cej.2016.06.020
|
Zeppilli M, Villano M, Aulenta F, et al. 2015. Effect of the anode feeding composition on the performance of a continuous-flow methane-producing microbial electrolysis cell[J]. Environmental Science and Pollution Research, 22(10): 7349–7360.
DOI:10.1007/s11356-014-3158-3
|
Zhen G, Kobayashi T, Lu X, et al. 2015. Understanding methane bioelectrosynthesis from carbon dioxide in a two-chamber microbial electrolysis cells (MECs) containing a carbon biocathode[J]. Bioresource Technology, 186: 141–148.
DOI:10.1016/j.biortech.2015.03.064
|
Zinder S H, Anguish T, Cardwell S C. 1984. Selective inhibition by 2-bromoethanesulfonate of methanogenesis from acetate in a thermophilic anaerobic digestor[J]. Applied and Environmental Microbiology, 47(6): 1343–1345.
|
 2017, Vol. 37
2017, Vol. 37


