四氯化碳(Carbon Tetrachloride, CT)是工业生产中一种重要的工业原材料和溶剂, 广泛应用于清洗、化工、制药、皮革等行业(孟亚锋, 2010).生产和使用过程中排放到环境中的CT, 容易通过淋溶作用进入到土壤甚至地下水, 引起土壤和地下水的污染, 进入人体后会损害肝脏, 也有可能致癌(梁峙等, 2014), 已经被美国环境保护局列入“129种优先控制污染物”名单(Hua et al., 1996).CT是地下水污染中最常见的污染物(Ferguson et al., 2000), 已有报道称我国某城市地下水受到CT的污染, 取样井中CT浓度严重超标(国家饮用水质卫生规范要求低于2 μg·L-1(GB5749-2006)), 最高达3909.2 μg·L-1(项玮等, 2009).目前, 环境中CT的污染尤其引人注目, 所以找到高效降解CT的方法使其转化为无毒或低毒性物质迫在眉睫.
目前, 人们对环境中CT的处理开展了广泛的研究, 主要方法包括微生物降解法(王震等, 2017)、金属及双金属还原法(陈静等, 2017; Wang et al., 2009; 张军等, 2015)、吸附法(张满满等, 2013)和空气吹脱法(李浩等, 2014)等.与其它方法相比, 电化学方法具有操作简单、与环境兼容性好等优点(王营茹等, 2011; Cruz-rizo et al., 2017).电化学方法不仅能通过阳极直接氧化(Lakshmipathiraj et al., 2012)或间接氧化(吕江维等, 2013)含氯代有机物, 还能通过阴极直接还原(徐文英等, 2005a)或间接还原(Sun et al., 2014a)含氯有机物.因此, 近年来利用电化学方法处理氯代有机物成为研究热点.Panizza等(2009)研究表明, Ti/IrO2电极具有较好的析氯活性, 通过电化学氧化可以有效地去除多种有机化合物.周鑫江等(2014)使用耐腐蚀较强的Ti/IrO2电极作为阳极, 电化学降解2, 4, 6-三硝基-1, 3, 5-苯三酚, 反应80 min后溶液COD基本去除完全.李慧媛等(2017)使用Ti/RuO2-IrO2阳极和Fe阴极, 电化学降解四溴双酚, 反应60 min后, 四溴双酚可降解97.2%.Li等(2009)选用Ti/IrO2-Pt作为阳极和Fe、Cu和Ti 3种不同材料作为阴极电化学还原硝酸盐, 其中, Fe电极还原硝酸盐的能力强于Cu和Ti电极.而目前利用Ti/IrO2阳极或Fe阴极电化学降解CT尚未有学者进行深入研究.
因此, 本研究以IrO2/Ti为阳极、Fe为阴极, 对CT进行电化学处理, 考察槽电压、极板间距、溶液的初始pH、电解质种类和浓度等因素对CT处理效果的影响, 并对其降解产物进行分析, 初步探讨电化学降解CT的机理, 以期为电化学处理氯代烃提供理论参数.
2 材料与方法(Materials and methods) 2.1 主要仪器和试剂实验试剂:四氯化碳、三氯甲烷、硫酸钠、硝酸钠、碳酸氢钠、氯化钠、硫酸钾、硫酸镁, 以上试剂均为分析纯, 实验用水均为去离子水.
实验仪器:阳极为IrO2/Ti电极(12 cm×6 cm×1 mm), 购自宝鸡市金埠钛镍设备制造有限公司, 阴极为纯Fe电极(12 cm×6 cm×1 mm), 购自河北盛世达金属材料公司;DJ-1型大功率磁力转子搅拌器;FA1004型分析天平;直流稳压电源(0~35 V);电化学工作站(上海辰华仪器公司).
2.2 实验方法电化学降解实验在容积为1.4 L的有机玻璃槽内(图 1)进行.先用1 mol·L-1 H2SO4或NaOH调节pH, 然后加入一定量的电解质, 通入氮气30 min后加入一定量的CT储备液, 使溶液中CT的浓度为1 mg·L-1, 并立即密封.用大功率磁力转子搅拌器搅拌一段时间以混合均匀.通入电流开始实验, 定时取样, 实验过程中保持恒温20 ℃.
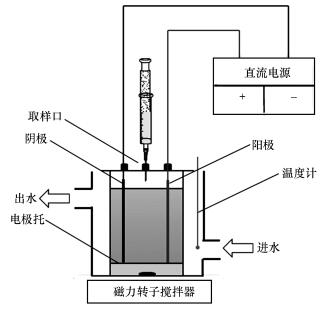 |
| 图 1 电化学反应装置示意图 Fig. 1 Schematic diagram of the electrochemical apparatus |
考察不同槽电压对CT降解的影响时, 在CT浓度为1 mg·L-1, pH=4.5, 电解质为10 mmol·L-1 Na2SO4, 极板间距为50 mm, 温度为20 ℃的条件下, 设置槽电压参数为1、3和5 V进行批实验.
2.2.2 不同极板间距的影响考察不同极板间距对CT降解的影响时, 在CT浓度为1 mg·L-1, pH=4.5, 电压为3 V, 电解质为10 mmol·L-1 Na2SO4, 温度为20 ℃的条件下, 设置极板间距参数为10、30和50 mm进行批实验.
2.2.3 不同初始pH的影响考察不同初始pH对CT降解的影响时, 在CT浓度为1 mg·L-1, 极板间距为50 mm, 电压为3 V, 电解质为10 mmol·L-1 Na2SO4, 温度为20 ℃的条件下, 设置pH=4.5、7.0和9.0进行批实验.
2.2.4 不同电解质种类的影响考察不同电解质种类对CT降解的影响时, 在CT浓度为1 mg·L-1, pH=4.5, 电压为3 V, 极板间距为50 mm, 温度为20 ℃的条件下, 分别设置10 mmol·L-1的Na2SO4、K2SO4、MgSO4、NaCl、NaNO3、NaHCO3进行批实验.
2.2.5 不同电解质浓度的影响考察不同电解质浓度对CT降解的影响时, 在CT浓度为1 mg·L-1, pH=4.5, 电压为3 V, 极板间距为50 mm, 温度为20 ℃的条件下, 分别设置10、30和50 mmol·L-1的Na2SO4进行批实验.
2.3 污染物测定方法利用气相色谱(岛津GC-2014), 采用顶空进样的方法测定降解过程中目标污染物CT和中间产物的浓度.测试条件为:电子捕获检测器(ECD), Rtx-1毛细管色谱柱(美国Restek, 30 m×0.25 mm×0.25 μm), 以高纯氮气为载气, 柱箱升温程序:初始40 ℃保持5 min, 然后以8 ℃·min-1升温到100 ℃后, 再以6 ℃·min-1升温至200 ℃, 保持10 min, 进样口温度220 ℃, 检测器温度320 ℃.
2.4 电化学特性 2.4.1 法拉第电流效率法拉第电流效率(Faraday current efficiency)常用于评价电能消耗效率, 其公式如式(1)所示.
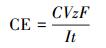
|
(1) |
式中, C为生成产物的浓度(mol·L-1);z为电子转移数量, CT还原为CF需要2个电子;F为法拉第常数(96485 C·mol-1);V为体积(L), 本研究为1.2 L;I为电流(A);t为时间(s).
2.4.2 单位能耗单位能耗计算公式如式(2)所示.
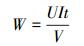
|
(2) |
式中, W为单位能耗(kWh·m-3), U为电压(V);I为电流(A);t为时间(h);V为体积(L).
2.4.3 循环伏安实验电化学工作站扫描循环伏安法曲线时, 工作电极、对电极和饱和甘汞电极(Saturated calomel electrode, SCE)组成三维电极.研究电化学氧化时, 工作电极是IrO2/Ti, 对电极是Fe, 参比电极是SCE.同样, 研究电化学还原时, 工作电极是Fe, 对电极是IrO2/Ti, 参比电极是SCE.支持电解质是10 mmol·L-1 Na2SO4.电极使用之前, 在去离子水中超声15 min, 然后用砂纸打磨Fe电极, 用去离子水冲洗干净.循环伏安法扫描之前, 通入氮气30 min, 赶走水中的氧气和二氧化碳等杂质气体.
3 结果与讨论(Results and discussion) 3.1 槽电压对CT降解的影响槽电压是电化学研究的重要影响因素.为研究不同槽电压对电化学降解CT的影响, 在其他条件相同的情况下, 测试不同槽电压(1、3和5 V)下CT的降解率, 结果如图 2a所示.槽电压为1、3和5 V时, 反应至180 min时CT的去除率分别为55.8%、68.6%和58.8%.
以-ln(C/C0)为纵坐标y, t为横坐标x, 用一级动力学方程对电化学降解CT进行拟合, 结果如表 1所示:槽电压为1、3和5 V的反应速率常数分别为0.00425、0.00639和0.00500 min-1, 设置槽电压为3 V时的反应速率明显高于其它两种情况, 表明槽电压过大和过小都不利于电化学降解CT.这是因为随着槽电压增加, 电化学反应的推动力增大, 加速了电极表面CT的还原速度.但槽电压过高时, 导致在阴、阳两极上发生副反应, 如阴极上的产生的活性氢不发生脱氯反应而相互反应, 发生析氢副反应, 导致CT脱氯效果降低(Zhu et al., 2012).另外, 电极的析氢, 使电极表面和溶液中存在大量气泡, 这些气泡一方面阻碍了电极表面上活性物质的生成, 另一方面使CT不能在电极表面很好的吸附(Xie et al., 2013), 尤其是在较高的电压下, 可以明显地看到阴极表面析出的氢气.
| 表 1 不同槽电压对电化学降解CT的一级动力学拟合参数 Table 1 First order kinetic fitting parameters of electrochemical degradation of CT with different voltages |
为了研究不同电压下, 体系的法拉第电流效率, 本文对相关数据进行了计算, 结果如图 2b所示.槽电压为1 V时, CE相对较高, 增加槽电压, CE反而下降, 并且随着反应时间的延长, CE逐渐下降.其原因可能是, 随着槽电压的增加, 阴极析氢副反应加剧, 从而影响CT在电极表面的吸附(Xie et al., 2013).本研究的CE整体低于用纳米氮化钛掺杂钯/泡沫镍电极电化学还原脱氯2, 4-二氯苯氧乙酸的CE(6.7%)(Sun et al., 2014b), 这可能是由于较低的初始浓度造成的.
如图 2c所示, 电化学降解CT的单位能耗随着反应时间的延长逐渐增大, 并且槽电压越大, 单位能耗越多.反应180 min时, 1、3和5 V电压下的单位能耗分别为0.0125、0.1500和0.7500 kWh·m-3.
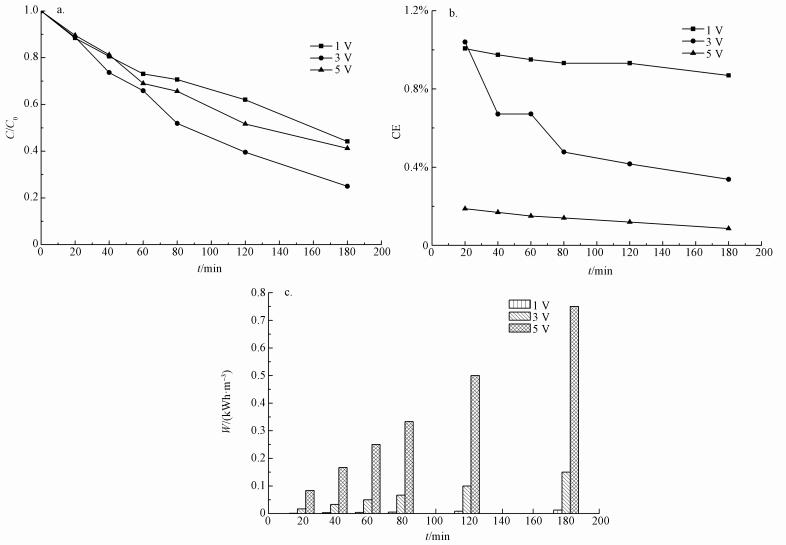 |
| 图 2 不同槽电压对电化学降解CT的影响(a)及不同槽电压的法拉第电流效率(b)和单位能耗(c) (C0 =1 mg·L-1, pH=4.5, 电解质为10 mmol·L-1 Na2SO4, 极板间距50 mm, 温度20 ℃) Fig. 2 Effects of different voltages on electrochemical degradation of carbon tetrachloride(a) and Faraday current efficiency(b) and energy consumption(c) of different voltages |
电极极板间距是电化学实验的重要影响因素, 本研究设计的极板间距分别为10、30和50 mm, 不同极板间距对CT的降解率的影响结果如图 3所示.从图中可以看出, 当极板间距由10 mm增加到50 mm时, CT的降解率也随之增加.极板间距为10 mm时, CT在反应至3 h时的降解率为53.3%, 极板间距为30 mm时, CT的降解率为61.5%, 极板间距增加到50 mm时, CT的降解率提高到68.6%.
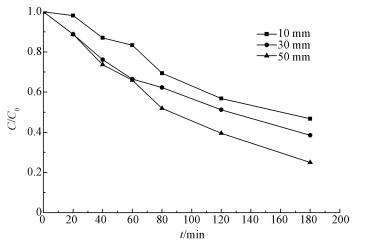 |
| 图 3 不同极板间距对电化学降解CT的影响(C0=1 mg·L-1, pH=4.5, 电压3 V, 电解质为10 mmol·L-3 Na2SO4, 温度20 ℃) Fig. 3 Effects of different distances of electrodes on electrochemical degradation of carbon tetrachloride |
极板间距对电化学降解的影响主要体现在电解体系中的传质过程, 当极板间距过小时, 两平行电极对其之间液体的粘滞作用相对增强, 使得极板间液体湍流度下降, 从而导致CT在其间的传质推动力下降, 由此影响了CT的降解率;而随着极板间距的增加, 极板表面的粘滞作用对其间的液体湍流度大小的影响程度呈下降趋势(叶舒帆等, 2011).另外, 极板间距过小, 会使电极钝化, 溶液的浓差极化很严重, 致使CT的降解率下降(Zhang et al., 2006).
3.3 初始pH对CT降解的影响为研究不同初始pH对降解CT的影响, 在其他条件相同的情况下测试了不同初始pH(4.5、7.0和9.0)时CT的降解率, 结果如图 4所示.由图可知, 不同初始pH对CT的降解影响并不明显, 初始pH为4.5时, CT的降解率为68.6%, 初始pH为9.0时, CT的降解率也可以达到54.9%.初始pH对电化学降解CT没有显著的影响, 这与Xu等(2007)的研究成果相吻合.但在初始条件为酸性和碱性的情况下, CT的降解效果略优于中性条件.这可能是由于:①在酸性条件下, 较多的氢离子容易产生活性氢, 有利于CT在阴极发生还原反应, 碱性条件下, 活性氢产生相对较困难, CT的脱氯反应难以进行(徐文英等, 2005b; 魏学锋等, 2014);②中性条件下, 随着反应的进行, 阴极表面生成了一层氧化膜, 阻碍了反应的进行, 而在酸性和碱性情况下, 阴极表面不易形成氧化膜.
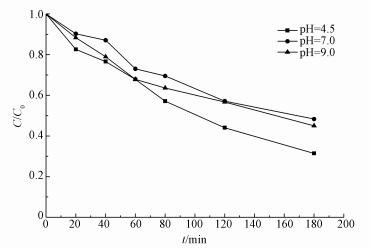 |
| 图 4 不同pH对电化学降解CT的影响 Fig. 4 Effects of different pH on electrochemical degradation of carbon tetrachloride |
为了评价水中常见化学物质存在时IrO2/Ti-Fe降解CT的性能, 本研究选用Na2SO4、K2SO4、MgSO4、NaCl、NaNO3、NaHCO3作为电解质来考察不同阳离子和阴离子对CT降解的影响, 结果如图 5所示.由图可知, 不同阳离子为电解质时, CT降解率的大小顺序为:Na+ > K+> Mg2+;不同阴离子为电解质时, CT降解率的大小顺序为:SO42-> NO3-> Cl- > HCO3-.
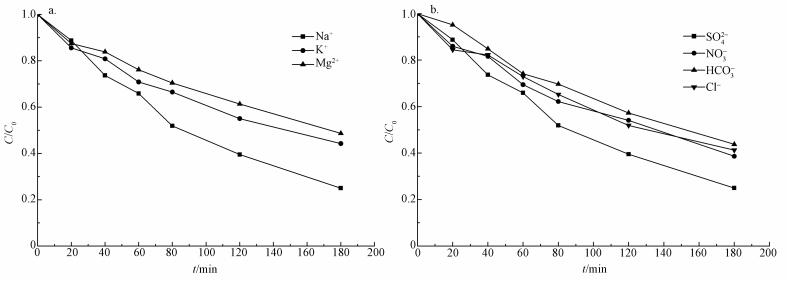 |
| 图 5 不同阳离子(a)和阴离子(b)对电化学降解CT的影响 Fig. 5 Effects of different cations (a) and anions (b) on electrochemical degradation of carbon tetrachloride |
选用10 mmol·L-1 K2SO4和MgSO4为电解质时, CT的降解率略低于以10 mmol·L-1Na2SO4为电解质时, 其原因可能是阳离子的导电性存在差异, 在相同的电压下, 反应电流大小不一样所导致的.
当选用NaNO3为电解质时, CT的降解率为61.4%, 低于以Na2SO4为反应电解质时的降解率(68.6%).这可能是由于NO3-在阴极发生的还原反应(Li et al., 2009)与CT在阴极发生的还原反应相互竞争, 同时进一步间接验证了电化学降解CT的降解机理为电化学还原降解.选用NaCl作为电解质时, CT的降解率为58.7%, 低于以Na2SO4为电解质时的降解率.在Cl-存在的情况下, Cl-可以在阳极生成Cl2, Cl2和H2O反应, 生成HClO等活性氯(Li et al., 2009), 但并没有增加CT的降解率, 表明活性氯可能不能氧化CT.与Na2SO4、NaNO3和NaCl相比, 选用10 mmol·L-1NaHCO3作为电解质时, CT的降解率较低, 这可能是由于HCO3-加入后, 增加了反应溶液的pH(Chen et al., 2017), 从而不利于产生活性氢.
3.5 不同电解质浓度对CT降解的影响为研究不同Na2SO4浓度对降解CT的影响, 测试了不同Na2SO4浓度(10、30和50 mmol·L-1)时的降解率, 结果如图 6所示.Na2SO4浓度为10 mmol·L-1时, CT的去除率为68.6%, Na2SO4浓度为30 mmol·L-1时, CT的去除率为57.6%, Na2SO4浓度为50 mmol·L-1时, CT的去除率为59.7%.
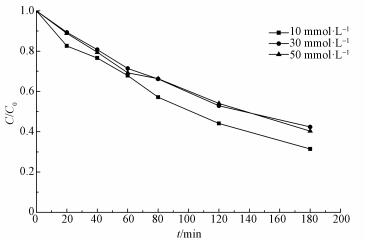 |
| 图 6 不同Na2SO4浓度对电化学降解CT的影响 Fig. 6 Effects of different Na2SO4 concentrations on electrochemical degradation of carbon tetrachloride |
由实验结果可知, 随着Na2SO4浓度的增加, CT的降解率并没有随之上升.原因可能是:①过电流效应导致极化, 降低了电流效率(刘开成, 2008);②增强了溶液的导电能力, 电流增大, 活性氢不能有效利用, 副反应加剧, 析氢和析氧的情况较严重(He et al., 2011).
3.6 降解机理和途径由图 7a可以看出, 阳极作为工作电极时, 添加CT前后, 扫描的循环伏安法曲线变化不大.而从图 7b可明显看出, 阴极作为工作电极时, 添加CT前后, 扫描的循环伏安法曲线变化较大, 加入CT之后, 扫描的正负电流明显增大, 可能是CT在阴极发生电化学还原反应导致的, 这种现象与Zhao等(2015)研究电化学还原CO2的CV曲线相似.
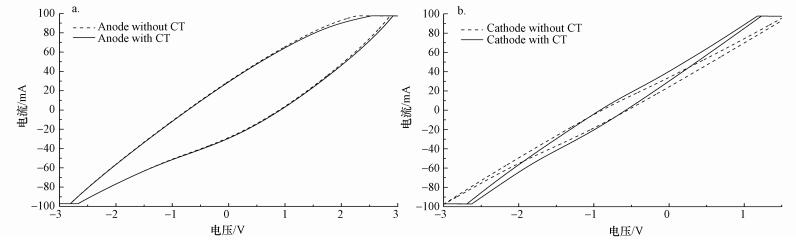 |
| 图 7 电化学循环伏安法曲线(a.阳极为工作电极, b.阴极为工作电极;C0=1 mg·L-1, 极板间距50 mm, 电解质为10 mmol·L-1Na2SO4, 25 ℃, 扫描速度100 mV·s-1) Fig. 7 Eletrochemical cyclic voltammetry curve |
由图 8可以明显看出:在CT初始浓度为1 mg·L-1、pH为4.5、10 mmol·L-1 Na2SO4、20 ℃的条件下, 不放置电极(Control 1), CT的浓度几乎不变.加入电极, 不通电时(Control 2), CT的浓度随着时间的增加而逐渐减少, 在180 min时, CT减少27.8%, 这可能是CT吸附在阴、阳电极表面导致的.加入电极并通电后, CT的浓度随着时间的延长而降低, 氯仿(Chloroform, CF)和二氯甲烷(Dichloromethane, DCM)的浓度逐渐增加.电化学反应180 min后, 1 mg·L-1的CT去除68.6%, 生成CF和DCM浓度分别为0.38 mg·L-1和0.11 mg·L-1.碳质量守恒表明, 还原脱氯和电极表面的吸附是电化学去除CT的主要途径.
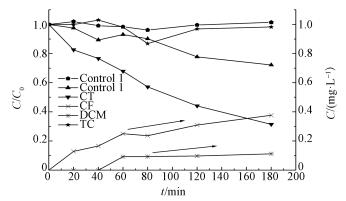 |
| 图 8 CT、CF和DCM的浓度变化及碳质量守恒(C0=1 mg·L-1, pH=4.5, 极板间距50 mm, 电解质为10 mmol·L-1 Na2SO4, 槽电压3 V, 温度20 ℃) Fig. 8 concentration of CT, CF and DCM and carbon mass conservation |
根据循环伏安法曲线和反应过程中CT、CF、DCM的浓度变化及碳守恒可以推断出电化学降解CT的机理是CT的电化学还原脱氯, 而非电化学氧化, 其中, DCM为最终降解产物.电化学还原降解CT的机理为:通过阴极电解水产生具有强还原性的活性氢(H·)(Wang et al., 2012)攻击吸附在电极表面的CT, 并导致碳氯键断裂和氢原子加成, 具体反应如下所示:
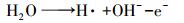
|
(1) |
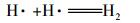
|
(2) |
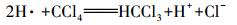
|
(3) |
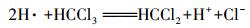
|
(4) |
1) IrO2/Ti-Fe电极处理CT(1 mg·L-1)的最佳降解条件为:槽电压3 V、极板间距50 mm、初始pH=4.5、10 mmol·L-1 Na2SO4, 3 h内CT去除率为68.6%, 且电化学降解CT遵循一级动力学方程.
2) 循环伏安曲线结果显示, Fe电极对CT具有较好的还原性能, 而CT在IrO2/Ti阳极上没有发生氧化反应.
3) 机理研究表明, 阴极还原脱氯是CT降解的主要途径, 检出的主要产物有CF和DCM.而CF和DCM仍具有一定的毒性, 对环境依然有害, 因此, 还需进一步研究.
Chen H, Zhang Z, Feng M, et al. 2017. Degradation of 2, 4-dichlorophenoxyacetic acid in water by persulfate activated with FeS (mackinawite)[J]. Chemical Engineering Journal, 313: 498–507.
DOI:10.1016/j.cej.2016.12.075
|
陈静, 陈海, 金歆, 等. 2017. 纳米零价铁降解水中四氯化碳的试验研究[J]. 环境科学学报, 2017, 37(2): 610–616.
|
Cruz-Rizo A, Gutie'rrez-Granados S, Salazar R, et al. 2017. Application of electro-Fenton/BDD process for treating tannery wastewaters with industrial dyes[J]. Separation and Purification Technology, 172: 296–302.
DOI:10.1016/j.seppur.2016.08.029
|
Ferguson J F, Pietari J M H. 2000. Anaerobic transformations and bioremediation of chlorinated solvents[J]. Environmental Pollution, 107(2): 209–215.
DOI:10.1016/S0269-7491(99)00139-6
|
He Z, Zhan L, Wang Q, et al. 2011. Increasing the activity and stability of chemi-deposited palladium catalysts on nickel foam substrate by electrochemical deposition of a middle coating of silver[J]. Separation and Purification Technology, 80(3): 526–532.
DOI:10.1016/j.seppur.2011.06.007
|
Hua I, Hoffmann M R. 1996. Kinetics and mechanism of the sonolytic degradation of CCl4: Intermediates and byproducts[J]. Environmental Science & Technology, 30(3): 864–871.
|
Lakshmipathiraj P, Bhaskar Raju G, Sakai Y, et al. 2012. Studies on electrochemical detoxification of trichloroethene (TCE) on Ti/IrO2-Ta2O5 electrode from aqueous solution[J]. Chemical Engineering Journal, 198-199: 211–218.
DOI:10.1016/j.cej.2012.05.092
|
Li M, Feng C, Zhang Z, et al. 2009. Efficient electrochemical reduction of nitrate to nitrogen using Ti/IrO2-Pt anode and different cathodes[J]. Electrochimica Acta, 54(20): 4600–4606.
DOI:10.1016/j.electacta.2009.03.064
|
Li M, Feng C, Zhang Z, et al. 2009. Simultaneous reduction of nitrate and oxidation of by-products using electrochemical method[J]. Journal of Hazardous Materials, 171(1/3): 724–730.
|
梁峙, 韩宝平, 马捷, 等. 2014. 双金属介质反应井对地下水四氯化碳污染治理[J]. 环境科学与技术, 2014, 37(11): 141–146.
|
项玮, 韩宝平, 李超. 2009. 某水源地四氯化碳人体健康风险评价动态分析[J]. 环境科学与技术, 2009, 32(2): 175–178.
|
李浩, 万吉昌, 马卫江, 等. 2014. 微孔曝气吹脱去除水中四氯化碳试验研究[J]. 城镇供水, 2014(3): 34–37.
|
李慧媛, 高丁, 史江红, 等. 2017. Ti/RuO2-IrO2电极电化学方法降解溶液中TBBPA及其降解机理探究[J]. 环境科学学报, 2017, 37(2): 642–650.
|
刘开成. 2008. 气态挥发性有机物的电化学降解研究[D]. 上海: 上海交通大学
http://cdmd.cnki.com.cn/Article/CDMD-10248-2008054664.htm |
吕江维, 冯玉杰, 曲有鹏, 等. 2013. BDD电极电催化降解苯酚废水的研究[J]. 水处理技术, 2013, 39(10): 53–58.
DOI:10.3969/j.issn.1000-3770.2013.10.012 |
孟亚锋. 2010. 零价铁还原降解四氯化碳废水研究[D]. 杭州: 浙江大学. 133
http://cdmd.cnki.com.cn/Article/CDMD-10335-2010166363.htm |
Panizza M, Cerisola G. 2009. Direct and mediated anodic oxidation of organic pollutants[J]. Chemical Reviews, 109(12): 6541–6569.
DOI:10.1021/cr9001319
|
Sun C, Baig S A, Lou Z, et al. 2014. Electrocatalytic dechlorination of 2, 4-dichlorophenoxyacetic acid using nanosized titanium nitride doped palladium/nickel foam electrodes in aqueous solutions[J]. Applied Catalysis B:Environmental, 158-159: 38–47.
DOI:10.1016/j.apcatb.2014.04.004
|
Wang H, Bian Z, Lu G, et al. 2012. Preparation of multifunctional gas-diffusion electrode and its application to the degrading of chlorinated phenols by electrochemical reducing and oxidizing processes[J]. Applied Catalysis B:Environmental, 125: 449–456.
DOI:10.1016/j.apcatb.2012.06.019
|
Wang X, Chen C, Chang Y, et al. 2009. Dechlorination of chlorinated methanes by Pd/Fe bimetallic nanoparticles[J]. Journal of Hazardous Materials, 161(2/3): 815–823.
|
王营茹, 陆晓华, 林莉. 2011. 阴极材料对模拟土壤淋洗液中六氯苯电化学降解的影响[J]. 环境科学与技术, 2011, 34(9): 92–94.
|
王震, 李群, 王帆, 等. 2017. 白腐真菌对四氯化碳的降解及吸附性能研究[J]. 环境科学与技术, 2017, 40(2): 150–157.
|
魏学锋, 孙治荣. 2014. Pd/Ti电极上2, 4, 6-三氯酚还原脱氯:条件优化及降解途径[J]. 中国环境科学, 2014, 34(9): 2285–2291.
|
Xie W, Yuan S, Mao X, et al. 2013. Electrocatalytic activity of Pd-loaded Ti/TiO2 nanotubes cathode for TCE reduction in groundwater[J]. Water Research, 47(11): 3573–3582.
DOI:10.1016/j.watres.2013.04.004
|
Xu W Y, Gao T Y. 2007. Dechlorination of carbon tetrachloride by the catalyzed Fe-Cu process[J]. Journal of Environmental Sciences, 19(7): 792–799.
DOI:10.1016/S1001-0742(07)60133-8
|
徐文英, 高廷耀, 周荣丰, 等. 2005a. 氯代烃在铜电极上的电还原特性和还原机理[J]. 环境科学, 2005a, 26(4): 51–54.
|
徐文英, 高廷耀, 周荣丰, 等. 2005b. 氯代烃在铜电极上的电还原特性和pH值的影响[J]. 环境化学, 2005b, 24(3): 318–321.
|
叶舒帆, 胡筱敏, 和英滇, 等. 2011. 非贵金属催化还原水中的硝酸盐氮[J]. 环境化学, 2011, 30(10): 1711–1717.
|
Zhang H, Zhang D, Zhou J. 2006. Removal of COD from landfill leachate by electro-Fenton method[J]. Journal of Hazardous Materials, 135(1/3): 106–111.
|
张军, 白孝康, 李晶晶, 等. 2015. 超声协同下镍铁双金属化合物催化降解水溶液中的四氯化碳[J]. 环境工程学报, 2015(4): 1693–1697.
DOI:10.12030/j.cjee.20150428 |
张满满, 肖昕, 朱雪强, 等. 2013. 活性炭去除水中四氯化碳的影响因素试验[J]. 中国科技论文, 2013, 8(9): 902–905.
|
Zhao C, Yin Z, Wang J. 2015. Efficient electrochemical conversion of CO2 to HCOOH using Pd-polyaniline/CNT nanohybrids prepared in situ[J]. Chem Electro Chem, 2(12): 1974–1982.
|
周鑫江, 王根, 胡伟武, 等. 2014. 电化学氧化处理废水中的2, 4, 6-三硝基-1, 3, 5-苯三酚[J]. 工业水处理, 2014, 34(10): 22–25.
DOI:10.11894/1005-829x.2014.34(10).022 |
Zhu K, Baig S A, Xu J, et al. 2012. Electrochemical reductive dechlorination of 2, 4-dichlorophenoxyacetic acid using a palladium/nickel foam electrode[J]. Electrochimica Acta, 69: 389–396.
DOI:10.1016/j.electacta.2012.03.038
|
 2017, Vol. 37
2017, Vol. 37


