2. 华南理工大学华南协同创新研究院, 东莞 523808
2. South China Institutes Collaborative Innovation, South China University of Technology, Dongguan 523808
全氟辛酸(PFOA)是一种典型的持久性有机污染物, 具有较强的化学稳定性、热稳定性和高表面活性(Poothong et al., 2012), 广泛应用于工业生产和生活领域, 如表面活性剂、阻燃剂、纺织、造纸和化妆品的生产等(王莉等, 2015).近年来, 在环境介质(Post et al., 2012;Dinglasanpanlilio et al., 2014)、生物体(马佳乐等, 2015)及人体(孙博等, 2017;Wu et al., 2015)均检测到PFOA的存在.由于PFOA含有高能C—F键, 且在其分子结构中没有活性基团, 使其具有环境持久性和生物累积性, 已经引起了人们的广泛关注(Huang et al., 2016;Ludwicki et al., 2014).
根据文献报道, 全氟辛酸的降解方法主要集中在生物降解、超声热解、高级氧化技术、电化学氧化、化学还原、硫酸自由基氧化和光化学降解等(梁小燕等, 2013).生物法利用微生物的代谢过程降解PFOA, 降解周期较长且不彻底, 某些降解产物还具有毒性(Remde et al., 1996;Liou et al., 2010).超声波热解法降解高效、快速, 但对设备要求较高, 能耗大(Cheng et al., 2010;Lin et al., 2016).电化学氧化相比其他氧化法, 优势在于可控性高、操作简易、处理效率高, 但电化学设备对电极材料要求高, 运行费用昂贵, 仅适用于小水量的废水处理(Lin et al., 2012).全氟辛酸的C—F键键能大, F具有很高的电负性, 具有接受电子的趋势, 在极端条件下可以实现还原降解(Park et al., 2009;Gu et al., 2016).以硫酸自由基为核心的新型高级氧化技术, 能完全矿化持久性难降解有机物PFOA.但体系对反应pH要求较为严格, 反应后会产生大量的SO42-, 造成二次污染(Lee et al., 2010;Qian et al., 2015).相对于上述降解技术, 光化学体系相对温和可控, 但脱氟过程缓慢且效率不高(Liang et al., 2016;Wang et al., 2011), 是阻碍其发展的关键因素.因此, 寻求条件温和、高效的PFOA光催化降解技术成为环境科学领域研究的热点.
PFOA的吸收光谱与紫外光谱有部分重叠, 当入射波长<200 nm时, PFOA可以直接光解.有研究表明, PFOA在185 nm的紫外灯辐射下显著光解, 120 min内降解率高于90%, 脱氟率高于20%, 而在254 nm紫外灯(UV)辐射下PFOA的降解极其微弱(Cao et al., 2010).Hori等(2004)研究发现, 紫外灯单独照射下PFOA的降解效果缓慢, 不能将PFOA完全矿化, 脱氟率低;而在磷钨酸(HPW)作为催化剂的情况下, 反应24 h后PFOA完全降解, 48 h后脱氟效果达到97%.磷钨酸兼具强酸性和氧化性, 在有机催化反应中腐蚀性小、活性高、污染低, 与真空紫外(VUV)协同作用能有效提高PFOA的脱氟效率.然而, 磷钨酸比表面积小(<10 m2·g-1)(Ma et al., 2017)、热稳定性差、易溶于极性溶剂, 且回收使用困难.因此, 最新的研究多集中于负载型的磷钨酸(Bhorodwaj et al., 2011;Sawant et al., 2007).
双模型介孔二氧化硅(BMMs)具有巨大的比表面积和独特的孔结构, 可实现磷钨酸的固载化, 克服磷钨酸直接作为催化剂比表面积小和污染物在孔道内扩散困难等缺点, 保证PFOA与活性位点的充分接触, 且负载磷钨酸后BMMs的结构不改变(戴群和, 2012).因此, 本文选择以BMMs负载磷钨酸, 建立VUV/BMMs/HPW体系降解PFOA, 考察PFOA初始浓度、催化剂投加量和初始pH值等因素对VUV/HPW/BMMs体系降解PFOA的影响, 并通过响应曲面法(Response Surface Method, RSM)分析体系降解PFOA过程中各影响因素间的相互作用效果, 确定关键影响因素和最佳边界反应条件, 优化体系对PFOA的脱氟条件, 并提出运行调控策略.
2 材料与方法(Materials and methods) 2.1 试剂与仪器试剂:全氟辛酸(PFOA, 96%)购自美国Alfa公司;磷钨酸(H3PW12O40)购自天津市百世化工有限公司;十六烷基三甲基溴化铵(CTAB)、正硅酸乙酯(TEOS)、氨水;无水碳酸钠(Na2CO3)、盐酸(HCl)、氢氧化钠(NaOH)等购自广州化学试剂厂;以上试剂均为分析纯.实验用水为超纯水, 由Millipore Milli-Q超纯水系统提供.
仪器:ML-902型型恒温磁力搅拌器;真空紫外灯(广州三晟环保科技有限公司, 发射185+254 nm紫外光, 其中, 185 nm的VUV占12%~15%);ICS-1000型离子色谱(美国戴安公司);PHS-25型pH仪(上海雷磁仪器厂);恒温控制箱(美国STIK公司).
2.2 实验装置采用自制光催化反应器进行PFOA降解实验(图 1), 采用8 W的真空紫外灯为光源, 外有石英玻璃套管, 置于500 mL的圆柱形聚四氟乙烯反应器中, 反应器置于一个恒温磁力搅拌器上, 反应过程中磁力搅拌器持续搅拌, 整个装置置于恒温控制箱控制反应温度.
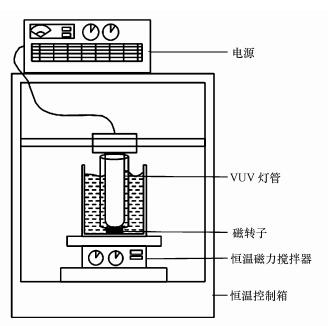 |
| 图 1 光催化反应装置示意图 Fig. 1 Photocatalytic degradation device |
通过浸渍法制备HPW/BMMs催化剂(戴群和, 2012), 具体步骤如下:称量5.2 g CTAB溶于蒸馏水, 搅拌至CTAB完全溶解, 再缓慢加入16.0 mL TEOS, 随后快速加入4.8 mL氨水(25%), 继续搅拌至溶液变成白色凝胶.将白色凝胶抽滤, 并用蒸馏水充分洗涤, 120 ℃干燥, 550 ℃焙烧除去有机模板剂制得BMMs.再称取一定量磷钨酸溶于10 mL去离子水, 加入BMMs后用硝酸调节溶液pH小于1, 搅拌12 h, 110 ℃干燥过夜, 所得固体经研磨充分后, 于氮气中200 ℃温度下焙烧2 h, 得到HPW/BMMs催化剂.
2.4 实验及分析方法将配置的PFOA溶液置于圆柱形聚四氟乙烯反应器中, 加入催化剂HPW/BMMs, 用0.1 mol·L-1 NaOH和HCl调节pH, 在恒温磁力搅拌器连续搅拌下, 开启紫外灯进行光降解反应, 反应温度由恒温培养箱调控, 在设定的时间间隔内取样, 用离子色谱法检测水样中的F-浓度, 以F-浓度来表征PFOA的降解情况.离子色谱仪(Dionex, ICS-90)工作条件:手动进样器(进样量1 mL);色谱柱AS4A-SC 4X 250 mm;流动相为Na2CO3(9 mmol·L-1), 流速1 mL·min-1;柱温箱柱温为40 ℃;带有抑制器的电导率检测器;扫描电流为45 mA.氟离子标准曲线为:y=0.0.1039x (R2=0.9999), 定量F-的峰面积计算溶液中F-浓度.
3 结果与讨论(Results and discussion) 3.1 VUV、VUV/HPW、VUV/HPW/BMMs体系对PFOA的降解效果不调节pH值, 反应温度通过恒温培养箱控制为25 ℃, 分别采用VUV、VUV/BMMs、VUV/HPW、VUV/HPW/BMMs体系降解10 mg·L-1 PFOA溶液, 其中, BMMs、HPW和HPW/BMMs投加量均为0.2 g·L-1, 脱氟效果见图 2.由图 2可知, 随着紫外灯辐照时间增加, 各体系脱氟率逐渐增大.反应进行4 h后, 单独的VUV体系脱氟率为18.7%, 略高于VUV/BMMs体系, BMMs对体系的作用可忽略不计, 对F-亦无吸附.加入HPW/BMMs后, 体系对PFOA的脱氟率显著提升至50.2%, 远优于VUV/HPW体系.本研究中紫外灯发射的VUV占整个光谱范围的12%~15%, 体系光能以254 nm UVC光为主, HPW和HPW/BMMs的加入均提高了体系的光能利用率, 增加了光解途径, HPW/BMMs具有巨大的比表面积和双孔道结构, 保证了PFOA与活性位点的充分接触.在紫外光照射下, 除PFOA直接光解外, 处于基态的[PW12O40]3-转化为激发态的[PW12O40]3-*, [PW12O40]3-*夺取PFOA羧基上的电子使C7F15与COOH之间的碳碳键断裂, 生成全氟自由基.全氟自由基一方面与氧气反应脱除一个CF2, 继续重复上述步骤至PFOA完全脱氟矿化;另一方面, 水解脱氟形成短链全氟羧酸, 短链全氟羧酸重复PFOA降解步骤完成脱氟.产生的PW12O404-阴离子与氧气反应再生成[PW12O40]3-, 实现反应的持续进行(Hori et al., 2004).
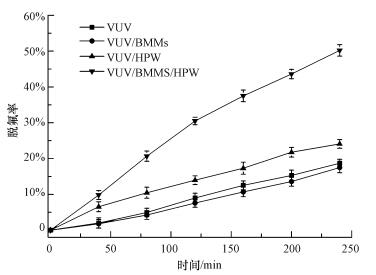 |
| 图 2 VUV、VUV/BMMs、VUV/HPW、VUV/HPW/BMMs体系脱氟效果比较 Fig. 2 Photochemical defluorination of PFOA under VUV, VUV/BMMs, VUV/HPW and VUV/HPW/BMMs system |
在反应温度25 ℃下, 不调节初始pH, 反应氛围为空气, HPW/BMMs投加量为0.2 g·L-1, 研究VUV/HPW/BMMs体系对不同浓度(10~50 mg·L-1)PFOA的脱氟效果, 结果如图 3所示.VUV/HPW/BMMs体系对各浓度PFOA均有明显的脱氟作用.反应4 h后, 脱氟率随着PFOA浓度的增大而减小, 在5、10、20、30、40 mg·L-1浓度下的脱氟率分别为52.1%、50.2%、44.3%、33.5、29.8%.从光化学原理可知, 在紫外灯功率恒定的条件下, 产生的光密度恒定.在PFOA浓度较低时, 丰富的光子量能满足PFOA的直接光解和光催化降解, 在较高的PFOA浓度下, 可能会出现光子限制条件, 产生的光子量无法满足过量PFOA的直接光解和光催化降解, 导致PFOA的脱氟率降低(梁小燕等, 2013).
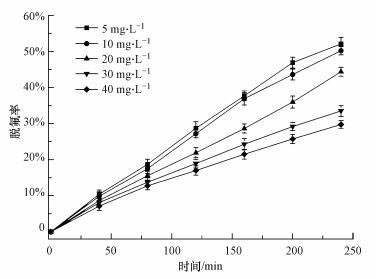 |
| 图 3 PFOA初始浓度对VUV/HPW/BMMs体系脱氟的影响 Fig. 3 Effect of initial PFOA concentration on defluorination in VUV/HPW/BMMs system |
反应温度为25 ℃, 初始pH值未调, PFOA初始浓度为10 mg·L-1, 考察不同HPW/BMMs投加量(0.1~1.0 g·L-1)对PFOA脱氟的影响, 结果如图 4所示.从图 4可见, VUV/HPW/BMMs体系对PFOA的脱氟率随着HPW/BMMs投加量的增大呈先增大后减小的趋势.在HPW/BMMs投加量为0.2 g·L-1时, PFOA脱氟率达到最大值50.5%.在HPW/BMMs浓度较低时(<0.2 g·L-1), 随着催化剂投加量的增加, 催化位点增多, 脱氟率相应增大.当HPW/BMMs投加量超过0.2 g·L-1, HPW/BMMs中磷钨酸分子间相互吸附作用强, 降低了磷钨酸吸收光生空穴的效率, 阻碍了强氧化性自由基[PW12O40]3-*的产生(黄志华, 2015).同时, HPW/BMMs投加量增加, 对光反射增强, 光吸收减少, 光解效率下降, 故PFOA脱氟率随着HPW/BMMs投加量增加反而下降(武钏, 2007).综上所述, 在VUV/HPW/BMMs体系中催化剂投加量存在饱和点, 过高的HPW/BMMs投加量反而对PFOA降解不利.
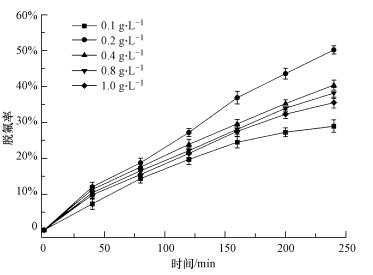 |
| 图 4 HPW/BMMs投加量对体系脱氟的影响 Fig. 4 Effect of HPW/BMMs dosage on defluorination in VUV/HPW/BMMs system |
在温度为25 ℃, 催化剂投加量为0.2 g·L-1时, 用0.1 mol·L-1的HCl和NaOH调节PFOA溶液的pH值分别为2、3、4、5、7, 探究pH对VUV/HPW/BMMs体系脱氟的影响, 结果如图 5所示.从图 5可知, 在pH=2和pH=7时几乎无脱氟效果, 而初始pH为3~5时PFOA脱氟率较大, pH = 4时脱氟率效果最佳, 反应4 h, 脱氟率达到37.9%, 表明酸性环境有利于PFOA在VUV/HPW/BMMs体系中脱氟.主要原因如下:一方面, HPW/BMMs降解PFOA以PW12O403-形式进行, 强酸环境不利于磷钨酸分子分解为离子, 而当pH值升高(>3.5), 磷钨酸会逐步分解而逐渐丧失其催化作用, 中性条件也不利于降解反应(黄志华, 2015).另一方面, 在酸性条件下, PFOA主要以C7F15COOH分子态形式存在, 中性和碱性条件下则主要以C7F15COO-态形式存在.PFOA及中间产物为分子态时有利于VUV光解, 实现更高的脱氟效率.PFOA的pKa值约为2.8, 所以当体系pH小于2.8时, PFOA以质子化的形式存在, 此时PFOA的脱羧过程会受阻(梁小燕等, 2013).因此, 体系的最佳初始pH值为3~4.
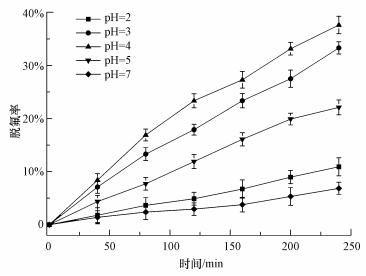 |
| 图 5 初始pH值对体系脱氟的影响 Fig. 5 Effect of initial pH on defluorination in VUV/HPW/BMMs system |
采用中心复合设计, 选择PFOA初始浓度、HPW/BMMs投加量和初始pH 3个因素为自变量, 分别以A、B、C表示, 进行响应面回归分析, 实验因素水平及编码见表 1.以脱氟率Y为响应值, 中心点为5个, 共进行17组试验, 试验设计方案及结果如表 2所示.
| 表 1 响应面模型的变量及其范围 Table 1 Variables and their scope of response surface model |
| 表 2 中心复合设计与实验结果 Table 2 Central composite experiment and results |
进行中心复合设计试验后, 运用Design Expert 8.0.6对不同水平中的脱氟率进行三元二次曲面方程拟合, 结果如下:
Y= 49.58-2.02A+3.39B-8.26C+0.62AB-0.88AC+ 1.15BC-1.18A2+0.04B2-21.15C2
ANOVA分析结果如表 3所示, 模型F值为653.9, p<0.0001, 表明回归效果较好;拟合模型信噪比参数(AP)值为73.8, 表示模型有足够的信号;R2=0.9988, 修正Radj2=0.9973, 表明预测模型拟合程度高.从回归方程系数可知, A、C、C2是主要的影响项, 体系影响因子排序为pH>PFOA初始浓度>HPW/BMMs投加量.pH值主要影响PFOA和磷钨酸的存在形式, 从而影响体系的催化活性, 结合pH因素实验可知, PFOA溶液在pH为3~4时有利于VUV/HPW/BMMs体系降解PFOA, 在实际应用中不必对原水再进行酸化处理.
| 表 3 回归方程方差分析 Table 3 Variance analysis of regression equation |
各因素项方差分析结果如表 4所示.从表 4可知, 3个影响因子的p值均小于0.0001, 3个影响因子的作用效果显著.此外, AC、BC对应的p<0.05, 表明PFOA初始浓度与pH值的交互作用及HPW/BMMs与初始pH的交互作用对目标函数影响显著.
| 表 4 各因素项的方差分析 Table 4 Variance analysis of variables |
图 6为初始pH和初始浓度对脱氟率的影响曲面图, 从左至右HPW/BMMs投加量依次为100、200、300 mg·L-1.由图 6可知, PFOA脱氟率与HPW/BMMs投加量呈正相关关系.当催化剂投加量一定, 脱氟率随着pH值增大先升高, 此pH范围内PFOA初始浓度的增大引起体系脱氟率降低, 但当pH值偏离最佳区域, 脱氟率急速下降, PFOA的初始浓度对脱氟率的作用减弱.初始pH和HPW/BMMs投加量对脱氟率的响应曲面图如图 7所示, 从左至右PFOA浓度依次为10、15、20 mg·L-1.从图中可以看出, 在一定pH范围内, 脱氟率随pH值增大而增大, 但当pH值偏离最佳点, 尽管增加HPW/BMMs的投加量, 脱氟率仍急速下降至25%以下.从上述三维响应曲面图可知, 体系初始pH值是影响PFOA脱氟率的关键因素, 实现高效脱氟的前提条件是调节反应体系的初始pH接近最佳pH值.
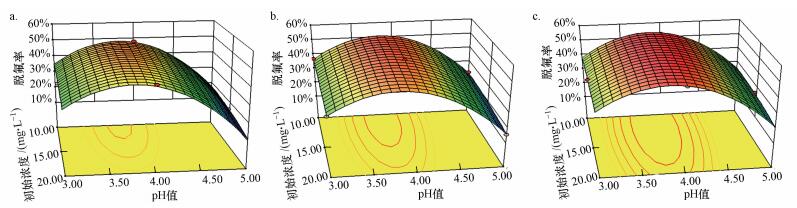 |
| 图 6 初始pH值和PFOA初始浓度对脱氟率的响应面图(a.投加量100 mg·L-1, b.投加量200 mg·L-1, c.投加量300 mg·L-1) Fig. 6 Response surface plot of pH and initial PFOA concentration on defluorination rate |
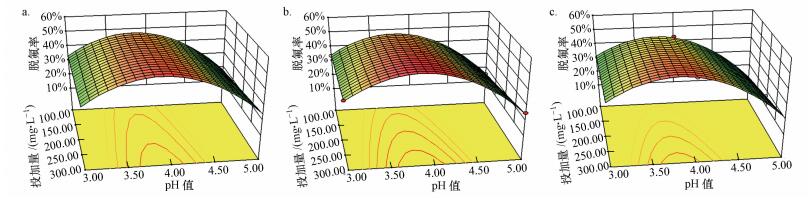 |
| 图 7 初始pH值和HPW/BMMs投加量对脱氟率的响应面图(a. PFOA 10 mg·L-1, b. PFOA 15 mg·L-1, c.PFOA 20 mg·L-1) Fig. 7 Response surface plot of pH and HPW/BMMs dosage on defluorination rate |
根据回归模型进行最优化模拟, VUV/HPW/BMMs体系运行的最佳条件为:PFOA初始浓度为200 mg·L-1, HPW/BMMs投加量为300 mg·L-1, 初始pH值为3.82, 此条件下脱氟率预测值为52.6%, 实际脱氟率为51.4%(3组试验平均值), 与预测值相比偏差为1.2%, 该模型可以分析不同条件下VUV/HPW/BMMs体系对PFOA脱氟率的变化.
4 结论(Conclusions)1) VUV/HPW/BMMs体系对PFOA的脱氟效果明显优于VUV、VUV/BMMs和VUV/HPW体系.脱氟效率随PFOA初始浓度的增大而减小, 随着HPW/BMMs投加量的增加先增大后减小, 最佳投加量为0.2 g·L-1, 且在酸性条件下(pH=3~4), 脱氟效果良好.
2) VUV/HPW/BMMs体系对PFOA脱氟的影响因子作用大小排序为:初始pH值>PFOA初始浓度>HPW/BMMs投加量.体系最佳运行条件为:pH=3.82, HPW/BMMs投加量为0.3 g·L-1, PFOA初始浓度为20 mg·L-1, 反应4 h的脱氟率达到52.6%, 与预测值相比偏差为1.2%.
3) 采用真空紫外与负载型磷钨酸催化剂构建光催化体系为高效、绿色脱氟提供了新的思路.
Bhorodwaj S K, Dutta D K. 2011. Activated clay supported heteropoly acid catalysts for esterification of acetic acid with butanol[J]. Applied Clay Science, 53(2): 347–352.
DOI:10.1016/j.clay.2011.01.019
|
Cao M, Wang B B, Yu H S, et al. 2010. Photochemical decomposition of perfluorooctanoic acid in aqueous periodate with VUV and UV light irradiation[J]. Journal of Hazardous Materials, 179(1): 1143–1146.
|
Cheng J, Vecitis C D, Park H, et al. 2010. Sonochemical degradation of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in groundwater:Kinetic effects of matrix inorganics[J]. Environmental Science & Technology, 44(1): 445–450.
|
戴群和. 2012. 双模型介孔SiO2负载磷钨酸催化剂的制备, 表征及催化性能[D]. 北京: 北京工业大学
http://cdmd.cnki.com.cn/Article/CDMD-10005-1012036958.htm |
Dinglasanpanlilio M J, Prakash S S, Baker J E, et al. 2014. Perfluorinated compounds in the surface waters of Puget Sound, Washington and Clayoquot and Barkley Sounds, British Columbia[J]. Marine Pollution Bulletin, 78(1): 173–180.
|
Gu Y, Dong W, Luo C, et al. 2016. Efficient reductive decomposition of perfluorooctanesulfonate in a high photon flux UV/Sulfite system[J]. Environmental Science & Technology, 50(19): 10554–10561.
|
Hori H, Hayakawa E, Einaga H, et al. 2004. Decomposition of environmentally persistent perfluorooctanoic acid in water by photochemical approaches[J]. Environmental Science & Technology, 38(22): 6118–6124.
|
Huang D, Yin L, Niu J, et al. 2016. Photoinduced hydrodefluorination mechanisms of perfluorooctanoic acid by the SiC/Graphene catalyst[J]. Environmental Science & Technology, 50(11): 5857–5863.
|
黄志华. 2015. 杂多酸光催化体系对全氟辛烷磺酸钾的脱氟研究[J]. 广东化工, 2015, 42(13): 33–34.
DOI:10.3969/j.issn.1007-1865.2015.13.015 |
Lee Y, Lo S, Chiueh P, et al. 2010. Microwave-hydrothermal decomposition of perfluorooctanoic acid in water by iron-activated persulfate oxidation[J]. Water Research, 44(3): 886–892.
DOI:10.1016/j.watres.2009.09.055
|
Liang X, Cheng J, Yang C, et al. 2016. Factors influencing aqueous perfluorooctanoic acid (PFOA) photodecomposition by VUV irradiation in the presence of ferric ions[J]. Chemical Engineering Journal, 298: 291–299.
DOI:10.1016/j.cej.2016.03.150
|
梁小燕, 程建华, 胡勇有, 等. 2013. VUV/Fe3+体系对水中全氟辛酸(PFOA)脱氟影响因素研究[J]. 环境科学学报, 2013, 33(4): 2432–2438.
|
Lin J, Hu C, Lo S, et al. 2016. Effect of surfactants on the degradation of perfluorooctanoic acid (PFOA) by ultrasonic (US) treatment[J]. Ultrasonics Sonochemistry, 28: 130–135.
DOI:10.1016/j.ultsonch.2015.07.007
|
Lin H, Niu J, Ding S, et al. 2012. Electrochemical degradation of perfluorooctanoic acid (PFOA) by Ti/SnO2-Sb, Ti/SnO2-Sb/PbO2 and Ti/SnO2-Sb/MnO2 anodes[J]. Water Research, 46(7): 2281–2289.
DOI:10.1016/j.watres.2012.01.053
|
Liou J, Szostek B, Derito C M, et al. 2010. Investigating the biodegradability of perfluorooctanoic acid[J]. Chemosphere, 80(2): 176–183.
DOI:10.1016/j.chemosphere.2010.03.009
|
Ludwicki J K, Goralczyk K, Strucinski P, et al. 2015. Hazard quotient profiles used as a risk assessment tool for PFOS and PFOA serum levels in three distinctive European populations[J]. Environment International, 74: 112–118.
DOI:10.1016/j.envint.2014.10.001
|
Ma H, Yang X, Huang Y, et al. 2017. Phosphotungstic acid based mesoporous silica catalysts for the preparation of soybean oil-based polyols[J]. Catalysis Letters, 147(3): 716–726.
DOI:10.1007/s10562-016-1965-5
|
马佳乐, 侯萍, 王思瑶, 等. 2016. 全氟辛酸诱导斑马鱼脾脏损伤及白细胞介素表达紊乱的免疫毒效应研究[J]. 环境科学学报, 2016, 36(7): 2687–2693.
|
Park H, Vecitis C D, Cheng J, et al. 2009. Reductive defluorination of aqueous perfluorinated alkyl surfactants:effects of ionic headgroup and chain length[J]. Journal of Physical Chemistry A, 113: 690–696.
DOI:10.1021/jp807116q
|
Poothong S, Boontanon S K, Boontanon N, et al. 2012. Determination of perfluorooctane sulfonate and perfluorooctanoic acid in food packaging using liquid chromatography coupled with tandem mass spectrometry[J]. Journal of Hazardous Materials, 205: 139–143.
|
Post G B, Cohn P D, Cooper K R. 2012. Perfluorooctanoic acid (PFOA), an emerging drinking water contaminant:A critical review of recent literature[J]. Environmental Research, 116(3): 93–117.
|
Qian Y, Guo X, Zhang Y, et al. 2015. Perfluorooctanoic acid degradation using UV-persulfate process:Modeling of the degradation and chlorate formation[J]. Environmental Science & Technology, 50(2): 772–781.
|
Remde A, Debus R. 1996. Biodegradability of fluorinated surfactants under aerobic and anaerobic conditions[J]. Chemosphere, 32(8): 1563–1574.
DOI:10.1016/0045-6535(96)00066-5
|
Sawant D P, Vinu A, Justus J, et al. 2007. Catalytic performances of silicotungstic acid/zirconia supported SBA-15 in an esterification of benzyl alcohol with acetic acid[J]. Journal of Molecular Catalysis A Chemical, 276(1/2): 150–157.
|
孙博, 马军. 2017. 水中全氟化合物的活性炭吸附特性研究[J]. 给水排水, 2017, 43(2): 14–18.
|
王莉, 喻泽斌, 李明樾, 等. 2015. 介质阻挡放电等离子去除PFOA的影响因素及机制研究[J]. 环境科学学报, 2015, 35(3): 764–772.
|
Wang Y, Zhang P. 2011. Photocatalytic decomposition of perfluorooctanoic acid (PFOA) by TiO2 in the presence of oxalic acid[J]. Journal of Hazardous Materials, 192(3): 1869–1875.
DOI:10.1016/j.jhazmat.2011.07.026
|
武钏. 2007. 负载型杂多酸对罗丹明B光催化降解的研究[J]. 光谱实验室, 2007, 24(4): 688–690.
|
Wu X, Bennett D H, Calafat A M, et al. 2015. Serum concentrations of perfluorinated compounds (PFC) among selected populations of children and adults in California[J]. Environmental Research, 136: 264–273.
DOI:10.1016/j.envres.2014.09.026
|
 2017, Vol. 37
2017, Vol. 37


