2. 中国农业大学理学院, 北京 100193
2. College of Sciences, China Agriculture University, Beijing 100193
噻吩磺隆(Thifensulfuron-methyl, TSM)是广泛用于防治禾谷类作物田间阔叶杂草的一种磺酰脲类除草剂.随着噻吩磺隆的大量使用, 其在作物、土壤和水体中产生残留现象, 并且易于对后茬敏感作物产生药害(Andersen et al., 2001;Polati et al., 2006).此外, 由于噻吩磺隆高的水溶性、移动性和持久性(如在pH=7.0的水溶液中, 其半衰期大于180 d), 易于对地下水和地表水造成污染(Zhao et al., 2015).因此, 迫切需要寻找快速高效地去除该药剂残留的方法, 以减少对环境的危害和提高农产品品质.
利用微生物对环境进行修复具有高效、廉价、安全、简便的特点, 逐渐成为处理农药污染的最佳选择方案(Singh et al., 2006), 因此, 微生物降解被认为是一种绿色和高效的农药降解方法(李顺鹏等, 2007).微生物降解是磺酰脲类除草剂在环境中的主要降解过程, 国内外学者报道的磺酰脲类除草剂降解菌主要有:假单胞属(Pseudomonas sp.)(Zhang et al., 2013)、寡养单胞属(Stenotrophomonas sp.)(黄星等, 2006)、芽孢杆菌属(Bacillus sp.)(Wang et al., 2012)、苍白杆菌属(Ochrobactrum sp.)(Zhao et al., 2015)等, 其中涉及到的农药种类主要有苯磺隆、甲磺隆、氯嘧磺隆、烟嘧磺隆等, 但有关噻吩磺隆的降解微生物资源较少.为了丰富噻吩磺隆的降解菌株, 本研究从受磺酰脲类除草剂污染的农田土壤中, 成功分离筛选到1株葡萄球菌属菌株(Staphylococcus sp.), 并对其降解特性和降解产物进行初步的研究, 以期为噻吩磺隆污染的生物修复提供理论依据与技术支持.
2 材料与方法(Materials and methods) 2.1 主要仪器与试剂主要仪器:Agilent 1260型高效液相色谱HPLC (Agilent technologies, USA);色谱柱为RP-Welch materials column XB C18(250 mm×4.0 mm, 内径5 μm);高效液相色谱-质谱联用仪(Aglient 1100 series LC/MS, USA);S-3400N扫描电子显微镜(Hitachi, Japan);Vortex-Genie 2涡旋振荡器(Scientific Industries, USA);Sigma 3-18K型离心机(Germany);Eppendorf Mastercycler nexus gradient梯度PCR仪(Germany);LDZX-50KBS立式压力蒸汽灭菌锅(上海申安医疗器械厂);JJT-1300月坛洁净工作台(北京半导体设备一厂);RXZ智能型人工气候箱(宁波江南仪器厂);ZQLY-180振荡培养箱(上海知楚仪器);HZQ-C型空气浴振荡器(哈尔滨市东联电子技术开发有限公司).
试剂:98.2%噻吩磺隆原药、97.8%烟嘧磺隆原药、96.2%苄嘧磺隆原药、95%醚苯磺隆原药、97%吡嘧磺隆原药、96%胺苯磺隆原药、96%甲磺隆原药等药剂由中国农业大学农药环境毒理实验室提供; 色谱级甲醇和乙腈购自北京迈瑞达科技有限公司;其余试剂均为国产分析纯.
基础无机盐培养基(MSM):KH2PO4 0.5 g, K2HPO4 1.5 g, 无水CaCl2 0.02 g, NaCl 1.0 g, MgSO4·7H2O 0.2 g, FeSO4·7H2O 0.025 g, NH4NO3 1.0 g, 去离子水定容至1 L, pH 7.0~7.2, 该培养基用于降解菌的富集培养.细菌普通培养基(LB):蛋白胨10.0 g, 酵母粉5.0 g, NaCl 5.0 g, 去离子水定容至1 L, pH 7.0~7.2, 该培养基用于菌株降解性能的实验(李宝庆等, 2010;Salunkhe et al., 2013).上述培养基添加1.5%的琼脂粉即得到相应的固体培养基, 在湿热灭菌锅121 ℃高压灭菌30 min备用.
2.2 噻吩磺隆降解菌的分离筛选用于降解菌分离筛选的土壤样品采自于河北省唐山市农科院试验站, 为经磺酰脲类除草剂使用10年以上的田间土壤.称取土壤样品10.0 g, 接种到含50 mg·L-1噻吩磺隆的100 mL基础无机盐培养液中, 在30 ℃、180 r·min-1摇床中黑暗振荡培养. 1周后按照10%的接种量转接到新鲜的相同培养液中, 并逐渐提高培养液中噻吩磺隆的浓度至200 mg·L-1, 用HPLC测定培养液中药剂的浓度, 将具有降解能力的富集发酵液进行梯度稀释, 涂布在含噻吩磺隆的固体培养基上, 待平板上出现单菌落后, 挑取单菌落分别转接至含药剂的培养液中, 验证菌株对噻吩磺隆的降解效果, 筛选到1株对噻吩磺隆具有降解能力的菌株, 命名为ZWS13.
2.3 噻吩磺隆的提取与测定噻吩磺隆的提取参考Zhao等(2015)方法, 具体如下:取5 mL含有噻吩磺隆的发酵液于15 mL的离心管中, 加入相同体积的乙腈萃取液(含有0.1%乙酸), 在振荡培养器上于转速为220 r·min-1、室温条件下振荡35 min, 加入无水NaCl并使其饱和, 在4000 g下离心5 min, 吸取1.0 mL上层有机相过0.22 μm滤膜于进样小瓶中, -20 ℃条件下保存, 待测.
仪器方法:高效液相色谱(Agilent 1260, USA), 配紫外检测器, 色谱柱为Welch materials XB-C18 column (4.0 mm×250 mm, 5 μm);流动相组成为乙腈:0.1%乙酸水=65:35(V/V), 流速为1.0 mL·min-1;检测波长为241 nm, 柱温为30 ℃, 进样量为20 μL;烟嘧磺隆保留时间为3.90 min左右.
2.4 菌株ZWS13的鉴定 2.4.1 菌株ZWS13的形态鉴定菌落形态:将分离菌划线接种于LB平板上, 30 ℃培养, 观察菌落形态特征.个体形态:用扫描显微镜(S-3400N)观察降解菌ZWS13的形状、大小.
2.4.2 菌株ZWS13的16S rRNA基因序列扩增、测序与分析将保存的菌株ZWS13转接到LB培养液中, 30 ℃、180 r·min-1下恒温振荡过夜培养.采用细菌基因组DNA提取试剂盒(TIANamp Bacteria DNA Kit)提取菌株ZWS13的DNA作为16S rRNA基因扩增的模板.用于扩增的正向引物:27F (5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物:1492R (5′-GGTTACCTTGTTACGACTT-3′. PCR反应体系如下(25 μL):2×Taq Master Mix (含Mg2+)12.5 μL, 引物(10 μmol·L-1)各1 μL, 模板DNA 1 μL, dd H2O补足至25 μL. PCR反应程序:95 ℃预变性5 min;94 ℃变性1 min, 54 ℃退火1 min, 72 ℃延伸1 min, 35个循环;72 ℃终延伸5 min.用1%琼脂糖凝胶电泳检测PCR产物.将回收的扩增产物T/A克隆后进行测序, 由北京三博远志公司完成.菌株ZWS13的16S rRNA基因测序结果与GeneBank数据库中的16S rRNA基因序列进行比较, 利用MEGA 5.1软件对不同菌株的序列进行Clustal W多重序列比对, 并采用软件中的Kimura 2-parameter模式和Neighbor-joining算法构建系统发育树, 发育树各分支的置信度由自引导法1000次重复检测.
2.5 菌株ZWS13种子液的制备与降解特性研究挑取菌株ZWS13的单菌落接种于液体LB培养基中, 30 ℃、180 r·min-1下培养24~48 h, 用相同的LB培养液调节成菌株生长量OD600=1.0的菌悬液作为降解实验的种子液.
将菌株ZWS13的种子液接种于含有一定浓度噻吩磺隆的LB培养液中(李宝庆等, 2010;Salunkhe et al., 2013), 分别改变接种量、培养液pH、培养温度、底物浓度, 研究不同因素对噻吩磺隆降解的影响.
2.6 菌株ZWS13的降解广谱性测定将上述种子液按5%接种量接种于分别含10 mg·L-1的不同磺酰脲类除草剂的培养液中, 以相同条件下不接菌的含药培养液作为空白对照, 在培养一定时间后, 按2.3节方法测定菌株对不同磺酰脲类除草剂的降解情况.
2.7 菌株ZWS13对噻吩磺隆降解产物的分析将种子液接种于含有一定浓度药剂的培养液中培养一定时间, 取20 mL发酵液于50 mL的离心管中, 加入相同体积的乙腈萃取液(含有0.1%乙酸), 在振荡培养器上于转速为220 r·min-1、室温条件下振荡35 min, 加入NaCl并使其饱和, 在8000 g下离心5 min, 将上层有机相转移至鸡心瓶中, 在旋转蒸发仪上, 于40 ℃条件下旋转浓缩至近干.然后用1.0 mL甲醇溶解, 并过0.22 μm滤膜于进样小瓶中, -20 ℃条件下保存待测.
仪器方法:高效液相色谱-质谱联用仪, ESI离子源, 正负离子模式, 干燥气(氮气)流速为5.0 L·min-1, 干燥气温度为350 ℃, 雾化器电压为0.24 MPa, 喷雾电压为3.5 kV, 全扫描模式, 扫描范围为50~600 (m/z).流动相为乙腈(A)和水(含有0.1%乙酸, B), 流速为0.5 mL·min-1, 进样量为10 μL;梯度洗脱模式:0~1 min, 30%A;1~8 min, 80%A;8~15 min, 30%A.
2.8 数据分析方法采用SPSS 17.0进行数据分析, 样品与对照组之间用单因素方差分析中的邓肯新复极差(Duncan)检验对试验数据进行统计分析.
3 结果与分析(Results and analysis) 3.1 降解菌的分离与鉴定采用富集培养技术经过多次培养后, 得到能够降解噻吩磺隆的混合微生物, 对其划线分离纯化、挑取单菌落, 最终从污染的土壤样品中分离得到1株噻吩磺隆降解菌, 命名为ZWS13.菌株ZWS13培养6 d后, 对初始浓度为100 mg·L-1的噻吩磺隆降解率达到60%以上.菌株ZWS13在LB平板上菌体呈白色、平滑、不透明并且边缘整齐(图 1a), 在扫描电子显微镜下观察菌株形态为球形、表面光滑, 直径大小为0.6~0.7 μm (图 1).
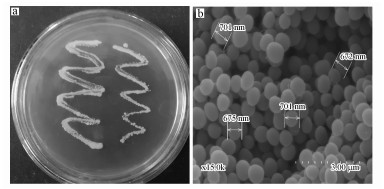 |
| 图 1 菌株在LB平板上的生长菌(a)落及其形态观察(b, 扫描电镜法, 15000×) Fig. 1 The growth of strain ZWS13 on LB plate (a) and its morphology observed under scanning electron microscope (b, SEM, 15000×) |
菌株ZWS13的16S rRNA基因序列长度为1514 bp, 将该序列提交到GenBank数据库中, 登录号为KM051419.将该菌株的16S rRNA基因序列与其他菌株16S rRNA基因进行同源性比较并建立系统发育树(图 2), 结果显示, 该菌株与科氏葡萄球菌Staphylococcus cohnii subsp. GH137(GeneBank登录号为NR036902.1)相似性最高, 亲缘关系最近.结合形态特征和16S rRNA基因序列, 初步将其鉴定为葡萄球菌属(Staphylococcus sp.).
 |
| 图 2 菌株ZWS13的16S rRNA基因序列同源性的系统发育树 Fig. 2 Phylogenetic tree based on 16S rRNA gene sequence of strain ZWS13 and related species |
将菌株按照5%接种量接种到添加噻吩磺隆浓度分别为5、50、100、200、400 mg·L-1的培养液中, 于30 ℃、180 r·min-1条件下培养不同时间, 测定底物浓度对菌株ZWS13降解噻吩磺隆的影响, 结果如图 3所示.在未接种菌株时, 不同浓度的药剂自然降解率分别为11.6%±3.8%、18.3%±1.9%、12.7%±0.6%、20.2%±0.2%和14.1%±0.4%;接种菌株ZWS13后噻吩磺隆的降解率分别为62.4%±2.7%、59.5%±0.9%、61.3%±1.9%、56.5%±0.6%和50.2%±0.2%.可以看出, 培养液中接种菌株ZWS13对噻吩磺隆具有很好的降解效果.显著性差异分析表明, 在5~100 mg·L-1范围内随着培养液中药剂浓度的升高, 降解率之间不存在显著性差异;当浓度高于100 mg·L-1时, 降解率下降并且存在显著性差异(p < 0.05).
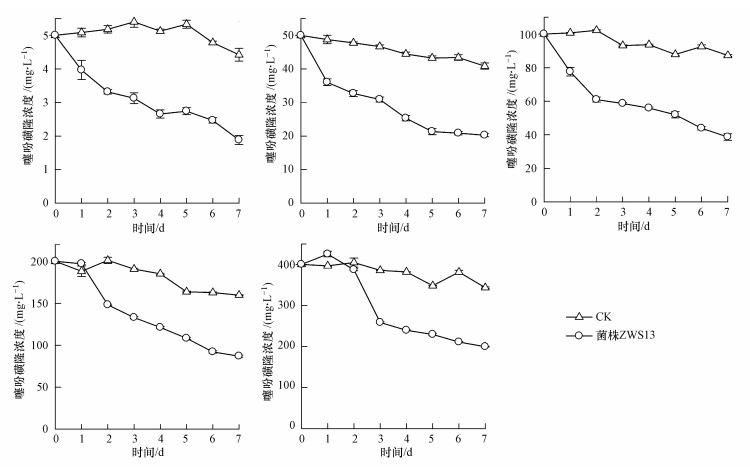 |
| 图 3 噻吩磺隆初始浓度对菌株ZWS13降解能力的影响 Fig. 3 Effect of initial concentration on the degradation of TSM by strain ZWS13 |
在培养液中加入50 mg·L-1的噻吩磺隆, 将种子液分别以1%、3%和5%的接种量接种于pH=7.0的培养液中, 在30 ℃、180 r·min-1条件下于摇床中培养不同时间, 测定噻吩磺隆的浓度, 结果如图 4所示.未接种菌株时, 药剂的自然降解率仅为10.1%±2.4%;当按照1%、3%和5%接种量接种菌株ZWS13培养10 d后, 药剂的降解率分别为80.9%±4.7%、77.2%±1.7%和72.9%±0.5%.菌株接种量的高低与农药的降解效率存在直接的关系, 本研究确定菌株ZWS13对噻吩磺隆降解较适宜的接种量为1%.
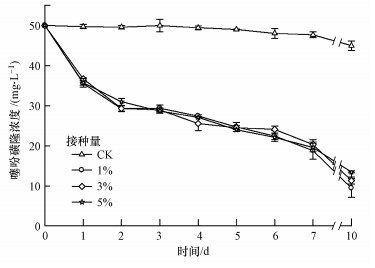 |
| 图 4 接种量对菌株ZWS13降解能力的影响 Fig. 4 Effect of inoculum size on the degradation of TSM by strain ZWS13 |
在培养液中添加终浓度为50 mg·L-1的噻吩磺隆, 以5%的接种量接种于pH=7.0的培养液中, 在不同温度(20、30、40 ℃)、180 r·min-1下摇床培养, 取样检测噻吩磺隆的浓度, 结果如图 5所示.未接种菌株时, 药剂的自然降解率分别为4.6%±0.6%、10.1%±2.4%和17.1%±2.5%;接种菌株ZWS13后噻吩磺隆的降解率分别为60.0%±1.7%、73.9%±0.5%和99.1%±0.4%.在研究温度范围内, 随着温度的升高, 菌株ZWS13对药剂的降解率呈明显的上升趋势, 确定菌株对药剂降解的较适宜培养温度为40 ℃.
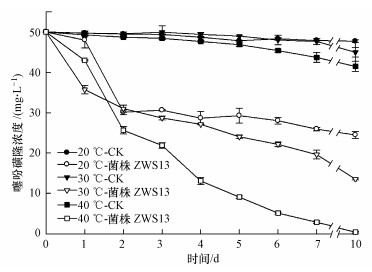 |
| 图 5 温度对菌株ZWS13降解能力的影响 Fig. 5 Effect of temperature on the degradation of TSM by strain ZWS13 |
在培养液中添加终浓度为50 mg·L-1的噻吩磺隆, 以5%的接种量接种于pH分别为6.0、7.0、8.0的培养液中, 于30 ℃、180 r·min-1下摇床培养, 取样检测噻吩磺隆的浓度, 结果如图 6所示.未接种菌株时, 在不同pH条件下药剂的自然降解率分别为14.8%±5.4%、10.1%±2.4%和25.5%±3.8%.当接种菌株ZWS13培养10 d后, 噻吩磺隆的降解率分别为71.5%±2.1%、73.9%±0.5%和84.8%±0.3%.当pH介于6.0~7.0时, 菌株对药剂的降解率之间不存在显著性差异.本研究确定菌株ZWS13降解噻吩磺隆较适宜的pH为8.0.
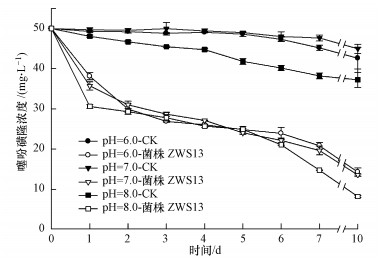 |
| 图 6 pH对菌株ZWS13降解能力的影响 Fig. 6 Effect of pH on the degradation of TSM by strain ZWS13 |
不同磺酰脲类除草剂在终浓度为10 mg·L-1、按照5%接种量接种降解菌培养8 d后, 未接种菌株时, 除吡嘧磺隆的自然降解率在25%左右外, 其余药剂的自然降解率均小于10%.菌株ZWS13对烟嘧磺隆、噻吩磺隆、苯磺隆、吡嘧磺隆、甲磺隆、醚苯磺隆、胺苯磺隆和苄嘧磺隆的降解率分别为74.2%±4.9%、62.0%±1.8%、29.4%±2.0%、36.3%±2.2%、35.1%±0.9%、10.6%±2.4%、25.9%±3.4%和1.8%±1.1%.
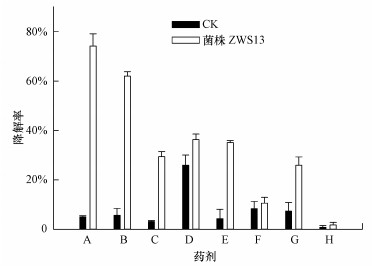 |
| 图 7 菌株ZWS13对不同磺酰脲类除草剂的降解谱(A.烟嘧磺隆, B.噻吩磺隆, C.苯磺隆, D.吡嘧磺隆, E.甲磺隆, F.醚苯磺隆, G.胺苯磺隆, H.苄嘧磺隆) Fig. 7 Degradation spectrum of different sulfonylurea herbicides by strain ZWS13(A.nicosulfuron, B.thifensulfuron-methyl, C.tribenuron-methyl, D.pyrazosulfuron-methyl, E.metsulfuron-methyl, F.triasulfuron, G.ethametsulfuron-methyl, H.bensulfuron-methyl) |
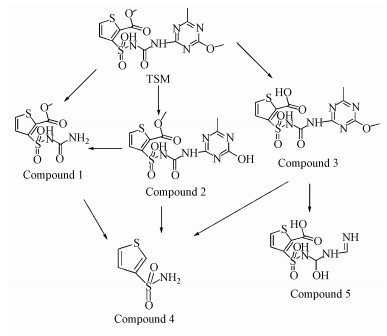
采用HPLC-MS检测菌株ZWS13对噻吩磺隆的降解产物, 图 8和图 9分别表示不同处理的总离子流图和紫外吸收图.由图 9可知, 共检测到6个紫外吸收峰, 其保留时间RT分别为9.1、10.6、11.6、12.0、12.8和13.7 min, 峰1~5分别代表不同的降解产物, 峰6为噻吩磺隆.根据质谱图对降解产物进行了推测(表 1), 在正离子和负离子模式下, 噻吩磺隆分别给出分子离子峰的质荷比m/z为387.7(M+H+)和386.0(M-H-).在负离子模式下, 降解产物1(RT=9.1 min)给出分子离子峰的质荷比m/z为262.9(M-H-), 其来自于磺酰脲桥上C-N键的断裂, 初步鉴定为methyl 3-(N-carbamoylsulfamoyl) thiophene-2-carboxylate;在正离子模式下, 降解产物2(RT=10.6 min)给出分子离子峰的质荷比m/z为372.7(M-CH3+), 其来自于母体化合物的脱甲基作用, 初步鉴定为3-(N-((4-hydroxy-6-methyl-1, 3, 5-triazin-2-yl)-carbamoyl) sulfamoyl) thiophene-2-carboxylate.相同的降解产物1和2已有研究报道(Zhao et al., 2015).在正离子和负离子模式下, 降解产物3(RT=11.6 min)分别给出分子离子峰的质荷比m/z为373.6(M+H+)和371.9(M-H-), 其来自于噻吩杂环取代基上的脱酯作用的甲基丢失, 化学名称为3-(((4-Methoxy-6-methyl-1, 3, 5-triazin-2-yl) carbamoyl) sulfamoyl) thiophene-2-carboxylic acid, 也称为噻吩磺隆酸.已有研究表明, 噻吩磺隆在不同环境条件下均检测到该降解产物(Zhao et al., 2015;Brown et al., 1997;Cambon et al., 1996).降解产物4(RT=12.0 min)给出分子离子峰的质荷比m/z为163.7(M+H+), 其来自于降解产物1、2或3的进一步断裂, 推测其化学名称为3-thiophenesulfonamide.降解产物5(RT=12.6 min)在负离子模式下给出分子离子峰的质荷比m/z为277.9(M-H-), 其来自于降解产物3(噻吩磺隆酸)的进一步断裂, 初步鉴定其为3-((Formimidoylamino-hydroxy-methyl)-sulfamoyl)-thiophene-2-carboxylic acid.通过其降解产物的质谱图分析表明, 在菌株ZWS13的作用下, 噻吩磺隆通过磺酰脲桥C-N键的断裂、脱甲基作用或脱酯作用的甲基丢失分别产生降解产物1、2和3, 并且被菌株进一步分解生成产物4;降解产物3进一步发生三嗪环的开裂反应生成降解产物5.根据目前报道的噻吩磺隆的降解产物和磺酰脲类药剂的降解途径, 推测了菌株ZWS13对噻吩磺隆的降解产物及途径(图 10).
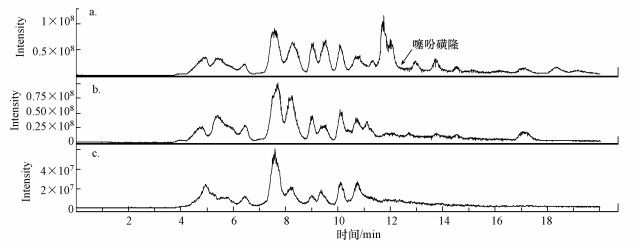 |
| 图 8 菌株ZWS13不同处理的总离子流图(a.ZWS13+噻吩磺隆, b.ZWS13菌液, c.空白培养基) Fig. 8 Total ion chromatorgraphy of different samples of strain ZWS13(a.medium+ZWS13+thifensulfuron-methyl, b.medium+ZWS13, c.medium blank) |
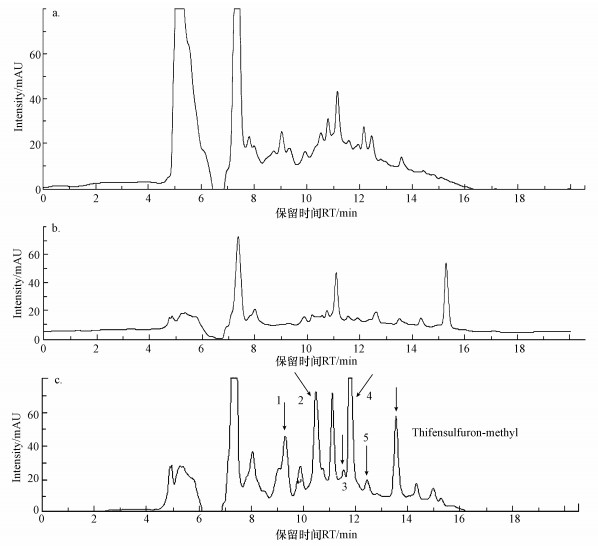 |
| 图 9 菌株ZWS13不同处理的紫外吸收色谱图(a.空白培养基, b.ZWS13菌液, c.ZWS13+噻吩磺隆) Fig. 9 Base peak chromatograms of different samples of strain ZWS13(a.medium blank, b.medium+ZWS13, c.medium+ZWS13+thifensulfuron-methyl) |
| 表 1 菌株ZWS13对噻吩磺隆降解产物的推测 Table 1 Probable degradation products of TSM by strain ZWS13 |
 |
| 图 10 菌株ZWS13对噻吩磺隆降解途径的推测 Fig. 10 Probable degradation pathways of TSM by strain ZWS13 |
此外, 研究发现, 随着培养时间的延长, 噻吩磺隆浓度(峰面积表示)呈现出下降趋势, 并且得到了降解产物噻吩磺隆酸.本文研究了菌株ZWS13降解过程中噻吩磺隆和噻吩磺隆酸之间的关系(图 11), 结果发现, 菌株ZWS13对噻吩磺隆作用后, 噻吩磺隆在不同时间的峰面积随着菌株培养时间的延长逐渐下降, 而生成的降解产物噻吩磺隆酸的峰面积则逐渐增加, 说明噻吩磺隆酸是由噻吩磺隆转化而得.在实验的第6 d时, 噻吩磺隆酸的峰面积达到最大, 之后随着菌株培养时间的延长, 噻吩磺隆酸的峰面积逐渐下降, 说明菌株ZWS13对噻吩磺隆酸具有一定的降解能力.
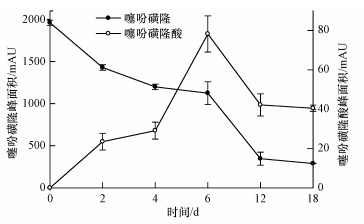 |
| 图 11 噻吩磺隆的降解及其与噻吩磺隆酸关系 Fig. 11 Relationship between TSM and thifensulfuron acid |
微生物降解是农药残留污染环境修复的重要途径, 筛选降解菌株是农药残留生物修复的首要步骤(Guo et al., 2009; Singh et al., 2006).然而, 目前已经报道筛选获得的噻吩磺隆降解菌株的数量还很少, 主要有苍白杆菌属(Ochrobactrum sp.)和寡养单胞菌属(Stenotrophomonas sp).近年来葡萄球菌属菌株(Staphylococcus sp.)对染料(Ayed et al., 2010)、芳香化合物(Chang et al., 2011; Karn et al., 2014)等有机污染物的降解得到广泛研究, 但其作为农药降解菌的研究少有报道.本研究从污染的土壤样品中分离到1株葡萄球菌属菌株, 该菌对噻吩磺隆和噻吩磺隆酸均具有降解能力, 经形态学和分子生物学鉴定为葡萄球菌属菌株.降解菌株的获得增加了降解磺酰脲类除草剂的微生物种类, 丰富了降解菌资源库.
利用微生物降解环境污染物受到诸多环境因素的影响, 如底物浓度、培养时间、接种量、温度、环境pH等(Jin et al., 2010; Chen et al., 2012; 李岩等, 2005).本研究通过单因素实验方法对影响菌株降解效率的各个因素进行了评价, 得到了菌株ZWS13降解噻吩磺隆的较适宜的条件范围.此外, 单因素实验没有考虑到环境因素之间对菌株降解效率的影响, 因此,还需要对影响因素进一步优化.
底物浓度对菌株ZWS13降解效率的影响研究结果表明, 当初始浓度大于100 mg·L-1时, 随着底物浓度的升高, 降解率逐渐下降, 这可能是由于较高浓度的噻吩磺隆对菌株产生毒害作用抑制了其生长, 并导致细胞生长的延滞期延长, 从而对降解率产生影响, 相似的观点已有研究报道(Zhao et al., 2015; 陈晓华等, 2012;霍莹等, 2011).因此, 在实际利用微生物消除农药污染时, 要充分考虑农药浓度与微生物数量的关系.本研究确定了菌株ZWS13对烟嘧磺隆较适宜的降解浓度范围为5~100 mg·L-1. 黄星等(2007)研究发现, 菌株Stenotrophomonas sp. FLX在2 d内对初始浓度50 mg·L-1的噻吩磺隆的降解率约为80%;Hang等(2012)分离的菌株Hansschlegelia zhihuaiae S113在2 d内能够降解200 μmol·L-1的噻吩磺隆.本研究结果发现, 分离到的菌株ZWS13在10 d内对50.0 mg·L-1噻吩磺隆的降解率为99.1%, 而且对初始浓度为400 mg·L-1的噻吩磺隆降解率达到50%以上, 说明菌株能够降解高浓度的药剂.
初始接种量是影响菌株对底物降解的关键因素之一. 杨旭等(2011)研究发现, 菌株初始接种量过多或过少都会对药剂的降解产生影响, 尤其是当初始接种量较高时, 会导致单个菌体吸收不到充足的碳源和能源用于生长, 从而导致降解率降低. Zhao等(2015)研究表明, 随着苍白杆菌属菌株接种量的增加, 噻吩磺隆的降解率下降.本研究结果表明, 当接种量为1%时, 菌株ZWS13对噻吩磺隆的降解效率最高, 然而当接种量增加时, 降解率反而表现出下降的趋势.可能的原因是菌株初始接种量过大, 而生长所需的营养物质相对不足, 产生竞争作用使降解效率下降(史延华等, 2015).因此, 接种量不宜过高且还需进一步优化.
关于温度和pH对微生物降解的影响已有很多报道.温度通过影响降解酶的活性来改变微生物对农药的降解效率(史延华等, 2015), 不同菌株对农药降解的适宜温度存在差异. Zhang等(2012)指出, 菌株S. marcescens N80对烟嘧磺隆降解的适宜的培养温度为30~35 ℃;Xu等(2009)报道, 菌株Pseudomonas sp.培养温度为28 ℃时对吡嘧磺隆的降解效率高于20 ℃和37 ℃, 然而菌株Bacillus sp.在37 ℃时具有高的降解效率. He等(2006)研究表明, 菌株Penicillium sp.培养温度为30 ℃时对甲磺隆具有很好的降解效果.本研究发现, 菌株ZWS13对噻吩磺隆的降解较适宜的培养温度为40 ℃, 表明菌株对高温有较好的耐受性.在pH影响方面, 不同pH值可能会影响菌株对营养物质的吸收, 并有可能改变菌株生长的速度.微生物菌体及其产生的降解酶只有在合适的pH范围内才能表现出活性, 过高或过低的pH值均能够影响酶的活性, 不利于菌株表现出很好的降解效果(杨旭等, 2011).许多学者认为, 磺酰脲类除草剂的降解受pH影响较大(Ruan et al., 2013; Song et al., 2013).本研究分离到的菌株在pH 6.0~8.0范围内对药剂的降解率在70%以上, 推测菌株在中性或微碱性条件下能够保持很好的降解能力.
已有研究表明, 相同微生物对磺酰脲类除草剂具有不同的降解能力. Huang等(2007)分离纯化得到的菌株Methylopila sp. S113对甲磺隆、噻吩磺隆、苄嘧磺隆和胺苯磺隆具有好的降解能力, 但不能降解氯磺隆和吡嘧磺隆. Ma等(2009)分离得到的菌株Pseudomonas sp. LW3能够降解苄嘧磺隆、噻吩磺隆、胺苯磺隆、吡嘧磺隆、氟胺磺隆和烟嘧磺隆, 但不能够降解甲磺隆.菌株ZWS13对磺酰脲类除草剂具有较宽的降解谱, 但菌株对不同种类磺酰脲类药剂的降解率存在很大差异, 可能是由于药剂的取代基不同影响了菌株的降解能力.
目前, 微生物对磺酰脲类除草剂降解途径的研究主要是通过高效液相、气相色谱和质谱分析对降解中间产物鉴定进行推测(阮志勇, 2014).国内外研究发现, 微生物对磺酰脲类除草剂降解途径的不同, 可导致所产生的中间降解产物存在差别(Bhattacharjee et al., 2002).已报道的磺酰脲类除草剂在环境中的降解方式有磺酰脲桥的断裂(Zhao et al., 2015; Zhang et al., 2013; Wang et al., 2012)、三嗪环的开裂(Zhao et al., 2015; Huang et al., 2007; Si et al., 2005; Sarmah et al., 2002)、皂化反应(Zhang et al., 2013)、脱甲基作用(Zhang et al., 2013)、芳香基环的羟基化(Zanardini et al., 2002)、脱酯反应(Huang et al., 2007)、磺酰脲桥的缩合反应等(Boschin et al., 2007), 其中,磺酰脲桥的断裂是该类除草剂主要的降解途径, 生成相应的磺酰胺和杂环胺(Zhao et al., 2015; Zhang et al., 2013; Zhang et al., 2012; Xu et al., 2009; He et al., 2006; Ruan et al., 2013; Song et al., 2013; Ma et al., 2009).菌株ZWS13对噻吩磺隆的降解产物经LC-MS鉴定, 推测降解途径为磺酰脲桥C-N键的断裂、脱甲基作用或脱酯作用的甲基丢失及三嗪环的开裂.
5 结论(Conclusions)1)从磺酰脲类除草剂污染的土壤中分离得到1株噻吩磺隆降解菌ZWS13, 根据细胞形态和16S rRNA基因序列, 初步鉴定其为葡萄球菌(Staphylococcus sp.).
2)菌株ZWS13能够有效地降解噻吩磺隆和噻吩磺隆酸, 并且降解效率受到环境因素的影响, 在初始浓度5~100 mg·L-1的范围内, 菌株具有较好的耐受能力和降解性.菌株降解较适宜的培养条件为pH=8.0, 40 ℃和接种量1%.同时, 菌株对烟嘧磺隆、吡嘧磺隆和甲磺隆亦具有很好的降解效果.
3)基于获得的5个降解产物的结构, 推测菌株对噻吩磺隆的断裂方式:磺酰脲桥C-N键的断裂、脱甲基作用或脱酯作用的甲基丢失及三嗪环的开裂.
| [${referVo.labelOrder}] | Andersen S M, Hertz P B, Holst T, et al. 2001. Mineralisation studies of C14-labelled metsulfuron-methyl, tribenuron-methyl, chlorsulfuron and thifensulfuron-methyl in one Danish soil and groundwater sediment profile[J]. Chemosphere, 45(6/7) : 775–782. |
| [${referVo.labelOrder}] | Ayed L, Achour S, Khelifi E, et al. 2010. Use of active consortia of constructed ternary bacterial cultures via mixture design for Congo Red decolorization enhancement[J]. Chemical Engineering Journal, 162(2) : 495–502. DOI:10.1016/j.cej.2010.05.050 |
| [${referVo.labelOrder}] | Bhattacharjee A K, Dureja R. 2002. Light-induced transformation of tribenuron-methyl on glass, soil, and plant surface[J]. Journal of Environmental Science and Health, Part B:Pesticides, Food Contaminants, and Agricultural Wastes, 37(2) : 131–140. DOI:10.1081/PFC-120002985 |
| [${referVo.labelOrder}] | Boschin G, D'Agostina A, Antonioni C, et al. 2007. Hydrolytic degradation of azimsulfuron, sulfonylurea herbicide[J]. Chemosphere, 68(7) : 1312–1317. DOI:10.1016/j.chemosphere.2007.01.036 |
| [${referVo.labelOrder}] | Brown H M, Joshi M M, Van A T, et al. 1997. Degradation of thifensulfuron methyl in soil:Role of microbial carboxyesterase activity[J]. Journal of Agricultural and Food Chemistry, 45(3) : 955–961. DOI:10.1021/jf9604145 |
| [${referVo.labelOrder}] | Cambon J P, Bastide J. 1996. Hydrolysis kinetics of thifensulfuron methyl in aqueous buffer solutions[J]. Journal of Agricultural Food Chemistry, 44(1) : 333–337. DOI:10.1021/jf950194f |
| [${referVo.labelOrder}] | Chang C H, Lee J, Ko B G, et al. 2011. Staphylococcus sp.KW-07 contains nahH gene encoding catechol 2, 3-dioxygenase for phenanthrene degradation and a test in soil microcosm[J]. International Biodeterioration & Biodegradation, 65(1) : 198–203. |
| [${referVo.labelOrder}] | Chen S H, Luo J J, Hu M Y, et al. 2012. Microbial detoxification of bifenthrin by a novel yeast and its potential for contaminated soils treatment[J]. PLoS One, 7(2) : e30862. DOI:10.1371/journal.pone.0030862 |
| [${referVo.labelOrder}] | 陈晓华, 魏刚, 刘思远, 等. 2012. 高效降酚菌株Ochrobactrum sp.CH10生长动力学和苯酚降解特性的研究[J]. 环境科学, 2012, 33(11) : 3956–3961. |
| [${referVo.labelOrder}] | Guo P, Wang B Z, Hang B J, et al. 2009. Pyrethroid-degrading Sphingobium sp.JZ-2 and the purification and characterization of a novel pyrethroid hydrolase[J]. International Biodeterioration & Biodegradation, 63(8) : 1107–1112. |
| [${referVo.labelOrder}] | Hang B J, Hong Q, Xie X T, et al. 2012. SulE, a sulfonylurea herbicide de-esterification esterase from Hansschlegelia zhihuaiae S113[J]. Applied and Environmental Microbiology, 78(6) : 1962–1968. DOI:10.1128/AEM.07440-11 |
| [${referVo.labelOrder}] | He Y H, Shen D S, Fang C R, et al. 2006. Rapid biodegradation of metsulfuron-methyl by a soil fungus in pure cultures and soil[J]. World Journal Microbiology Biotechnology, 22(10) : 1095–1104. DOI:10.1007/s11274-006-9148-y |
| [${referVo.labelOrder}] | 黄星, 何健, 潘继杰, 等. 2006. 噻吩磺隆降解菌FLX的分离鉴定及降解特性[J]. 中国环境科学, 2006, 26(2) : 214–218. |
| [${referVo.labelOrder}] | Huang X, He J, Sun J Q, et al. 2007. Isolation and characterization of a metsulfuron-methyl degrading bacterium Methylopila sp.S113[J]. International Biodeterioration & Biodegradation, 60(3) : 152–158. |
| [${referVo.labelOrder}] | 霍莹, 许景钢, 李淑芹, 等. 2011. 咪唑乙烟酸降解菌S181的分离鉴定及其降解特性[J]. 环境科学, 2011, 32(5) : 1518–1523. |
| [${referVo.labelOrder}] | Jin L Q, Liu Z Q, Zheng Y G, et al. 2010. Identification and characterization of Serratia marcescens ZJB-09104, a nitrileconverting bacterium[J]. World Journal Microbiology Biotechnology, 26(5) : 817–823. DOI:10.1007/s11274-009-0238-5 |
| [${referVo.labelOrder}] | Karn S K, Reddy M S, Chakrabarti S K. 2014. Biomineralization of 2, 3, 4, 6-tetrachlorophenol by Bacillus sp.and Staphylococcus sp.isolated from secondary sludge of pulp and paper mill[J]. Bioremediation Journal, 18(2) : 93–99. DOI:10.1080/10889868.2014.889073 |
| [${referVo.labelOrder}] | 李岩, 蒋继志, 马平, 等. 2005. 细菌降解农药研究新进展[J]. 西北农林科技大学学报, 2005, 33(s) : 250–252. |
| [${referVo.labelOrder}] | 李顺鹏, 刘君寒, 王兆守.2007.拟除虫菊酯类农药降解菌改良农作物品质的应用[P].中国专利:200710022920.3.2007-10-24 |
| [${referVo.labelOrder}] | 李宝庆, 鹿秀云, 郭庆港, 等. 2010. 克百威降解菌CYW-44的分离及其酶促降解研究[J]. 农业环境科学学报, 2010, 29(s) : 196–200. |
| [${referVo.labelOrder}] | Ma J P, Wang Z, Lu P, et al. 2009. Biodegradation of the sulfonylurea herbicide chlorimuron-ethyl by the strain Pseudomonas sp.LW3[J]. Fems Microbiology Letters, 296(2) : 203–209. DOI:10.1111/fml.2009.296.issue-2 |
| [${referVo.labelOrder}] | Polati S, Bottaro M, Frascarolo P, et al. 2006. HPLC-UV and HPLC-MSn multiresidue determination of amidosulfuron, azimsulfuron, nicosulfuron, rimsulfuron, thifensulfuron methyl, tribenuron methyl and azoxystrobin in surface waters[J]. Analytica Chimica Acta, 579(2) : 146–151. DOI:10.1016/j.aca.2006.07.034 |
| [${referVo.labelOrder}] | 阮志勇.2014.醚磺隆降解菌的分离鉴定、基因组学分析及其降解特性研究[D].武汉:华中农业大学.10 |
| [${referVo.labelOrder}] | Ruan Z Y, Zhou S, Jiang S H, et al. 2013. Isolation and characterization of a novel cinosulfuron degrading Kurthia sp.from a methanogenic microbial consortium[J]. Bioresource Technology, 147 : 477–483. DOI:10.1016/j.biortech.2013.08.017 |
| [${referVo.labelOrder}] | Salunkhe V P, Sawant I S, Banerjee K, et al. 2013. Biodegradation of profenofos by Bacillus subtilis isolated from grapevines (Vitis vinifera)[J]. Journal of Agricultural and Food Chemistry, 61(30) : 7195–7202. DOI:10.1021/jf400528d |
| [${referVo.labelOrder}] | Sarmah A K, Sabadie J. 2002. Hydrolysis of sulfonylurea herbicides in soils and aqueous solutions:A review[J]. Journal of Agricultural and Food Chemistry, 50(22) : 6253–6265. DOI:10.1021/jf025575p |
| [${referVo.labelOrder}] | 史延华, 任磊, 贾阳, 等. 2015. 施氏假单胞菌YC-YH1的萘降解特性及产物分析[J]. 微生物学通报, 2015, 42(10) : 1866–1876. |
| [${referVo.labelOrder}] | Si Y B, Wang S Q, Zhou J, et al. 2005. Leaching and degradation of ethametsulfuron-methyl in soil[J]. Chemosphere, 60(5) : 601–609. DOI:10.1016/j.chemosphere.2005.01.051 |
| [${referVo.labelOrder}] | Singh B K, Walker A. 2006. Microbial degradation of organophosphorus compounds[J]. FEMS Microbiology Reviews, 30(3) : 428–471. DOI:10.1111/j.1574-6976.2006.00018.x |
| [${referVo.labelOrder}] | Song J L, Gu J G, Zhai Y, et al. 2013. Biodegradation of nicosulfuron by a Talaromyces flavus LZM1[J]. Bioresource Technology, 140 : 243–248. DOI:10.1016/j.biortech.2013.02.086 |
| [${referVo.labelOrder}] | Wang N X, Tang Q, Ai G M, et al. 2012. Biodegradation of tribenuron methyl that is mediated by microbial acidohydrolysis at cell-soil interface[J]. Chemosphere, 86(11) : 1098–1105. DOI:10.1016/j.chemosphere.2011.12.013 |
| [${referVo.labelOrder}] | Wang Y H, Du L W, Chen Y X, et al. 2012. Biodegradation of pyrazosulfuron-ethyl by Acinetobacter sp.CW17[J]. Folia Microbiologica, 57(2) : 139–147. DOI:10.1007/s12223-012-0107-8 |
| [${referVo.labelOrder}] | Xu J, Li X S, Xu Y J, et al. 2009. Biodegradation of pyrazosulfuron-ethyl by three strains of bacteria isolated from contaminated soils[J]. Chemosphere, 74(5) : 682–687. DOI:10.1016/j.chemosphere.2008.09.078 |
| [${referVo.labelOrder}] | 杨旭, 唐玉, 陈芳艳, 等. 2011. 一株萘降解菌的分离鉴定及其降解特性研究[J]. 环境科学与技术, 2011, 34(10) : 43–47. |
| [${referVo.labelOrder}] | Zanardini E, Arnoldi A, Boschin G, et al. 2002. Degradation pathways of chlorsulfuron and metsulfuron-methyl by a Pseudomonas fluorescens strain[J]. Annals of Microbiology, 52(1) : 25–37. |
| [${referVo.labelOrder}] | Zhang H, Mu W H, Hou Z G, et al. 2012. Biodegradation of nicosulfuron by the bacterium Serratia marcescens N80[J]. Journal of Environmental Science and Health, Part B:Pesticides, Food Contaminants, and Agricultural Wastes, 47(3) : 153–160. DOI:10.1080/03601234.2012.632249 |
| [${referVo.labelOrder}] | Zhang J J, Chen Y F, Fang T, et al. 2013. Co-metabolic degradation of tribenuron methyl, a sulfonylurea herbicide, by Pseudomonas sp.strain NyZ42[J]. International Biodeterioration & Biodegradation, 76 : 36–40. |
| [${referVo.labelOrder}] | Zhao W S, Wang C, Xu L, et al. 2015. Biodegradation of nicosulfuron by a novel Alcaligenes faecalis strain ZWS11[J]. Journal of Environmental Sciences, 35 : 151–162. DOI:10.1016/j.jes.2015.03.022 |
| [${referVo.labelOrder}] | Zhao W S, Xu L, Li D Z, et al. 2015. Biodegradation of thifensulfuron-methyl by Ochrobactrum sp.in liquid medium and soil[J]. Biotechnology Letters, 37(7) : 1385–1392. DOI:10.1007/s10529-015-1807-3 |
 2017, Vol. 37
2017, Vol. 37


