CH4是一种重要的温室气体, 对全球增温潜势的贡献率达17%, 是同等浓度水平下CO2的23倍, 而且还参于对流层的化学反应(Parry, 2007;IPCC, 2007).一般认为通气性较好的旱地性土壤是最主要的大气CH4汇, 每年约能吸收10~44 Tg大气中的CH4, 对全球CH4汇的贡献率达到10%(Grosso et al., 2000;Fang et al., 2014).目前, 有关大气CH4汇的研究主要集中在草地(齐玉春等, 2005;Lin et al., 2015)、森林(Reay et al., 2005;Xu et al., 2007)、沙地(Angel et al., 2009;Hou et al., 2012)等土壤类型.统计表明, 目前全球盐碱土壤面积达9.5×108 hm2, 大约占陆地总面积的25%, 中国盐碱土壤面积约为0.6×108 hm2(Liu, 2008).随着盐渍化土壤面积的不断扩大, 盐含量及pH不断改变着土壤的质地结构、土壤有机碳及土壤肥力等(Wang et al., 2014).Steinkamp等(2001)研究表明, 土壤有机层阻隔了大气中CH4或O2向土壤中甲烷氧化菌的扩散.张景峰等(2011)研究发现, 当土壤盐含量从2.5 μmol·g-1 (以每g干土中的NaCl计)变化到10 μmol·g-1时, 导致CH4吸收速率从原来的45%降低到18%;Dalal等(2008)认为盐碱土壤中高盐离子浓度可能会通过土壤水势抑制CH4的氧化过程;Whalen (2000)通过室内实验证明了CH4吸收对盐离子很敏感, 尤其是氯离子.大多数甲烷氧化菌适宜生长在pH值范围为6.6~6.8, 其进行CH4氧化最适宜的pH范围大约为中性弱碱性环境, pH在7.0~7.5之间变动(Smith et al., 2008).Dunfield等(2003)在3种原始森林土壤中观测到甲烷氧化菌生长的最适pH为5.5, 而且能够生长繁殖并具有活跃的代谢功能.甲烷氧化菌是好气性土壤CH4吸收最主要的微生物之一, 能依靠CH4作为其生长的唯一的碳源和能源(Katrin et al., 2012;Jeremy et al., 2010).土壤中甲烷氧化菌种群及其CH4氧化活性直接影响着由土壤进入大气的CH4量, 改变着土壤中的CH4氧化速率(陈中云等, 2001).Nancy等(2014)通过对墨西哥盐碱土壤的研究表明, 增加盐浓度根本上是降低了土壤甲烷氧化菌的比活性, 间接地降低了CH4吸收速率;Menyailo等(2008)研究发现, 土壤甲烷氧化菌比活性在俄罗斯草原种植人工林后土壤CH4吸收速率变化中扮演重要角色;杨芊葆等(2010)通过对旱地农田土壤的研究发现, 比活性越大, CH4吸收速率越大.土壤甲烷氧化菌落特征主要受土壤性质的调控, 近几年一些大尺度的调查也证实, 土壤性质(如pH和盐含量)是调控土壤甲烷氧化菌群落多样性和群落结构的关键因子(Fierer et al., 2006).
目前, 国内有关CH4排放的研究主要集中在南方酸性土壤, 而CH4吸收潜力研究在北方旱地碱性土壤开展.由于有关环境因素(盐含量)对内蒙古中部河套灌区旱地盐碱土壤CH4吸收潜力的报道较少, 因此, 本研究通过室内培养实验探究在不同外源CH4浓度、外源盐加入对不同盐碱程度土壤CH4吸收潜力的影响, 为评估全球盐碱土壤温室气体汇的累积量提供理论依据.同时, 通过实时荧光定量PCR技术间接获得盐碱土壤甲烷氧化菌比活性的大小, 从微生物的角度探究CH4吸收的响应机制, 以期为治理盐碱土壤提供参考.
2 材料与方法(Materials and methods) 2.1 研究区概况供试土壤属于农田土壤, 种植葵花作物, 采于内蒙古自治区巴彦淖尔市乌拉特前旗, 地理位置在东经108°11′~109°54′、北纬40°28′~41°16′之间, 总面积7476 km2.研究区地处黄河北岸, 河套平原东端, 该地属中温带大陆性气候, 冬寒而长, 夏热而短, 干旱少雨, 春季风沙较大, 最高气温为39.7 ℃, 最低气温是-30.7 ℃, 年平均气温为7.7 ℃.年平均日照时间是3212.5 h.降水集中于6-9月, 年平均降水量为213.5 mm, 年蒸发量为1900~2300 mm.
2.2 样品采集试验时间为2014年5月(土壤未种植作物), 为避免地形等因素干扰, 研究样区选择为地势平坦地区, 按照邻近原则布置样点, 距离地表0~20 cm取样.依据不同盐碱程度土壤盐含量, 参照土壤盐化含量分级标准(王遵亲, 1993), 选取3种不同盐碱程度土壤(表 1):轻度盐化土(SA1)、强度盐化土(SB1)、盐土(SC1).一份土壤经风干研磨过2 mm筛, 用于理化性质测定和CH4培养实验, 另一份土壤迅速运回实验室, 然后将部分土壤分装于若干无菌离心管中, 于-8 ℃保存.
| 表 1 试验土壤盐分含量 Table 1 Salt content in test soil |
| 表 2 试验土壤基本理化性质 Table 2 Physico-chemical properties of soil samples |
土壤基本理化测定方法(鲍士旦, 2000)如下:pH采用复合电极法测定(土水质量比1:2.5), 电导率EC采用复合电极法测定(土水质量比1:5), 土壤容重ρb采用环刀法测定, 土壤质地用比重计速测法测定, 土壤有机质OC选用重铬酸钾容量-外加热法测定, 土壤TP用HClO4-H2SO4测定, 土壤TN通过凯氏定氮法测定, 土壤NH4+-N采用纳氏试剂比色法测定, 土壤NO3--N选用酚二磺酸比色法测定.试验土壤基本理化性质如表 2所示.
2.4 PCR体系的建立DNA提取采用CTAB/SDS方法.利用广泛存在于环境样品中的甲烷氧化菌pmoA基因的检测与定量化, 在pmoA定量过程中, 所采用的引物(Adrian et al., 2011)为A189f (5′-GGN GAC TGG GAC TTC TGC-3′)和A682r (5′-GAA SGC NGA GAA GAA SGC-3′), 利用2对特异性引物分别扩增样品DNA中细菌数目的DNA序列.QPCR反应所需PCR扩增体系(25 μL):10×PCR buffer 2.5 μL, dNTP (2.5 mmol·L-1)1.6 μL, primers F (5P)1 μL, primers R (5P)1 μL, Taq (5 U·μL-1)0.125 μL, 模板DNA 50 ng, 补H2O 16.775 μL.PCR扩增程序为:95 ℃预变性4 min;95 ℃变性30 s, 60 ℃复性30 s, 72 ℃延伸30 s, 30个循环;最终72 ℃延伸10 min.PCR产物采用AXYGEN公司DNA Gel Extraction Kit进行纯化.筛选阳性克隆, 对插入的细菌DNA片段进行序列测定, 序列正确的阳性克隆子利用试剂盒提取质粒作为标准品, 制备好的质粒标准品进行10倍梯度质量浓度稀释, 得到4个稀释度的标准模板, 以QPCR反应的循环数为横坐标, 以不同模板拷贝数的对数为纵坐标, 绘制标准曲线.PCR仪为Biometra公司生产的T-gradient, 凝胶成像仪为Bio-Rad公司的Gel-Doc2000凝胶成像系统.
2.5 CH4室内培养实验分别称取过100目筛的SA1、SB1、SC1土壤样品各50 g (相当于烘干土重), 装入250 mL规格的培养瓶(Glasgeratebau OCHS GmbH), 加入灭菌去离子水5 mL, 预培养7 d, 激活土壤微生物.7 d后取出培养瓶, 对土壤样品添加盐(KCl)溶液调节土壤盐含量(表 3), 并保证培养体系中土壤质量含水率为25%, T型硅胶塞封口, 于(25±1) ℃下恒温培养箱避光培养328 h.设置两种外源CH4浓度, 即大气外源CH4浓度(未向培养瓶中注射99.9%的CH4气体, 即(2.5±0.1) μL·L-1)和高外源CH4浓度, (向培养瓶中注射99.9%的CH4气体2 mL, 即(6451.6±2.9) μL·L-1).每个处理均设置3次重复.为了保持瓶内压力恒定, 抽取培养瓶空气体积5 mL, 之后用注射器从瓶内注入相同体积的空气, 前12次每隔12 h抽取培养瓶中混合气体, 之后每24 h抽1次, CH4质量浓度用改进后的气相色谱仪(Agilent 6820)测定.仪器配备:FID检测器和不锈钢的Porapak Q (80/100 mesh);工作条件设定:柱温、进样口和检测器的温度分别设为55、130、250 ℃, 载气(氮气)、FID氢气和FID空气的流速分别设为30、30和400 mL·min-1.
| 表 3 外源盐调控土壤盐分含量 Table 3 Exogenous salt content in soils |
甲烷氧化菌丰度、CH4吸收速率和比活性的计算公式分别如式(1)~(3)所示.
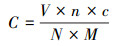
|
(1) |
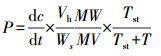
|
(2) |
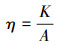
|
(3) |
式中, C为甲烷氧化菌丰度(copies);V为DNA体积(μL);n为DNA物质的量(个·mol-1);c为样品中检测目标的质量浓度:依据标准品, PCR得到的数据通过换算得到样品片段的质量浓度(ng·μL-1);N为pEASY-T碱基数, 即为载体构建的标准品碱基对的数量(个);M为脱氧核糖核苷酸平均分子量(607.4 g·mol-1);P为CH4吸收速率(μg·kg-1·h-1)(负值代表吸收, 正值表明排放);dc/dt为单位时间培养瓶内CH4质量浓度的变化量(μg·kg-1·h-1);Vh指培养瓶内部空间的体积(mL);Ws为土样的质量(g);MW表示CH4的分子量, 取值为16.04;MV为标准状态下1 mol气体的体积, 取值为22.4 L;T为培养温度(℃);Tst为标准温度(℃);η为比活性(μg·kg-1·copies-1·h-1);K为单位土壤吸收速率(μg·kg-1·h-1);A为该土壤pmoA基因丰度(copies).
采用OriginPro8.0和Excel 2010软件进行数据处理和制图, 利用SPSS22.0软件进行单因素方差分析(AVNOA), 以不同字母表示差异显著.
3 结果与分析(Resulets and analysis) 3.1 不同盐碱程度土壤无外源盐调控的CH4吸收大气外源CH4浓度((2.5±0.1) μL·L-1)和高外源CH4浓度((6451.6±2.9) μL·L-1)条件下, 随着培养时间的增加, 3种不同盐碱程度土壤(轻度盐化土壤SA1、强度盐化土壤SB1、盐土SC1)表现为CH4吸收速率降低趋势, 整体表现为吸收特征, CH4吸收速率为负值, 培养30 h和78 h时出现排放特征, CH4吸收速率为正值, 培养后328 h时, CH4吸收速率曲线趋于稳定, 数值接近0 μg·kg-1·h-1;3种不同盐碱程度土壤在培养12 h内CH4吸收速率有最大值, 分别为(-0.9±0.1) μg·kg-1·h-1(图 1a)和(-3.0±0.1)×103 μg·kg-1·h-1(图 1b).大气外源CH4浓度下, 土壤SA1、SB1、SC1吸收速率曲线上下波动幅度较大, 盐碱程度越高, CH4吸收速率曲线变化越剧烈;高外源CH4浓度下, 土壤SA1、SB1、SC1吸收速率曲线轨迹基本一致, 上下波动幅度较缓, 在培养后210 h达到稳定.
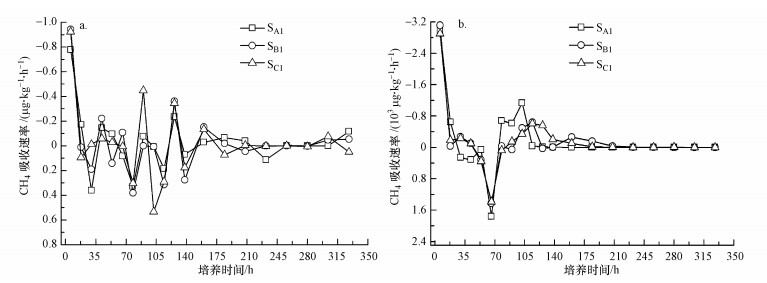 |
| 图 1 不同外源CH4浓度下无外源盐调控的不同盐碱程度土壤CH4吸收速率随时间的变化(a.大气外源CH4浓度, b.高外源CH4浓度) Fig. 1 Change in CH4 uptake rate without exogenous salt and different exogenous CH4 concentrations in saline-alkaline soils (a.atmospheric exogenous CH4 concentration, b.high exogenous CH4 concentration) |
两种不同外源CH4浓度下, 无外源盐调控的3种不同盐碱程度土壤SA1、SB1、SC1的CH4累积吸收量均表现为:SA1>SB1>SC1.土壤SA1的CH4累积吸收量最大, 分别为7.29 μg·kg-1和4.40×104 μg·kg-1, 而土壤SC1的CH4累积吸收量最小, 分别为6.46 μg·kg-1和3.83×104 μg·kg-1(图 2).不同外源CH4浓度下土壤CH4累积吸收量平均值表现为:高外源CH4浓度(4.10×104 μg·kg-1)远远大于大气外源CH4浓度(6.85 μg·kg-1).
 |
| 图 2 不同外源CH4浓度下无外源盐调控的不同盐碱程度土壤CH4累积吸收量(a.大气外源CH4浓度, b.高外源CH4浓度) Fig. 2 CH4 uptake accumulation without exogenous salt and different exogenous CH4 concentrations in saline-alkaline soils (a.atmospheric exogenous CH4 concentration, b.high exogenous CH4 concentration) |
两种不同外源CH4浓度下, 外源盐分调控的3种不同盐碱程度土壤(SA、SB、SC)中, 随着培养时间的增加, CH4的吸收速率呈现降低趋势, 在培养12 h内, CH4吸收速率达到最大值.大气外源CH4浓度下, 添加外源盐后, 3种不同盐碱程度土壤的CH4吸收速率曲线变化幅度降低, 培养后126 h时, 均出现吸收峰值;高外源CH4浓度下, 添加不同外源盐后, 3种不同盐碱程度土壤CH4吸收速率曲线变化一致, 相比较无外源盐添加处理, 达到稳定的时间变短, 约为培养后184 h.
两种不同外源CH4浓度下, 3种不同盐碱程度土壤(SA1、SB1、SC1)均表现为随着添加盐含量的增加, CH4累积吸收量呈现降低的趋势, 即SA1>SA2>SA3, SB1>SB2>SB3, SC1>SC2>SC3 (图 3、图 4).由单因素AVNOA方差分析可以发现, 不同盐梯度土壤之间CH4累积吸收量具有明显的差异性(F=367.6, p < 0.01(大气外源CH4浓度);F=913.5, p < 0.01(高外源CH4浓度)).大气外源CH4浓度下, 轻度盐化土壤(SA1~SA3)盐含量从0.1%增加到0.2%、0.3%时, CH4累积吸收量分别降低7.4%和18.7%;强度盐化土壤(SB1~SB3)盐含量从0.8%增加到1.6%、2.4%时, CH4累积吸收量分别降低3.7%和9.0%;盐土(SC1~SC3)盐含量从1.7%增加到3.4%、5.1%时, CH4累积吸收量分别降低1.7%和42.3%.高外源CH4浓度下, 轻度盐化土壤(SA1~SA3)盐含量从0.1%增加0.2%、0.3%时, CH4累积吸收量分别降低0.5%、1.4%;强度盐化土壤(SB1~SB3)盐含量从0.8%增加到1.6%、2.4%时, CH4累积吸收量分别降低43.4%、47.1%;盐土(SC1~SC3)盐含量从1.7%增加到3.4%、5.1%时, CH4累积吸收量分别降低39.7%、46.5%.这表明盐含量高的盐土SC1加入外源盐后, 会明显降低CH4吸收.两种不同外源CH4浓度下, 盐含量与CH4累积吸收量均呈显著负相关关系, r=-0.8020(n=9, p < 0.01)和r=-0.8470(n=9, p < 0.01)(表 4).
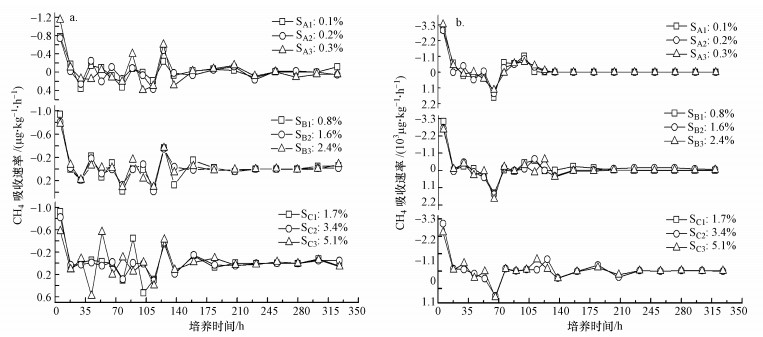 |
| 图 3 不同外源CH4浓度下外源盐调控的不同盐碱程度土壤CH4吸收速率变化(a.大气外源CH4浓度, b.表示高外源CH4浓度) Fig. 3 Change in CH4 uptake rate with exogenous salt and different CH4 concentrations in saline-alkaline soils (a.atmospheric exogenous CH4 concentration, b. high exogenous CH4 concentration) |
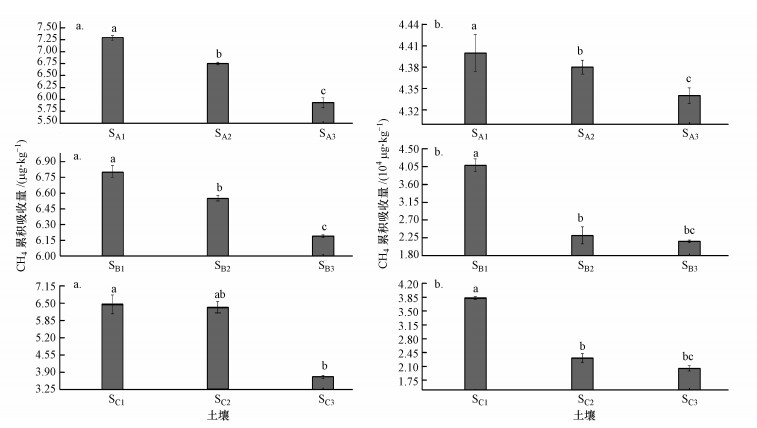 |
| 图 4 不同外源CH4浓度下外源盐调控的不同盐碱程度土壤CH4累积吸收量(a.大气外源CH4浓度, b.高外源CH4浓度) Fig. 4 CH4 uptake accumulation with exogenous salt and different CH4 concentrations in saline-alkaline soils (a.atmospheric exogenous CH4 concentration, b. high exogenous CH4 concentration) |
| 表 4 不同外源CH4浓度下CH4吸收与土壤性质的相关关系 Table 4 Correlation between CH4 uptake and soil properties with different exogenous CH4 concentrations |
两种外源CH4浓度下, 不同盐梯度土壤甲烷氧化菌丰度变化范围为493.90~3030.97 copies, 变化范围较小, 不具有显著的相关性(p>0.05).大气外源CH4浓度下, 无外源盐添加时, 3种不同盐碱程度土壤(SA1、SB1、SC1)甲烷氧化菌丰度表现为SA1>SB1>SC1, 分别为493.90、778.90、1474.77 copies, 而外源盐含量和外源CH4浓度对土壤甲烷氧化菌丰度影响不显著.
3.3.2 盐碱土壤甲烷氧化菌比活性分析两种外源CH4浓度下, 3种不同盐碱程度土壤(SA1、SB1、SC1)均表现为添加盐含量增加, 土壤甲烷氧化菌比活性降低的趋势, 即:SA1>SA2>SA3, SB1>SB2>SB3, SC1>SC2>SC3 (图 5).由单因素AVNOA方差分析可以发现, 不同盐梯度土壤之间甲烷氧化菌比活性具有明显的差异性(F=134.8, p < 0.01;F=902.3, p < 0.01).不同外源CH4浓度下, 土壤甲烷氧化菌比活性平均值表现为:高外源CH4浓度(8.27×10-2 μg·kg-1·copies-1·h-1)>大气外源CH4浓度(1.63×10-5 μg·kg-1·copies-1·h-1).大气外源CH4浓度下, 轻度盐化土壤(SA1~SA3)盐含量从0.1%增加到0.2%、0.3%时, 土壤甲烷氧化菌比活性分别降低45.0%和66.6%;强度盐化土壤(SB1~SB3)添加盐含量从0.8%增加到1.6%、2.4%时, 土壤甲烷氧化菌比活性分别降低63.5%和69.5%;盐土(SC1~SC3)盐含量从1.7%增加到3.4%、5.1%时, 土壤甲烷氧化菌比活性分别降低34.3%和77.6%.这表明盐含量高的盐土SC1加入外源盐后, 土壤甲烷氧化菌比活性降低较明显.高外源CH4浓度下, 轻度盐化土壤(SA1~SA3)添加盐含量从0.1%增加到0.2%、0.3%时, 土壤甲烷氧化菌比活性分别降低7.8%和9.7%;强度盐化土壤(SB1~SB3)盐含量从0.8%增加到1.6%、2.4%时, 土壤甲烷氧化菌比活性分别降低45.3%和65.6%;盐土(SC1~SC3)添加盐含量从1.7%增加到3.4%、5.1%时, 土壤甲烷氧化菌比活性分别降低32.1%和55.5%.这表明盐含量低的轻度盐化土壤SA1外源调控盐后, 土壤甲烷氧化菌比活性降低不明显, 盐含量较高的土壤(SB1、SC1)加入外源盐后, 明显降低土壤甲烷氧化菌比活性.两种外源CH4浓度下, 盐含量与土壤甲烷氧化菌比活性均呈显著负相关关系, r=-0.6670(n=9, p < 0.05)和r=-0.8970(n=9, p < 0.01)(表 4).
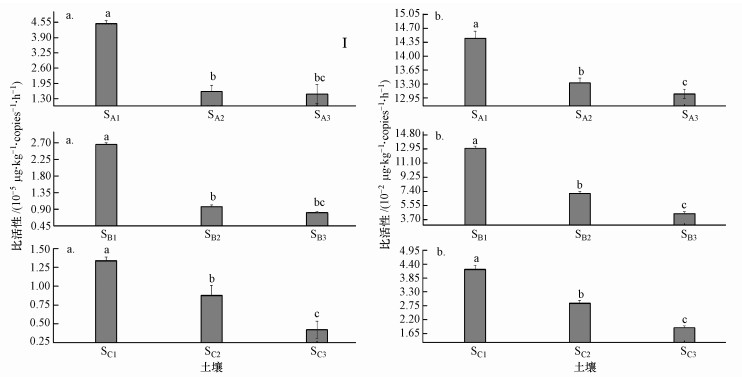 |
| 图 5 不同外源CH4浓度下不同盐碱程度土壤中的甲烷氧化菌比活性(a.大气外源CH4浓度, b.高外源CH4浓度) Fig. 5 Methanotrophs special activity with exogenous salt and different CH4 concentrations in saline-alkaline soils (a.atmospheric exogenous CH4 concentration, b. high exogenous CH4 concentration) |
两种外源CH4浓度下, 甲烷氧化菌比活性与CH4累积吸收量呈线性显著正相关关系.表明盐碱土壤甲烷氧化菌比活性越高, CH4累积吸收量越大.高外源CH4浓度下, 土壤甲烷氧化菌比活性与CH4累积吸收量相关系数更高;大气外源CH4浓度下, 土壤甲烷氧化菌比活性降低百分数与CH4累积吸收降低量呈非线性正相关关系(r=0.8860, p < 0.05, n=6);在高浓度CH4环境下, 土壤甲烷氧化菌比活性降低百分数与CH4累积吸收降低量表现为线性正相关关系(r=0.9143, p < 0.05(n=6).表明两种外源CH4浓度下, 盐碱土壤甲烷氧化菌比活性降低百分数越大, CH4累积吸收减少量越高.
4 讨论(Discussion)外源盐调控的盐碱土壤盐含量在0.1%~5.1%变化时, CH4累积吸收量表现为:轻度盐化土壤(SA)>强度盐化土壤(SB)>盐土(SC), 随着土壤盐含量的增加, CH4吸收速率呈降低趋势.Nanba等(2000)通过对美国缅甸洲森林土壤的铝盐添加实验发现, 不同种类的铝盐, 包括AlCl3、Al (NO3)3和Al2(SO4)3都会抑制CH4吸收, 其中, AlCl3的抑制率最高;Whalen (2000)通过实验证明, 相比较铵根离子和硝酸根离子, 高浓度氯离子会强烈地抑制CH4的吸收潜力.Chambers等(2011)在圣约翰高盐湿地土壤中得到, 不同浓度的盐(NaCl)对CH4吸收的抑制率不同, 其中, 35 g·kg-1 NaCl的抑制率为55%, 而14 g·kg-1 NaCl的抑制率仅为23%, 因此, 高浓度的NaCl对CH4吸收的抑制作用更强;张景峰等(2011)发现, 土壤CH4吸收速率表现为:中度盐碱土壤(EC=7.8 mS·cm-1)>重度盐碱土壤(EC=12.2 mS·cm-1), 与本研究结论一致.回归分析得出, 土壤CH4累积吸收量的改变57%是由盐含量所决定的(Osudar et al., 2015).Nancy等(2014)在研究墨西哥湖区盐碱土壤(EC=85.1 mS·cm-1)时发现, 该区域CH4吸收速率是中国黄河流域盐碱土壤(3.2 mS·cm-1)的900倍, 说明较高的盐含量会强烈降低CH4的吸收潜力.
值得注意的是, 培养时间在0~70 h内出现了CH4排放高峰值, 表明好氧环境培养期间仍可能有相当数量的CH4产生.CH4是产甲烷菌在严格厌氧条件产生的, 因此, 理论上CH4应在极端还原条件下才能产生(丁维新等, 2002).尽管培养在好氧条件下进行, 但由于盐碱土壤质地较为粘重, 内部可能仍然存在厌氧微环境.早期研究证明, 颗粒很小的粘土能使产甲烷菌在有氧条件下存活(Wagner et al., 1999).本研究温度和土壤质量含水率恒定, 土壤CH4产生主要应受盐碱土壤中产甲烷菌丰度和活性的影响, 而产甲烷菌的丰度和活性影响土壤电动势, 即适合的厌氧微环境.同时, 本研究甲烷氧化菌丰度与CH4吸收潜力没有表现出一致的规律性, 说明在不同的培养期内甲烷氧化菌可能和产甲烷菌共同作用, 共同竞争碳源, 较高的土壤含盐量可能降低土壤水势, 导致甲烷氧化菌出现生理性缺水, 从而降低土壤CH4吸收(闵航等, 2002).由于培养土壤内部可能仍然存在适合产甲烷菌活动的厌氧微环境, 因此, 当产甲烷菌的数量和活性达到一定程度时, 就会使得CH4的产生量超过氧化量, 可能导致CH4排放现象的出现.好氧条件下CH4的产生已为诸多研究所证实.徐华等(2008)发现, 水稻土在好氧条件下仍有相当数量的CH4产生;Boeckx等(1991)研究比利时10种不同草地土壤质地CH4吸收潜力时发现, 重粘质土和粘质土均出现CH4排放现象;王长科等(2008)的研究亦表明, 好氧培养条件下, 旱田表层土壤CH4的吸收潜力为0, 反而表现为CH4排放特征.
本研究表明, 盐碱土壤甲烷氧化菌比活性和土壤盐含量呈正相关关系, 即土壤盐含量增加, 甲烷氧化菌比活性降低.盐含量是影响土壤微生物活性的重要因素之一, 其中, 甲烷氧化菌已经被证实广泛存在于盐碱土壤中(Chambers et al., 2000), 土壤含盐量与甲烷氧化菌的群落结构(包括种类、丰度、多样性及比活性等因素)高度相关(César et al., 2012;Lin et al., 2015), 土壤对CH4的氧化能力受甲烷氧化菌多样性的显著影响, MOB Ⅰ和MOB Ⅱ的多样性与土壤对CH4氧化活性有一致的趋势(郑聚锋等, 2008).Osudar等(2015)在比较德国南部土壤时证实, 影响甲烷氧化菌比活性的两个重要因素分别是外源CH4浓度和土壤盐含量.盐含量高的盐碱土壤, 甲烷氧化菌比活性低, 这可能是因为甲烷氧化菌种群的另外一种pMMO酶在盐碱程度高的土壤停止表达(邓永翠, 2013).有研究发现, 只有在外源CH4浓度>30 nmol·L-1时, CH4吸收速率与盐含量呈显著负相关, 相关系数r=-0.39(Osudar et al., 2015).
不同外源CH4浓度下, 土壤CH4累积吸收量表现为:高外源CH4浓度(4.10×104 μg·kg-1)远远大于大气外源CH4浓度(6.85 μg·kg-1).当外源CH4浓度较高时, 盐含量较低的土壤起始消耗CH4的速度较快(Middelburg et al., 2012), 可能的原因是充足外源碳的环境下, 低盐土壤甲烷氧化菌比活性更强;Aronson等(2010)发现, 过高的铵离子也会抑制甲烷氧化菌的比活性大小.因此, 随着土壤盐含量的增加, 土壤甲烷氧化菌比活性降低, CH4累积吸收量亦降低.杨铭德等(2015)通过对3种不同盐含量土壤室内培养实验及荧光定量PCR技术发现, 土壤甲烷氧化菌比活性是解释土壤氧化潜力的根本原因;杨芊葆等(2010)的研究也表明, 暗棕土壤甲烷氧化菌的比活性与CH4累积吸收量具有显著正相关关系.
5 结论(Conclusions)1)两种不同外源CH4浓度下, 无外源盐调控时, 3种不同盐碱程度土壤(SA、SB、SC)均表现为盐碱程度增加, CH4累积吸收量降低的趋势;轻度盐化土壤(SA1)吸收最多, 强度盐化土壤(SB1)次之, 盐分含量高的盐土(SC1) CH4吸收最低.
2)两种不同外源CH4浓度下, 外源盐加入3种不同盐碱程度土壤后对CH4的影响不尽一致.外源盐加入后, 随土壤盐分水平的升高, 盐土CH4累积吸收量最低, 强度盐化土壤CH4累积吸收量较高, 轻度盐化土壤CH4累积吸收量最高.
3)两种不同外源CH4浓度下, 3种不同盐碱程度土壤随添加盐含量增加, 甲烷氧化菌比活性均降低, 盐含量低的轻度盐化土壤土SA1加入外源盐后, 土壤甲烷氧化菌比活性降低不明显, 盐含量较高的土壤(SB1、SC1)加入外源盐后, 明显降低了土壤甲烷氧化菌比活性.甲烷氧化菌比活性越高, CH4累积吸收量越大;盐碱土壤甲烷氧化菌比活性变化量越大, CH4累积吸收变化量亦越大.
| [${referVo.labelOrder}] | Adger N, Aggarwal P, Agrawala S, et al.2007.Climate Change 2007-Impacts, Adaptation and Vulnerability.Working Group I Contribution to the Fourth Assessment Report of the IPCC[M].New York+Cambridge:Cambridge University Press.1-22 |
| [${referVo.labelOrder}] | Adrian H, Claudia L, Peter F. 2011. Recovery of methanotrophs from disturbance:population dynamics, evenness and functioning[J]. The ISME Journal, 5(4) : 750–758. DOI:10.1038/ismej.2010.163 |
| [${referVo.labelOrder}] | Angel R, Conrad R. 2009. In situ measurement of methane fluxes and analysis of transcribed particulate methane monooxygenase in desert soils[J]. Environmental Microbiology, 11 : 2598–2610. DOI:10.1111/emi.2009.11.issue-10 |
| [${referVo.labelOrder}] | Aronson E L, Helliker B R. 2010. Methane flux in non-wetland soils in response to nitrogen addition:a meta-analysis[J]. Ecology, 91(11) : 3242–3251. DOI:10.1890/09-2185.1 |
| [${referVo.labelOrder}] | Boeckx P, Van Cleemput O, Villaralvo I. 1991. Methane oxidation in soils with different textures and land use[J]. Nutrient Cycling in Agroecosystems, 49 : 91–95. |
| [${referVo.labelOrder}] | 鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业出版社. |
| [${referVo.labelOrder}] | 陈中云, 阈航, 昊伟祥, 等. 2001. 土壤中甲烷氧化菌种群数量及其与甲烷氧化活性的关系[J]. 浙江大学学报(农业与生命科学版), 2001, 27(5) : 146–155. |
| [${referVo.labelOrder}] | César V E, Rocio J A H, Isabel E A, et al. 2012. The archaeal diversity and population in a drained alkaline saline soil of the former lake Texcoco (Mexico)[J]. Geomicrobiology Journal, 29(1) : 18–22. DOI:10.1080/01490451.2010.520075 |
| [${referVo.labelOrder}] | Chambers L G, Reddy K R, Osborne T Z. 2011. Short-term response of carbon cycling to salinity pulses in a freshwater wetland[J]. Soil Science Society of America, 75(5) : 2000–2007. DOI:10.2136/sssaj2011.0026 |
| [${referVo.labelOrder}] | 邓永翠.2013.青藏高原湿地好氧甲烷氧化菌的群落多样性及活性研究[D].北京:中国科学院大学.130 |
| [${referVo.labelOrder}] | 丁维新, 蔡祖聪. 2002. 沼泽CH4排放及其主要影响因素[J]. 地理科学, 2002, 22(5) : 619–625. |
| [${referVo.labelOrder}] | Dalal R C, Allen D E, Livesley S J, et al. 2008. Magnitude and biophysical regulators of methane emission and consumption in the Australian agricultural, forest and submerged landscapes:a review[J]. Plant and Soil, 309(1/2) : 43–76. |
| [${referVo.labelOrder}] | Dunfield P F, Khmelenina V N, Suzina N E, et al. 2003. Methylocella silvestris sp[J]. Nov., a novel methanotroph isolated from an acidic forest cambisol[J].International Journal of Systematic and Evolutionary Microbiology, 53(5) : 1231–1239. |
| [${referVo.labelOrder}] | Fang H J, Cheng S L, Yu G R. 2014. Low-level nitrogen deposition significantly inhibits methane uptake from an alpine meadow soil on the Qinghai-Tibetan Plateau[J]. Geoderma, 213 : 444–452. DOI:10.1016/j.geoderma.2013.08.006 |
| [${referVo.labelOrder}] | Fierer N, Jackson R B. 2006. The diversity and biogeography of soil bacterial communities[J]. PNAS, 103(3) : 626–631. DOI:10.1073/pnas.0507535103 |
| [${referVo.labelOrder}] | Grosso S J D, Parton W J, Mosier A R, et al. 2000. General CH4 oxidation model and comparisons of CH4 oxidation in natural and managed systems[J]. Global Biogeochemical Cycles, 14(4) : 999–1019. DOI:10.1029/1999GB001226 |
| [${referVo.labelOrder}] | Hou L Y, Wang Z P, Wang J M, et al. 2012. Growing season in situ uptake of atmospheric methane by desert soils in a semiarid region of northern China[J]. Geoderma, 189 : 415–422. |
| [${referVo.labelOrder}] | Jeremy D S, Alan A D, Sukhwan Y. 2010. Methanotrophs and copper[J]. FEMS Microbiology Reviews, 34(4) : 496–531. DOI:10.1111/j.1574-6976.2010.00212.x |
| [${referVo.labelOrder}] | Katrin W, Heiner F, Edzo V. 2012. Atmospheric methane uptake by tropical montane forest soils and the contribution of organic layers[J]. Biogeochemistry, 111(1/3) : 469–483. |
| [${referVo.labelOrder}] | Lin J L, Joye S B, Scholten J C M, et al. 2005. Analysis of methane monooxygenase genes in mono lake suggests that increased methane oxidation activity may correlate with a change in methanotroph community structure[J]. Applied and Environmental Microbiology, 71(10) : 6458–6462. DOI:10.1128/AEM.71.10.6458-6462.2005 |
| [${referVo.labelOrder}] | Lin X W, Wang S P, Hu Y G, et al. 2015. Experimental warming increases seasonal methane uptake in an alpine meadow on the Tibetan Plateau[J]. Ecosystems, 18(2) : 274–286. DOI:10.1007/s10021-014-9828-7 |
| [${referVo.labelOrder}] | Liu J H. 2008. Research progress of development and control of saline land[J]. Journal of Shanxi Agricultural Science, 36(12) : 51–53. |
| [${referVo.labelOrder}] | Menyailo O V, Hungate B A, Abraham W R, et al. 2008. Changing land use reduces soil CH4 uptake by altering biomass and activity but not composition of high-affinity methanotrophs[J]. Global Change Biology, 14(10) : 2405–2419. DOI:10.1111/gcb.2008.14.issue-10 |
| [${referVo.labelOrder}] | 闵航, 陈中云, 吴伟祥, 等. 2002. 碳、氮物质对水稻田土壤CH4氧化活性影响的研究[J]. 环境科学学报, 2002, 22(1) : 70–75. |
| [${referVo.labelOrder}] | Middelburg J J, Nieuwenhuize J, Iversen N, et al. 2002. Methane distribution in European tidal estuaries[J]. Biogeochemistry, 59 : 95–119. DOI:10.1023/A:1015515130419 |
| [${referVo.labelOrder}] | Nanba K, KING A M. 2000. Response of atmospheric methane consumption by maine forest Soils to exogenous aluminum salts[J]. Applied and Environmental Microbiology, 66(9) : 3674–3679. DOI:10.1128/AEM.66.9.3674-3679.2000 |
| [${referVo.labelOrder}] | Nancy S S, Cesar V E, Rodolfo M, et al. 2014. Changes in methane oxidation activity and methanotrophic community composition in saline alkaline soils[J]. Extremophiles, 18(3) : 561–571. DOI:10.1007/s00792-014-0641-1 |
| [${referVo.labelOrder}] | Osudar R, Matousu A, Alawi M, et al. 2015. Environmental factors affecting methane distribution and bacterial methane oxidation in the German Bight (North Sea)[J]. Estuarine Coastal and Shelf Science, 160 : 10–21. DOI:10.1016/j.ecss.2015.03.028 |
| [${referVo.labelOrder}] | 齐玉春, 董云社, 杨小红, 等. 2005. 放牧对温带典型草原含碳温室气体CO2、CH4通量特征的影响[J]. 资源科学, 2005, 17(2) : 104–109. |
| [${referVo.labelOrder}] | Reay D S, Nedwell D B, McNamara N, et al. 2005. Effect of tree species on methane and ammonium oxidation capacity in forest soils[J]. Soil Biology and Biochemistry, 37 : 719–730. DOI:10.1016/j.soilbio.2004.10.004 |
| [${referVo.labelOrder}] | Smith N R, Kishchuk B E, Mohn W W. 2008. Effects of wildfire and harvest disturbances on forest soil bacterial communities[J]. Applied and Environmental Microbiology, 74(1) : 216–224. DOI:10.1128/AEM.01355-07 |
| [${referVo.labelOrder}] | Solomon S, Qin D, Manning M, et al.2007.Climate Change 2007-the Physical Science Basis Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panelon Climate Change[M].New York:J Neorealism.95-844 |
| [${referVo.labelOrder}] | Steinkamp R, Butterbach B H, Papen H. 2001. Methane oxidation by soils of an N limited and N fertilized spruce forest in the black forest[J]. Soil Biology and Biochemistry, 33(2) : 145–153. DOI:10.1016/S0038-0717(00)00124-3 |
| [${referVo.labelOrder}] | Wagner D, Pfeiffer E M, Bock E. 1999. Methane production in aerated marshland and model soils:effects of microflora and soil texture[J]. Soil Biology and Biochemistry, 31 : 999–1006. DOI:10.1016/S0038-0717(99)00011-5 |
| [${referVo.labelOrder}] | Wang Q J, Lu C Y, Lia H W, et al. 2014. The effects of no-tillage with subsoiling on soil properties and maize yield:12-Year experiment on alkaline soils of Northeast China[J]. Soil and Tillage Research, 137 : 43–49. DOI:10.1016/j.still.2013.11.006 |
| [${referVo.labelOrder}] | Whalen S C. 2000. Influence of N and non-N salts on atmospheric methane oxidation by upland boreal forest and tundra soils[J]. Biology and Fertility of Soils, 31(3/4) : 279–287. |
| [${referVo.labelOrder}] | 王长科, 吕宪国, 蔡祖聪, 等. 2006. 土地利用方式对白浆土氧化甲烷的影响[J]. 地理研究, 2006, 25(2) : 335–341. |
| [${referVo.labelOrder}] | 王遵亲. 1993. 中国盐渍土[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | 徐华, 蔡祖聪, 八木一行. 2008. 水稻土甲烷产生潜力及其影响因素[J]. 土壤学报, 2008, 45(1) : 98–104. |
| [${referVo.labelOrder}] | Xu X K, Inubushi K. 2007. Effects of nitrogen sources and glucose on the consumption of ethylene and methane by temperate volcanic forest surface soils[J]. Chinese Science Bulletin, 52(23) : 3281–3291. DOI:10.1007/s11434-007-0499-z |
| [${referVo.labelOrder}] | 杨铭德, 焦燕, 李新, 等. 2015. 基于实时荧光定量PCR技术对不同盐碱程度土壤甲烷氧化菌比活性的研究[J]. 生态环境学报, 2015, 24(5) : 797–803. |
| [${referVo.labelOrder}] | 杨芊葆, 范分良, 王万雄, 等. 2010. 长期不同施肥对暗棕壤甲烷氧化菌群落特征与功能的影响[J]. 环境科学, 2010, 31(11) : 2756–2762. |
| [${referVo.labelOrder}] | Zhang J F, Li Z J, Ning T Y, et al. 2011. Methane uptake in salt-affected soils shows low sensitivity to salt addition[J]. Soil Biology and Biochemistry, 43(7) : 1434–1439. DOI:10.1016/j.soilbio.2011.03.010 |
| [${referVo.labelOrder}] | 郑聚锋, 张平究, 潘根兴, 等. 2008. 长期不同施肥下水稻土甲烷氧化能力及甲烷氧化菌多样性的变化[J]. 生态学报, 2008, 28(10) : 4865–4872. |
 2017, Vol. 37
2017, Vol. 37


