2. 固体废物处理与资源化广东省环境保护重点实验室, 广州 510006;
3. 工业聚集区污染控制与生态修复教育部重点实验室, 广州 510006
2. Guangdong Environmental Protection Key Laboratory of Solid Waste Treatment and Recycling, Guangzhou 510006;
3. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou 510006
磺胺二甲基嘧啶(4-氨基-N-(4, 6-二甲基-2-嘧啶基),Sulfamethazine,SMT)是一种广谱抗菌剂,因其疗效长,相对安全等特点而被广泛用于人和动物的疾病治疗与预防(赵方, 2012).其进入动物体内后只有小部分被吸收转化,有高达85%以上的抗生素会以原药或代谢产物的形式被排到体外,并在使用动物粪便施肥过程中进入土壤(赵双阳, 2013).与此同时,随着大量重金属的开采和利用,不可避免的导致重金属通过多种途径进入到环境中,从而造成重金属和抗生素的复合污染(胡秀敏等, 2013).数据显示,在猪场等典型复合污染环境中,SMT浓度最高达47 μg·L-1.根据黄治平等(2008)报道,河北某县猪场(万头)猪粪中镉的总量为6.93 mg·kg-1,有效态为0.32 mg·kg-1,由于菜农长期施用该猪场的粪肥来改善土壤肥力,每年土壤中的镉含量还在以约0.87 kg·hm-2的速度增加.
抗生素与重金属共存时会相互产生影响,从而影响各自在环境中的行为(Bao et al., 2013).已有的研究表明,抗生素可改变矿物表面带电情况(Wang et al., 2008);抗生素也可与重金属产生竞争吸附,降低重金属在矿物上的吸附能力(黄文飞, 2007); 另外,抗生素本身所含的可电离有机官能团(羟基、羧基、氨基等)能与重金属络合(Wallis, 1996),形成矿物-有机物-重金属三元络合物,从而改变重金属在环境中的赋存形态,影响其化学和生物行为(Pei et al., 2011).有学者用量子化学方法研究了SMT与Fe3+络合物的结构,并测试了络合物的抗菌性能(Mansour, 2014).Wu等(2012)研究了磺胺甲恶唑(SMX)与铜在碳纳米管(CNTs)上的共吸附现象,并推测可能会形成三元络合物Cu-SMX-CNTs或SMX-Cu-CNTs, 从而影响SMX与铜在CNTs上的吸附行为.本研究以地表环境中分布广泛的针铁矿作为土壤活性介质的代表(Zhao et al., 2014),考察SMT与镉的络合能力以及SMT对针铁矿吸附镉的影响,为准确评估复合污染条件下抗生素与重金属的环境效应提供依据.
2 材料与方法(Materials and methods) 2.1 实验材料SMT (纯度>99%)购于美国Sigma公司,-20 ℃保存;乙腈和甲醇均为色谱纯,购自上海安谱科学仪器有限公司,其它试剂均为分析纯,购自阿拉丁试剂有限公司;实验用水为超纯水,由Milli-Q超纯水仪制备(Merck Millipore Advantage A10).SMT的理化性质见表 1.
| 表 1 磺胺二甲基嘧啶的分子结构与理化性质 Table 1 Structures and physico-chemical properties of SMT |
在不同的pH条件下SMT以不同的形式存在.溶液pH值小于2.28时带正电荷,在pH值大于2.28小于7.42时,以不带电荷的分子态形式存在,在pH>7.28时以带负电荷的离子态存在.
2.2 制备针铁矿针铁矿(α-FeOOH)的制备参考Brigante (2010)方法,向Fe (NO3)3水溶液中加入2.5 mol·L-1的NaOH,将悬浮液pH值调整到12.0.混合悬浮液置于60 ℃烘箱陈化24 h后,将沉淀倒入透析袋中,在去离子水中浸泡,定时换水,直至溶液pH值呈中性.离心分离沉淀物,将沉淀置于真空干燥箱中干燥,研磨后过200目筛保存.将制得的针铁矿分别进行AFM、XRD、比表面分析仪(Micromeritics, ASAP2000型)及表面电位分析仪(Zetasizer Nano ZS 90, Malvern, UK)进行表征, 表征结果见图 1.将其XRD图谱与标准矿物(针铁矿Goethite卡片号29-0713)及相关文献对照,可以确定该合成的矿物为针铁矿.其比表面积为58.89 m2·g-1,等电点为9.2.
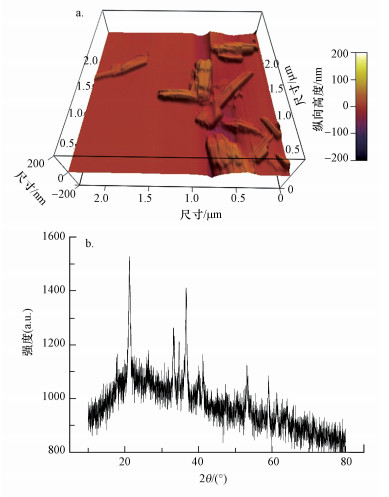 |
| 图 1 针铁矿的原子力显微镜,XRD图 Fig. 1 AFM (a) and XRD patterns (b) of goethite |
络合实验:配置一系列同时含有SMT浓度为10 mg·L-1,镉离子浓度为100~800 mg·L-1的混合溶液,并设置10 mg·L-1 SMT不添加镉的空白对照.用35 mL的玻璃离心管作为反应容器.放入25 ℃环境中静置30 min,避光.待体系达到反应平衡后,使用紫外可见分光光度计扫描其在220~320 nm的吸收光谱,计算络合前后SMT吸光度的差值记为ΔA,选取ΔA最大波长处作为实验波长.预实验表明,在波长262 nm处,SMT络合前后吸光度差异最大.将相关参数带入方程(1)中拟合,计算络合常数.
单吸附体系:分别配制一系列初始浓度为0.5~50 mg·L-1 SMT和2~300 mg·L-1的镉吸附液.并投加一定量的针铁矿,用35 mL的玻璃离心管作为反应容器.放入(25±2) ℃,150 r·min-1的摇床中振荡达到平衡.每个样品重复3个平行样,每个浓度设置空白样品对照.平衡后,所有样品于3000 r·min-1条件下离心10 min,然后静置12 h取上清液,使针铁矿颗粒完全沉淀.分别吸取一定量上清液待测.吸附实验中采用0.01 mol·L-1的NaNO3作为背景溶液,在吸附背景溶液中加入0.001 mol·L-1叠氮化钠以抑制微生物的影响.
双吸附体系:将特定浓度的SMT吸附液加入含有一定量针铁矿的玻璃离心管中,于150 r·min-1,(25±2)℃的条件下恒温振荡24 h后.离心,除去上清液.再分别加入一定量2~300 mg·L-1的镉吸附液,充分摇匀后,继续于150 r·min-1,25 ℃的条件下恒温振荡24 h,离心,取上清液用火焰原子吸收分光光度计测定其中镉的浓度.每个浓度均做3个平行.固相上吸附质的浓度通过质量守恒计算所得.
Zeta电位测定:吸附SMT前后的针铁矿表面电位采用表面电位仪测定(马尔文,Nano ZS90).采用背景溶液将SMT母液稀释至1和100 mg·L-1,分别将其加入到含有一定量针铁矿的50 mL离心管中,采用HNO3和NaOH将体系pH值调节到3.0~9.0,于150 r·min-1,(25±2) ℃的条件下恒温振荡24 h后.静置30 min,测定其表面电位并记录体系pH值.
2.4 检测方法SMT在200~350 nm波长内的吸收光谱采用岛津UV-2550紫外可见分光光度计测定.上清液中SMT的分析检测用高效液相色谱(安捷伦1260)进行检测,色谱条件:Luna,C18(2)型色谱柱(250 mm×4.6 mm,5 μm);流动相是(0.05% V/V)甲酸溶液:乙腈=40:60;流速0.5 mL·min-1;进样量100 μL;检测波长264 nm.上清液中镉的浓度采用日立Z-2000塞曼原子吸收分光光度仪测定.吸附前后的针铁矿红外光谱采用Thermofisher Nicolet 6700傅里叶变换红外光谱仪检测.
2.5 数据分析络合常数的计算参照(Singh et al., 2010)的方法,使用以下方程进行拟合:
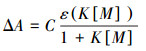
|
(1) |
式中,ΔA表示添加重金属前后,SMT在某特定波长(262 nm)处的吸光度变化,C代表体系中SMT浓度,即10 mg·L-1;ε表示单位浓度络合物的吸光度.K表示络合物的稳定常数,[M]表示配制的镉离子浓度(50~800 mg·L-1).
吸附等温线分别使用Langmuir模型,Freundlich模型以及线性分配模型进行拟合:

|
(2) |
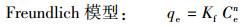
|
(3) |
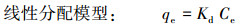
|
(4) |
式中,qe为污染物在固相中的平衡浓度(mg·g-1);Ce为污染物在液相中的平衡浓度(mg·L-1);qm为Langmuir饱和吸附量(μg·g-1);b是Langmuir吸附常数(L·mg-1).Kf是Freundlich分配系数((μg·g-1)/(μg·L-1)-n),用于表征吸附作用强弱;n无量纲,可以表征吸附等温线的非线性程度;Kd为污染物在固相和液相中的线性分配系数(L·g-1).
3 结果与讨论(Results and discussion) 3.1 SMT与镉的络合本研究中,262 nm波长处得到的ΔA值最大,因此选择262 nm处的吸光度带入方程(1)进行计算.SMT与镉络合情况的拟合结果见图 2.从拟合结果可以看出,ΔA与镉离子的浓度关系可以用方程(1)很好地拟合.由拟合结果得到,中性条件下SMT对镉表现出一定的络合能力,络合常数(logK)为-3.31,与文献报道接近.童非等(2014)采用酸碱滴定法,用1:1(镉:SMR)络合模型得到磺胺甲基嘧啶(SMR)与镉的络合常数为-3.80.由于中性条件下,大部分SMT以中性分子的形式存在,可通过阳离子-π键作用与镉离子发生络合(Wu et al., 2012),使镉的赋存形态发生改变,进而可能影响镉在矿物上的吸附行为.
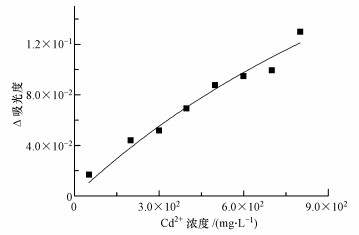 |
| 图 2 中性条件下SMT与镉络合情况拟合结果 Fig. 2 Fitting curves of absorption deviation ΔA verses Cd2+ concentration at neutral condition |
针铁矿对SMT的吸附等温线见图 3,吸附数据分别用3种吸附模型进行了拟合,拟合参数见表 2.从表中发现,Langmuir模型拟合的qmax小于实际吸附量,这与qmax的物理意义不相符,即Langmuir模型不能描述SMT在针铁矿上的吸附行为.Linear模型和Freundlich模型均能较好的拟合吸附数据,其中Linear模型的拟合结果更好.说明在本研究的浓度范围内,SMT在针铁矿上的吸附接近于线性,SMT的吸附量与SMT的初始浓度存在一定的线性关系.Guo等(2013)研究了pH对SMT在针铁矿上吸附的影响,结果表明在pH 3.0到8.0之间,随着pH的升高,分子态SMT所占的比例增大,在针铁矿上的吸附能力随之增强,分子态的SMT在吸附中的贡献明显大于离子态.由于分子态的SMT疏水性强于离子态SMT,这在一定程度上表明了疏水性作用对SMT在针铁矿上吸附行为的重要性.
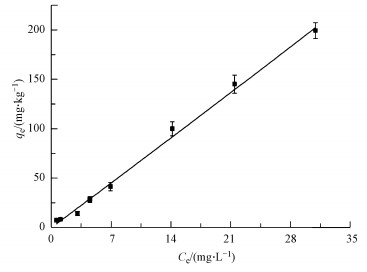 |
| 图 3 针铁矿对磺胺的吸附等温线 Fig. 3 Sorption isotherm of SMT on goethite |
| 表 2 磺胺二甲基嘧啶在针铁矿上的吸附等温线拟合参数 Table 2 Sorption parameters of SMT on goethite |
由于针铁矿与镉都带较强的正电荷,静电斥力成为限制镉在针铁矿上吸附的主要因素,而有机物的存在可能会改变矿物表面带电情况(Zhang et al., 2009),进而影响镉在针铁矿上的吸附.为了进一步了解针铁矿吸附SMT后表面电荷的变化情况,对其表面电位进行了测定,结果如图 4所示.从图 4可以看出,针铁矿吸附SMT后,在所研究的pH范围内,表面带的正电荷减少.且随着SMT初始浓度的增加,针铁矿表面正电荷下降越多,但是等电点并没有发生明显变化.部分带负电荷的SMT由于静电作用力被针铁矿吸附,降低了针铁矿表面的净正电荷,这有利于促进针铁矿对镉的吸附(Collins et al., 1999).
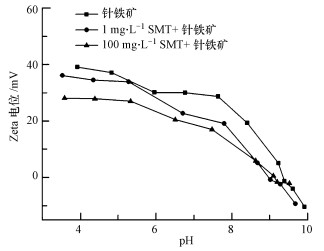 |
| 图 4 吸附磺胺前后针铁矿的表面电位变化 Fig. 4 Zeta potential of goethite before and after the adsorption of SMT |
针铁矿对镉的吸附等温线见图 5,吸附数据分别用3种吸附模型进行了拟合,拟合参数见表 3,其中Langmuir模型拟合的相关性最好,表明镉在针铁矿上的吸附接近于单分子层表面吸附(张志军等, 2011).本研究中针铁矿对镉的理论最大吸附容量为3.83 mg·g-1,与前人报道的5.17 mg·g-1比较相近(Granados Correa et al., 2011).镉在针铁矿表面形成的微晶矿物还可能与针铁矿表面具有微溶性(罗文倩等, 2009),有助于镉的吸附作用.
| 表 3 镉在针铁矿上的吸附等温线拟合参数 Table 3 Sorption parameters of Cd on goethite |
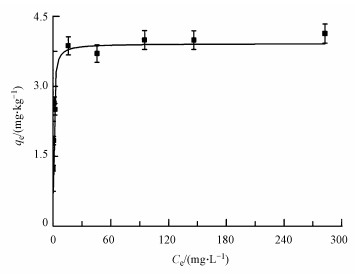 |
| 图 5 针铁矿对镉的吸附等温线 Fig. 5 Sorption isotherm of Cd2+ on goethite |
在离子强度分别为0.1和0.01 mol·L-1,pH为3~8的情况下镉在针铁矿上吸附行为如图 6所示.在酸性条件下,镉的吸附量很小,这是由于在酸性条件下针铁矿的表面会发生溶解,使表面吸附位点减少.在pH为4.0~6.5时,镉的吸附量随着pH的增加显著增强,pH达到6.5后,随着pH的增加,镉的吸附量达到最大值并趋于平稳.实验结果与前人(Wang et al., 2004)研究结果类似,针铁矿对镉的吸附受pH影响很大,几乎不受离子强度影响.这种现象符合内层络合吸附作用的特点(Tan et al., 2008).Randall等(1999)采用EXAFS对吸附了镉的针铁矿进行表征,结果也表明镉主要以内层络合的方式被吸附.当这些高能吸附位点被占据完之后,再由离子交换等其它作用位点吸附.
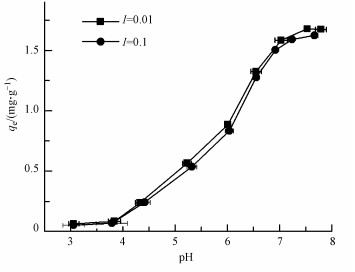 |
| 图 6 pH和离子强度对镉在针铁矿上吸附的影响(CCd0=2 mg·L-1) Fig. 6 Sorption of Cd on goethite affected by pH and ionic strength (CCd0=2 mg·L-1) |
由于SMT对镉有一定的络合能力,当二者共存时,是否会改变镉的吸附行为?这里进一步考察了不同初始浓度SMT存在条件下镉在针铁矿上的吸附行为,如图 7所示.吸附数据分别用Langmuir模型与Freundlich模型进行拟合,拟合结果见表 4.从表中可以看出不同浓度SMT存在时,两种模型均能较好的拟合吸附数据,Freundlich模型拟合效果更好,表明SMT的存在会使镉的吸附特性发生改变,使其更接近与在非均质表面的非特异性吸附(Granados Correa et al., 2011).
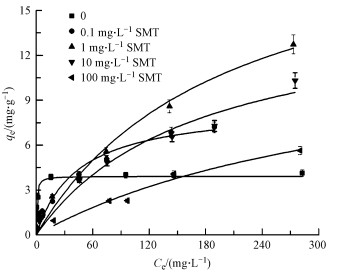 |
| 图 7 SMT存在情况下镉在针铁矿上的吸附等温线 Fig. 7 Sorption isotherms of Cd2+ in the presence of SMT |
| 表 4 不同初始浓度SMT条件下镉在针铁矿上的吸附模型拟合参数 Table 4 Sorption parameters of cadmium on goethite |
SMT的存在可以显著提高针铁矿对镉的吸附,且随着SMT浓度的增加,镉在针铁矿上的吸附容量表现出先增加后减少的趋势,这与针铁矿表面正电荷一直减小的变化趋势不同.可见,吸附态SMT对针铁矿表面电荷的影响并不是导致镉吸附增加的唯一原因,还可能存在其它因素影响镉在针铁矿上的吸附.前面的研究表明,SMT对镉有一定的络合能力,可能形成针铁矿-SMT-镉三元络合物,这将可能促进镉在针铁矿上的吸附.
为了进一步了解SMT以及镉在针铁矿上的吸附行为,对吸附SMT和镉前后的针铁矿进行了傅立叶红外光谱表征,结果如图 8所示.由图 8可以看出,吸附SMT后,针铁矿上的官能团发生了较明显的变化,在1374和1620 cm-1处都有明显的化学键伸缩振动.据报道(Villalobos, 2011),1374和1620 cm-1分别为氨基和酰胺基团的伸缩振动.表明在本研究浓度范围内,除了疏水性作用以外,SMT还能通过氨基和酰胺基团与针铁矿的表面发生络合作用而被吸附.而SMT存在情况下,针铁矿吸附镉后,在1000~1300 cm-1之间有明显的振动,这部分对应的是芳香环的伸缩振动.表明,镉可能与吸附态的SMT在芳香环上发生了络合反应.
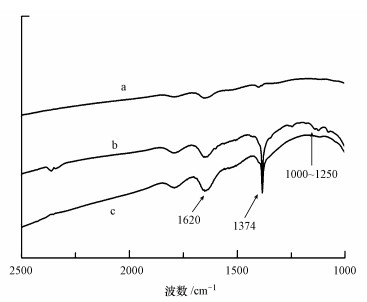 |
| 图 8 针铁矿吸附SMT和镉前后的红外光谱图(a.针铁矿, b.针铁矿先吸附SMT再吸附镉, c.吸附SMT后的针铁矿) Fig. 8 FTIR spectra of goethite (a. goethite, b. Cd sorbed on goethite in the presence of SMT, c. SMT sorbed on goethite) |
推测SMT存在时,镉在针铁矿上的吸附可能遵循以下过程:初始,SMT首先以疏水性作用被吸附,随后进入体系的镉除了可与针铁矿形成微溶晶体,以内层络合物的形式被吸附(Jiang et al., 2013)外,还以针铁矿-SMT-镉三元络合物的形式被吸附在针铁矿表面,使镉的吸附作用增强.前人也曾有过类似的报道,Jia等(2008)曾报道四环素会与铜形成络合物,增加铜在土壤表面的吸附;Hoins等(1993)也曾经报道硫代硫酸盐与镉以及针铁矿表面形成三元络合物,Lamy等(1991)报道了草酸与镉也能在针铁矿表面形成三元络合物,从而影响镉在针铁矿表面的吸附;随后,随着SMT浓度的继续增加,镉的吸附作用减弱,这可能是由于随着SMT浓度的增大,优先吸附的高能疏水性位点全部被占据后,接着SMT会占据部分镉离子的吸附位点(Zhang et al., 2012),使得镉在矿物上的吸附减少.文献也有类似现象报道,SMT与镉都能以表面吸附(Lertpaitoonpan et al., 2009)和离子交换作用被矿物吸附.当SMT对镉吸附位点的占据强于络合作用对镉吸附的促进时,表现出镉的吸附容量随SMT添加量的增加而减少(Wu et al., 2014).可见,当体系中有抗生素存在时,镉在针铁矿上的行为会发生变化,在抗生素的环境浓度下,镉的吸附将可能得到强化,进而可能影响其在土壤环境中的迁移和生物有效性.因此,在评估镉的环境风险时,还应考虑到共存抗生素的影响.
4 结论(Conclusions)1) SMT对镉有一定的络合能力,在中性条件下,络合常数为-3.31.
2) SMT能够显著提高针铁矿对镉吸附能力,这可能是由于SMT改变了针铁矿表面带电状况,同时形成了针铁矿-SMT-镉三元络合物,当体系中SMT积累到一定程度,SMT可与镉竞争针铁矿表面的吸附位点,使镉的吸附减弱.因此,在存在抗生素与重金属复合污染时,应充分考虑两类污染共存时协同环境效应.
| [${referVo.labelOrder}] | Bao Y, Wan Y, Zhou Q, et al. 2013. Competitive adsorption and desorption of oxytetracycline and cadmium with different input loadings on cinnamon soil[J]. Journal of Soils and Sediments, 13(2) : 364–374. DOI:10.1007/s11368-012-0600-3 |
| [${referVo.labelOrder}] | Brigante M, Zanini G, Avena M. 2010. Effect of humic acids on the adsorption of paraquat by goethite[J]. Journal of Hazardous Materials, 184(1/3) : 241–247. |
| [${referVo.labelOrder}] | Collins C R, Ragnarsdottir K V, Sherman D M. 1999. Effect of inorganic and organic ligands on the mechanism of cadmium sorption to goethite[J]. Geochimica et Cosmochimica Acta, 63(19/20) : 2989–3002. |
| [${referVo.labelOrder}] | Granados Correa F, Corral Capulin N G, Olguín M T, et al. 2011. Comparison of the Cd (Ⅱ) adsorption processes between boehmite (γ-AlOOH) and goethite (α-FeOOH)[J]. Chemical Engineering Journal, 171(3) : 1027–1034. DOI:10.1016/j.cej.2011.04.055 |
| [${referVo.labelOrder}] | Guo X T, Yang C, Dang Z, et al. 2013. Sorption thermodynamics and kinetics properties of tylosin and sulfamethazine on goethite[J]. Chemical Engineering Journal, 223(1) : 59–67. |
| [${referVo.labelOrder}] | 胡秀敏, 杨琛, 张倩, 等. 2013. 泰乐菌素对菲在蒙脱石上吸附作用的影响[J]. 农业环境科学学报, 2013, 32(4) : 729–734. |
| [${referVo.labelOrder}] | 黄文飞. 2007.复合污染体系中, 重金属和有机物在沉积物上的吸附行为[D].杭州:浙江大学. 69 |
| [${referVo.labelOrder}] | Hoins U, Charlet L, Sticher H. 1993. Ligand effect on the adsorption of heavy metals:The sulfate-cadmium-goethite case[J]. Water, Air, and Soil Pollution, 68(1/2) : 241–255. |
| [${referVo.labelOrder}] | Jia D A, Zhou D M, Wang Y J, et al. 2008. Adsorption and cosorption of Cu (Ⅱ) and tetracycline on two soils with different characteristics[J]. Geoderma, 146(1) : 224–230. |
| [${referVo.labelOrder}] | Jiang W, Lv J, Luo L, et al. 2013. Arsenate and cadmium co-adsorption and co-precipitation on goethite[J]. Journal of Hazardous Materials, 262 : 55–63. DOI:10.1016/j.jhazmat.2013.08.030 |
| [${referVo.labelOrder}] | Lamy I, Djafer M, Terce M. 1991. Influence of oxalic acid on the adsorption of cadmium at the goethite surface[J]. Water, Air, and Soil Pollution, 57(1) : 457–465. |
| [${referVo.labelOrder}] | Lertpaitoonpan W, Ong S K, Moorman T B. 2009. Effect of organic carbon and pH on soil sorption of sulfamethazine[J]. Chemosphere, 76(4) : 558–564. DOI:10.1016/j.chemosphere.2009.02.066 |
| [${referVo.labelOrder}] | 罗文倩, 魏世强. 2009. 镉在针铁矿、针铁矿-腐植酸复合胶体中吸附解吸行为比较研究[J]. 农业环境科学学报, 2009, 28(5) : 897–902. |
| [${referVo.labelOrder}] | Mansour A M. 2014. DFT studies, spectral and biological activity evaluation of binary and ternary sulfamethazine Fe (Ⅲ) complexes[J]. Journal of Coordination Chemistry, 16(67) : 2680–2687. |
| [${referVo.labelOrder}] | Pei Z, Shan X, Zhang S, et al. 2011. Insight to ternary complexes of co-adsorption of norfloxacin and Cu (Ⅱ) onto montmorillonite at different pH using EXAFS[J]. Journal of Hazardous Materials, 186(1) : 842–848. DOI:10.1016/j.jhazmat.2010.11.076 |
| [${referVo.labelOrder}] | Randall S R, Sherman D M, Ragnarsdottir K V, et al. 1999. The mechanism of cadmium surface complexation on iron oxyhydroxide minerals[J]. Geochimica et Cosmochimica Acta, 63(19/20) : 2971–2987. |
| [${referVo.labelOrder}] | Singh R, Tønnesen H H, Vogensen S B, et al. 2010. Studies of curcumin and curcuminoids. XXXVI. The stoichiometry and complexation constants of cyclodextrin complexes as determined by the phase-solubility method and UV-Vis titration[J]. Journal of Inclusion Phenomena and Macrocyclic Chemistry, 66(3/4) : 335–348. |
| [${referVo.labelOrder}] | Tan X L, Chang P P, Fan Q H, et al. 2008. Sorption of Pb (Ⅱ) on Na-rectorite:Effects of pH, ionic strength, temperature, soil humic acid and fulvic acid[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 328(1/3) : 8–14. |
| [${referVo.labelOrder}] | 童非, 顾雪元. 2014. 重金属离子与典型离子型有机污染物的络合效应研究[J]. 中国环境科学, 2014(7) : 1776–1784. |
| [${referVo.labelOrder}] | Villalobos M, Leckie J O. 2001. Surface Complexation Modeling and FTIR Study of Carbonate Adsorption to Goethite[J]. Journal of Colloid and Interface Science, 235(1) : 15–32. DOI:10.1006/jcis.2000.7341 |
| [${referVo.labelOrder}] | Wallis S C, Gahan L R, Charles B G, et al. 1996. Copper (Ⅱ) complexes of the fluoroquinolone antimicrobial ciprofloxacin. synthesis, X-Ray structural characterization, and potentiometric study[J]. Journal of Inorganic Biochemistry, 62(1) : 1–16. DOI:10.1016/0162-0134(95)00082-8 |
| [${referVo.labelOrder}] | Wang K, Xing B. 2004. Mutual effects of cadmium and phosphate on their adsorption and desorption by goethite[J]. Environmental Pollution, 127(1) : 13–20. DOI:10.1016/S0269-7491(03)00262-8 |
| [${referVo.labelOrder}] | Wang Y J, Jia D A, Sun R J, et al. 2008. Adsorption and Cosorption of Tetracycline and Copper (Ⅱ) on Montmorillonite as Affected by Solution pH[J]. Environmental Science & Technology, 42(9) : 3254–3259. |
| [${referVo.labelOrder}] | Wu D, Li H, Liao S, et al. 2014. Co-sorption of ofloxacin and Cu (Ⅱ) in soils before and after organic matter removal[J]. Science of The Total Environment, 481 : 209–216. DOI:10.1016/j.scitotenv.2014.02.041 |
| [${referVo.labelOrder}] | Wu D, Pan B, Wu M, et al. 2012. Coadsorption of Cu and sulfamethoxazole on hydroxylized and graphitized carbon nanotubes[J]. Science of the Total Environment, 427 : 247–252. |
| [${referVo.labelOrder}] | Zhang D, Pan B, Wu M, et al. 2012. Cosorption of organic chemicals with different properties:Their shared and different sorption sites[J]. Environmental Pollution, 160 : 178–184. DOI:10.1016/j.envpol.2011.08.053 |
| [${referVo.labelOrder}] | Zhang Y, Chen Y, Westerhoff P, et al. 2009. Impact of natural organic matter and divalent cations on the stability of aqueous nanoparticles[J]. Water Research, 43(17) : 4249–4257. DOI:10.1016/j.watres.2009.06.005 |
| [${referVo.labelOrder}] | Zhao Y, Tong F, Gu X, et al. 2014. Insights into tetracycline adsorption onto goethite:Experiments and modeling[J]. Science of the Total Environment, 470 : 19–25. |
| [${referVo.labelOrder}] | 张志军, 刘炯天, 冯莉, 等. 2011. 基于Langmuir理论的平衡吸附量预测模型[J]. 东北大学学报(自然科学版), 2011, 32(5) : 749–751. |
| [${referVo.labelOrder}] | 赵方. 2012.磺胺二甲基嘧啶的微波与微生物降解研究[D].郑州:郑州大学. 58 |
| [${referVo.labelOrder}] | 赵双阳. 2013.活性炭改性及吸附水中磺胺类抗生素的研究[D].哈尔滨:哈尔滨工业大学. 66 |
 2017, Vol. 37
2017, Vol. 37



