2, 4-二氯苯氧乙酸(简称2, 4-D)是一种选择性高效有机除草剂, 因用量少、成本低, 成为世界上广泛使用的主要除草剂之一.2, 4-D降解性差, 水溶性低, 进入环境后会产生一定的积累, 造成水体和土壤的污染, 危害人类健康及环境安全(Badellino et al., 2006;Merini et al., 2007;Lachapelle et al., 2007).同时, 2, 4-D作为一种内分泌干扰物, 具有生物毒性, 对人类和动物都有胚胎毒性、致畸性和神经毒性(Pochettino et al., 2013).
零价铁来源丰富, 化学性质活泼, 电极电位E0(Fe2+/Fe)=-0.44 V, 具有较强的还原能力, 能有效地除去水中的含氯有机物(Wei et al., 2006)、偶氮染料(Zhao et al., 2008)、重金属(Lv et al., 2013;Wu et al., 2009)、硝酸盐(Hwang et al., 2011)等污染物.但是, 纳米零价铁还原技术自身也存在一些缺陷.纳米零价铁对某些污染物的处理效率较低, 而且纳米铁巨大的比表面积带来的较高表面能使其表面极易氧化, 易于聚集成团, 导致反应活性降低, 限制了其广泛使用(Phenrat et al., 2007).为了推动纳米零价铁还原技术在污染物治理中的应用, 多种稳定化手段应运而生, 目前主要有纳米铁负载技术、纳米铁包覆技术、纳米铁分散稳定技术等.纳米铁负载技术可防止纳米铁的聚合沉降, 主要载体有活性碳(Xu et al., 2011;Xu et al., 2016)、壳聚糖(Kustov et al., 2011)、硅土(Zhu et al., 2006)、膨润土(Su et al., 2011)、金属氧化物(Xu et al., 2013)等.通过负载可以使纳米铁颗粒有效分布在载体表面, 防止聚合, 保持纳米铁颗粒的反应活性.Xu等(2013)用纳米级Fe3O4作为负载材料, 将纳米钯/铁负载其上用于2, 4-D的降解, 结果表明, 相对于未负载Fe3O4纳米颗粒的Pd/Fe体系, 2, 4-D的去除效率从35.8%提高到76.4%.Fe3O4纳米颗粒可以吸附体系中具有磁性的物质, Fe0可吸附在Fe3O4表面, 不易团聚.此外, Fe3O4还起到了电子转移中介的作用, 促进电子从Fe0转移到2, 4-D, 提高反应效率.纳米铁包覆技术可防止纳米零价铁表面发生氧化, 研究人员尝试用二氧化硅(Li et al., 2012;Mao et al., 2014;Yang et al., 2011)、氧化铁(Sohn et al., 2006;Antony et al., 2006;Ai et al., 2008)、碳(Cao et al., 2012)等对纳米零价铁进行包覆, 发现包覆后的纳米零价铁抗氧化, 且不易团聚, 提高了反应活性.Mao等(2014)通过水还原结合Stöber的方法, 两步合成SiO2包覆的纳米铁复合材料(Fe@SiO2), 用于有机染料的去除, 相较于未包覆的纳米铁, Fe@SiO2对于有机染料具有更好的去除效果.纳米零价铁的分散稳定技术常采用在体系中投加稳定剂和分散剂的方法, 使纳米铁在溶液中保持相对分散的悬浮状态, 减少纳米颗粒的团聚, 增加催化剂与污染物的接触, 从而提高反应活性.Cao等(2011)在制备纳米Cu/Fe双金属体系时, 引入CMC作为稳定剂, 显著提高了Cu/Fe双金属对于1, 2, 4-三氯苯的降解速率.另外, 为了抑制零价铁表面的钝化层形成或剥离钝化层, 研究人员在零价铁体系里引入EDTA (Noubactep et al., 2009;Noubactep et al., 2010), 结果表明, EDTA可以溶解零价铁表面的氧化物并且络合反应过程中生成铁离子, 抑制零价铁表面氧化层的形成, 保持零价铁的活性.但目前在纳米级Pd/Fe双金属体系里加入EDTA用于处理含氯有机污染物方面的研究较少.
EDTA具有络合作用, 可以络合反应过程中产生的铁离子, 抑制纳米铁表面钝化层的形成, 保持纳米Pd/Fe的反应活性, 提高2, 4-D的去除效率.因此, 本研究以2, 4-D为目标污染物, 采用纳米Pd/Fe颗粒对其进行催化还原脱氯, 在反应过程中加入EDTA, 改善纳米Pd/Fe还原脱氯性能.同时, 考察EDTA投加量、pH、钯化率、温度等对脱氯效果的影响, 研究EDTA对纳米Pd/Fe还原活性的改进效果及EDTA存在条件下纳米Pd/Fe对2, 4-D的脱氯作用, 探讨催化脱氯机制, 以期为零价铁还原脱氯技术的实际应用提供理论支持.
2 材料与方法(Materials and methods) 2.1 实验试剂氯钯酸钾(K2PdCl6, 含量99%)购自Sigma-Aldrich公司.2, 4-二氯苯氧乙酸(2, 4-D, C8H6Cl2O3, 纯度98%)、2-氯苯氧乙酸(2-CPA, C8H7ClO3, 纯度>98%)、4-氯苯氧乙酸(4-CPA, C8H7ClO3, 纯度>98%)、苯氧乙酸(PA, C8H8O3, 纯度98%)均购自Alfa Aesar公司.高效液相色谱(HPLC)所用甲醇为色谱纯.EDTA (C10H14N2O8Na2·2H2O, >99.0%)、硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4)及其它试剂均为分析纯.实验过程用水均为通氮去离子水.
2.2 实验方法 2.2.1 纳米Pd/Fe颗粒制备称取一定量FeSO4·7H2O, 溶解后倒入三口烧瓶中, 逐滴滴入NaBH4溶液;反应一段时间后, 加入配好的K2PdCl6溶液, 制备得到纳米Pd/Fe.
2.2.3 催化脱氯实验将制备好的纳米Pd/Fe颗粒放入三口烧瓶, 将反应瓶置于恒温水槽中, 随后加入2, 4-D溶液, 开启搅拌器进行反应.同时, 开启恒流泵使络合剂EDTA以20 mL·h-1的速度持续滴加到三口烧瓶中.反应进行210 min, 不同时间间隔取样.反应过程中持续往反应瓶中通N2以维持厌氧环境.
实验研究EDTA的投加量、pH、钯化率、反应温度等因素对EDTA优化纳米Pd/Fe催化脱氯的影响.实验基准条件为:EDTA投加量25.0 mmol·L-1, 纳米铁1.0 g·L-1, 钯化率0.5%, 2, 4-D初始浓度10.0 mg·L-1, 初始pH=7.0, 反应温度25.0 ℃, 搅拌速率200 r·min-1.
2.3 分析方法 2.3.1 扫描电子显微镜(SEM)在氮气保护下, 通过水浴加热(55.0 ℃)将新鲜制备的纳米Pd/Fe、反应210 min后的纳米Pd/Fe及EDTA优化体系中的纳米Pd/Fe颗粒样品烘干, 采用S4700扫描电子显微镜(SEM)观察各样品颗粒的表面形貌.
2.3.2 透射电子显微镜(TEM)将制得的纳米Pd/Fe颗粒样品保存在乙醇中, 用Tecnai G2 F30 S-Twin高分辨透射电子显微镜在300 kV条件下观测.
2.3.3 X射线光电子能谱(XPS)在氮气保护下, 通过水浴加热(55.0 ℃)将反应210 min后的无EDTA体系中纳米Pd/Fe及EDTA存在情况下的纳米Pd/Fe颗粒样品烘干, 采用Kratos AXIS Ultra DLD X射线光电子能谱仪(XPS)对各样品进行分析.
2.3.4 高效液相色谱(HPLC)PA、2-CPA和2, 4-D用高效液相色谱(Agilent Technologies 1200 Series)进行分析.色谱操作条件:ZORBAX Eclipse XDB-C18色谱柱(4.6 mm×150 mm, 5 μm), 柱温为30.0 ℃; 流动相为甲醇/超纯水=60/40(V/V), 甲醇经磷酸调节pH至3.2, 流速l.0 mL·min-1, 紫外检测波长为210 nm, 进样量为5.0 μL.
3 结果与讨论(Results and discussion) 3.1 EDTA优化的纳米Pd/Fe电镜图图 1a~c为相同放大倍率下无EDTA体系中Pd/Fe纳米颗粒反应前后及有EDTA存在情况下Pd/Fe纳米颗粒反应后的扫描电镜图(SEM).图 1a显示, 反应前的纳米Pd/Fe颗粒中钯的分布较为均匀, 形成细小的突起, 且纳米铁的表面比较光滑.与图 1a相比, 反应结束后的纳米Pd/Fe表面的钯呈现不均匀分布, 纳米铁的表面也不光滑(图 1b), 可能被反应过程中形成的氧化物所覆盖.图 1c为有EDTA存在情况下Pd/Fe纳米颗粒反应后的表面形态, 从图中可以观察到纳米铁表面的钯在反应后分布也不均匀, 但与图 1b相比, 纳米铁的表面仍比较光滑, 说明由于EDTA的络合作用, 抑制了铁表面氧化层的形成, 使得纳米Pd/Fe保持较高的反应活性, 能够持续地进行催化还原脱氯.图 1d为Pd/Fe纳米颗粒反应前的透射电镜图(TEM), 可以看出, 部分纳米Pd/Fe颗粒由于颗粒间的磁力作用及范德华力使它们团聚在一起, 形成大片密集程度不同的树杈状絮体, 颗粒直径小于100 nm.
 |
| 图 1 纳米Pd/Fe的SEM图(a.无EDTA, 反应前;b.无EDTA, 反应后;c.有EDTA, 反应后)及TEM图(d.无EDTA, 反应前) Fig. 1 SEM images of Pd/Fe nanoparticles before (a) and after reaction (b), EDTA-Pd/Fe nanoparticles after reaction (c) and TEM images of Pd/Fe nanoparticles before reaction (d) |
图 2、图 3分别为无EDTA体系及有EDTA存在情况下纳米Pd/Fe颗粒反应210 min后的X射线光电子能谱(XPS)表征结果.图 2a中, 在710 eV和723 eV附近的光电子峰表明纳米颗粒表面存在铁的氧化物(Allen et al., 1974;Nurmi et al., 2005).图 3a中除了710 eV和723 eV附近的光电子峰外, 706 eV附近的光电子峰为零价铁(Fe0)2p3/2的特征峰(Nurmi et al., 2005), 说明添加EDTA体系中纳米Pd/Fe颗粒反应后表面仍存在零价铁.这是由于EDTA络合了反应过程中生成的铁离子, 抑制钝化层生成, 保持纳米零价铁的活性.从O 1s的结合能能谱中可以看到, 图 2b及图 3b中都存在529.7 eV附近的光电子峰, 证实了O与Fe的结合(Allen et al., 1974;Asami et al., 1977), 在纳米Pd/Fe还原脱氯过程中, Fe容易被氧化, 生成铁的氧化物.532.0 eV附近的光电子峰表现的是O与C的结合(Dubois et al., 1986), 说明铁表面有C存在, 表明含碳有机物附着在铁表面, 可推测反应过程中有机物先被吸附到零价铁表面, 进而发生表面化学反应.通过分析表明, EDTA对纳米Pd/Fe有良好的性能改善作用, 可以络合反应过程中生成的铁离子, 保持纳米零价铁的高还原活性.
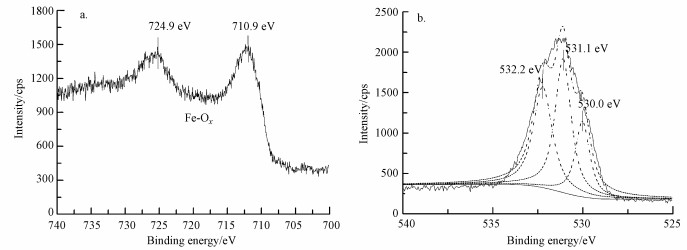 |
| 图 2 纳米Pd/Fe颗粒反应后的XPS能谱图(a.Fe 2p, b.O 1s) Fig. 2 XPS spectra of nano-Pd/Fe particles after reaction (a. Fe 2p, b. O 1s) |
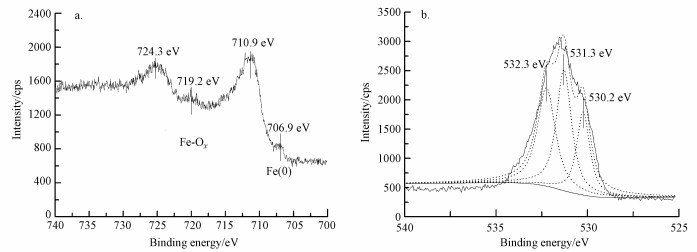 |
| 图 3 EDTA优化的纳米Pd/Fe颗粒反应后的XPS能谱图(a.Fe 2p, b. O 1s) Fig. 3 XPS spectra of EDTA-Pd/Fe nanoparticles after reaction (a. Fe 2p, b. O 1s) |
图 4为体系中有、无EDTA条件下, 纳米Pd/Fe催化脱氯2, 4-D过程中各物质浓度的变化.由图 4a可知,无EDTA的体系中, 在反应初期, 2, 4-D先被吸附在纳米Pd/Fe上, 体系中的总碳浓度下降, 随后上升并在之后的反应过程中基本保持稳定;2, 4-D浓度先持续快速降低, 50 min后接近稳定, 210 min后, 去除率仅为47.3%, 中间产物未检测到4-CPA;而2-CPA浓度在20 min后达到最大值, 随后在反应过程中一直保持稳定;终产物PA浓度随反应进行逐渐增加, 50 min后趋于稳定.图 4b显示, 体系中加入EDTA后, 在反应开始的20 min内总碳浓度下降, 随后持续上升, 110 min后保持稳定;2, 4-D浓度则持续快速下降, 110 min后2, 4-D去除率达到了92.5%, 210 min后, 2, 4-D去除率达到95.5%;2-CPA则在2 min内达到了最高值, 随后快速下降, 维持在较低的浓度水平;终产物PA浓度在反应过程中持续快速地增长, 在110 min内达到最高值0.0433 mmol·L-1, 生成率达到89.7%, 随后基本保持稳定.由实验结果可得, EDTA的加入大大增强了纳米Pd/Fe体系处理含氯有机物的能力, 其脱氯中间产物主要是2-CPA, 最终产物为PA.
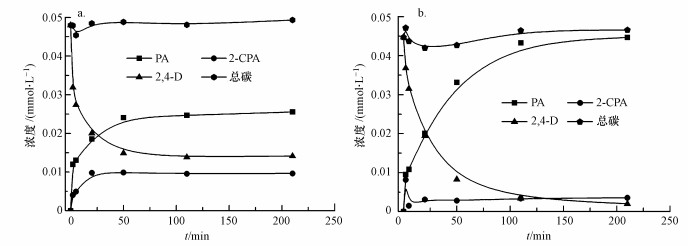 |
| 图 4 纳米Pd/Fe催化脱氯2, 4-D过程(a.无EDTA, b. 50.0 mmol·L-1 EDTA;CnZVI=1.0 g·L-1, C02, 4-D=10.0 mg·L-1, Pd/Fe=0.5%, T=25.0 ℃, pH=7.0, 转速200 r·min-1) Fig. 4 The catalytic dechlorination of 2, 4-D by nanoscale Pd/Fe (a.no EDTA, b.50.0 mmol·L-1 EDTA) |
实验基准条件下, 调节反应液初始pH分别为4.3、7.0、8.5、11.2, 考察pH对EDTA优化的纳米Pd/Fe催化脱氯2, 4-D的影响, 结果如图 5所示.从图 5a可以看出, 2, 4-D还原脱氯效果随pH增大而降低;pH为4.3时, 反应50 min后, 2, 4-D已经完全去除;pH为7.0时, 210 min后, 去除率为81.5%;随着pH升高到8.43、11.2, 去除率显著降低, 分别为27.9%、18.2%.从图 5b可以看出, PA生成率随pH增大而降低, 与2, 4-D的去除趋势相近.
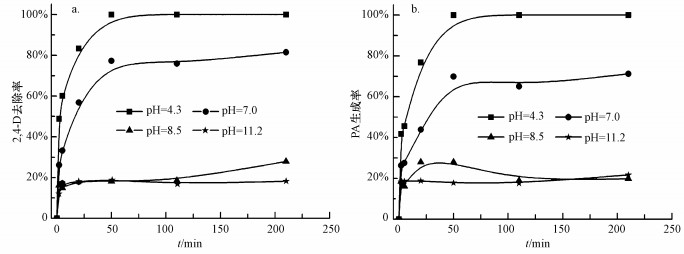 |
| 图 5 初始pH对纳米Pd/Fe催化脱氯2, 4-D的影响(a.2, 4-D, b.PA;CEDTA=25.0 mmol·L-1, CnZVI=1.0 g·L-1, C02, 4-D=10.0 mg·L-1, Pd/Fe=0.5%, T=25.0 ℃, 转速200 r·min-1) Fig. 5 Effect of initial pH on catalytic dechlorination of 2, 4-D by Pd/Fe nanoparticles (a.2, 4-D, b.PA) |
在纳米Pd/Fe体系中, Fe-H2O腐蚀生成H2, 催化剂Pd对2, 4-D还原进行催化加氢, 推动脱氯反应进行.低pH使Fe-H2O腐蚀加剧, 有利于H2生成.同时, pH值增高, Fe0易形成铁的氢氧化物沉淀附着在Fe0颗粒表面, 形成钝化层, 阻碍反应进行, 降低纳米Pd/Fe对2, 4-D的催化脱氯效率.
3.5 钯化率对2, 4-D催化脱氯的影响实验基准条件下, 考察了钯化率对EDTA优化的纳米Pd/Fe去除2, 4-D的影响, 结果如图 6所示.图 6a显示, 随着钯化率从0、0.1%增加到0.5%, 反应210 min后, 2, 4-D的去除率从15.3%、40.1%提高到81.5%.由图 6b可知, PA生成率随钯化率增加而提高, 钯化率为0.5%时, PA的生成率可达到71.2%.
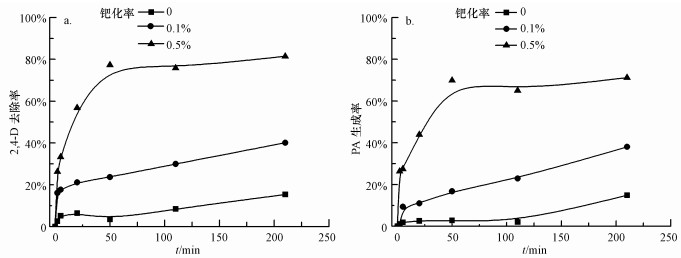 |
| 图 6 钯化率对纳米Pd/Fe还原脱氯2, 4-D的影响(a.2, 4-D, b. PA;CEDTA=25.0 mmol·L-1, CnZVI=1.0 g·L-1, C02, 4-D=10.0 mg·L-1, T=25.0 ℃, pH=7.0, 转速200 r·min-1) Fig. 6 Effect of Pd loading on dechlorination of 2, 4-D by Pd/Fe nanoparticles (a.2, 4-D, b.PA) |
钯在体系中作为高还原电位的金属可对零价铁体系产生腐蚀诱导效应, 更是一种良好的加氢催化剂, 能吸附铁腐蚀产生的H2, 促进2, 4-D的还原脱氯.因此, 钯化率对纳米Pd/Fe的还原脱氯有比较重要的影响(Zhang et al., 2010).钯化率的提高能有效促进纳米Pd/Fe对2, 4-D的还原脱氯.
3.6 温度对2, 4-D催化脱氯的影响实验基准条件下, 考察了反应温度对2, 4-D催化脱氯的影响, 结果如图 7所示.从图 7a中可以看出, 2, 4-D的去除率随温度升高而降低, 温度为20.0 ℃时, 反应210 min时, 2, 4-D几乎完全去除; 随温度升至25.0、30.0、40.0 ℃, 去除率分别为81.5%、60.1%、21.3%.从图 7b中可看出, PA生成率的趋势与2, 4-D的去除趋势相近, 温度为20.0 ℃时, 反应210 min时, PA生成率达到100.0%;随温度升至25.0、30.0、40.0 ℃, PA生成率分别为71.2%、49.1%、18.9%.
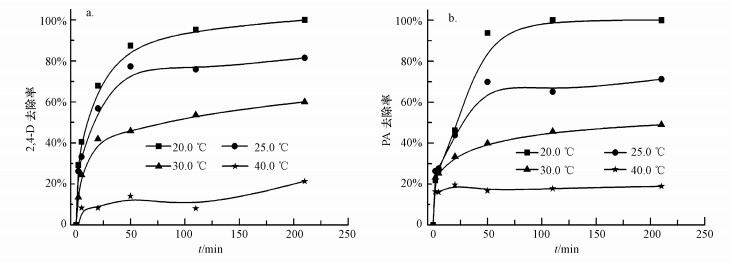 |
| 图 7 温度对纳米Pd/Fe催化脱氯2, 4-D的影响(a. 2, 4-D, b. PA;CEDTA=25.0 mmol·L-1, CnZVI=1.0 g·L-1, C02, 4-D=10.0 mg·L-1, Pd/Fe=0.5%, pH=7.0, 转速200 r·min-1) Fig. 7 Effect of temperature on catalytic dechlorination of 2, 4-D by Pd/Fe nanoparticles (a. 2, 4-D, b.PA) |
产生这个现象的原因可能是:①温度提高有利于脱氯反应进行, 同时也有利于铁的氧化(Wu et al., 2009), 零价铁表面钝化加速, 超过了EDTA抑制钝化层生成的速度, 零价铁表面生成钝化层, 降低了其反应活性, 脱氯率下降;②温度升高可以加快分子运动, 纳米Pd/Fe容易团聚成大颗粒, 颗粒表面反应活性位减少;③温度升高, 氢气溶解度下降而逸出, 新生态还原氢减少, 降低了脱氯效率.
3.7 EDTA投加浓度对2, 4-D催化脱氯的影响实验基准条件下, 考察了EDTA投加浓度对纳米Pd/Fe催化脱氯2, 4-D的影响, 结果见图 8.图 8a显示, 2, 4-D的去除率随着EDTA浓度增加而增加.无EDTA的体系中, 2, 4-D还原脱氯效率较低, 反应开始后50 min内, 2, 4-D迅速被还原, 去除率迅速增加, 50 min后, 去除率基本保持不变, 210 min后, 去除率为50.3%.持续滴加EDTA后, 2, 4-D去除率随着EDTA投加浓度的增大而提高, 并且在反应初期速率极快.EDTA浓度为25.0 mmol·L-1时, 反应5 min后, 2, 4-D的去除率达到了33.3%, 50 min后达到77.1%, 210 min后, 则达到81.5%.EDTA浓度为50.0 mmol·L-1时, 反应210 min后, 2, 4-D的去除率为95.5%.EDTA浓度为75.0 mmol·L-1时, 反应50 min后, 溶液中已检测不到2, 4-D.当EDTA浓度为100.0 mmol·L-1时, 反应进行的前20 min内, 2, 4-D的去除率比75.0 mmol·L-1时快, 而20 min之后, 与75.0 mmol·L-1时基本相同.从图 8b可以看出, PA生成率的趋势与2, 4-D的去除趋势相近.
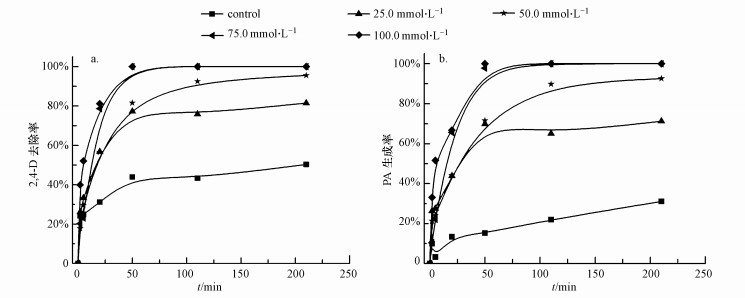 |
| 图 8 EDTA投加浓度对纳米Pd/Fe催化脱氯2, 4-D的影响(a.2, 4-D, b.PA;CnZVI=1.0 g·L-1, C02, 4-D=10.0 mg·L-1, Pd/Fe=0.5%, T=25.0 ℃, pH=7.0, 转速200 r·min-1) Fig. 8 Effect of EDTA on catalytic dechlorination of 2, 4-D by Pd/Fe nanoparticles (a.2, 4-D, b.PA) |
EDTA的加入络合了纳米铁还原过程生成的铁离子, 防止钝化层的形成, 此外, EDTA可以剥离纳米Pd/Fe表面已有的氧化层(Zhou et al., 2008;Kunwar et al., 2012), 增加催化脱氯的反应活性位, 提高反应速率.随着EDTA浓度增加, 对铁离子的络合、氧化层的剥离更加彻底, 催化脱氯效率提高程度明显增强.
3.8 EDTA优化的纳米Pd/Fe催化脱氯2, 4-D机制探讨由图 8可知, 在同等条件下, 无EDTA的体系中, 纳米级Pd/Fe对2, 4-D的去除率最高为50.3%, EDTA投加后, 2, 4-D去除率随EDTA浓度增加而提高.当EDTA投加浓度为75.0 mmol·L-1时, 2, 4-D的去除率最高达到100.0%, 是无EDTA体系的2倍.EDTA的加入提高了纳米Pd/Fe体系对2, 4-D的催化脱氯作用.EDTA对纳米Pd/Fe催化脱氯的影响主要体现在两个方面:①纳米Pd/Fe催化脱氯过程中, 纳米零价铁通过直接的电子转移, 生成Fe2+(图 9).EDTA的投加可以络合纳米Pd/Fe在催化脱氯过程中产生的Fe2+及可能存在的Fe3+, 阻止或减缓纳米Pd/Fe表面钝化层的形成, 保持纳米铁表面的反应活性位, 促进反应进行.②EDTA可以吸附并且络合铁的氧化物, 剥离纳米Pd/Fe表面的钝化层(Zhou et al., 2008;Kunwar et al., 2012), 促进催化脱氯反应进行.
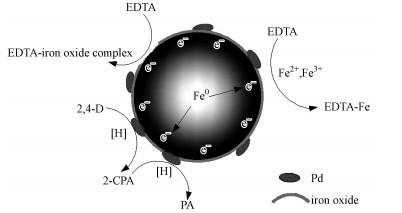 |
| 图 9 络合剂EDTA对纳米Pd/Fe催化脱氯2, 4-D反应活性改进作用机制 Fig. 9 Improvement of EDTA on the catalytic dechlorination of 2, 4-D by Pd/Fe nanoparticles |
1)络合剂EDTA滴加到纳米Pd/Fe体系中, 可以络合反应过程中产生的铁离子, 防止形成或剥离纳米铁表面钝化层, 保持纳米Pd/Fe的反应活性.
2) EDTA连续滴加的纳米Pd/Fe还原脱氯2, 4-D的主要影响因素有EDTA浓度、初始pH、钯化率、温度等.较高的EDTA浓度、较低的初始pH、较高的钯化率、室温有利于2, 4-D还原脱氯的进行.
3)持续投加浓度为25.0 mmol·L-1的EDTA, 纳米铁投加量为1.0 g·L-1, 反应初始pH=4.3, 钯化率0.5%, 反应温度为25.0 ℃, 转速为200 r·min-1的条件下, 2, 4-D初始浓度10.0 mg·L-1, 反应50 min后, PA生成率及2, 4-D去除率均达到100%.
| [${referVo.labelOrder}] | Antony J, Qiang Y, Bear D R, et al. 2006. Synthesis and characterization of stable iron-iron oxide core-shell nanoclusters for environmental applications[J]. Journal of Nanoscience and Nanotechnology, 6(2) : 568–572. DOI:10.1166/jnn.2006.925 |
| [${referVo.labelOrder}] | Ai Z, Wang Y, Xiao M, et al. 2008. Microwave-induced catalytic oxidation of RhB by a nanocomposite of Fe@Fe2O3 core-shell nanowires and carbon nanotubes[J]. Journal of Physical Chemistry C, 112(26) : 9847–9853. DOI:10.1021/jp801950r |
| [${referVo.labelOrder}] | Allen G C, Curtis M T, Hooper A J, et al. 1974. X-Ray photoelectron spectroscopy of iron-oxygen systems[J]. Journal of the Chemical Society Dalton Transactions, 15(14) : 1525–1530. |
| [${referVo.labelOrder}] | Asami K, Hashimoto K. 1977. The X-ray photoelectron spectra of several oxides of iron and chromium[J]. Corrosion Science, 17(7) : 559–570. DOI:10.1016/S0010-938X(77)80002-4 |
| [${referVo.labelOrder}] | Badellino C, Rodrigues C A, Bertazzoli R. 2006. Oxidation of pesticides by in situ electro generated hydrogen peroxide:study for the degradation of 2, 4-dichlorophenoxyacetic acid[J]. Journal of Hazardous Materials, 137(2) : 856–864. DOI:10.1016/j.jhazmat.2006.03.035 |
| [${referVo.labelOrder}] | Cao C, Ma Z, Ma C, et al. 2012. Synthesis and characterization of Fe/C core-shell nanoparticles[J]. Materials Letters, 88(1) : 61–64. |
| [${referVo.labelOrder}] | Cao J, Xu R, Tang H, et al. 2011. Synthesis of monodispersed CMC-stabilized Fe-Cu bimetal nanoparticles for in situ reductive dechlorination of 1, 2, 4-trichlorobenzene[J]. Science of the Total Environment, 409(11) : 2336–2341. DOI:10.1016/j.scitotenv.2011.02.045 |
| [${referVo.labelOrder}] | Dubois L H, Zegarski B R, Nuzzo R G. 1986. Spontaneous organization of carboxylic acid monolayer films in ultrahigh vacuum:kinetic constraints to assembly via gas-phase adsorption[J]. Langmuir, 2(4) : 412–417. DOI:10.1021/la00070a006 |
| [${referVo.labelOrder}] | Hwang Y H, Kim D G, Shin H S. 2011. Mechanism study of nitrate reduction by nano zerovalent iron[J]. Journal of Hazardous Materials, 185(2) : 1513–1521. |
| [${referVo.labelOrder}] | Kustov L M, Finashina E D, Shuvalova E V, et al. 2011. Pd-Fe nanoparticles stabilized by chitosan derivatives for perchloroethene dechlorination[J]. Environment International, 37(6) : 1044–1052. DOI:10.1016/j.envint.2011.05.003 |
| [${referVo.labelOrder}] | Kunwar P S, Arun K S, Shikha G, et al. 2012. Optimization of nitrate reduction by EDTA catalyzed zero-valent bimetallic nanoparticles in aqueous medium[J]. Enviromental Science and Pollution, 19(9) : 3914–3924. |
| [${referVo.labelOrder}] | Lachapelle A M, Ruygrok M L, Toomer M, et al. 2007. The hormonal herbicide, 2, 4-dichllorophenoxyacetic acid, inhibits xenopus oocyte maturation by targeting translational and post-translation mechanisms[J]. Reproductive Toxicology, 23(1) : 20–31. DOI:10.1016/j.reprotox.2006.08.013 |
| [${referVo.labelOrder}] | Lv X S, Hu Y J, Xu X H, et al. 2013. Effects of co-existing ions and natural organic matter on removal of chromium (VI) from aqueous solution by nanoscale zero valent iron (nZVI)-Fe3O4 nanocomposites[J]. Chemical Engineering Journal, 218 : 55–64. DOI:10.1016/j.cej.2012.12.026 |
| [${referVo.labelOrder}] | Li Y C, Jin Z H, Li T L, et al. 2012. One-step synthesis and characterization of core-shell Fe@SiO2 nanocomposite for Cr (VI) reduction[J]. Science of the Total Environment, 421-422 : 260–266. DOI:10.1016/j.scitotenv.2012.01.010 |
| [${referVo.labelOrder}] | Merini L J, Cuadrado V, Flocco C G, et al. 2007. Dissipation of 2, 4-D in soils of the Humid Pampa region, Argentina:a microcosm study[J]. Chemosphere, 68(2) : 259–265. DOI:10.1016/j.chemosphere.2007.01.012 |
| [${referVo.labelOrder}] | Mao Z, Wu Q, Wang M, et al. 2014. Tunable synthesis of SiO2-encapsulated zero-valent iron nanoparticles for degradation of organic dyes[J]. Nanoscale Research Letters, 9(13) : 501–509. |
| [${referVo.labelOrder}] | Noubactep C. 2009. Characterizing the effects of shaking intensity on the kinetics of metallic iron dissolution in EDTA[J]. Journal of Hazardous Materials, 170(2/3) : 1149–1155. |
| [${referVo.labelOrder}] | Noubactep C. 2010. Characterizing the reactivity of metalliciron in Fe0/EDTA/H2O systems with column experiments[J]. Chemical Engineering Journal, 162(2) : 656–661. DOI:10.1016/j.cej.2010.06.016 |
| [${referVo.labelOrder}] | Nurmi J T, Tratnyek P G, Sarathy V, et al. 2005. Characterization and properties of metallic iron nanoparticles:spectroscopy, electrochemistry, and kinetics[J]. Environmental Science and Technology, 39(5) : 1221–1230. DOI:10.1021/es049190u |
| [${referVo.labelOrder}] | Pochettino A A, Bonqiovanni B, Duffard R O, et al. 2013. Oxidative stress in ventral prostate, ovary, and breast by 2, 4-dichlorophenoxyacetic acid in pre-and postnatal exposed rats[J]. Environmental Toxicology, 28(1) : 1–10. DOI:10.1002/tox.v28.1 |
| [${referVo.labelOrder}] | Phenrat T, Saleh N, Sirk K, et al. 2007. Aggregation and sedimentation of aqueous nanoscale zerovalent iron dispersions[J]. Environmental Science and Technology, 41(1) : 284–290. DOI:10.1021/es061349a |
| [${referVo.labelOrder}] | Su J, Lin S, Chen Z L, et al. 2011. Dechlorination of p-chlorophenol from aqueous solution using bentonite supported Fe/Pd nanoparticles:synthesis, characterization and kinetics[J]. Desalination, 280(1/3) : 167–173. |
| [${referVo.labelOrder}] | Sohn K, Kang S W, Ahn S, et al. 2006. Fe (0) nanoparticles for nitrate reduction:stability, reactivity, and transformation[J]. Environmental Science and Technology, 40(17) : 5514–5519. DOI:10.1021/es0525758 |
| [${referVo.labelOrder}] | Wei J J, Xu X H, Liu Y, et al. 2006. Catalytic hydrodechlorination of 2, 4-dichlorophenol over nanoscale Pd/Fe:reaction pathway and some experimental parameters[J]. Water Research, 40(2) : 348–354. DOI:10.1016/j.watres.2005.10.017 |
| [${referVo.labelOrder}] | Wu Y, Zhang J, Xu X H, et al. 2009. Chromium (Ⅵ) reduction in aqueous solutions by Fe3O4-stabilized Fe0 nanoparticles[J]. Journal of Hazardous Materials, 172(s 2/3) : 1640–1645. |
| [${referVo.labelOrder}] | Xu X H, Lv X, Xu J, et al. 2011. Removal of chromium (Ⅵ) from wastewater by nanoscale zero-valent iron particles supported on multiwalled carbon nanotubes[J]. Chemosphere, 85(7) : 1204–1209. DOI:10.1016/j.chemosphere.2011.09.005 |
| [${referVo.labelOrder}] | Xu J, Liu X, Xu X H, et al. 2016. Dechlorination mechanism of 2, 4-dichlorophenol by magnetic MWCNTs supported Pd/Fe nanohybrids:rapid adsorption, gradual dechlorination, and desorption of phenol[J]. ACS Applied Materials & Interfaces, 8(11) : 7333–7342. |
| [${referVo.labelOrder}] | Xu J, Tang J, Xu X H, et al. 2013. Enhanced dechlorination of 2, 4-dichlorophenol by Pd/FeFe3O4 nanocomposites[J]. Journal of Hazardous Materials, 244(2) : 628–636. |
| [${referVo.labelOrder}] | Yang B, Wu Z, Zou Z, et al. 2011. High-performance Fe/SiO2 soft magnetic composites for low-loss and high-power applications[J]. Journal of Physics D Applied Physics, 43(36) : 365003–365008. |
| [${referVo.labelOrder}] | Zhao Z S, Liu J F, Chao T, et al. 2008. Rapid decolorization of water soluble azo-dyes by nanosized zero-valent iron immobilized on the exchange resin[J]. Science in China, 51(2) : 186–192. DOI:10.1007/s11426-007-0121-x |
| [${referVo.labelOrder}] | Zhu B W, Lim T T, Feng J. 2006. Reductive dechlorination of 1, 2, 4-trichlorobenzene with palladized nanoscale Fe0 particles supported on chitosan and silica[J]. Chemosphere, 65(7) : 1137–1145. DOI:10.1016/j.chemosphere.2006.04.012 |
| [${referVo.labelOrder}] | Zhang Z, Shen Q, Xu X H, et al. 2010. Catalytic dechlorination of 2, 4-dichlorophenol by Pd/Fe bimetallic nanoparticles in the presence of humic acid[J]. Journal of Hazardous Materials, 182(1/3) : 252–258. |
| [${referVo.labelOrder}] | Zhou H, He Y, Lan Y, et al. 2008. Influence of complex reagents on removal of chromium (Ⅵ) by zero-valent iron[J]. Chemosphere, 72(6) : 870–87. DOI:10.1016/j.chemosphere.2008.04.010 |
 2017, Vol. 37
2017, Vol. 37


