天然木质纤维素原料是地球上最丰富的可再生有机质.全世界植物每年通过光合作用能产生高达1.64×1011 t木质纤维素类物质,其中,用于生产乙醇的纤维素、半纤维素的总量约为850亿t (赵磊,2008).根据农业生物质能产业规划(2007-2015年)的估算,我国每年可开发纤维素资源约6亿t,其中50%来自农作物(稻草、麦秸秆、玉米秸秆等).木质纤维素类生物质糖化的方法有酸水解、碱水解和酶水解(酶解).其中, 酶解因具有反应条件温和、设备简单、能耗低、污染小、腐蚀小、副产物少等特点,相比于酸水解或碱水解, 酶水解更具优势(Zhang et al., 2004; Berlin et al., 2006; Yang et al., 2006; 杨森等,2005;Huber et al, 2006).
预处理是生物乙醇生产过程中最关键的环节,因为它能破坏木质纤维素材料复杂的高分子结构.预处理方法有物理方法(如蒸汽爆破、辐射、冷冻等)和化学方法(如酸、碱、有机溶剂等)(Sun et al., 2002),虽然这两类方法都能提高木质纤维材料的酶解效果,但也分别存在着耗能高、效率低且过程污染较严重等问题,难以工业化推广.因此,需要寻求一种成本低、效果好、对下一步处理影响小的方法.近年来,离子液体以其独特的优势,逐渐成为生物质前处理体系的理想选择.与传统的化学溶剂相比,离子液体具有不易挥发、热稳定性和化学稳定性高、溶解性好、性能可调、易于分离、易回收和可循环使用等特点.随着研究的展开和逐步深入,单一体系的弊端也逐渐展露,因此,越来越多的研究开始转向于混合体系,采用表面活性剂辅助离子液体作为预处理成为近年来受到关注的新技术(冯圆圆等,2014).
木质纤维材料酶解动力学研究对于厘清木质纤维材料酶解的过程机制、工程放大和过程控制都具有重要意义.因此,本研究通过研究纤维素酶和β-葡萄糖苷酶单独作用及协同作用对稻秆酶解还原糖产量的影响,以确定最佳酶体系,并研究表面活性剂辅助离子液体预处理对稻秆在最佳酶体系中的酶解动力学,最后通过成分分析、红外光谱(FTIR)、X-射线衍射分析仪(XRD)、扫描电子显微镜(SEM)等分析手段研究预处理后稻秆的结构变化.
2 材料与方法(Materials and methods) 2.1 实验材料本次实验的木质纤维素原料为稻草秸秆,品种为生长期为5个月的日本稻米,样品采收于台湾省台北市“中央”研究院的实验农场(北纬25°020′32.79″,东经121°360′47.40″,海拔高度为18 m).稻草秸秆收集后进行风干处理,研磨成粉即为本次实验的样品.将稻草秸秆储存在密封的塑料袋中,于干燥处室温保存.用网筛对稻草秸秆进行筛分,得到实验稻草秸秆粉末的粒径范围及其含量分别为:粒径大于300 mm的占3.39%,粒径为150~300 mm的占47.95%,粒径为106~150 mm的占15.52%,粒径为75~106 mm的占20.57%,粒径小于75 mm的占2.63%.
2.2 实验试剂与仪器试剂:氯化-1-丁基-3-甲基咪唑([BMIM]Cl,纯度99%)购自上海默尼化工有限公司;十二烷基硫酸钠(SDS,纯度>65%)购自上海泰坦科技股份有限公司;十六烷基三甲基溴化铵(CTAB,纯度>98%)购自Sigma-Aldrich;吐温80 (Tween80,纯度99%)、曲拉通100 (Triton-X100,纯度99%)、鼠李糖脂(纯度99%)购自阿拉丁公司;酶(NS22086、NS22118)购自Novozymes公司.
仪器:BSA221S型电子天平(德国赛多利斯公司);HC-3018型高速离心机(安徽中科中佳科学仪器有限公司);MS-100型恒温混匀仪(杭州奥盛仪器有有限公司);UV756CRT型紫外可见分光光度计(上海佑科仪器仪表有限公司);Nicolet6700傅立叶红外光谱仪(美国赛默飞世尔科技公司);UItima X-射线衍射仪(日本理学);JSM-7001F扫描电子显微镜(日本JEOL公司).
2.3 木质纤维材料预处理称取0.5 g稻秆加入到带螺旋塞的瓶子中,加入5 g离子液体及1%的表面活性剂(SDS、CTAB、Tween80、Triton-X100、鼠李糖脂);离子液体预处理稻秆前,将离子液体在120 ℃下加热30 min,并不断搅拌,以去除离子液体中的水分(Nawsha et al., 2013);然后置于磁力搅拌器上,在110 ℃条件下搅拌1 h,加入45 mL去离子水,将混合液置于50 mL的离心管中,以7000 r·min-1高速离心15 min后分离;移出上层清液,储存.取下层沉淀物,用去离子水反复清洗,去除离子液体,在60 ℃真空干燥至少18 h,取出称重,留至下一步的酶解.
2.4 预处理前后的木质纤维素样品糖化按2.5%(m/V, mg/mL)的比例准确称取预处理前后稻秆试样分别置于50 mL锥形瓶中,加入0.1 mol·L-1 pH=4.8的柠檬酸缓冲溶液和100 μL 0.02%叠氮化钠溶液,摇匀,再分别加入水解酶50 FPU·g-1(纤维素酶)及40 CBU·g-1(葡萄糖苷酶),置于(50.0±0.5)℃恒温水浴振荡器中,转速为150 r·min-1下分别糖化24、48、72 h.反应完毕,在13500 r·min-1下离心得酶水解液,取样用DNS测定法分析还原糖含量,根据公式(1)计算纤维转化率(Worasuwannarak et al., 2007).
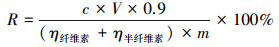
|
(1) |
式中,R为纤维转化率,c为72 h后反应生成还原糖浓度(mg·mL-1),V为反应液总体积(mL),η为纤维素、半纤维素的占比,m为使用原始稻秆量(mg).
预处理后的稻秆酶解反应是一个复杂的非均相反应体系,纤维素酶是由多种酶混合组成的,是具有协同作用的复杂酶系.根据酶功能的不同,纤维素酶主要分为3种组分:葡聚糖内切酶(EC)、葡聚糖外切酶(CBH)、β-葡萄糖苷酶(BG)(Lius et al., 2007),通常简化为两个步骤(鲁爱华等,2010):
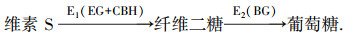
|
为了建立其动力学模型,现对预处理后酶解过程作如下简化和假设:①预处理后的稻秆酶解反应是单一纤维素的拟均相酶解反应;②预处理后稻草酶解中的纤维素由可酶水解和不可酶水解两部分组成;③在酶解反应体系中,纤维素酶作用是一个复杂的过程,内切葡聚糖酶作用产生大量带非还原性末端的纤维素,外切葡聚糖酶在这些非还原性末端上依次水解生成纤维二糖,β-葡萄糖苷酶水解纤维二糖生成葡萄糖分子;④两种酶共同作用下,遵守米氏方程的规律.基于以上的假定,结合文献报道(鲁爱华等,2010),提出以下方程:
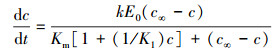
|
(2) |
式中,c为还原糖浓度(mg·mL-1),t为糖化时间(min),k为糖化速率常数(min-1),E0=0.45,c∞为预处理后稻秆生成还原糖浓度(mg·mL-1),Km为米氏常数(mg·mL-1),K1为产物抑制常数.
利用Lineweaver-Burk法作图,取Michae-Menten的倒数式:
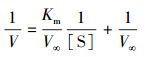
|
(3) |
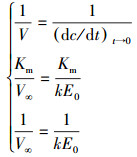
|
(4) |
式中,V∞为最大反应速率(mg·mL-1·min-1),[S]为初始底物浓度(mg·mL-1);1/V与1/[S]呈线性关系,以1/V为纵坐标,1/[S]为横坐标,截距为1/V∞,斜率为Km/V∞,确定V∞和Km.
2.6 模型验证由于植物纤维素原料酶解过程较为复杂,因而各个研究者所得出酶解的动力学表达式及模型参数值有较大的差异,对于描述纤维素原料酶解的过程没有普遍意义.因此,对特定的物系在特定的条件下进行酶解,有必要对其动力学进行研究(鲁爱华等,2010).本试验取底物浓度分别为5、10、15、25、30 mg·mL-1,试验测试产物还原糖生成初速度(初速度以酶解前30 min还原糖生成速度近似为初速度).
2.7 木质纤维素材料的成分与结构分析 2.7.1 预处理前后木质纤维材料的成分分析采用硝酸乙醇法和亚氯酸钠法测定秸秆中纤维素和半纤维素,采用72%浓硫酸法测定秸秆中木质素(石淑兰, 2006).
2.7.2 预处理前后木质纤维素材料的FTIR分析取1 mg预处理前后的稻秆样品研磨,然后与300~400 mg干燥的KBr粉末充分混合,再次研磨至符合压片要求为止,将其压成透明薄片,以KBr空白片作为参比扫描红外光谱, 扫描范围为4000~400 cm-1.
2.7.3 预处理前后木质纤维素材料的XRD分析采用Cu靶产生X射线,管压40 kV, 管流20 mA,扫描步长0.02°·s-1.样品的结晶度指数利用下面的方程(Nasirpour et al., 2014)进行计算:
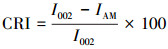
|
(5) |
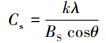
|
(6) |
式中, CRI为结晶度指数,I002为晶体衍射最大强度,IAM为在2θ=16.6°时的衍射强度;Cs为晶粒大小(nm),k为谢乐常数,λ为X-射线波长(nm),θ为衍射角度(rad),Bs为最大半宽高(rad).
3 结果与讨论(Results and discussion) 3.1 纤维素酶和β-葡萄糖苷酶的最佳酶组合分析不同纤维素酶与β-葡萄糖苷酶浓度组合与0.025g·L-1的稻秆反应所产生的还原糖变化如图 1所示.从图 1a可以看出,当β-葡萄糖苷酶浓度固定为40 CBU·g-1时,还原糖产量随纤维素酶浓度的增加先增加后减小,当纤维素酶增加到60 FPU·g-1时,酶解还原糖产量反而下降,说明纤维素酶浓度超过50 FPU·g-1后,增加纤维素酶浓度并不能增加酶解效率.这可能是由于纤维素高度结晶,呈紧密堆积结构,纤维素表面吸附纤维素酶的吸附点有限,在水溶液中不溶解,导致酶降解效率低(Zhang et al., 2005);也可能是由于β-葡萄糖苷酶不足造成纤维素二糖的积累,而纤维二糖又会对纤维素酶的酶水解形成强烈抑制.从图 1b可以看出,当纤维素酶固定为50 FPU·g-1时,还原糖产量随着β-葡萄糖苷酶浓度的增加而先增后减,当β-葡萄糖苷酶浓度为50 CBU·g-1,还原糖产量下降.其原因可能是纤维素酶解中部分纤维素酶卡在纤维素的空隙中,导致这部分酶失去活性(张益良,2008),进而无法产生更多纤维二糖提供给β-葡萄糖苷酶水解成葡萄糖,因此,进一步增加β-葡萄糖苷酶浓度也不能提高还原糖产量.
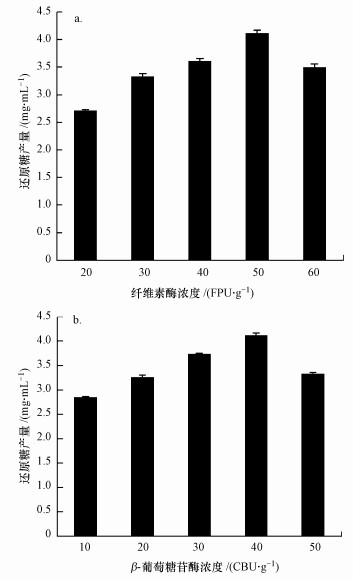 |
| 图 1 纤维素酶(a)与β-葡萄糖苷酶(b)不同组合时的酶解效果 Fig. 1 Effects of different cellulase (a)/β-glucosidase (b) combinations on reducing sugar formation |
纤维素酶和β-葡萄糖苷酶一般用于纤维素发酵前的酶解,经过此酶水解过程,纤维素从链状高分子化合物变成小分子的单糖,即产生大量葡萄糖,继续参与酵母菌的代谢活动产生酒精.稻秆先经过纤维素酶水解,然后经过β-葡萄糖苷酶酶解,形成还原性糖.由图 2可知,纤维素酶单独作用时的还原糖产量高于β-葡萄糖苷酶单独作用时的还原糖产量.主要原因是当纤维素酶作用时,内切葡聚糖酶首先是作用于结晶纤维素,使其转变为可被外切葡聚糖酶作用的无定型纤维素,外切葡聚糖酶随机水解无定型纤维素,然后β-葡萄糖苷酶将纤维二糖水解成葡萄糖.纤维素酶和β-葡萄糖苷酶协同作用比纤维素酶和β-葡萄糖苷酶分别单独作用时的还原糖产量高.推测原因是纤维素酶是分解纤维素的一类复合酶,其中,β-葡萄糖苷酶是纤维素酶中的一种非常重要的酶.在利用纤维素酶水解纤维素的过程中,由于β-葡萄糖苷酶不足造成纤维素二糖的积累,而纤维二糖又会对纤维素酶的酶水解形成强烈抑制,因此,向纤维素酶体系中加入β-葡萄糖苷酶是提高纤维素水解还原糖得率的关键措施之一.此实验说明纤维素酶与β-葡萄糖苷酶具有协同作用.
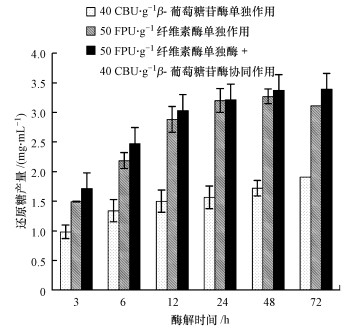 |
| 图 2 两种酶单独作用和协同作用下还原糖浓度随时间的变化关系 Fig. 2 Effect of single cellulase system followed by single β-glucosidase systemand a mix system with cellulase and β-glucosidase on reducing sugar formation in time course experiment |
为了将稻秆等木质纤维素原料用于后续生物乙醇的发酵,需要在纤维素酶的作用下将预处理后的稻秆酶解成单糖,而酶水解液中纤维转化率将作为一个衡量预处理方法效果好坏的重要指标.图 3为不同种类表面活性剂辅助离子液体对稻秆酶解效果的影响.由图中可以看出,所有的样品酶解24 h后纤维转化率明显升高,延长酶解时间至72 h时纤维转化率基本保持不变,其主要原因可能是随着酶解时间的增加,体系中基质或酶活已经消耗尽;预处理后的稻秆纤维转化率明显高于未处理稻秆的纤维转化率.酶解48 h时,未处理的稻秆纤维转化率很低(20.39%),但经[BMIM]Cl、[BMIM]Cl+1%SDS、[BMIM]Cl+1%CTAB、[BMIM]Cl+1%Tween80、[BMIM]Cl+1%Triton-X100、[BMIM]Cl+1%鼠李糖脂预处理的稻秆纤维转化率分别为28.82%、31.79%、29.09%、31.93%、33.88%、37.78%,与未处理稻秆相比分别增加了40.38%、54.85%、41.69%、55.53%、64.78%、84.02%.而经表面活性剂辅助离子液体预处理与单独离子液体预处理相比分别增加了10.30%、9.37%、10.79%、17.56%、31.09%.这说明本试验所采取的预处理方法可有效降低纤维素的结晶度,去除木质素,破坏木质素对纤维素的包裹,增加纤维素与酶的有效接触,提高酶解效率.
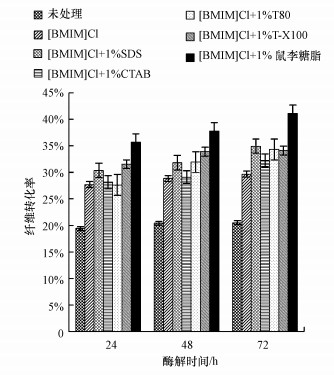 |
| 图 3 不同种类表面活性剂辅助离子液体对稻秆酶解效果的影响 Fig. 3 Effect of different surfactants-assisted ionic liquid on enzymatic hydrolysis of rice straw |
为了更深入地研究稻秆的酶水解过程,对稻秆酶水解动力学进行研究,其中,Michaelis-Menten动力方程运用最广泛.用Lineweaver-Burk法作图,可得图 4,由其测定出的米氏方程及计算所得到的Km和Vmax如表 1所示.
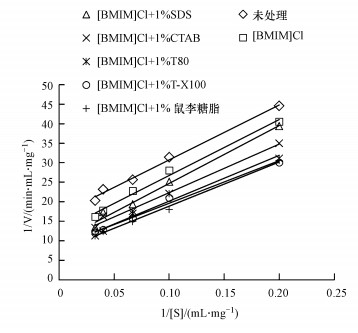 |
| 图 4 L-B双倒数图 Fig. 4 L-B doubler-reciprocal plot |
| 表 1 不同预处理对酶解动力学特征的影响 Table 1 Effect of different pretreatment on enzyme kinetic characteristics |
由表 1可知,通过预处理可以提高最大反应速率和米氏常数.由米氏方程计算得到:R2>0.9, 说明预处理对反应速率的提高有促进作用;未处理稻秆的酶解反应速率为0.06003 mg·mL-1·min-1,与未处理稻秆相比,预处理后的稻秆酶解反应速率和米氏常数明显增大;与单独离子液体预处理相比,表面活性剂辅助离子液体预处理稻秆对酶解反应速率和米氏常数影响更明显.此外,Km值可表征酶与底物的亲和力强弱程度.单独离子液体预处理的Km值比未处理稻秆的Km高37%,而表面活性剂辅助离子液体预处理稻秆的Km又比单独离子液体预处理的Km值高8%~29%.推测原因为稻秆是由多孔纤维素结构组成的,在预处理过程中,表面活性剂被吸附在稻秆上从而对后续酶解产生影响.
3.5 预处理前后的稻秆成分分析对预处理后的稻秆和原始稻秆做成分比较,如表 2所示,原始稻秆中纤维素、半纤维素和木质素含量分别为35.36%、24.15%和25.98%.经过[BMIM]Cl、[BMIM]Cl+1%SDS、[BMIM]Cl+1%CTAB、[BMIM]Cl+1%Tween80、[BMIM]Cl+1%Trition-X100、[BMIM]Cl+1%鼠李糖脂预处理后,稻秆木质素脱除率可分别提高为24.98%、49.38%、34.76%、43.38%、50.50%和51.92%.其中,[BMIM]Cl+1%鼠李糖脂预处理后的稻秆富含最多的碳水化合物,其中,纤维素占38.27%,半纤维素占22.99%,同时木质纤维素含量由原始的25.98%降低到12.49%,木质纤维素降低了51.92%.本试验表明, 表面活性剂耦合离子液体处理稻秆更容易破坏木质素的包裹作用,大幅度增加纤维转化率,并充分说明表面活性剂辅助离子液体混合体系作用过程能有效去除木质素.
| 表 2 预处理前后的稻秆化学成分分析 Table 2 Chemical composition of untreated and pretreated rice straw |
稻秆的结晶度是影响后续酶解的重要因素之一.本文利用红外光谱(FTIR)分析预处理前后稻秆的结构特征,由此推测表面活性剂辅助离子液体预处理稻秆提高酶解效果的机理.根据红外光谱图,可以计算出两条红外透过率的比率(Nasirpour et al., 2014):① α1437cm-1/α899cm-1,表示结晶指数或者侧枝结构指数(LOI);②α1378cm-1/α2900cm-1,表示总结晶指数(TCI).较高的指数说明材料有较高的结晶度和结构指数.由表 3可知,与原始稻秆相比,预处理后的稻秆LOI和TCI有明显的降低,而表面活性剂辅助离子液体预处理稻秆的LOI和TCI下降幅度更大.这表明溶解后的稻秆重新析出时,材料的结晶结构遭到破坏,变得比较松散.推测可能是因为析出过程中,水使得被溶解的稻秆快速沉淀析出,从而阻止它形成原来的结晶结构,分子发生重排,氢键也进行重新排列,因此,结构不完整的稻秆更易被酶解.通过XRD研究原始稻秆与预处理后稻秆的结晶指数和晶粒尺寸,其中,结晶指数(CRI)代表该结晶区的相对含量,可以从公式(5)计算得出.由表 3可知,与未处理稻秆相比,经过预处理后的稻秆的结晶指数均有下降,而添加表面活性剂进行预处理的稻秆结晶指数下降更明显.其中,[BMIM]Cl+1%鼠李糖脂预处理稻秆结晶度下降最大,比原始稻秆降低了13.95%,比单独离子液体预处理降低了9.76%,意味着结晶区比例进一步减少,结晶指数降低可进一步提高酶解率.FTIR分析与XRD分析结果一致,说明预处理效果是有效的.
| 表 3 预处理前后稻秆XRD结晶指数和红外比率 Table 3 The crystallinity index of XRD and the infrared ratios of Fourier transform spectroscopy for various untreated and pretreated and pretreated rice straw |
图 5为稻秆在2000倍下的扫描电镜图.从图中可观察到,未处理的稻秆纤维素结构非常紧致,表面较光滑,没有裂痕(图 5a).单独离子液体处理的稻秆表面的微观形貌失去原有杆状骨架结构, 变得空洞破碎并伴有不规则空洞和凹槽(图 5b).而通过鼠李糖脂辅助离子液体预处理的稻秆表面遭到更大的破坏,稻秆结构变得更加疏松,完全看不出稻秆原来的杆状骨架结构,呈不规则的颗粒状或团状(图 5c),从而使纤维素与酶可及度增加,提高酶解效果.
 |
| 图 5 不同预处理方式得到的稻秆SEM图(a.未处理, b.[BMIM]Cl, c.[BMIM]Cl+1%鼠李糖脂) Fig. 5 SEM of rice straw after diffident pretreatment technology |
1)本研究得出的最佳酶组合为:纤维素酶50 FPU·g-1和β-葡萄糖苷酶40 CBU·g-1.纤维素酶单独作用时的还原糖产量高于β-葡萄糖苷酶单独作用的还原糖产量,纤维素酶和β-葡萄糖苷酶协同作用时比纤维素酶和β-葡萄糖苷酶分别单独作用时的还原糖产量高.
2)在协同作用的酶体系中,与原始稻秆及单独离子液体预处理相比,不同表面活性剂辅助离子液体预处理稻秆在酶水解48 h后纤维转化率分别增加了40%~85%、10%~31%,而且通过预处理能提高最大反应速率.
3)稻秆成分分析结果表明,表面活性剂辅助离子液体混合体系作用过程能有效去除木质素.红外分光光谱图(FTIR)和X-射线衍射(XRD)分析表明,经处理后稻秆结晶指数下降,晶体尺寸也变小,说明预处理后能有效降低结晶度,提高纤维素与酶的结合效果.SEM显微镜下观察形貌发现, 处理后的稻秆失去原有杆状骨架,结构遭到很大程度的破坏,使纤维素与酶可及度增加.
| [${referVo.labelOrder}] | Berlin A, Maximenko V, Bura R, et al. 2006. A rapid microassay to evaluate enzymatic hydrolysis of lignocellulosic substrates[J]. Biotechnol Bioteng, 93(5) : 880–886. DOI:10.1002/(ISSN)1097-0290 |
| [${referVo.labelOrder}] | Chang K L, Chen X M, Han Y J, et al. 2016. Effect study on enzymatic hydrolysis of rice straw by surfactant-Assisted ionic liquid pretreatment[J]. CIESC Journal, 67(5) : 2078–2083. |
| [${referVo.labelOrder}] | 冯圆圆, 李强, 季更生, 等. 2014. 表面活性剂对离子液体预处理纤维素的影响[J]. 化工进展, 2014, 33(12) : 3349–3352. |
| [${referVo.labelOrder}] | Huber G W, Iborra S, Gorma A. 2006. Synthesis of transportation fuels from biomass:Chemistry, catalysts, and engineering[J]. Chemical Reviews, 106(9) : 4044–4098. DOI:10.1021/cr068360d |
| [${referVo.labelOrder}] | 鲁爱华, 袁兴中, 康广博, 等. 2010. 稻草超声辅助预处理后酶解过程的动力学研究[J]. 环境工程学报, 2010, 4(6) : 1399–1404. |
| [${referVo.labelOrder}] | Lius L, Wang H, Wang C Y. 2007. Progress of the molecular structure and mechanism about cellulase[J]. Food Science and Technology, 7 : 12–15. |
| [${referVo.labelOrder}] | Nawsha M, ZakariaMan M, et al. 2013. Investigations of novel nitrile based ionic liquids as pretreatment solvent for extraction of lignin from bamboo biomass[J]. Journal of Industrial and Engineering Chemistry, 19(1) : 207–214. DOI:10.1016/j.jiec.2012.08.003 |
| [${referVo.labelOrder}] | Nasirpour N, Mousavi S M, Shojaosadti S A. 2014. A novel surfactant-assisted ionic liquid pretreatment of sugarcane bagasse for enhanced enzymatic hydrolysis[J]. Bioresource Technology, 169 : 33–37. DOI:10.1016/j.biortech.2014.06.023 |
| [${referVo.labelOrder}] | Sun Y, Cheng J. 2002. Hydrolysis of lignocellulosic materials for ethanol production:a review[J]. Bioresorce Technology, 83(1) : 1–11. DOI:10.1016/S0960-8524(01)00212-7 |
| [${referVo.labelOrder}] | 石淑兰. 2006. 纸浆造纸分析与检测[M]. 北京: 中国轻工业出版社: 1–380. |
| [${referVo.labelOrder}] | Worasuwannarak N, Sonobe T, Tanthapanichakoon W. 2007. Pyrolysisbehavious of rice straw, rice husk, and corncob by TG-MS technique[J]. Journal of Analtical and Applied Pyrolysis, 78(2) : 265–271. DOI:10.1016/j.jaap.2006.08.002 |
| [${referVo.labelOrder}] | Yang S, Ding W Y, Chen H Z. 2006. Enzymatic hydrolysis of rice straw in a tubular reactor coupled with UF membrane[J]. Process Biochemistry, 41(3) : 721–725. DOI:10.1016/j.procbio.2005.08.002 |
| [${referVo.labelOrder}] | 杨森, 丁文勇, 陈洪章. 2005. 膜生物反应器在汽爆稻草秸秆酶解中的应用研究[J]. 环境科学, 2005, 26(5) : 161–163. |
| [${referVo.labelOrder}] | 张耿崚, 陈细妹, 韩业钜, 等. 2016. 表面活性剂耦合离子液体对稻秆酶解糖化的影响[J]. 化工学报, 2016, 67(5) : 2078–2083. |
| [${referVo.labelOrder}] | 张益良.2008.离子液体溶解及酶降解纤维动力学初探[D].天津:天津大学 http://www.doc88.com/p-111697469038.html |
| [${referVo.labelOrder}] | Zhang Y H P, Lynd L R. 2005. Determination of the number-average degree of polymerization of celledextrins and cellulose:with application to enzymatic hydrolysis[J]. Biomacromdecnles, 6(3) : 1510–1515. |
| [${referVo.labelOrder}] | Zhang Y H P, Lynd L R. 2004. Toward an aggregated understanding of enzymatic hydrolysis cellulose:Noncomplexed cellulose systems[J]. Biotechnol, 88(7) : 797–824. |
| [${referVo.labelOrder}] | 赵磊.2008.玉米秸秆降解及生产乙醇的研究[D].西安:西北大学 |
 2017, Vol. 37
2017, Vol. 37



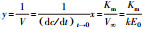 .
.