在我国工业快速发展的背景下,水体重金属的污染问题已成为一个迫切需要面对和解决的环境问题.水体中的重金属通过食物链在生物体内流动、富集,最终进入人体,严重威胁了人类的生命健康.研究表明,当人体摄入一定量的重金属时,将会导致诸如贫血、神经功能障碍、肝功能异常等一系列健康疾病,有些重金属甚至会造成人体DNA的损伤,进而引起生育能力下降并可能诱发癌症(Zhao et al., 2012;Na et al., 2010).治理重金属废水较为常用的方法有化学沉淀、离子交换、膜处理、反渗透及吸附等(Tong et al., 2011).吸附法是常用的水体重金属污染治理技术之一,因经济有效、操作简单等优势而倍受关注(万顺利等,2014),而对绿色、高效重金属吸附剂的开发也成为研究热点(李成杨等,2015).
胡敏素是腐殖质中的一类大分子有机物,其在酸性条件和碱性条件下均不溶解.腐殖质分子含有多种基团,包括芳香族和脂肪族化合物上的羧基和芳香环上的酚羟基、醇羟基、醚基、酮基等.已有大量研究(杜凤龄等,2015;Chutia et al., 2009;Vetrova et al., 2014)表明,腐殖质能与金属离子发生吸附、络合等多种作用,从而改变重金属的价态和形态,达到去除重金属的目的.目前对于腐殖质中可溶性的富里酸和胡敏酸在水体重金属污染修复方面的应用有较多研究(Chen et al., 2012;Arslan et al., 2006;Garcia Mina et al., 2010),但对于胡敏素的研究却较少.
响应面法是优化最佳工艺参数、减少实验次数及评价各影响因素水平及交互作用的有效方法之一(Pinheiro et al., 1995).本实验利用胡敏素对模拟含铜废水中Cu2+进行吸附,根据响应面法中的Box-Behnken实验设计原理对吸附时间、吸附剂用量、pH、温度、Cu2+初始浓度5个因素对胡敏素吸附Cu2+的综合影响进行研究.然后分别采用Langmuir、Freundlich和Dubinin-Radushkevich 3种等温吸附模型,将上述最优条件下获得的实验结果进行拟合,最后结合扫描电镜、EDX能谱、红外光谱等分析手段对其吸附机理进行探讨,以期为实际利用胡敏素吸附去除污水中重金属离子提供理论依据.
2 材料与方法(Materials and methods) 2.1 胡敏素的制备及零点电荷的测定胡敏素的原料为泥炭土.首先将泥炭土进行预处理,然后称取一定量于锥形瓶中,以1:10的质量比加入0.1 mol·L-1的氢氧化钠溶液中;之后置于摇床上振荡5~6 h,用离心机(TDL-40C)在4000 r·min-1下离心分离20 min,弃去上清液,此步骤反复进行10次,此时上清液的颜色变为淡黄色.离心分离后,弃去上清液,残余固体物用双蒸水反复洗涤至中性,最后在30~35 ℃烘箱中烘干,即获得胡敏素(HM)(刘国光等,2014).采用批量处理平衡法测定胡敏素零点电荷pHzpc(Wu et al., 2011).
2.2 吸附率的测定在250 mL锥形瓶中加入一定量(1.6、2、2.4 g·L-1)的胡敏素和50 mL一定浓度(200、250、300 mg·L-1)的硝酸铜溶液.用0.1 mol·L-1的NaOH和HCl调节溶液的pH (2、4、6),密封后放入一定温度(25、45、65 ℃)、转速为200 r·min-1的恒温摇床振荡一定时间(60、90、120 min).吸附完成后取样,样品经4000 r·min-1离心20 min后,取上清液用0.22 μm的滤膜过滤,最后采用火焰原子吸收光度计(Z-2000,HITACHI)测定上清液中Cu2+浓度.按照公式(1)计算Cu2+的吸附率.
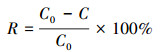
|
(1) |
式中,R为吸附率,C0为溶液中金属离子初始浓度(mg·L-1),C为吸附平衡时溶液中金属离子浓度(mg·L-1).
2.3 响应面法优化反应条件研究吸附时间、吸附剂用量、pH、温度和Cu2+初始浓度5个因素对胡敏素吸附Cu2+影响的主效应和交互作用,在实验范围内对吸附条件进行优化.采用Box-Behnken响应面优化实验设计,分别在低(-1)、中(0)、高(1)的3个水平上对吸附实验进行了中心复合设计,共有46组实验,其中,中心点实验重复6组,并且每组实验重复3次,取其平均值作为对应的响应值.5个因素的3个水平编码和实验值关系见表 1,实验方案见表 2.实验中溶液体积均为50 mL.其它因素根据表 2和表 1确定,实验过程基本同2.2节.
| 表 1 实验自变量因素及其水平表 Table 1 Factors and levels of Box-Behnken design |
取50 mL Cu2+初始浓度分别为20、40、60、100、200、300、400、500 mg·L-1的Cu (NO3)2溶液于系列150 mL锥形瓶中,控制其它条件均为最优状态下进行吸附实验,测出吸附后溶液中Cu2+的平衡浓度,并由此浓度计算出平衡吸附量qe.分别用Langmuir、Freundlich和Dubinin-Radushkevich吸附等温式对吸附结果进行拟合.
2.5 吸附机理将吸附前后的胡敏素样品干燥处理,酒精脱水,喷金后在扫描电镜(HITACHI S-3700N)上观察胡敏素的表面结构.利用EDX (Emax Energy HORIBA7962-H)对吸附前后的胡敏素样品进行元素分析.将吸附前后的胡敏素样品干燥处理,用傅里叶变换红外光谱仪(Nicolet6700,Thermofisher)测定胡敏素表面官能团特征,扫描范围为4000~400 cm-1.采用全自动快速比表面积分析仪(Gemini V2380)测定胡敏素的比表面积.
3 结果与讨论(Results and analysis) 3.1 响应面优化反应条件胡敏素吸附去除水中Cu2+的实验设计及结果见表 2.对表 2中的实验结果用软件Design-Experts7进行方差分析,结果列于表 3.以Cu2+吸附率为响应值,以吸附时间、吸附剂用量、pH、温度、初始浓度为自变量建立响应面二次多项式,具体如式(2)所示.
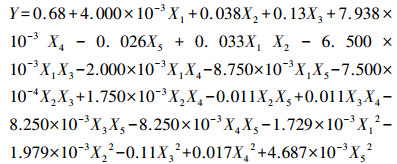
|
(2) |
式中,Y为响应值,即Cu2+吸附率;X1、X2、X3、X4、X5分别代表吸附时间、吸附剂用量、pH、温度和Cu2+初始浓度这5个自变量的编码值.
| 表 2 实验设计与结果 Table 2 Experimental design and the corresponding results |
通常,利用F值来进行统计显著性检测,利用p值来检测每个回归系数的显著性.p值越小,表 3表明结果越显著,若p < 0.0001,说明回归模型所对应项目的相关性是非常显著的;若0.0001 < p < 0.05,说明回归模型所对应项目的相关性是显著的;若p > 0.05,说明回归模型所对应项目的相关性不显著(张文彤,2013).由表 3可以看出,模型F值为50.87,p < 0.0001,这说明模型具有非常显著的适应性,回归方程描述各因素与响应值之间的非线性方程关系是显著的;模型决定系数R2=0.9760,表明仅有2.4%不能由回归模型来解释;RAdj2-RPred2=0.9568-0.9117=0.0451 < 0.2;R2与RAdj2(0.9568)接近1,表明该模型的预测结果与实验结果高度吻合(图 1);变异系数CV=3.21% < 10%,信噪比为25.375,远大于4,表明该模型具有比较高的可信度和精密度.综上所述,模型可用于预测.
| 表 3 方差分析表 Table 3 Analysis of variance |
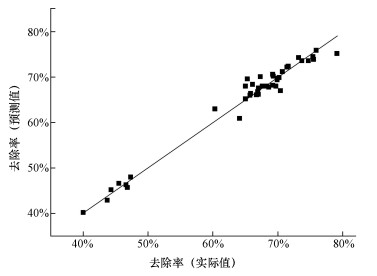 |
| 图 1 模型预测值与实际值比较 Fig. 1 Comparison of the predicted and actual removal |
由表 3可知,胡敏素用量、pH值和Cu2+初始浓度均对吸附率有显著影响;二次项中,pH值和温度对吸附率有显著影响(p < 0.05);交互项中,吸附时间和胡敏素用量的交互作用对吸附率有显著影响,其它p值均大于0.05,说明其显著性不明显.
从图 2可以看出,胡敏素对Cu2+的吸附率与吸附剂用量成正比关系;而随着溶液pH值(2~6)的升高,Cu2+的吸附率先升高(pH值为2~5)后略微降低(pH值为5~6);随着Cu2+初始浓度的升高,胡敏素对Cu2+的吸附率下降.这说明适当地提高溶液pH值(4.5~5.5),增加吸附剂用量及相应地降低溶液中Cu2+初始浓度将有助于提高胡敏素对Cu2+的吸附率.
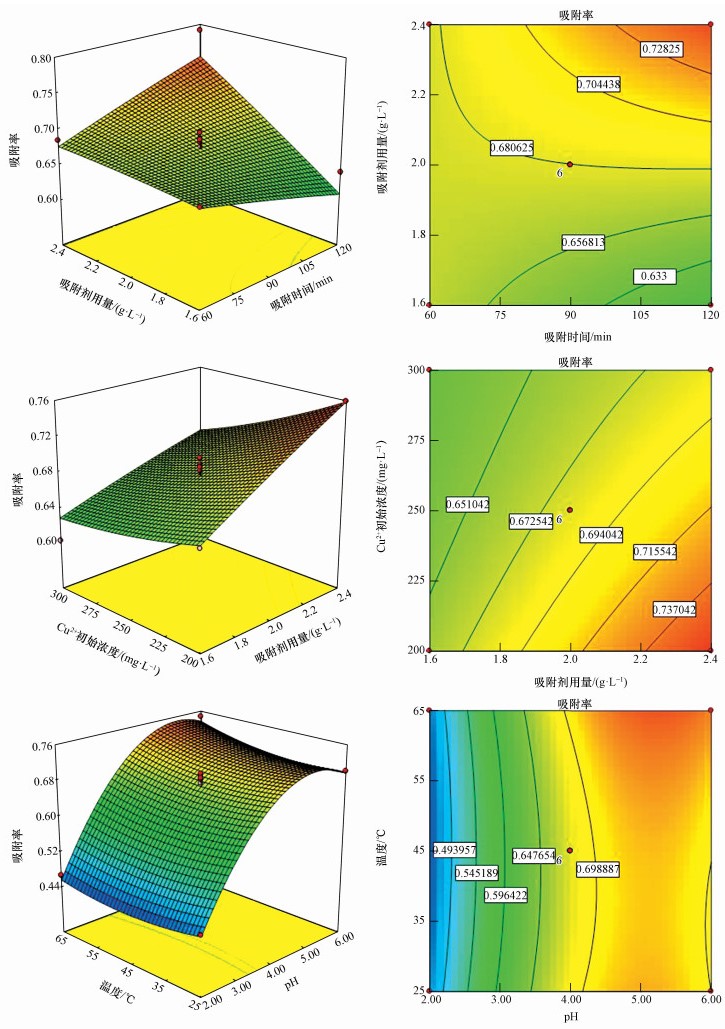 |
| 图 2 三维曲面和等高线图 Fig. 2 3D surface and contour |
对方程(2)求一阶导数得到最佳条件:吸附时间110 min、吸附剂用量2.4 g·L-1、pH=5.4、温度56.7 ℃、Cu2+初始浓度208 mg·L-1.为了验证预测结果,在最优条件下进行实验,实验重复3次取平均值,得到Cu2+的平均去除率为80.89%,与模型的预测值81.33%相接近,预测精度达99.46%,说明预测值与实验值拟合度较高,具有一定的指导意义.然而由图 2可以看出,温度对胡敏素吸附Cu2+的影响不明显,并且温度和其他4个因素的交互作用也不显著.因此,结合实际废水环境条件,优化条件调整为:吸附时间110 min、吸附剂用量2.4 g·L-1、pH=5.4、温度25.0 ℃、Cu2+初始浓度208 mg·L-1.在此条件下计算模型预测值为81.25%,3次平行实验取平均值得吸附率实验值为80.78%,与最优条件下吸附效果很接近.
随着吸附剂用量的增加,体系中总的吸附位点增加,从而有利于吸附的进行.pH需设在适宜范围内,同时考虑其对生物吸附的影响才是有效的(Lopičić et al., 2013).pH>7时,Cu2+可能与OH-结合,而以Cu (OH)2沉淀的形式被去除(Fan et al., 2008).为排除Cu2+沉淀去除对吸附率的影响,实验中设置pH最高值为6.0(Hasan et al., 2008).实验测得胡敏素零点电荷为2.74.当溶液pH值小于胡敏素零点电荷2.74时,胡敏素表面正电荷占优势,质子化程度较高,同时,溶液中大量游离的H+和Cu2+竞争胡敏素表面的结合位点,导致吸附率较低;当溶液pH值大于胡敏素零点电荷2.74时,胡敏素表面负电荷占优势,有助于对Cu2+的吸附,同时,随着pH值的升高,胡敏素表面质子化程度减弱,大量有效吸附基团(如-COOH、-NH、-OH等基团)开始作用,这些基团上的氢键容易丢失,产生-COO-、-N-、-O-,表现出电负性,从而有助于吸附基团与Cu2+之间的反应,使吸附率增大(Huang et al., 2009);但另一方面,随着pH值升高,一部分Cu2+转化为Cu (OH)+,由于Cu (OH)+比Cu2+表面所带正电荷减少,使得-COO-、-O-等对Cu (OH)+的吸附作用减弱.由图 2可以看出,pH值大于5时吸附率随pH升高而略微下降,这与李璐等(2009)的研究结果相似.当溶液中Cu2+浓度较低时,达到吸附平衡时胡敏素表面的吸附位点比较充分,吸附率较高;当溶液中Cu2+浓度较高时, 胡敏素表面的金属吸附位点逐渐达到饱和,因而对Cu2+的吸附率逐渐降低.此变化规律与其他研究者的研究结果相一致(Martina et al., 2009;Zhang et al., 2013).
3.2 吸附等温模型吸附等温实验目的在于通过研究吸附等温线,确定胡敏素对Cu2+的最大吸附量.通常采用Langmuir、Freundlich和Dubinin-Radushkevich等温吸附模型(式(3)~(5))来进行分析.
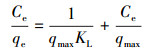
|
(3) |
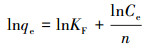
|
(4) |
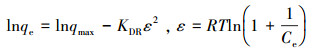
|
(5) |
式中,qe为平衡吸附量(mg·g-1),qmax为最大吸附量(mg·g-1),KL为Langmuir吸附常数(L·mg-1),KF为Freundlich吸附常数(L·g-1),n为Freundlich吸附常数,ε为Polenyi势,KDR为与吸附能有关的常数,其值与平均吸附自由能E的关系为:E=(2KDR)-1/2,R为气体常数(J·mol-1·K-1),T为吸附温度(K).
在最优吸附条件下进行实验,将实验数据用Langmuir模型、Freundlich模型和Dubinin-Radushkevich模型进行拟合,结果见图 3,模型拟合参数如表 4所示.从表 4可以看出,RL2大于RF2,并且大于RD-R2,显然Langmuir等温线方程的可决系数更接近1,拟合效果较好,表明用Langmuir等温模型来描述胡敏素对Cu2+的吸附更为合适,最大吸附量为88.97 mg·g-1,吸附量大,优于其它多种吸附剂(Demirbas et al., 2009;Zendelska et al., 2015).
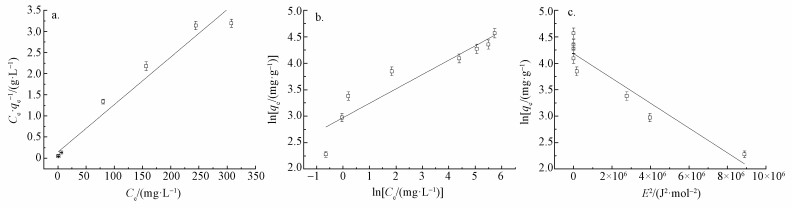 |
| 图 3 Langmuir (a), Freundlich (b)和Dubinin-Radushkevich (c)模型吸附等温线 Fig. 3 Langmuir (a), Freundlich (b) and Dubinin-Radushkevich (c) adsorption isotherms |
| 表 4 Langmuir、Freundlich和Dubinin-Radushkevich模型的拟合参数 Table 4 Constants of Freundlich, Langmuir and Dubinin-Radushkevich isotherms |
胡敏素吸附Cu2+前后扫描电镜观察结果如图 4所示.吸附前如图 4a所示,胡敏素表面较为蓬松,孔隙结构发达,支干错综复杂呈分散状,比表面积较大,实验测得为54 m2·g-1,因而能够提供较大的吸附面积.吸附后如图 4b所示,胡敏素表面呈粘连聚合体,颗粒变得紧密,小颗粒沉积在大颗粒空隙之间,使胡敏素颗粒变得紧密厚实,团聚状态良好.图 4c、d所示为两个大颗粒的侧面图,可明显看出吸附后小颗粒簇拥在大颗粒表面.胡敏素表面结构的变化可以推测胡敏素对Cu2+的吸附存在物理吸附行为.物理吸附的发生依靠分子间力来作用,吸附能小,胡敏素表面多微孔,能够提供较大的表面能,满足物理吸附的发生(Kuchta et al., , 2005).
 |
| 图 4 胡敏素吸附Cu2+前后扫描电镜下表面特征(a, c.吸附前;b, d.吸附后) Fig. 4 SEM images showing the characteristics of humin surface before (a, c) and after (b, d) adsorption |
胡敏素吸附Cu2+前后的X射线能谱图见图 5,各元素百分比见表 5.吸附前(图 5a)铜元素谱线有微弱的吸收,可能是因为制备胡敏素的原料泥炭土中含有极微量铜离子所致.吸附后(图 5b),铜元素谱线峰处出现吸收峰,由表 5可知,铜元素的质量和原子比重分别比吸附前增加5.88%和1.40%,表明胡敏素表面络合了Cu2+.胡敏素吸附Cu2+后,胡敏素表面的Na、Ca、Mg、K、Al元素吸附后比吸附前原子比重下降,而Cu元素原子比重增加,表明胡敏素表面存在离子交换.吸附后检测不到Na元素,Ca、Mg元素在吸附后质量和原子比重比K、Al元素下降量多.因此,吸附过程中胡敏素表面的离子交换作用主要由Na+、Ca2+、Mg2+完成.
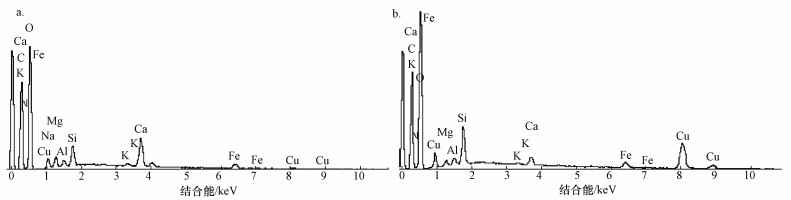 |
| 图 5 胡敏素吸附Cu2+前后X射线能谱图(a.吸附前; b.吸附后) Fig. 5 EDX spectrum of humin before (a) and after (b) Cu2+ biosorption |
| 表 5 胡敏素吸附Cu2+前后X射线能谱分析 Table 5 EDX analysis of substrate before and after biosorption |
将吸附Cu2+前后的胡敏素进行红外光谱分析,结果见图 6(红外光谱分辨率为2 cm-1).胡敏素的红外图谱上,主要的吸收区域是3600~3200、2940~2850、1650~1600和1020~1080 cm-1.它们的吸收分别是-OH的O-H振动(-NH的N-H振动)、脂肪族-CH3中的C-H振动、不饱和烃中的C=C振动(C=O)和羧基基团中C-O振动的结果.在整个吸收波数范围内几乎所有波峰强度均有所减弱,其中尤以3414.29 cm-1处的波峰强度减弱最为显著,其次为1048.50 cm-1处的波峰,这说明胡敏素与Cu2+之间存在化学吸附,对化学吸附贡献最大的为胡敏素表面的-OH及-NH基团,其次为-COOH基团.3414.29、3418.30 cm-1处是-OH/-NH的伸缩振动峰(Helal et al., 2011;吴景贵等,1998),吸附后比吸附前移动了4.01 cm-1,表明-OH/-NH在吸附过程中发生了反应.1610.29、1617.12 cm-1处为不饱和烃中的C=C振动(C=O)伸缩振动峰,吸附后比吸附前移动了6.83 cm-1,表明不饱和羟中的C=C振动(C=O)在吸附时也发生了反应.2919.75、2921.67 cm-1处为脂肪族-CH3和-CH2中的C-H伸缩振动峰,吸附后比吸附前移动了1.92 cm-1,其位移明显小于-OH/-NH及C=C/C=O基团,这段位移是在红外光谱分辨率范围内的.可见胡敏素吸附Cu2+时起作用的有氨基、羟基、羰基、羧基和芳烃中的C=C等,胡敏素分子中富含这些基团.已有大量研究(Zhang et al., 2009;张云松等,2008)表明,氨基、羟基、羰基和羧基在吸附时起配位络合作用.
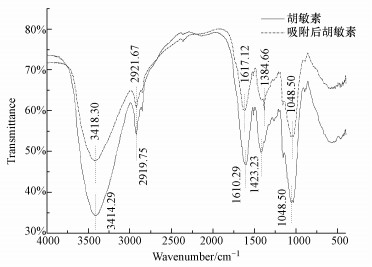 |
| 图 6 胡敏素吸附Cu2+前后红外图谱 Fig. 6 FTIR spectrum of humin before and after Cu2+ adsorption |
1) Box-Behnken实验设计研究结果表明,胡敏素吸附Cu2+过程中,胡敏素用量、pH值和Cu2+初始浓度是对吸附率有显著影响的因素;二次项中,pH和温度是对吸附率有显著影响的因素;交互项中,吸附时间和吸附剂用量的交互作用是对吸附率有显著影响的因素.
2)响应面优化结果表明,吸附时间110 min、吸附剂用量2.4 g·L-1、pH=5.4、温度25.0 ℃、Cu2+初始浓度208 mg·L-1时,胡敏素对Cu2+吸附率较高,可达80.78%,吸附模型符合Langmuir等温线方程.胡敏素对Cu2+吸附效果显著,可作为新型离子吸附剂的良好材料.
3)胡敏素分子疏松多孔,比表面积较大,易于进行物理吸附.胡敏素表面的羟基、氨基、羰基、羧基和芳烃中的C=C键等与能与Cu2+发生配位络合作用,同时, Cu2+和胡敏素表面的Na+、Ca2+、Mg2+等发生离子交换反应,从而发生化学吸附.
| [${referVo.labelOrder}] | Arslan G, Edebali S, Pehlivan E. 2010. Physical and chemical factors affecting the adsorption of Cr (Ⅵ) via humic acids extracted from brown coals[J]. Desalination, 255(1) : 117–123. |
| [${referVo.labelOrder}] | Chen Q Q, Yin D Q, Zhu S J, et al. 2012. Adsorption of cadmium (Ⅱ) on humic acid coated titanium dioxide[J]. Journal of Colloid & Interface Science, 367(1) : 241–248. |
| [${referVo.labelOrder}] | Chutia P, Kato S, Kojima T, et al. 2009. Arsenic adsorption from aqueous solution on synthetic zeolites[J]. Journal of Hazardous Materials, 162(1) : 440–447. DOI:10.1016/j.jhazmat.2008.05.061 |
| [${referVo.labelOrder}] | Demirbas E, Dizge N, Sulak M T, et al. 2009. Adsorption kinetics and equilibrium of copper from aqueous solutions using hazelnut shell activated carbon[J]. Chemical Engineering Journal, 148(2/3) : 480–487. |
| [${referVo.labelOrder}] | 杜凤龄, 王刚, 徐敏, 等. 2015. 新型高分子螯合-絮凝剂制备条件的响应面法优化[J]. 中国环境科学, 2015, 35(4) : 1116–1122. |
| [${referVo.labelOrder}] | Fan T, Liu Y, Feng B, et al. 2008. Biosorption of cadmium (Ⅱ), zinc (Ⅱ) and lead (Ⅱ) by Penicillium simplicissimum:Isotherms, kinetics and thermodynamics[J]. Journal of Hazardous Materials, 160(2/3) : 655–61. |
| [${referVo.labelOrder}] | Garcia Mina J M. 2006. Stability, solubility and maximum metal binding capacity in metal-humic complexes involving humic substances extracted from peat and organic compost[J]. Organic Geochemistry, 37(12) : 1960–1972. DOI:10.1016/j.orggeochem.2006.07.027 |
| [${referVo.labelOrder}] | Hasan S, Ghosh T K, Viswanath D S, et al. 2008. Dispersion of chitosan on perlite for enhancement of copper (Ⅱ) adsorption capacity[J]. Journal of Hazardous Materials, 2(2) : 826–837. |
| [${referVo.labelOrder}] | Helal A A, Murad G A, Helal A A. 2011. Characterization of different humic materials by various analytical techniques[J]. Arabian Journal of Chemistry, 4(1) : 51–54. DOI:10.1016/j.arabjc.2010.06.018 |
| [${referVo.labelOrder}] | Huang G, Shi J X, Langrish T A G. 2009. Removal of Cr (Ⅵ) from aqueous solution using activated carbon modified with nitric acid[J]. Chemical Engineering Journal, 152(2/3) : 434–439. |
| [${referVo.labelOrder}] | Kuchta B, Firlej L, Maurin G. 2005. Modeling of adsorption in nanopores[J]. Journal of Molecular Modeling, 11(5) : 293–300. |
| [${referVo.labelOrder}] | 李成杨, 庄泽超, 金晓英, 等. 2015. 氧化石墨烯对亚甲基蓝和铜离子的共吸附行为研究[J]. 环境科学学报, 2015, 35(10) : 3163–3169. |
| [${referVo.labelOrder}] | 刘国光, 李利明, 姚琨, 等.2014.一种土壤重金属钝化剂及其制备方法[P].中国:发明专利.CN103980907A, 2014-08-13 |
| [${referVo.labelOrder}] | 李璐, 杨朝晖, 孙珮石, 等. 2009. 基于响应面优化条件下柚皮对Pb2+的吸附[J]. 环境科学学报, 2009, 29(7) : 1426–1433. |
| [${referVo.labelOrder}] | Lopičić Z R, Milojković J V, Šoštarić T D, et al. 2013. Influence of pH value on Cu (Ⅱ) biosorption by lignocellulose peach shell waste material[J]. Hemijska Industrija, 67(6) : 1007–1015. DOI:10.2298/HEMIND121225018L |
| [${referVo.labelOrder}] | Martina H, Jirí M, Ivana S, et al. 2009. Sorption of metal ions on lignite and the derived humic substances[J]. Journal of Hazardous Materials, 161(1) : 559–64. DOI:10.1016/j.jhazmat.2008.03.136 |
| [${referVo.labelOrder}] | Na Z, Liu J, Wang Q, et al. 2010. Health risk assessment of heavy metal exposure to street dust in the zinc smelting district, Northeast of China[J]. Science of the Total Environment, 408(4) : 726–733. DOI:10.1016/j.scitotenv.2009.10.075 |
| [${referVo.labelOrder}] | Pinheiro J P, Mota A M, Gonçalves M S. 1995. Voltammetric analysis of the competition between calcium and heavy metal for complexation by humic material[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 95 : 305–313. |
| [${referVo.labelOrder}] | Tong K S, Kassim M J, Azraa A. 2011. Adsorption of copper ion from its aqueous solution by a novel biosorbent Uncaria gambir:Equilibrium, kinetics, and thermodynamic studies[J]. Chemical Engineering Journal, 170(1) : 145–153. DOI:10.1016/j.cej.2011.03.044 |
| [${referVo.labelOrder}] | Vetrova O V, Konovalov K B, Gavrilenko M A. 2014. Application of humic sorbents for Pb2+, Cu2+ and Hg2+ lons preconcentration from aqueous solutions[J]. Procedia Chemistry, 10 : 120–126. DOI:10.1016/j.proche.2014.10.022 |
| [${referVo.labelOrder}] | 万顺利, 马钊钊, 薛瑶, 等. 2014. 氧化锰改性的茶叶渣吸附水体中Pb (Ⅱ)[J]. 环境化学, 2014, 33(12) : 2198–2205. |
| [${referVo.labelOrder}] | 吴景贵, 席时权, 姜岩. 1998. 红外光谱在土壤有机质研究中的应用[J]. 光谱学与光谱分析, 1998, 18(1) : 52–57. |
| [${referVo.labelOrder}] | Wu P, Zhang Q, Dai Y, et al. 2011. Adsorption of Cu (Ⅱ), Cd (Ⅱ) and Cr (Ⅲ) ions from aqueous solutions on humic acid modified Ca-montmorillonite[J]. Geoderma, 164(3) : 215–219. |
| [${referVo.labelOrder}] | Zendelska A, Golomeova M, Blažev K, et al. 2015. Adsorption of copper ions from aqueous solutions on natural zeolite[J]. Environment Protection Engineering, 41(4) : 17–36. |
| [${referVo.labelOrder}] | Zhang J, Wang S, Wang Q, et al. 2013. First determination of Cu adsorption on soil humin[J]. Environmental Chemistry Letters, 11(1) : 41–46. DOI:10.1007/s10311-012-0375-1 |
| [${referVo.labelOrder}] | Zhang J, Dai J, Wang R, et al. 2009. Adsorption and desorption of divalent mercury (Hg2+) on humic acids and fulvic acids extracted from typical soils in China[J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 335(1) : 194–201. |
| [${referVo.labelOrder}] | 张文彤. 2013. SPSS统计分析高级教程[M]. 北京: 高等教育出版社. |
| [${referVo.labelOrder}] | Zhao H, Xia B, Chen F, et al. 2012. Human health risk from soil heavy metal contamination under different land uses near Dabaoshan Mine, Southern China[J]. Science of the Total Environment, 417-418(7385) : 45–54. |
| [${referVo.labelOrder}] | 张云松, 王仁国, 代先祥, 等. 2008. 修饰作用对面包酵母细胞形貌及其吸附Cu2+性能的影响比较[J]. 环境科学学报, 2008, 28(5) : 897–901. |
 2017, Vol. 37
2017, Vol. 37


