2. 中国科学院大学, 北京 100049;
3. 中国农业大学, 北京 100193
2. University of Chinese Academy of Sciences, Beijing 100049;
3. China Agricultural University, Beijing 100193
四溴双酚A (Tetrabromobisphenol-A, TBBPA)广泛用作反应型阻燃剂以制造含溴环氧树脂和含溴聚碳酸酯以及作为中间体合成其他复杂的阻燃剂, 也作为添加型阻燃剂用于制动防抱死系统(ABS)、抗冲击性聚苯乙烯(HIPS)、不饱和聚酯、硬质聚氨酯泡沫塑料、胶黏剂以及涂料等, 是目前世界范围内使用量最大的溴代阻燃剂之一, 年消耗量约占全球阻燃剂总用量的1/2(Mehran et al., 2003). TBBPA具有低水溶性和较强的亲脂性, 易吸附于土壤颗粒物或沉积物中, 在空气、土壤、水生生物体内(Steven et al., 2004;Hloušková et al., 2013;Fujii et al., 2014), 甚至人体血液和母乳中均已证实有TBBPA的存在(Jakobsson et al., 2002;Ronan et al., 2005).在我国东部沿海工业区的土壤中检出TBBPA的最大浓度为78.6 ng·g-1(Tang et al., 2014).研究表明, TBBPA是一种类似于持久性有机污染物的潜在环境内分泌干扰物, 能在环境和生物体内积累并产生严重影响(Darnerud, 2003;Shigeyuki et al., 2005;Shi et al., 2005;薛银刚等, 2009).近年来, 国内外关于TBBPA影响水生生态系统的研究表明, TBBPA对生物具有细胞和神经毒性、免疫毒性、甲状腺素干扰性以及雌激素干扰性等(Kuiper et al., 2007;Akira et al., 2009;Ronisz et al., 2004;Liang et al., 2014;Linhartova et al., 2014).邓结平等研究表明TBBPA对牟氏角毛藻、微拟球藻、等鞭金藻塔溪堤品系、湛江等鞭金藻、塔胞藻的96 h半效应浓度分别为2.59、2.64、4.23、4.35和6.71 mg·L-1, 均属于高毒性(邓结平等, 2015).关于TBBPA对土壤生态系统影响的研究较少(刘莉莉等, 2008;钱艳园等, 2012), 迫切需要完善TBBPA的土壤毒理学方面数据, 从而更为全面地评价TBBPA对生态系统的影响, 明确其生态安全性, 防止并减少其危害.
代谢是生物体不断进行物质和能量交换的过程, 一旦物质和能量的交换受到阻碍, 生物体的结构和系统就会受到影响.代谢物作为细胞调节过程的终极产物, 其水平能够定性、定量地反映生物体对遗传因素或环境变化的复杂响应(Bundy et al., 2004a;2004b;Ekman et al., 2008;2009;Brown et al., 2008;2010;Lankadurai et al., 2015).代谢组学以组群指标分析为基础、以高通量检测和数据处理为手段、以信息建模与系统整合为目标, 从整体角度揭示生物体系生理和生化功能状态. Åslund利用核磁共振波谱的代谢组学研究持久性有机污染物, 将蚯蚓(Eisenia fetida)暴露于亚致死剂量的多氯联苯2 d后, 发现蚯蚓的ATP含量显著升高((Åslund et al., 2011).可见, 以蚯蚓为指示性生物的代谢组学毒理学研究已得到了较为广泛的应用, 并表现出了较高的灵敏性.
已有学者在个体、组织、基因水平上分别研究TBBPA对蚯蚓生长抑制、酶活和基因损伤等方面的影响(徐湘博等, 2014), 而关于代谢方面研究报道甚少(Liu et al., 2013).本文研究了TBBPA对赤子爱胜蚓的毒性效应, 通过设置不同剂量水平进行急性和亚急性暴露, 研究蚯蚓代谢水平与污染物剂量水平的关系, 试图找出差异代谢物作为TBBPA毒性效应的代谢标志物, 并通过分析代谢途径, 探索该污染物的相关毒理机制, 以期为TBBPA的生态风险评价提供一定的科学依据.
2 材料与方法(Materials and methods) 2.1 实验材料实验用赤子爱胜蚓(Eisenia fetida)购于北京润丰蚯蚓养殖场, 挑选生殖带明显且无损伤、体长5~6 cm、体重0.35~0.45 g的成熟蚯蚓, 实验前蚯蚓在无污染人工土壤中适应24 h. TBBPA (CAS No. 79-94-7, 纯度98%)购自梯希爱(上海)化成工业发展有限公司(中国);丙酮(分析等级)、叠氮化钠(99%)和磷酸二氢钠(99.3%)购自中国国药有限公司.重水(99.9%)、氘代氢氧化钠(99.5%)和2, 2-二甲基-2-硅烷-5-磺酸钠(DSS;97%)均购自Sigma Aldrich公司.
2.2 暴露方法为了更好模拟自然土壤条件, 暴露采用ISO Guideline No.11268-1和No.11268-2标准规定的人工土壤(ISO, 2012).人工土壤成分:石英砂70%、高岭土20%、草炭10%.以丙酮为溶剂溶解一定量TBBPA配成系列梯度剂量染毒组, 依次为0、50、100、200、400、600 mg·kg-1(以干重计, 下同).置于通风橱待溶剂完全挥发, 用去离子水调节土壤湿度为25%(相对含水量), 挑选10条成熟健康蚯蚓放入装有750 g湿土的1 L烧杯中, 置于人工气候箱.培养条件:温度(20±2) ℃, 相对湿度80%~85%, 光照强度400~800 lx, 24 h连续光照.急性期(0~14 d)需适当补充水分, 亚急性期(14~28 d)需在补充水分的同时向土壤中添加干牛粪粉末(0.5 g·条-1).设空白对照(CK)和溶剂空白对照(CKS), 每个处理设3个平行.
2.3 组织提取在14和28 d时从每个重复中随机挑选3条蚯蚓, 每个剂量组共9条, 清洗干净, 黑暗培养24 h.蚯蚓吐泥后用液氮冷冻并用冷冻干燥机干燥2 d, 然后匀浆.组织提取采用Brown等(2008)的方法, 提取液为重水溶剂, 内含0.2 mol·L-1磷酸二氢钠、0.1%(W/V)叠氮化钠和10 mg·L-1 2, 2-二甲基-2-硅烷-5-磺酸钠(DSS)作为内标, 并用氘代氢氧化钠调节pH为7.4.匀浆后的组织加入1.2 mL提取液, 涡旋30 s (v×100), 超声处理15 min后离心(14000 r·min-1, 4 ℃)20 min, 取上清液供分析.
2.4 一维氢谱核磁数据获取采用配备超低温探头的高分辨核磁共振波谱仪系统500 M核磁设备(Bruker AVANCE III 500)测定蚯蚓组织上清液获取代谢物的一维氢谱和次数据.采用标准的Noesypr1D脉冲序列, 参数设置为自旋弛豫延迟为320 ms、自由感应衰减为64 K数据点、谱宽为9000 Hz、扫描64次.利用MestReNova核磁图谱处理软件对图谱进行相位调整、基线校正和内标校准等处理.以化学位移δ 0.01(化学位移值, 下同)为单位, 对图谱δ 0.00~9.50区域分段积分, 去除水峰δ 4.70~5.10, 并对积分数据进行归一化处理, 获得蚯蚓组织中代谢物数据.
2.5 数据统计分析与差异代谢物的识别采用SIMCA-P 12.0对代谢物数据依次进行中心化(mean-centering and not scaling, Ctr)和自动规格化(unit variance scaling, UV)处理, 然后进行主成分分析(principal component analysis, PCA)和正交偏最小二乘投影分析(orthogonal partial least-squares discriminant analysis, OPLS), 识别差异性成分.参照Chenomx NMR Suite (Chenomx Inc., Edmonton, AB, Canada)数据库以及查阅文献, 辨识差异代谢物.运用SPSS 21.0软件分析不同剂量TBBPA暴露下代谢物间的相关关系变化并进一步分析数据.
3 结果(Results) 3.1 TBBPA急性暴露代谢特征 3.1.1 TBBPA系列剂量急性暴露下蚯蚓代谢的主成分分析蚯蚓经不同剂量TBBPA急性暴露后代谢产物一维核磁氢谱数据经过归一化处理并采用正交偏最小二乘投影法分析(OPLS)(图 1). OPLS得分图中, 两点间距离越远, 说明蚯蚓样本差异越大.从图 1可以看出, 急性暴露14 d时, 组间区分趋势非常明显, TBBPA剂量越高的染毒组距离空白组越远.空白组、溶剂空白组和低剂量50 mg·kg-1染毒组样本分散, 组内蚯蚓个体间存在代谢差异.暴露剂量为400 mg·kg-1染毒组中, 蚯蚓样本个体分布十分离散, 说明蚯蚓在此暴露剂量下代谢不稳定, 个体间代谢差异较大.其余剂量暴露组分布较为集中, 个体间差异较小, 代谢较为稳定.
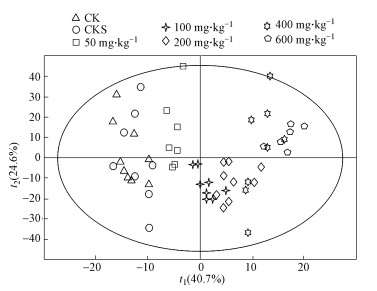 |
| 图 1 OPLS分析TBBPA系列浓度急性暴露下赤子爱胜蚓代谢的得分图(样品分布散点图)(14 d) Fig. 1 OPLS scores plot (sample distribution scatter plot) of metabolites of Eisenia fetida after acute exposure to TBBPA (14 d) |
与得分图相对应, 主成分分析还可以得到载荷图, 载荷图表示了所检测的变量(NMR中的化学位移)分布情况, 载荷图中的变量分布与得分图中样品分布和位置相对应.载荷图中VIP (变量重要性)值反映了变量对差异的贡献大小, 常被作为筛选差异代谢物的重要依据.暴露中, 选取代谢差异较大的染毒组(400 mg·kg-1)与空白组构建模型, 选取VIP值>1的代谢物为差异代谢物, 并通过网络数据库查询和比对标准物质, 鉴别确认了15种物质作为空白组和染毒组的差异代谢物, 这些物质中可能存在TBBPA急性暴露毒性效应的潜在生物标志物.还有一些代谢物的VIP值>1, 但由于资料或研究不足, 目前不能进行指认, 有待进一步研究.
识别的代谢物根据其生物功能主要分为4类;①能量供给:亮氨酸、缬氨酸、乳酸、丙氨酸、ATP、麦芽糖/β-葡萄糖(麦芽糖和β-葡萄糖2种物质在核磁图谱上重叠, 下同)和麦芽糖/α-葡萄糖(麦芽糖和α-葡萄糖2种物质在核磁图谱上重叠, 下同);②神经及免疫功能:赖氨酸、甘氨酸、谷氨酸、苯丙氨酸、酪氨酸;③渗透压调节:甜菜碱;④细胞膜的稳定性:富马酸.
急性暴露中, 染毒组较空白组代谢物变化贡献最大的是甜菜碱, 亮氨酸次之.
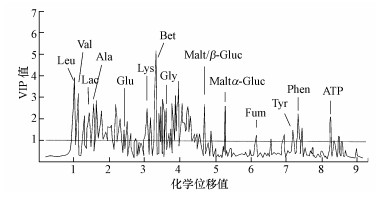 |
| 图 2 TBBPA急性暴露下赤子爱胜蚓差异代谢物的识别(注:Leu:亮氨酸, Val:缬氨酸, Lac:乳氨酸, Ala:丙氨酸, Glut:谷氨酸, Lys:赖氨酸, Bet:甜菜碱, Gly:甘氨酸, Malt/β: Gluc:麦芽糖/β:葡萄糖, Malt/α: Gluc:麦芽糖/α:葡萄糖, Fum:富马酸, Tyr:酪氨酸, Phen:苯丙氨酸) Fig. 2 Identification of metabolites ofEisenia fetida after acute exposure to TBBPA |
从TBBPA系列剂量亚急性暴露下蚯蚓代谢OPLS得分图(图 3)可以看出, 亚急性暴露28 d时, 组间区分趋势非常明显, TBBPA剂量越高的染毒组较空白组距离越远.空白组、溶剂组、50和100 mg·kg-1剂量组中样本集中, 组内个体差异较小, 200、400和600 mg·kg-1剂量染毒组, 个体分布较其他剂量组离散, 说明蚯蚓在此暴露剂量下代谢不稳定, 个体间代谢差异较大.
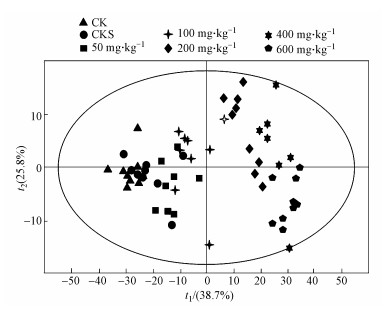 |
| 图 3 OPLS分析TBBPA系列浓度亚急性暴露下赤子爱胜蚓代谢的得分图(样品分布散点图)(28 d) Fig. 3 OPLS scores plot (sample distribution scatter plot) of metabolites of Eisenia fetida after sub-lethal exposure to TBBPA (28 d) |
选取代谢差异较大的染毒组(400 mg·kg-1)与空白组构建模型, 确认VIP值>1的代谢物为差异代谢物, 并通过网络数据库查询和比对标准物质, 鉴别确认了14种物质作为空白组和染毒组的差异代谢物(图 4), 这些物质中可能存在TBBPA亚急性暴露毒性效应的潜在生物标志物.
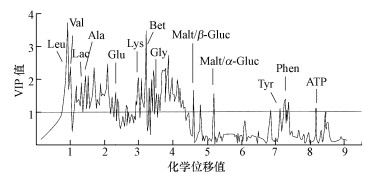 |
| 图 4 TBBPA亚急性暴露下赤子爱胜蚓差异代谢物的识别(注:Leu:亮氨酸, Val:缬氨酸, Lac:乳氨酸, Ala:丙氨酸, Glut:谷氨酸, Lys:赖氨酸, Bet:甜菜碱, Gly:甘氨酸, Malt/β: Gluc:麦芽糖/β:葡萄糖, Malt/α: Gluc:麦芽糖/α:葡萄糖, Tyr:酪氨酸, Phen:苯丙氨酸) Fig. 4 Identification of metabolites of Eisenia fetida after sub-lethal exposure |
亚急性暴露中, 除富马酸以外, 识别出的其他差异代谢物与急性暴露基本一致.富马酸是三羧酸循环的产物, 主要存在于膜和线粒体中, 具有信号传导、能量储存、膜完整性及稳定性等功能.富马酸虽然在亚急性暴露未被识别为差异代谢物, 但它仍是鉴定TBBPA毒性效应的重要特征代谢物.亚急性暴露中, 染毒组较空白组代谢物变化贡献最大的是亮氨酸, 甜菜碱次之.
3.3 赤子爱胜蚓对TBBPA急性与亚急性暴露代谢响应比较 3.3.1 急性暴露代谢物与亚急性暴露代谢物的主成分分析比较对比不同时长暴露下蚯蚓的代谢差异(图 5), 急性暴露下空白组、溶剂组以及50、100和200 mg·kg-1染毒组的样本(黑色实线圈内样本)与同剂量亚急性暴露组样本(黑色虚线圈内样本)不重合, 急性暴露蚯蚓代谢水平与亚急性暴露的代谢水平存在一定差异;TBBPA暴露剂量为400和600 mg·kg-1时, 急性暴露组的样本基本与同剂量亚急性暴露组样本重合(黑色点画线圈内样本), 急性暴露蚯蚓代谢水平与亚急性暴露的代谢水平相当或存在的差异较小.如图 1和图 3所示, TBBPA急性暴露与亚急性暴露均能够清楚地区分不同剂量TBBPA影响下蚯蚓的代谢差异.
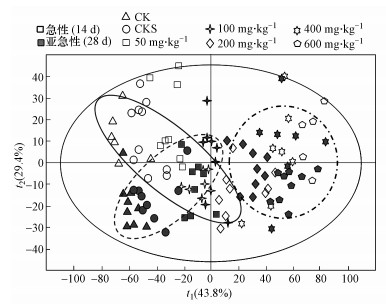 |
| 图 5 急性暴露和亚急性暴露赤子爱胜蚓代谢OPLS得分图(样品分布散点图) Fig. 5 OPLS scores plot (sample distribution scatter plot) of metabolites of Eisenia fetida after both acute and sub-lethal exposure to TBBPA |
代谢物间存在一定的相关关系, 因而有些代谢物随TBBPA剂量增加, 呈现出相似的变化规律.依据生物功能从指认的差异代谢物中选取剂量较大和变化趋势较明显的6种代谢物, 相比于同时期空白组蚯蚓的代谢物变化率, 分析赤子爱胜蚓在不同剂量TBBPA暴露下, 代谢物在急性与亚急性暴露中的变化规律(图 6).所选代谢物包括4类生物功能, 能量供给:亮氨酸(调节血糖, 供能, 促进脂肪代谢)、ATP (直接能源);神经及免疫功能:赖氨酸(提高中枢神经组织功能, 增强免疫功能)、谷氨酸(抑制神经兴奋);渗透压调节:甜菜碱;细胞膜的稳定性:富马酸(三羧酸循环产物).
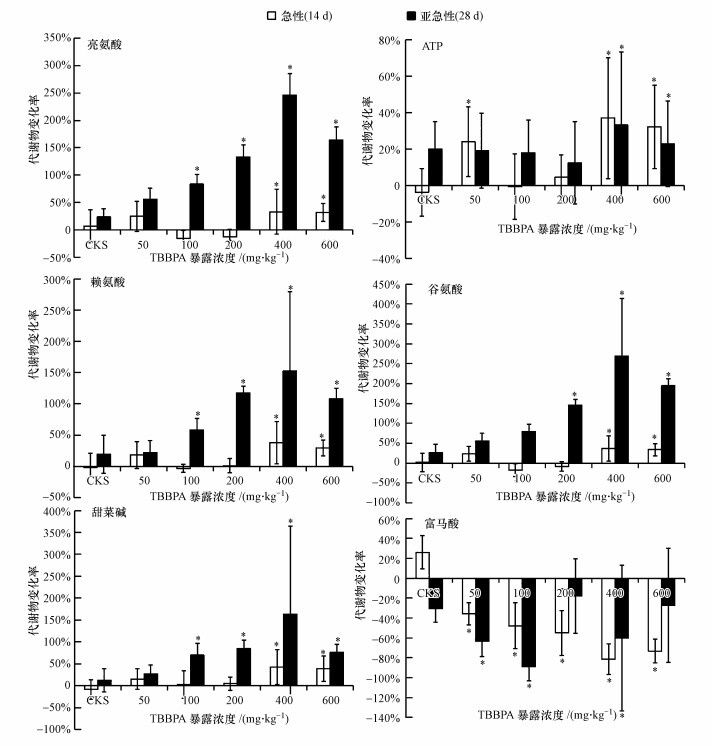 |
| 图 6 急性暴露与亚急性暴露差异代谢物剂量随TBBPA浓度增加的变化百分比(注:“*”表示与空白组相比, p<0.05) Fig. 6 Change of selected metabolites after both acute and sub-lethal exposure to TBBPA. The percentage changes that were significantly (at α=0.05) different from the control are labelled with an asterisk (*) |
TBBPA 50、100和200 mg·kg-1急性暴露下, 与空白组相比, 赤子爱胜蚓体内亮氨酸变化不显著, 暴露剂量为400和600 mg·kg-1的急性暴露, 亮氨酸显著增加30%~40%;亚急性暴露下, TBBPA剂量为100、200、400和600 mg·kg-1时, 赤子爱胜蚓体内亮氨酸均显著增加, 增幅为50%~220%.
TBBPA急性暴露剂量为50、400和600 mg·kg-1, ATP的剂量增加显著, 急性暴露剂量为100和200 mg·kg-1时, ATP变化不显著;亚急性暴露时, ATP的剂量在400和600 mg·kg-1时显著增加.
TBBPA急性暴露剂量为400和600 mg·kg-1时, 谷氨酸与赖氨酸均显著增加, 暴露剂量为50、100和200 mg·kg-1时, 甜菜碱变化不显著;亚急性暴露下, TBBPA剂量为100、200、400和600 mg·kg-1时, 谷氨酸与赖氨酸均显著增加.暴露剂量为400 mg·kg-1时, 亚急性暴露中的增加幅度为急性暴露的3~4倍.
TBBPA急性暴露剂量为50、100和200 mg·kg-1时, 甜菜碱变化不显著, 暴露剂量为400和600 mg·kg-1时, 甜菜碱显著增加35%~45%;亚急性暴露下, TBBPA剂量为100、200、400和600 mg·kg-1时, 甜菜碱显著增加65%~220%.
TBBPA急性暴露下, 各剂量染毒组富马酸显著减少, 且TBBPA暴露剂量越大, 富马酸减少量越大;亚急性暴露剂量为50、100和400 mg·kg-1, 富马酸与空白相比显著减少, 而暴露剂量为200和600 mg·kg-1, 富马酸含量有所下降, 但变化不显著.
4 讨论(Discussion)OPLS得分图中(图 1和图 3), TBBPA剂量越高的染毒组较空白组距离越远, 表明TBBPA剂量越高, 蚯蚓的代谢水平较健康蚯蚓差异越大, 受到的毒害就越大.对比不同时长暴露下蚯蚓的代谢差异(图 5), 同剂量TBBPA染毒组大多重合, 表明急性暴露和亚急性暴露中, 蚯蚓代谢水平差异不大.空白组和溶剂空白组在急性暴露下, 蚯蚓的代谢与亚急性暴露组存在一定差异.一方面蚯蚓在染毒暴露中, 由于人工培养条件有限, 可能会存在营养物质减少或营养不均衡等情况(徐湘博等, 2014), 从而导致代谢差异;另一方面这种由于营养物质减少或营养不均衡等造成的代谢差异不同于蚯蚓暴露于污染物TBBPA所产生的代谢差异.急性暴露中, 组内样本分布离散, 体现了个体在TBBPA毒性效应下的应激反应过程;亚急性暴露中, 组内样本较为集中, 且不同剂量TBBPA暴露下蚯蚓的代谢变化趋于一致, 表明暴露时间的延长, 可能掩盖蚯蚓在环境胁迫下的生理反应过程, 而直接呈现出污染物毒性效应累积的最终代谢结果.如TBBPA染毒组100和200 mg·kg-1时, 急性暴露下蚯蚓体内代谢物与空白组相比有变化趋势, 但变化不显著, 而亚急性暴露下代谢物变化显著, 延长暴露时间对毒性作用有一定的积累作用.
分析鉴定的15种差异代谢物主要涉及蛋白质代谢、脂肪代谢、糖类代谢、三羧酸循环等多种代谢途径.蚯蚓暴露于TBBPA染毒组50、400和600 mg·kg-1时, 通过提高体内甜菜碱的剂量, 维持细胞渗透压, 保护酶的活性, 增加亮氨酸和缬氨酸的含量调节血糖, 促进体内脂肪代谢, 确保能量供应, 防止肌肉组织受损, 提高中枢神经组织功能, 增强免疫功能以应对氧化胁迫.此外, 蚯蚓体内谷氨酸、甘氨酸剂量增加, 神经兴奋受到抑制, 富马酸剂量减少, 三羧酸循环受到阻碍.蚯蚓暴露于TBBPA染毒组100和200 mg·kg-1时, 体内赖氨酸和谷氨酸剂量在急性暴露中有所减少, 免疫力有所下降;在亚急性暴露中, 蚯蚓体内赖氨酸和谷氨酸剂量增加, 机体通过增强免疫力对抗氧化胁迫.
本研究中代谢物谷氨酸和甘氨酸在400 mg·kg-1时迅速增加, 与徐湘博等(2014)研究发现谷胱甘肽转移酶(GST)基因表达量在400 mg·kg-1迅速增加到空白组的8.73倍相符合, 都表明TBBPA剂量高达400和600 mg·kg-1时, 蚯蚓肝脏解毒功能最大化, 细胞承受巨大的毒害作用.徐湘博等研究在超过400 mg·kg-1剂量时, TBBPA的毒性效应超过蚯蚓的应对能力范围, 使机体遭受损伤, 低于400 mg·kg-1蚯蚓能利用自身的抗氧化酶系统, 维持内部的动态平衡稳定, 使机体免受损伤(徐湘博等, 2014).在本研究中, 在TBBPA为100 mg·kg-1时, 蚯蚓体内代谢物变化显著, 代谢平衡遭到破坏, 功能紊乱, 机体已经受到毒害.吉成龙等研究也表明, TBBPA暴露使贻贝体内甘氨酸、甜菜碱和ATP等代谢物剂量发生显著变化, 干扰能量代谢和渗透调节(Ji et al., 2015).因此, 代谢物不仅能动态地展示生物对暴露处理所做出的生理生化反应, 而且对毒性效应的指示作用较酶活和基因损伤更为敏感.
5 结论(Conclusions)1)急性暴露和亚急性暴露均能很好地区分不同TBBPA剂量染毒组间的代谢差异, 且暴露剂量越大, 蚯蚓体内的代谢差异越大.在急性暴露和亚急性暴露中, 亮氨酸、赖氨酸和甜菜碱等代谢物剂量随TBBPA剂量增加的变化趋势是一致的, 但亚急性暴露中的变化幅度大于急性暴露.
2) TBBPA剂量为400和600 mg·kg-1时, 赤子爱胜蚓在急性和亚急性暴露后, 体内亮氨酸、甜菜碱、ATP、赖氨酸和谷氨酸剂量显著增加, 富马酸剂量显著减少;TBBPA剂量为100和200 mg·kg-1时, 急性暴露后, 蚯蚓体内富马酸显著减少, 其余代谢物变化不显著, 而亚急性暴露后, 蚯蚓体内亮氨酸、甜菜碱、ATP、赖氨酸和谷氨酸剂量显著增加, 富马酸剂量显著减少.
3)暴露结果表明, TBBPA暴露剂量为100 mg·kg-1时, 赤子爱胜蚓受到毒害作用, 体内代谢已严重失衡.与酶的活性和基因表达量相比, 差异代谢物对毒性效应的指示作用更为敏感.甜菜碱、亮氨酸和赖氨酸可作为标志性代谢物揭示TBBPA对赤子爱胜蚓在渗透压调节、能量供给以及免疫功能方面的毒性效应.
| [${referVo.labelOrder}] | Akira N, Daisuke S, Tetsu N, et al. 2009. Neurobehavioral effects of tetrabromobisphenol A, a brominated flame retardant, in mice[J]. Toxicology Letters, 189(1) : 78–83. DOI:10.1016/j.toxlet.2009.05.003 |
| [${referVo.labelOrder}] | Åslund M L W, Simpson A J, Simpson M J. 2011. 1H NMR metabolomics of earthworm responses to polychlorinated biphenyl (PCB) exposure in soil[J]. Ecotoxicology, 20(4) : 836–46. DOI:10.1007/s10646-011-0638-9 |
| [${referVo.labelOrder}] | Brown S A E, Mckelvie J R, Simpson A J, et al. 2010. 1H NMR metabolomics of earthworm exposure to sub-lethal concentrations of phenanthrene in soil[J]. Environmental Pollution, 158(6) : 2117–23. DOI:10.1016/j.envpol.2010.02.023 |
| [${referVo.labelOrder}] | Brown S A E, Simpson A J, Simpson M J. 2008. Evaluation of sample preparation methods for nuclear magnetic resonance metabolic profiling studies with Eisenia fetida[J]. Environmental Toxicology & Chemistry, 27(4) : 828–836. |
| [${referVo.labelOrder}] | Bundy J G, Spurgeon D J, Svendsen C, et al. 2004a. Environmental metabonomics:applying combination biomarker analysis in earthworms at a metal contaminated site[J]. Ecotoxicology, 13(8) : 797–806. DOI:10.1007/s10646-003-4477-1 |
| [${referVo.labelOrder}] | 邓结平, 李赟, 潘鲁青. 2015. 四溴双酚A对7种海洋微藻的急性毒性[J]. 中国海洋大学学报:自然科学版, 2015, 45(2) : 54–59. |
| [${referVo.labelOrder}] | Ekman D R, Teng Q, Villeneuve D L, et al. 2009. Profiling lipid metabolites yields unique information on sex-and time-dependent responses of fathead minnows (Pimephales promelas) exposed to 17 α-ethynylestradiol[J]. Metabolomics, 5(1) : 22–32. DOI:10.1007/s11306-008-0138-y |
| [${referVo.labelOrder}] | Ekman D R, Teng Q, Villeneuve D L, et al. 2008. Investigating Compensation and Recovery of Fathead Minnow (Pimephales promelas) Exposed to 17 α-Ethynylestradiol with Metabolite Profiling[J]. Environmental Science & Technology, 42(11) : 4188–4194. |
| [${referVo.labelOrder}] | Fujii Y, Nishimura E, Kato Y, et al. 2014. Dietary exposure to phenolic and methoxylated organohalogen contaminants in relation to their concentrations in breast milk and serum in Japan[J]. Environment International, 63(3) : 19–25. |
| [${referVo.labelOrder}] | Hloušková V, Lanková D, Kalachová K, et al. 2013. Brominated flame retardants and perfluoroalkyl substances in sediments from the Czech aquatic ecosystem[J]. Science of the Total Environment, 470-471C(2) : 407–416. |
| [${referVo.labelOrder}] | ISO. 2012. Soil quality-Effects of pollutants on earthworms (Eisenia fetida)-Part 1:Determination of acute toxicity using artificial soil substrate, ISO 11268-1. International Organization for Standardization, Geneva, Switzerland |
| [${referVo.labelOrder}] | Jakobsson K, Kaj T, Rylander L, et al. 2002. Exposure to polybrominated diphenyl ethers and tetrabromobisphenol A among computer technicians[J]. Chemosphere, 46(5) : 709–716. DOI:10.1016/S0045-6535(01)00235-1 |
| [${referVo.labelOrder}] | Ji C L, Li F, Wang Q, et al. 2015. An integrated proteomic and metabolomic study on the gender-specific responses of mussels Mytilus galloprovincialis to tetrabromobisphenol A (TBBPA)[J]. Chemosphere, 144 : 527–539. |
| [${referVo.labelOrder}] | Kuiper R V, Brandhof E J V D, Leonards P E G, et al. 2007. Toxicity of tetrabromobisphenol A (TBBPA) in zebrafish (Danio rerio) in a partial life-cycle test[J]. Archives of Toxicology, 81(1) : 1–9. DOI:10.1007/s00204-006-0117-x |
| [${referVo.labelOrder}] | 刘莉莉, 林匡飞, 苏爱华, 等. 2008. 四溴双酚A对土壤酶活性的影响[J]. 环境污染与防治, 2008, 30(6) : 13–16. |
| [${referVo.labelOrder}] | Lankadurai B P, Nagato E G, Simpson A J, et al. 2015. Analysis of Eisenia fetida earthworm responses to sub-lethal C 60 nanoparticle exposure using 1 H-NMR based metabolomics[J]. Ecotoxicology & Environmental Safety, 120 : 48–58. |
| [${referVo.labelOrder}] | Liang X, Li W, Martyniuk C J, et al. 2014. Effects of dechlorane plus on the hepatic proteome of juvenile Chinese sturgeon (Acipenser sinensis)[J]. Aquatic Toxicology, 148(3) : 83–91. |
| [${referVo.labelOrder}] | Linhartova P, Gazo I, Shaliutina Kolesova A, et al. 2014. Effects of tetrabrombisphenol A on DNA integrity, oxidative stress, and sterlet (Acipenser ruthenus) spermatozoa quality variables[J]. Environmental Toxicology, 30(7) : 735–745. |
| [${referVo.labelOrder}] | Liu X, Wu H, Ji C, et al. 2013. An Integrated Proteomic and Metabolomic Study on the Chronic Effects of Mercury in Suaeda salsa under an Environmentally Relevant Salinity[J]. Plos One, 8(5) : 879–882. |
| [${referVo.labelOrder}] | Mehran A, Pedro A, Andreas S, et al. 2003. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release[J]. Environment International, 29(6) : 683–689. DOI:10.1016/S0160-4120(03)00121-1 |
| [${referVo.labelOrder}] | Darnerud P O. 2003. Toxic effects of brominated flame retardants in man and in wildlife[J]. Environment International, 29(6) : 841–853. DOI:10.1016/S0160-4120(03)00107-7 |
| [${referVo.labelOrder}] | 钱艳园, 刘莉莉, 于晓娟, 等. 2012. 四溴双酚A好氧降解菌的筛选及其降解特性研究[J]. 环境科学, 2012, 33(11) : 3962–3966. |
| [${referVo.labelOrder}] | Ronan C, Jean philippe A, Philippe M, et al. 2005. New multiresidue analytical method dedicated to trace level measurement of brominated flame retardants in human biological matrices[J]. Journal of Chromatography A, 1100(2) : 144–152. DOI:10.1016/j.chroma.2005.09.040 |
| [${referVo.labelOrder}] | Ronisz D, Farmen F E, Karlsson H, et al. 2004. Effects of the brominated flame retardants hexabromocyclododecane (HBCDD), and tetrabromobisphenol A (TBBPA), on hepatic enzymes and other biomarkers in juvenile rainbow trout and feral eelpout[J]. Aquatic Toxicology, 69(3) : 229–245. DOI:10.1016/j.aquatox.2004.05.007 |
| [${referVo.labelOrder}] | Steven M, Allchin C R, Zegers B N, et al. 2004. Distribution and fate of HBCD and TBBPA brominated flame retardants in North Sea estuaries and aquatic food webs[J]. Environmental Science & Technology, 38(21) : 5497–5504. |
| [${referVo.labelOrder}] | Shigeyuki K, Teruhisa K, Mitsuru I, et al. 2005. Anti-thyroid hormonal activity of tetrabromobisphenol A, a flame retardant, and related compounds:Affinity to the mammalian thyroid hormone receptor, and effect on tadpole metamorphosis[J]. Life Sciences, 76(14) : 1589–1601. DOI:10.1016/j.lfs.2004.08.030 |
| [${referVo.labelOrder}] | Shi H, Wang X, Yi L, et al. 2005. Electron paramagnetic resonance evidence of hydroxyl radical generation and oxidative damage induced by tetrabromobisphenol A in Carassius auratus[J]. Aquatic Toxicology, 74(4) : 365–371. DOI:10.1016/j.aquatox.2005.06.009 |
| [${referVo.labelOrder}] | Tang J, Feng J, Li X, et al. 2014. Levels of flame retardants HBCD, TBBPA and TBC in surface soils from an industrialized region of East China[J]. Environmental Science Processes Impacts, 16(5) : 1015–1021. DOI:10.1039/c3em00656e |
| [${referVo.labelOrder}] | 薛银刚, 王晓蓉, 顾雪元, 等. 2009. 四溴双酚A对赤子爱胜蚓的急性毒性及抗氧化防御系统酶的影响[J]. 生态毒理学报, 2009, 4(1) : 93–100. |
| [${referVo.labelOrder}] | 徐湘博, 史雅娟, 吕永龙, 等. 2014a. 四溴双酚A对赤子爱胜蚓的生长和基因表达的影响[J]. 生态毒理学报, 2014a, 6(9) : 1053–1059. |
| [${referVo.labelOrder}] | 徐湘博, 史雅娟, 吕永龙, 等. 2014b. 2, 2', 4, 4'-四溴联苯醚对赤子爱胜蚓的抗氧化酶、代谢酶及其基因表达的影响[J]. 环境科学学报, 2014b, 34(11) : 2948–2955. |
| [${referVo.labelOrder}] | Yasmin S, D'Souza D. 2010. Effects of pesticides on the growth and reproduction of earthworm:a review[J]. Applied & Environmental Soil Science, 2010(3) : 1–9. |
 2017, Vol. 37
2017, Vol. 37


