《巴黎气候协定》的签署意味着污水处理碳中和运行时代的来临(郝晓地等,2014a;2014b).污水处理化石燃料消耗产生的CO2及处理过程产生的甲烷(CH4)与氮氧化物(N2O)引起的CO2排放当量约占全球温室气体排放量的2%~5%(Kampschreur et al., 2009;El-Fadel et al., 2001).污水处理如果实现碳中和运行,或者说完全能量自给,那么,因外源化石燃料消耗所产生的CO2排放量便可为零(Hao et al., 2015).显然,碳中和运行能量自给的首要来源是污水处理过程中产生的剩余污泥(Hao et al., 2015).然而,污泥中细菌细胞结构、木质纤维素及腐殖质等在很大程度上制约了污泥厌氧消化转化能源的效率(郝晓地等,2014b),中温厌氧消化获得的污泥能源转化率一般在30%~45%以下(Weemaes et al., 2000),这就制约了污泥厌氧消化转化能源的大规模应用.其中,污泥所含腐殖质成分较为特别,它不仅自身难以生物降解,而且在厌氧消化过程中还会影响其它有机物降解或转化(Fernandes et al., 2014),这就使之成为需要重点研究的对象.
腐殖质(Humic Substances,HS)广泛分布于土壤、沉积物与水体环境之中,由动、植物与微生物残骸经物理、化学、生物分解、合成作用产生,是一类具有芳香族醌类结构特征的聚合物(Sastre et al., 1996).腐殖质是污水/污泥有机成分(COD)中不可忽视的组成成分.研究表明,腐殖质在污水中大部分以胶体微粒(1~100 nm)形式存在,部分以悬浮颗粒形式存在,亦有少量以溶液形式存在;它们是污水中溶解性有机物(DOM,可通过0.45 μm滤膜)组成成分之一,含量约占污水中溶解性有机物(DOM)的3%~55%、约占剩余污泥中有机物含量的6%~20%(以VSS计)(Thurman et al., 1985;Imai et al,2002;郝晓地等,2013;Akio et al,2002;金鹏康等,2015).污泥中的腐殖质含量虽少,但极难降解,而且会明显抑制蛋白质、脂质、纤维素等复杂有机物的水解(Fernandes et al., 2014).此外,腐殖质或醌类物质还会影响污泥厌氧消化系统产甲烷细菌生理代谢,进而影响污泥厌氧消化产甲烷过程(Cervantes et al., 2000).但是,腐殖质结构中的醌类基团可以作为电子受体、电子中间体参与厌氧消化过程微生物与有机底物间的电子传递,可促进酸化和产氢/乙酸过程(Scott et al., 1998;Dos Santos et al., 2004).这就是说,污泥中腐殖质可能抑制或影响厌氧消化过程的两头,对中间过程或许还存在某些促进作用.因此,研究腐殖质影响厌氧消化过程的机理十分必要,这对提高污泥厌氧消化有机物能源转化效率具有十分重要的意义.
本文在介绍剩余污泥腐殖质来源与形成、结构与性质的基础上,归纳腐殖质对污泥厌氧消化过程的作用机理,探讨破解腐殖质抑制厌氧消化的方法,总结污泥腐殖质厌氧消化研究方向.
2 剩余污泥中的腐殖质(Humic substances in excess sludge)了解剩余污泥中腐殖质来源、形成及结构和性质对深入认识其对厌氧消化过程的影响十分重要,是本文的基础,分述如下.
2.1 来源与形成腐殖质是土壤有机质最主要的存在形式,一般占土壤有机质的60%~90%(窦森等,2008).腐殖质由胡敏酸(俗称腐殖酸)、富里酸、胡敏素组成;胡敏酸溶于碱, 在pH < 2的酸液中会形成沉淀,富里酸为在酸、碱溶液中均可溶解的低分子物质,胡敏素既不溶于碱也不溶于酸(Schinner et al., 2012).土壤(黑土、草甸土)腐殖质中胡敏酸、富里酸、胡敏素含量分别为42%、22%和36%(张晋京等,2004).因腐殖质中胡敏酸、富里酸为主要成分(达60%以上),且胡敏酸最为活跃,因此,研究多以胡敏酸、富里酸为主;胡敏素由于分离纯化复杂,难以测定,对它的研究相对较少(张晋京等,2008).
剩余污泥中的腐殖质来源于污水中夹杂的蔬菜残渣、厕纸、纸屑、杂草树叶等;同时,雨水冲刷土壤也会将土壤腐殖质带入污水.此外,木质素及其降解产物(酚类、醌类及脂肪族化合物)也是腐殖质形成的重要前体物质(王一明等,2006).研究表明,在微生物作用下,木质素侧链氧化生成木质素类衍生物,构成了腐殖质核心骨架;木质素经微生物代谢单体产物经缩合或聚合反应也可能形成腐殖质(Amir et al., 2006).腐殖质一般比其前体物质更难降解(Bo et al., 1996;李晓齐,1993).剩余污泥腐殖质中富里酸含量约为胡敏酸含量的1/8(Li et al., 2013).腐殖质因来源、形成路径、前体物聚合方式等不同,导致腐殖质组分千差万别,其提纯过程也复杂、繁琐(Hofrichter et al., 2004;李学垣,1997).剩余污泥中的腐殖质比土壤腐殖质含有较少的C元素、芳香族和羧基官能团,而其中H、N元素、脂肪族和酚羟基官能团含量较多(Hernández et al., 1990).
因活性污泥比表面积较大,且具有多孔结构和黏性胞外聚合物(EPS),所以,活性污泥具有良好的吸附性能(冯华军等,2008).在传统活性污泥工艺,污水中腐殖质难以作为微生物生长的碳源而被降解,主要(67%~84%)通过活性污泥吸附于污泥表面而随同污泥从污水中分离出来;腐殖质随污泥进入厌氧消化系统后,一部分被吸附的腐殖质会在污泥水解过程中解吸(方芳等,2008;Yu et al., 2012)而溶入消化液.
醌类物质是形成腐殖质的重要前体物质.虽然醌类模式物--蒽醌-2, 6-双磺酸(AQDS)与腐殖质物理特性完全不同,但微生物还原腐殖质过程主要通过醌类基团接受电子,能够还原AQDS的微生物也能还原腐殖质(Cervantes et al., 2000;Newman et al., 2000).腐殖质或AQDS作为电子受体可氧化不同有机物(如甲苯、甲酚、四氯化碳等),腐殖质或AQDS氧化有机物的降解率十分相近(Cervantes et al., 2001; 2004).此外,醌类或腐殖质具有相似的生物化学特性,厌氧条件下腐败希瓦菌(Shewanella putrefaciens MR)可降解腐殖质或醌类物质(Lovley et al., 1999b).因此,有研究人员使用醌类模式物AQDS代替腐殖质作为厌氧消化电子受体进行实验.
2.2 结构与性质腐殖质主要由C、H、O、N、P、S等元素构成,并含有少量Ca、Mg、Fe、Al等元素.因腐殖质组分复杂、官能团序列不一,因此,至今仍无统一的分子结构和相对分子量.污泥中腐殖质分子量从几百到几万不等,胡敏酸分子量大于50 kDa的约占72%左右, 而富里酸分子量约有65%分布在10~50 kDa之间(Li et al., 2014a).
腐殖质是芳香族多环或杂环状有机物,在污水/污泥处理中极难被微生物降解,其降解难度甚至高过络氨酸和色氨酸(Li et al., 2014c).腐殖质中含有大量羧基(-COOH)、酚羟基(酚-OH),醇羟基(醇-OH)、甲氧基(-OCH3)和羰基(CO)等多种含氧官能团,且这些官能团具有离子交换性、弱酸性、吸附性、络合性、氧化还原性等性质(Schnitzer et al., 1974).腐殖质呈负电性,容易与金属离子形成复合物;腐殖质具有较强的氧化还原活性,可还原电势为0.5~0.7 V以下的金属离子(陶祖贻等,1992).
虽然腐殖质难以被微生物降解,但腐殖质可作为微生物和污染物间的电子中间体或直接作为微生物厌氧呼吸电子受体参与厌氧消化电子传递过程(Scott et al., 1998;Lovley et al., 1999a).微生物和有机物在自然条件下是腐殖质的主要电子供体,腐殖质可显著提高厌氧消化系统电子转移能力(Scott et al., 1998).除作为电子受体外,当腐殖质遇到更高氧化还原电位物质存在时,如硝酸盐、延胡索酸、高氯酸盐、砷酸盐和硒酸盐等,腐殖质本身亦可作为电子供体(Lovley et al., 1999b;Bruce et al., 1999).
剩余污泥中部分细菌能够在厌氧条件下以腐殖质或腐殖质模式物AQDS作为终端电子受体,通过氧化有机底物(如糖原、乙酸、甲酸等)或H2,进行腐殖质氧化还原,从而参与细菌呼吸代谢过程(Lovley et al., 1996).目前发现具有腐殖质或醌参与呼吸功能的微生物主要集中在地杆菌属(Geobacter)和希瓦氏菌属(Shewanella), 具体包括Fe3+还原菌、硝酸盐还原菌、脱亚硫酸菌、发酵性细菌和嗜热产甲烷菌等(马晨等,2011;许志诚等,2006).研究表明,厌氧条件下腐殖质可作为电子中间体促进难降解有机物(如偶氮染料活性红、四氯化碳)和Fe3+等转化;同时,电子传递过程会产生能量,支持菌体生长.图 1显示了腐殖质作为电子受体/中间体的作用机制(Scott et al., 1998;Cervantes et al., 2013).
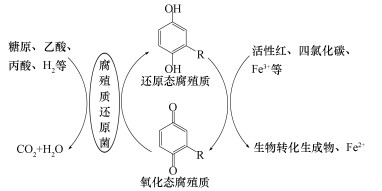 |
| 图 1 腐殖质作为电子受体/中间体的作用机制 Fig. 1 Reactions′ mechanisms of humic substances as electron acceptor/intermediate |
总之,因腐殖质含诸多复杂官能团和电子传递机制的存在,腐殖质无疑会参与污泥厌氧消化反应过程,势必影响酶促水解反应、厌氧消化底物分解/合成、微生物生理代谢等.
3 腐殖质对污泥厌氧消化过程的影响(Effects of humic substances on anaerobic digestion of excess sludge)腐殖质对厌氧消化过程的影响在不同阶段表现不同,可能呈现出完全不同的影响.正影响自然不必担心,而负影响就是副作用、甚至是抑制作用.因此,首先需要全面了解腐殖质对厌氧消化全过程的不同影响,以制定消除负作用或者解除抑制作用的技术路线.
3.1 水解阶段水解是厌氧消化的限速步骤(Eliosov et al., 1995).污泥中腐殖质含量虽然较少,但一旦出现则会抑制蛋白质酶、脂肪酶和纤维素酶活性,导致厌氧消化水解效率降低、后续产酸和产甲烷阶段延迟(Sarkar et al., 1987;Brons et al., 1985;Jahnel,1994b).研究表明,结晶纤维素(Avicel)单独进行厌氧消化水解效率为78%,添加5.0 g·L-1腐殖质后结晶纤维素厌氧消化水解效率可降低50%(Azman et al., 2015).也有研究显示,当厌氧消化系统未添加腐殖质时,纤维素(Sigmacell type 50)水解效率为6%,当腐殖质添加浓度提高至0.5 g·L-1时,纤维素水解几乎被完全抑制;腐殖质对于三丁酸甘油酯水解抑制率约为10%~50%(Fernandes et al., 2014).有学者尝试采用紫外分光光度法探究水溶性腐殖质对链霉蛋白酶水解底物L-亮氨酸-4-硝基苯胺E的影响,发现当水解底物浓度为150~450 mg·L-1时,约22.7%的蛋白酶活性被腐殖质抑制(Jahnel et al., 1994a).
腐殖质主要通过共价键作用、静电网捕作用、化学平衡作用等方式抑制污泥厌氧消化有机底物水解过程,具体如图 2所示.
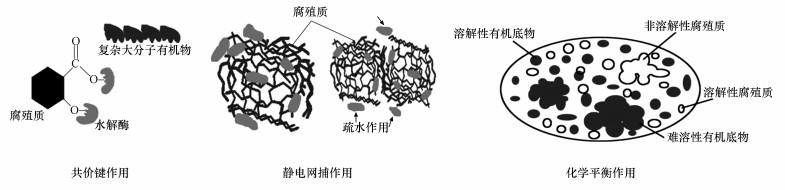 |
| 图 2 腐殖质抑制有机物水解作用机理 Fig. 2 Mechanisms of humic substances on inhibiting hydrolysis of organic substrates |
水解酶碰撞反应物分子频率和超越活化能(屏障)而有效碰撞的机会决定了水解反应进行的速度(陈世和,1992).腐殖质通过共价键方式与水解酶发生作用;腐殖质所含羧基、酚羟基与水解酶氨基相互连结,从而减少、阻碍了水解酶与反应物碰撞频率,使厌氧消化水解速度和效率降低(Ladd et al., 1969).研究表明,腐殖质酚羟基含量越多,其对苹果酸酶亲和性就越好(亲和系数Km小);腐殖质会优先与酶相互结合,阻碍其它有机底物与酶活性点位接触,从而抑制水解酶的催化作用(Pflug et al., 1981b;Wedding et al., 1967).更多研究显示,腐殖质会抑制胰蛋白酶水解苯甲酰精氨酸乙酯(BAEE)66%~68%的活性;腐殖质还会抑制羧肽酶水解苄氧羰基甘氨酰基苯丙氨酸(Z-gly-phe)66%~74%的活性;但是,当两者水解酶氨基被乙酰化后,酶活性并未受到抑制(Ladd et al., 1971).
3.1.2 静电网捕作用腐殖质相互交联具有空隙网状结构,能够捕获和包裹各种有机物、无机物和水分子,因此,腐殖质会阻碍水解酶与复杂有机物接触(Schulten et al., 1997;Pflug et al., 1981a).研究显示,通过气相色谱-质谱联用、核磁共振等技术证实了复杂难溶蛋白质颗粒或水解酶容易被腐殖质网状结构所包裹,物质不容易进出,从而阻止有机物与水解酶接触,减少有机物水解效率(Weetall,1974;Zang et al., 2000).也有研究人员采用动电光散射、滴定仪、微热量等技术证实了在静电和疏水作用下,蛋白质被包裹在腐殖质内部结构之中(Tan et al., 2008).脂质分子具有非极性疏水性,分子量小于蛋白质、糖类,不能形成聚合物(王镜岩等,2008).因此,腐殖质对脂质的包裹作用较蛋白质、糖类要小.更多研究表明,胞外聚合物(EPS)中腐殖质含量约为25 mg·L-1,其中,粘性层(最外层)腐殖质含量约占67%;EPS所含腐殖质多数存在于粘性层,因此,会包裹细胞,阻碍外界水解酶对内层蛋白质、多糖水解(Yuan et al., 2013).
腐殖质与水解酶质量比会影响结合物分子表面所带电荷量(Tomaszewski et al., 2011).当比值小于等电点质量比,分子间以静电作用力为主,水解酶被腐殖质包裹,使得底物不易接触到酶活性位点,导致酶活性下降.当比值大于等电点质量比,因结合多余腐殖质导致分子之间存在静电排斥作用,此时疏水作用开始发挥;当疏水作用不足以克服静电排斥力时就会导致部分水解酶游离,促使水解酶部分活性位点裸露出来,增强酶活性;反之,水解酶仍被包被,导致酶活性不变或下降(Yan et al., 2013).
3.1.3 化学平衡作用随着厌氧消化过程进行,系统中溶解性腐殖质浓度会不断积累.根据化学平衡原理,溶解性腐殖质浓度升高会阻碍难溶性有机聚合物(蛋白质、糖类、脂质等)向溶解性有机物方向水解(Li et al., 2014b;2014c).此外,位于酶活性中心的金属离子(如Fe3+、Zn2+、Cu2+、Ni2+等)是酶的重要组成部分,腐殖质存在可能会与这些金属离子发生络合、螯合、吸附反应,减少活性中心与底物接触,改变酶结构,从而抑制酶活性(Cunningham,1965).
3.2 酸化阶段酸化阶段是水解阶段产生的有机化合物既作为电子受体亦作为电子供体的生物降解过程.腐殖质能促进酸化过程进行,腐殖质所含醌基可以作为乙酸形成的电子受体,且醌基越多其接受电子容量越高,形成的乙酸就越多(Lovley et al., 1996;Liu et al., 2015).研究表明,添加醌类模式物AQDS可促进污泥厌氧消化酸化过程VFAs产量;仅添加AQDS剂量为0.066和0.33 g·g-1 TS时,VFAs产生量便可分别提高0.9和1.7倍,产生的VFAs主要是乙酸和丙酸;同时,添加AQDS还可显著提高蛋白质降解率,但对多糖降解率提高并不明显.酸化过程中,AQDS作为电子受体加速了氨基酸氧化还原(Yang et al., 2012).
污泥厌氧消化酸化阶段有机物会转化为VFAs,这使得厌氧消化系统pH下降,而适度pH值下降(pH=4.5~5.5)对酸化细菌较为有利.由于腐殖酸中羧基和羟基解离可以释放出质子,因此,腐殖酸为弱酸,其与腐殖酸盐可以形成良好的酸/碱缓冲体系.腐殖质在厌氧消化系统可作为酸碱缓冲剂,避免厌氧消化酸化过度,维持微生物活性(Garcia-Gil et al., 2004;Ceppi et al., 1999).
3.3 产氢/乙酸阶段表 1列举了产氢/乙酸阶段有机底物产氢/乙酸生化反应.表 1中的生化反应只有在厌氧消化系统中乙酸和H2分压很低时才能完成.当H2分压低于1.5×104 Pa时,乙醇可进行产氢产乙酸反应;丁酸要求低于200 Pa,丙酸则要求低于900 Pa (任南琪,2004).因此,系统H2分压较高时会先后抑制丙酸、丁酸和乙醇降解.厌氧消化系统H2分压降低必须依靠嗜氢营养菌完成.换言之,自养产甲烷菌和硫酸盐还原菌(SRB)会利用H2,使厌氧消化系统H2分压降低,促进有机酸降解.同时,腐殖质还原菌也可利用H2作为电子供体生成AH2QDS,使系统H2分压降低.然而,因反应热力学吉布斯自由能不同(表 2),因此,以H2作为电子供体的硫酸盐还原菌、产甲烷菌和同型产乙酸菌利用H2比腐殖质还原菌更具优势(Cervantes et al., 2008;Madigan et al., 2000).
| 表 1 有机底物产氢/乙酸生化反应 Table 1 Biochemical reactions of producing hydrogen and acetic acid from organic substrates |
| 表 2 嗜氢营养细菌热力学反应 Table 2 Thermodynamics of bacteria reaction addicted to hydrogen |
污泥厌氧消化系统挥发性脂肪酸(VFAs)中丙酸是最难降解的;丙酸产氢产乙酸速率很慢,大量丙酸会在厌氧消化系统中形成积累,进而使系统pH值降低,影响产甲烷菌活性(任南琪,2004).研究表明,厌氧消化过程中30%的电子传递与丙酸降解过程有关,腐殖质可作为电子中间体,提高厌氧消化氧化还原电位,强化丙酸氧化生成乙酸(Sahm,1984;Ho et al., 2012).
乳酸也是厌氧消化的关键中间产物,研究表明,几乎所有单糖可通过乳酸路径进行降解,但乳酸降解很快,只有当瞬时有机负荷过高时乳酸才会出现(Skiadas et al., 2000).污泥厌氧消化系统中乳酸转化为丙酸,会对系统造成潜在危害,且乳酸不宜作为产甲烷细菌利用的终端产物(方晓瑜等,2015).研究也表明,腐殖质还原菌可利用乳酸作为底物,促进乳酸向乙酸转化,减少系统内丙酸积累,参与产氢/乙酸形成(Lovley,1996).腐殖质促进乳酸转化乙酸的反应过程如式(1)所示.
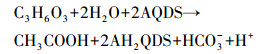
|
(1) |
厌氧条件下腐殖质所含醌基可作为微生物呼吸电子受体,氧化简单有机物而产生CO2(Dos et al., 2004;Cervantes et al., 2002).在厌氧呼吸中,腐殖质所含醌基或胞外醌类物质可充当微生物电子中间穿梭体,醌基数量决定了腐殖质接受电子的能力(Cervantes et al., 2000).研究表明,在腐殖质或醌类模式物缺乏条件下,G. Metallireducens或W. Succinogenes均难以利用乙酸;G. Metallireducens和W. Succinogenes加入到含乙酸缓冲溶液后,乙酸仍未被利用;但添加腐殖质或醌类模式物后,乙酸(标记2-14C)则被迅速氧化为14CO2.结果显示,腐殖质或醌类模式物可作为电子中间穿梭体促进微生物共同作用氧化乙酸(Lovley et al., 1999b).腐殖质或AQDS作为电子受体,氧化乙酸产甲烷反应过程如式(2)所示(许志诚等,2006).
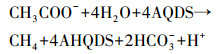
|
(2) |
然而,腐殖质也可能抑制污泥厌氧消化产甲烷过程(Blodau et al., 2012;Minderlein et al., 2010).有学者尝试从煤中提取腐殖质并添加到厌氧消化系统中,系统CH4产量几乎被完全抑制,但发现有少量CO2产生(Keller et al., 2009).研究表明,向污泥厌氧消化系统添加剂量分别为0.3、0.5、0.8和1.0 g·g-1的腐殖质,CH4产量分别减少了14%、42%、85%和97%;腐殖质抑制CH4产生主要是抑制嗜乙酸产甲烷路径,而嗜氢型产甲烷路径几乎未被抑制;抑制嗜乙酸产甲烷路径为乙酰辅酶A向5-甲基-四氢甲烷蝶呤转化过程,腐殖质会与该过程竞争电子,致使乙酸产甲烷路径被阻断(Liu et al., 2015;Ferry et al., 2010;Fischer et al., 1990).
厌氧条件下腐殖质还原菌、产甲烷细菌和硫酸盐还原菌(SRB)仅以乙酸为底物时,腐殖质还原菌会在竞争乙酸中占优势,且腐殖质浓度越高对产甲烷细菌抑制效果越好;但当腐殖质与硫酸盐还原菌(SRB)仅以丙酸为底物时,硫酸盐还原菌会在竞争中会占优势(Van et al., 2009;Cervantes et al., 2002).在实际应用中,因污泥腐殖质浓度低,腐殖质作为电子受体容量有限,因此,腐殖质还原菌并不会对产甲烷菌造成明显抑制作用(Heitmann et al., 2006).
前已述及,高浓度腐殖质会对产甲烷过程造成明显抑制作用,且腐殖质浓度越高抑制作用越明显,但低浓度腐殖质可作为良好电子受体促进产甲烷过程.研究表明,腐殖质对垃圾渗滤液厌氧消化系统CH4产生速率有促进作用;与不加腐殖质相比,加入腐殖质浓度由250 mg·L-1提高至2000 mg·L-1,厌氧消化系统产气速率提高了10.2%~28.2%(Guo et al., 2015).也有研究显示,高浓度(10 g·L-1)腐殖质会抑制产甲烷活性,导致CH4产量降低;原因主要是腐殖质浓度过高使得污泥基质黏度增加,从而微生物利用营养物质出现延迟;腐殖质还原菌会与产甲烷菌(Archaea)竞争并占优势(Cervantes et al., 2002).但较低浓度(1.0~5.0 g·L-1)的腐殖质可作为厌氧消化降解有机物的电子受体,促进VFAs转化效率和CH4产量增加(Ho et al., 2012).更多研究显示,在极端嗜热条件下,低浓度AQDS (0.2 mg·L-1)可作为电子中间穿梭体强化Fe2O3还原;但当浓度超过2.0 g·L-1时,腐殖质呼吸作用会抑制产甲烷细菌活性(Dos et al., 2004;马晨等,2011).因此,有必要进一步探究污泥厌氧消化系统腐殖质提高VFAs转化效率和CH4产量而不会对CH4产生抑制作用的最佳浓度.
此外,参与中温厌氧消化产甲烷细菌要求环境中维持氧化还原电位(ORP)应低于-350 mV,而腐殖质作为电子受体属于氧化剂.研究显示,在T=25 ℃和pH=5.0的条件下,腐殖质标准电极电位平均值为0.778 V,且pH每升高1,标准电极电位降低约20 mV (Struyk et al., 2001).因此,过高浓度的腐殖质或AQDS会使厌氧消化系统氧化还原电位升高,导致产甲烷细菌活性被抑制.
4 腐殖质抑制污泥厌氧消化消除方法(Elimination of humic substances inhibition on anaerobic digestion of excess sludge)尽管腐殖质可能促进酸化和产氢/乙酸过程,且在低浓度时还有可能有利于产甲烷过程,但腐殖质对厌氧消化水解过程的抑制是肯定的、显著的、不可逆转的(任冰倩等,2015).因此,避免或减少腐殖质进入污泥厌氧消化系统成为破解腐殖质抑制水解过程的关键环节.为此,从污泥中提取、回收腐殖质显然是技术首选,亦可考虑在腐殖质进入厌氧消化系统前采用预处理措施将其结构破坏.一旦腐殖质进入厌氧消化系统则需要采取被动技术措施来屏蔽、消除抑制影响.在此方面,金属阳离子的存在可减缓、甚至完全屏蔽腐殖质对水解酶的抑制束缚作用(Ladd et al., 1970).
4.1 腐殖质提取为避免腐殖质进入污泥厌氧消化系统,抑制污泥水解过程,有学者尝试通过碱处理方法提取初沉污泥腐殖质,以利于污泥进行厌氧消化产甲烷.实验表明,碱处理方法提取腐殖质后,污泥厌氧消化效果明显改善,沼气产量提高了29.4%~49.2%,其中,提取腐殖质对沼气增量的贡献率约为10.3%~17.2%(Li et al., 2014a).
尽管碱处理提取腐殖质的实验手段在很大程度上可避免腐殖质抑制水解的过程,但其经济性和实用性备受质疑,因为腐殖质提取过程需要消耗大量化学药剂,且需经过滤膜截留腐殖质分子,步骤异常复杂.
4.2 腐殖质预处理目前单独针对污泥腐殖质预处理的研究并不多见,只在农业土壤学方面存在少量文献.其实,很多污泥预处理方法亦适用于腐殖质,如酸/碱、热解、水解酶、微波和H2O2预处理等.
4.2.1 酸/碱处理污泥酸/碱预处理为常规方法,可有效促进污泥水解.因腐殖质内部共价键结合稳定、复杂,绝大多数结合键仅通过酸/碱水解反应很难断裂, 因此,酸/碱预处理对腐殖质结构破稳效果并不理想(梁重山等,2001).况且,碱预处理只会增加溶解性腐殖质浓度,并不能起到结构破稳作用(Li et al., 2015).只有酸预处理对腐殖质破稳效果稍好,但所需酸的浓度很高;在6 mol·L-1 HCl条件下,腐殖质水解产生单糖、氨基酸、嘌呤和嘧啶等水溶性有机分子,最后50 %以上的研究发现腐殖质发生了水解反应(Hayes et al., 1989).
4.2.2 热解处理有学者尝试将污泥中的胡敏酸和富里酸提取后在180 ℃条件下进行30 min热水解,发现腐殖质浓度基本没有变化,只是溶解性腐殖质增加了35%;其中,部分大分子腐殖质分解成小分子,约32%的胡敏酸转化成富里酸;胡敏酸分子量中位数由81 kDa减至41 kDa,富里酸分子量中位数由15 kDa减至2 kDa;与此同时,热水解也导致某些含氧官能团消失,使芳香族结构增加(Yang et al., 2014).也有研究人员用热解方法处理沥青煤腐殖质,实验结果显示,随温度升高腐殖质官能团会发生分解,芳香族结构增加;在温度低于200~400 ℃时,羧基会发生分解,而酚羟基分解温度需达600 ℃以上(Skhonde et al., 2006).也有研究显示,污泥经65 ℃热水解后进行厌氧消化(SRT=60 d),可生物降解有机物浓度几乎未变,热处理只是增加了非溶解态有机物(蛋白质、多糖、腐殖质等)向溶解态转化,并未提高污泥有机物降解效率;污泥经48 h或更长时间热处理厌氧消化后,污泥中溶解性腐殖质占难降解有机物的比例几乎恒定在28%左右(Lefebvre et al., 2014).
可见,热解预处理虽然可使腐殖质羧基和酚羟基发生一定程度分解,并使腐殖质向溶解态方向转化,在一定程度上减轻腐殖质对水解酶的束缚,但所需温度很高,能量入不敷出.
4.2.3 生物酶处理生物酶处理是向污泥中投加酶制剂或可以分泌胞外酶的细菌.酶能够催化有机物水解,降低长链蛋白质、碳水化合物和脂质黏性,使大分子有机物分解成小分子有机物,提高污泥有机物转化效率(Dursun et al., 2006).
腐殖质会对水解酶产生束缚作用,从而阻碍水解酶与有机物接触, 但污泥中腐殖质含量一定,其束缚水解酶的数量也就一定.因此,向污泥厌氧消化系统添加水解酶,强化酶对污泥的水解作用,可有效提高厌氧消化系统污泥水解的速度和效率.研究表明,将淀粉酶与蛋白酶分别以6%的剂量添加到剩余污泥中,污泥VSS溶解性可分别达54.24%和39.70%(而控制组溶解性为10%).当用淀粉酶与蛋白酶以1:3比例(质量比)处理污泥时,污泥固体溶解性达到了68.43%;添加水解酶也促进了溶解性腐殖质成分的增加(Luo et al., 2013).
剩余污泥生物酶预处理可增强污泥水解和产甲烷能力,具有较好的处理效果,且不需要额外设施与能量消耗.随着生物工程技术的发展,生物酶制剂提取成本会不断降低,相信这种技术也会有较好的发展前景.
4.2.4 微波/H2O2处理有研究人员实验比较了H2O2、微波和微波/H2O2联合方法预处理污泥的效果,结果显示,添加H2O2剂量为1.0 g·g-1(以TS计)预处理后,污泥溶解性COD由原来的2.7 g·L-1提高到10.6 g·L-1,溶解性腐殖质浓度由0.3 g·L-1提高至1.5 g·L-1,而总腐殖质浓度由原来的8.3 g·L-1降低至6.9 g·L-1;采用微波、微波/H2O2联合预处理同样可达到与H2O2预处理类似的效果(Cigdem et al., 2008).因此,采用H2O2、微波和微波/H2O2联合预处理方法,均可降低污泥总腐殖质浓度,但溶解性腐殖质浓度会有所升高,腐殖质仍会抑制水解酶活性.
4.3 金属离子屏蔽腐殖质抑制水解作用腐殖质活性基团能够与金属离子发生络合、螯合、吸附等作用,尤其是羧基、酚羟基可与金属离子相互结合(Stevenson et al., 1994).研究表明,腐殖质对金属离子捕获容量很大,1.0 g腐殖质可以和数克金属离子发生络合反应(曾蕾等,2010).腐殖质与金属离子的结合能力较水解酶强,因此,金属离子会与酶竞争腐殖质羧基、酚羟基点位并优先与腐殖质结合,导致水解酶被替换而“解脱”.
研究表明,当腐殖质与水解酶存在静电吸引力时,金属离子会屏蔽分子之间的静电引力作用(Wang et al., 2007).当腐殖质与水解酶质量比小于腐殖质与水解酶电中性质量比时,相反电荷分子间主要是静电引力,金属离子在一定程度上能够减弱腐殖质对蛋白质分子的包裹作用,提高酶与底物接触的机率(Yan et al., 2013).更多研究表明,虽然金属阳离子可解除腐殖质对酶的吸附作用,但只有当金属离子达到一定浓度时,这种作用才会出现;达到同样解除抑制效果时,多价金属离子较单价金属离子效果要好;1价和3价金属离子浓度分别大于10-2、10-3 mol·L-1时,便可使酶从腐殖质上“解脱”(Tipping et al., 2011).
由于羧基、酚羟基等酸性官能团在不同pH条件下电离度不同,因此,金属离子参与键合腐殖质基团的情况也不一样.在中性条件下,以羧基络合金属离子为主;而在碱性条件下,羧基和酚羟基共同络合金属离子(Garcia-Mina et al., 2006).腐殖质含有羧基、酚羟基等多种官能团,它们与金属离子相互作用的形式多样.研究表明,腐殖质与金属离子作用主要有4种可能模式:①1个羧基与金属离子Mn+形成有机盐或络合物;②1个羧基和1个酚羟基(即水杨酸型官能团)与Mn+形成二齿络合物;③2个羧基(即苯二酸型官能团)与Mn+形成二齿络合物;④游离羧基与水合金属离子M (H2O)x通过静电相互作用形成结合物,如Fe3+、Al3+等(Schnitzer et al., 1982).图 3显示了腐殖质与金属离子的4种作用模式.
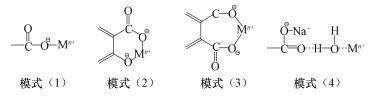 |
| 图 3 腐殖质与金属离子的4种作用模式 Fig. 3 Four types of reaction models for humic substances with metal ions |
腐殖质与2价或3价金属离子容易形成稳定配合物(Theng et al., 1975).因此,4种作用模式中,模式(2)~(4)应占主导地位.腐殖质与金属离子络合稳定常数受腐殖质来源、金属离子性质和介质条件(pH、离子强度、介质阴阳离子等)的影响(李云峰等,1999).不同学者对腐殖质与金属离子络合物稳定性进行了研究,得出了不太一致的结果.有学者实验得出,金属离子络合稳定性满足Irving-Williams序列:Ba < Ca < Mg < Mn < Fe < Zn < Co < Pb < Ni < Cu (Irving et al., 1948).也有学者采用离子交换平衡法测定了腐殖质与金属离子形成络合稳定序列为:Mg < Ca < Ag < Zn < Co < Mn < Cu < Pb < Ni (pH < 5.5)(李云峰等,1999).还有学者采用电位滴定法测定了腐殖质形成络合物稳定序列为:Mn < Co < Ni < Zn < Cu < Al < Fe (pH < 7.5)(Khanna et al., 1962).因污泥腐殖质存在较多脂肪族和较少芳香族聚合物,因此,污泥腐殖质与金属离子络合稳定常数较土壤腐殖质要小(Rovira et al., 2002).
研究表明,向含有木质纤维素和腐殖质的实验组中分别添加Ca2+、Mg2+和Fe3+,木质纤维素水解效率较未添加金属离子分别提高了47%、37%和44%,CH4产量分别提高146%、128%和145%,且添加的Fe3+被腐殖质还原成Fe2+;然而,添加Na+、K+解除腐殖质抑制效果并不明显,腐殖质与金属离子络合稳定性满足K+、Na+ < Mg2+ < Fe3+ (Fe2+) < Ca2+(Azman et al., 2015).也有研究表明,添加Ca2+可以有效缓解腐殖质对土豆蛋白质的水解(Brons et al., 1985).更多研究显示,Ca2+与腐殖质结合能力较强,随添加Ca2+浓度增加,80%以上被抑制的苹果醋酶活性可以恢复,且Ca2+添加对系统中未受抑制的酶活性并没有影响(Ladd et al., 1969).这些实验均得出,金属离子可以解除腐殖质抑制木质纤维素水解并提高CH4产量,而金属离子解除剩余污泥水解抑制和提高CH4产量的效果还有待进一步探究.
重金属离子(如Hg2+、Cu2+、Cd2+、Cr2+等)与腐殖质结合能力较Ca2+、Mg2+、Al3+、Fe3+等高很多.然而,向污泥厌氧消化系统添加重金属离子(Fe3+除外)会提高污泥重金属离子浓度,增加生态系统的环境风险.因此,Ca2+、Mg2+、Al3+、Fe3+等较适宜被选作屏蔽腐殖质抑制污泥厌氧消化水解作用的研究对象.除了考虑投加金属离子种类外,还需要考虑金属离子浓度对厌氧微生物的毒害作用,但金属离子对厌氧微生物毒害作用存在一定的浓度阀值,投加适宜浓度的金属离子并不会对厌氧微生物产生毒害作用.
5 结论(Conclusions)1) 腐殖质作为一种结构异常复杂、稳定性极强的芳香族多环或杂环状有机物难以在常规污水生物处理过程中被降解,大多数(67%~84%)被吸附于活性污泥而最终进入污泥厌氧消化系统.即使是被微生物厌氧分解,也难以破坏腐殖质结构,它们大多会原封不动地随消化污泥排出系统,这也是污泥有机物能源转化率不高的原因之一.
2) 腐殖质在厌氧消化中最大的问题还不是自身难以降解,而是它们还会抑制其它有机物水解过程,造成更低的有机物能源转化率.腐殖质含有大量羧基(-COOH)、酚羟基(酚-OH),醇羟基(醇-OH)、甲氧基(-OCH3)和羰基(CO)等多种含氧官能团,这些官能团具有离子交换性、弱酸性、吸附性、络合性、氧化还原性等性质.腐殖质中的某些官能团可通过共价键方式与水解酶发生作用,如腐殖质所含的羧基、酚羟基可与水解酶氨基相互连结,从而减少、阻碍水解酶与其它有机物的接触机会,使厌氧消化水解速度和效率均降低.虽然腐殖质可作为电子受体、中间体、pH缓冲剂等具有促进厌氧消化酸化、产氢/乙酸、甚至产甲烷的有限作用,但与其抑制水解作用相比则显得微不足道.况且,水解是厌氧消化的第一步,这步不能有效完成,后续步骤便无从谈起.
3) 需要在厌氧消化阶段以“防患于未然”和“除患于既成之后”两个方面来最大限度地去除或消除腐殖质对水解的影响.提取腐殖质与污泥预处理(如酸/碱、热、微波,H2O2、生物酶等预处理)是去除腐殖质的有效手段,但这些方法大都需要投入大量化学/生物试剂及消耗大量能量,且对腐殖质结构破稳作用不强,预处理后大多腐殖质仍以溶解状态存在,进入厌氧系统仍会抑制其它有机物水解.
4) 相对于上述方法,金属离子可起到“解脱”水解酶的作用,很大程度上可破解腐殖质对其它有机物的水解作用.腐殖质与金属离子的结合能力较水解酶要强,金属离子会与酶竞争腐殖质羧基、酚羟基活性点位并优先与腐殖质结合,从而“解脱”它们对水解酶的束缚.因此,研究金属离子破解水解酶束缚作用显得很有必要,二价或三价等高价离子效果似乎更好.到目前相关研究较少,该种技术尚未有工程化应用报道,未来工程化应选择屏蔽腐殖质抑制水解作用效果好、价格低廉的金属离子,以达到入能敷出目的.
5) 污泥细胞破壁、木质纤维素破稳、腐殖质屏蔽是提高污泥有机物能源转化率的三大关键技术.细胞破壁、木质素破稳可通过合二而一的预处理实现,但随之而来的可能是腐殖质仍然不变、甚至略有增量地进入厌氧消化系统,使本来可以水解的破壁、破稳有机物难以水解.因此,用金属离子吸附腐殖质活性点位的研究对提高有机物能源转化率便显得至关重要.
| [${referVo.labelOrder}] | Akio I, Takehiko F, Kazuo M, et al. 2002. Characterization of dissolved organic matter in effluents from wastewater treatment plants[J]. Water Research, 36(4) : 859–870. DOI:10.1016/S0043-1354(01)00283-4 |
| [${referVo.labelOrder}] | Amir S, Lemee M H, Merlina G, et al. 2006. Structural characterization of humic acids, extracted from sewage sludge during composting, by thermochemolysis-gas chromatography-mass spectrometry[J]. Process Biochemistry, 41(2) : 410–422. DOI:10.1016/j.procbio.2005.07.005 |
| [${referVo.labelOrder}] | Azman S, Khadem A, Zeeman G, et al. 2015. Mitigation of humic acid inhibition in anaerobic digestion of cellulose by addition of various salts[J]. Bioengineering, 2(2) : 54–65. DOI:10.3390/bioengineering2020054 |
| [${referVo.labelOrder}] | Blodau C, Deppe M. 2012. Humic acid addition lowers methane release in peats of the Mer Bleue bog, Canada[J]. Soil Biology & Biochemistry, 52(3) : 96–98. |
| [${referVo.labelOrder}] | Bo F, Palmgren R, Keiding K, et al. 1996. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 30(8) : 1749–1758. DOI:10.1016/0043-1354(95)00323-1 |
| [${referVo.labelOrder}] | Brons H J, Field J A, Lexmond W A C, et al. 1985. Influence of humic acids on the hydrolysis of potato protein during anaerobic digestion[J]. Agricultural Wastes, 13(2) : 105–114. DOI:10.1016/0141-4607(85)90017-4 |
| [${referVo.labelOrder}] | Bruce R A, Achenbach L A, Coates J D. 1999. Reduction of (per) chlorate by a novel organism isolated from paper mill waste[J]. Environmental Microbiology, 1(4) : 319–329. DOI:10.1046/j.1462-2920.1999.00042.x |
| [${referVo.labelOrder}] | Ceppi S B, Velasco M I, Pauli C P D. 1999. Differential scanning potentiometry:surface charge development and apparent dissociation constants of natural humic acids[J]. Talanta, 50(5) : 1057–1063. DOI:10.1016/S0039-9140(99)00209-X |
| [${referVo.labelOrder}] | Cervantes F J, de Bok F A M, Duong-Dac T, et al. 2002. Reduction of humic substances by halorespiring, sulphate-reducing and methanogenic microorganisms[J]. Environmental Microbiology, 4(1) : 51–57. DOI:10.1046/j.1462-2920.2002.00258.x |
| [${referVo.labelOrder}] | Cervantes F J, Dijksma W, Duong-Dac T A, et al. 2001. Anaerobic mineralization of toluene by enriched sediments with quinones and humus as terminal electron acceptors[J]. Applied & Environmental Microbiology, 67(10) : 4471–4478. |
| [${referVo.labelOrder}] | Cervantes F J, Martínez C M, Jorge G E, et al. 2013. Kinetics during the redox biotransformation of pollutants mediated by immobilized and soluble humic acids[J]. Applied Microbiology & Biotechnology, 97(6) : 2671–2679. |
| [${referVo.labelOrder}] | Cervantes F J, van der Velde S, Lettinga G, et al. 2000. Competition between methanogenesis and quinone respiration for ecologically important substrates in anaerobic consortia[J]. Fems Microbiology Ecology, 34(2) : 161–171. DOI:10.1111/fem.2000.34.issue-2 |
| [${referVo.labelOrder}] | Cervantes F J, Vu-Thi-Thu L, Lettinga G, et al. 2004. Quinone-respiration improves dechlorination of carbon tetrachloride by anaerobic sludge[J]. Applied Microbiology & Biotechnology, 64(5) : 702–711. |
| [${referVo.labelOrder}] | Cigdem E, Audrey P, Juan M, et al. 2008. Synergetic pretreatment of sewage sludge by microwave irradiation in presence of H2O2 for enhanced anaerobic digestion[J]. Water Research, 42(18) : 4674–4682. DOI:10.1016/j.watres.2008.08.010 |
| [${referVo.labelOrder}] | Cunningham L. 1965. The structure and mechanism of action of proteolytic enzymes[J]. Comprehensive Biochemistry, 16 : 85–188. DOI:10.1016/B978-1-4831-9710-4.50010-6 |
| [${referVo.labelOrder}] | 陈世和. 1992. 微生物生理学原理[M]. 上海: 同济大学出版社. |
| [${referVo.labelOrder}] | Dos Santos A B, Cervantes F J, Van Lier J B. 2004. Azo dye reduction by thermophilic anaerobic granular sludge, and the impact of the redox mediator anthraquinone-2, 6-disulfonate (AQDS) on the reductive biochemical transformation[J]. Applied Microbiology and Biotechnology, 64(1) : 62–69. DOI:10.1007/s00253-003-1428-y |
| [${referVo.labelOrder}] | 窦森, 李凯, 崔俊涛, 等. 2008. 土壤腐殖物质形成转化与结构特征研究进展[J]. 土壤学报, 2008, 45(6) : 1148–1158. |
| [${referVo.labelOrder}] | Dursun D, Turkmen M, Abu-Orf M, et al. 2006. Enhanced sludge conditioning by enzyme pre-treatment:comparison of laboratory and pilot scale dewatering results[J]. Water Science & Technology, 54(5) : 33–41. |
| [${referVo.labelOrder}] | El-Fadel M, Massoud M. 2001. Methane emissions from wastewater management[J]. Environmental Pollution, 114(2) : 177–185. DOI:10.1016/S0269-7491(00)00222-0 |
| [${referVo.labelOrder}] | Eliosov B, Argaman Y. 1995. Hydrolysis of particulate organics in activated sludge systems[J]. Water Research, 29(1) : 155–163. DOI:10.1016/0043-1354(94)E0109-J |
| [${referVo.labelOrder}] | 方芳, 刘国强, 郭劲松, 等. 2008. 活性污泥法对水溶性腐殖酸的去除效能与机制研究[J]. 环境科学, 2008, 29(8) : 2266–2270. |
| [${referVo.labelOrder}] | 方晓瑜, 李家宝, 芮俊鹏, 等. 2015. 产甲烷生化代谢途径研究进展[J]. 应用与环境生物学报, 2015, 21(1) : 1–9. |
| [${referVo.labelOrder}] | 冯华军, 胡立芳, 邱才娣, 等. 2008. 3类金属离子对活性污泥吸附水体腐殖酸的影响[J]. 环境科学, 2008, 29(1) : 77–81. |
| [${referVo.labelOrder}] | Fernandes T V, Lier J B V, Zeeman G. 2014. Humic acid-like and fulvic acid-like inhibition on the hydrolysis of cellulose and tributyrin[J]. Bioenergy Research, 8(2) : 821–831. |
| [${referVo.labelOrder}] | Ferry J G. 2010. The chemical biology of methanogenesis[J]. Planetary & Space Science, 58(14/15) : 1775–1783. |
| [${referVo.labelOrder}] | Fischer R, Thauer R K. 1990. Ferredoxin-dependent methane formation from acetate in cell extracts of Methanosarcina barkeri (strain MS)[J]. Febs Letters, 269(2) : 368–372. DOI:10.1016/0014-5793(90)81195-T |
| [${referVo.labelOrder}] | Garcia-Gil J C, Ceppi S B, Velasco M I, et al. 2004. Long-term effects of amendment with municipal solid waste compost on the elemental and acidic functional group composition and pH-buffer capacity of soil humic acids[J]. Geoderma, 121(1) : 135–142. |
| [${referVo.labelOrder}] | Garcia-Mina J M. 2006. Stability, solubility and maximum metal binding capacity in metal-humic complexes involving humic substances extracted from peat and organic compost[J]. Organic Geochemistry, 37(12) : 1960–1972. DOI:10.1016/j.orggeochem.2006.07.027 |
| [${referVo.labelOrder}] | Guo M, Xian P, Yang L, et al. 2015. Effect of humic acid in leachate on specific methanogenic activity of anaerobic granular sludge[J]. Environmental technology, 36(21) : 2740–2745. DOI:10.1080/09593330.2015.1045040 |
| [${referVo.labelOrder}] | 郝晓地, 曹兴坤, 王吉敏, 等. 2013. 剩余污泥中木质纤维素稳定并转化能源可行性分析[J]. 环境科学学报, 2013, 33(5) : 1215–1223. |
| [${referVo.labelOrder}] | Hao X D, Liu R B, Huang X. 2015. Evaluation of the potential for operating carbon neutral WWTPs in China[J]. Water Research, 87 : 424–431. DOI:10.1016/j.watres.2015.05.050 |
| [${referVo.labelOrder}] | 郝晓地, 魏静, 曹亚莉. 2014a. 美国碳中和运行成功案例--Sheboygan污水处理厂[J]. 中国给水排水, 2014a, 30(24) : 1–6. |
| [${referVo.labelOrder}] | 郝晓地, 张璇蕾, 刘然彬, 等. 2014b. 剩余污泥转化能源的瓶颈与突破技术[J]. 中国给水排水, 2014b, 30(18) : 1–7. |
| [${referVo.labelOrder}] | Hayes M H B, MacCarthy P, Malcolm R L, et al. 1989. Humic substances Ⅱ:In search of structure[M]. Hoboken: John Wiley & Sons Ltd. |
| [${referVo.labelOrder}] | Hernández M T, Moreno J I, Costa F, et al. 1990. Structural features of humic acid like substances from sewage sludge[J]. Soil Science, 149(2) : 63–68. DOI:10.1097/00010694-199002000-00001 |
| [${referVo.labelOrder}] | Heitmann T, Blodau C. 2006. Oxidation and incorporation of hydrogen sulfide by dissolved organic matter[J]. Chemical Geology, 235(1/2) : 12–20. |
| [${referVo.labelOrder}] | Hofrichter M.2004.生物高分子(第1卷):木质素、腐殖质和煤[M].郭圣荣, 译.北京:化学工业出版社 |
| [${referVo.labelOrder}] | Ho L, Ho G. 2012. Mitigating ammonia inhibition of thermophilic anaerobic treatment of digested piggery wastewater:Use of pH reduction, zeolite, biomass and humic acid[J]. Water Research, 46(14) : 4339–4350. DOI:10.1016/j.watres.2012.05.016 |
| [${referVo.labelOrder}] | Imai A, Fukushima T, Matsushige K, et al. 2002. Characterization of dissolved organic matter in effluents from wastewater treatment plants[J]. Water Research, 36(4) : 859–870. DOI:10.1016/S0043-1354(01)00283-4 |
| [${referVo.labelOrder}] | Irving H, Williams R J P. 1948. Order of stability of metal complexes[J]. Nature, 161(4090) : 436–437. |
| [${referVo.labelOrder}] | Jahnel J B, Frimmel F H. 1994a. Comparison of the enzyme inhibition effect of different humic substances in aqueous solutions[J]. Chemical Engineering & Processing, 33(5) : 325–330. |
| [${referVo.labelOrder}] | Jahnel J B, Mahlich B, Frimmel F H. 1994b. Influence of humic substances on the activity of a protease[J]. Acta Hydrochimica Et Hydrobiologica, 22(3) : 109–116. DOI:10.1002/(ISSN)1521-401X |
| [${referVo.labelOrder}] | 金鹏康, 石彦丽, 任武昂. 2015. 城市污水处理过程中溶解性有机物转化特性[J]. 环境工程学报, 2015, 9(1) : 1–6. |
| [${referVo.labelOrder}] | Kampschreur M J, Temmink H, Kleerebezem R, et al. 2009. Nitrous oxide emission during wastewater treatment[J]. Water Research, 43(17) : 4093–4103. DOI:10.1016/j.watres.2009.03.001 |
| [${referVo.labelOrder}] | Kazuya W, Mike M, Matthew L, et al. 2009. Electron shuttles in biotechnology[J]. Current Opinion in Biotechnology, 20(6) : 633–641. DOI:10.1016/j.copbio.2009.09.006 |
| [${referVo.labelOrder}] | Keller J K, Weisenhorn P B, Megonigal J P. 2009. Humic acids as electron acceptors in wetland decomposition[J]. Soil Biology & Biochemistry, 41(7) : 1518–1522. |
| [${referVo.labelOrder}] | Khanna S S, Stevenson F J. 1962. Metalallo-organic complexes in soil:I[J]. potentiometric titration of some soil organic matter isolates in the presence of transition metals[J].Soil Science, 93(5) : 298–305. |
| [${referVo.labelOrder}] | Ladd J N, Butler J H A. 1969. Inhibition and simulation of proteolytic enzyme activities by soil humic acids[J]. Soil Research, 7(3) : 253–261. DOI:10.1071/SR9690253 |
| [${referVo.labelOrder}] | Ladd J N, Butler J H A. 1971. Inhibition by soil humic acids of native and acetylated proteolytic enzymes[J]. Soil Biology & Biochemistry, 3(2) : 157–160. |
| [${referVo.labelOrder}] | Ladd J N, Butler J H A. 1970. The effect of inorganic cations on the inhibition and stimulation of protease activity by soil humic acids[J]. Soil Biology & Biochemistry, 2(1) : 33–40. |
| [${referVo.labelOrder}] | Lefebvre D, Dossat-Létisse V, Lefebvre X, et al. 2014. Fate of organic matter during moderate heat treatment of sludge:kinetics of biopolymer and hydrolytic activity release and impact on sludge reduction by anaerobic digestion[J]. Water Science & Technology, 69(9) : 1828–1833. |
| [${referVo.labelOrder}] | Li D, Zhou Y, Tan Y, et al. 2015. Alkali-solubilized organic matter from sludge and its degradability in the anaerobic process[J]. Bioresource Technology, 200 : 579–586. |
| [${referVo.labelOrder}] | Li H, Li Y, Li C. 2013a. Characterization of humic acids and fulvic acids derived from sewage sludge[J]. Asian Journal of Chemistry, 25(18) : 10087. |
| [${referVo.labelOrder}] | Li Y, Tan W F, Koopal L K, et al. 2013b. Influence of soil humic and fulvic acid on the activity and stability of lysozyme and urease[J]. Environmental Science & Technology, 47(10) : 5050–5056. |
| [${referVo.labelOrder}] | Li H, Li Y, Jin Y, et al. 2014a. Recovery of sludge humic acids with alkaline pretreatment and its impact on subsequent anaerobic digestion[J]. Journal of Chemical Technology & Biotechnology, 89(5) : 707–713. |
| [${referVo.labelOrder}] | Li H, Li Y, Zou S, et al. 2014b. Extracting humic acids from digested sludge by alkaline treatment and ultrafiltration[J]. Journal of Material Cycles & Waste Management, 16(1) : 93–100. |
| [${referVo.labelOrder}] | Li X, Dai X, Takahashi J, et al. 2014c. New insight into chemical changes of dissolved organic matter during anaerobic digestion of dewatered sewage sludge using EEM-PARAFAC and two-dimensional FTIR correlation spectroscopy[J]. Bioresource Technology, 159 . |
| [${referVo.labelOrder}] | 李学垣. 1997. 土壤化学及实验指导[M]. 北京: 中国农业出版社. |
| [${referVo.labelOrder}] | 李晓齐. 1993. 腐殖质的形成[J]. 腐植酸, 1993(4) : 58–62. |
| [${referVo.labelOrder}] | 李有康, 李欢, 李忱忱. 2013. 污泥中腐殖酸的含量及其特征分析[J]. 环境工程, 2013(S1) : 22–24. |
| [${referVo.labelOrder}] | 李云峰, 王兴理. 1999. 腐殖质-金属离子的络合稳定性及土壤胡敏素的研究[M]. 贵阳: 贵州出版社. |
| [${referVo.labelOrder}] | 梁重山, 刘丛强, 党志. 2001. 现代分析技术在土壤腐殖质研究中的应用[J]. 土壤, 2001, 33(3) : 154–158. |
| [${referVo.labelOrder}] | Liu K, Chen Y G, Xiao N D, et al. 2015. Effect of humic acids with different characteristics on fermentative short-chain fatty acids production from waste activated sludge[J]. Environmental Science & Technology, 49(8) : 4929–4936. |
| [${referVo.labelOrder}] | Lovley D R, Blunt-Harris E L. 1999a. Role of humic-bound iron as an electron transfer agent in dissimilatory Fe (Ⅲ) reduction[J]. Applied & Environmental Microbiology, 65(9) : 4252–4254. |
| [${referVo.labelOrder}] | Lovley D R, Fraga J L, Coates J D, et al. 1999b. Humics as an electron donor for anaerobic respiration[J]. Environmental Microbiology, 1(1) : 89–98. DOI:10.1046/j.1462-2920.1999.00009.x |
| [${referVo.labelOrder}] | Lovley D R, Coates J D, Blunt-Harris E L, et al. 1996. Humic substances as electron acceptors for microbial respiration[J]. Nature, 382(6590) : 445–448. DOI:10.1038/382445a0 |
| [${referVo.labelOrder}] | Lovley D R, Fraga J L, Blunt-Harris E L, et al. 1998. Humic substances as a mediator for microbially catalyzed metal reduction[J]. Acta Hydrochimica Et Hydrobiologica, 26(3) : 152–157. DOI:10.1002/(ISSN)1521-401X |
| [${referVo.labelOrder}] | Luo K, Yang Q, Li X, et al. 2013. Novel insights into enzymatic-enhanced anaerobic digestion of waste activated sludge by three-dimensional excitation and emission matrix fluorescence spectroscopy[J]. Chemosphere, 91(5) : 579–585. DOI:10.1016/j.chemosphere.2012.12.002 |
| [${referVo.labelOrder}] | 马晨, 周顺桂, 庄莉, 等. 2011. 微生物胞外呼吸电子传递机制研究进展[J]. 生态学报, 2011, 31(7) : 2008–2018. |
| [${referVo.labelOrder}] | Minderlein S, Blodau C. 2010. Humic-rich peat extracts inhibit sulfate reduction, methanogenesis, and anaerobic respiration but not acetogenesis in peat soils of a temperate bog[J]. Soil Biology & Biochemistry, 42(12) : 2078–2086. |
| [${referVo.labelOrder}] | Newman D K, Kolter R. 2000. A role for excreted quinones in extracellular electron transfer[J]. Nature, 405(6782) : 94–97. DOI:10.1038/35011098 |
| [${referVo.labelOrder}] | Pflug W, Kurzmitteilung. 1981a. Effect of humic acids on the activity of soil enzymes[J]. Journal of Plant Nutrition & Soil Science, 144(4) : 423–425. |
| [${referVo.labelOrder}] | Pflug W, Ziechmann W. 1981b. Inhibition of malate dehydrogenase by humic acids[J]. Soil Biology & Biochemistry, 13(4) : 293–299. |
| [${referVo.labelOrder}] | 任冰倩.2015.腐殖酸抑制厌氧消化过程实验研究[D].北京:北京建筑大学.1-46 |
| [${referVo.labelOrder}] | 任南琪. 2004. 厌氧生物技术原理与应用[M]. 北京: 化学工业出版社. |
| [${referVo.labelOrder}] | Rovira P A S, Brunetti G, Polo A, et al. 2002. Comparative chemical and spectroscopic characterization of humic acids from sewage sludge and sludge-amended soils[J]. Soil Science, 167(4) : 235–245. DOI:10.1097/00010694-200204000-00001 |
| [${referVo.labelOrder}] | Sahm H. 1984. Anaerobic Wastewater Treatment[M]. Berlin Heidelberg: Springer. |
| [${referVo.labelOrder}] | Sarkar J M, Bollag J M. 1987. Inhibitory effect of humic and fulvic acids on oxidoreductases as measured by the coupling of 2, 4-dichlorophenol to humic substances[J]. Science of the Total Environment, 62 : 367–377. DOI:10.1016/0048-9697(87)90524-9 |
| [${referVo.labelOrder}] | Sastre I, Vicente M A, Lobo M C. 1996. Influence of the application of sewage sludge on soil microbial activity[J]. Bioresource Technology, 57(1) : 19–23. DOI:10.1016/0960-8524(96)00035-1 |
| [${referVo.labelOrder}] | Schnitzer M, Khan S U. 1974. Humic substances in the environment[J]. Journal of Environmental Quality, 3(2) : 186. |
| [${referVo.labelOrder}] | Schnitzer M. 1982. Proceedings of the 12th International Congress of Soil Science[M]. New Delhi: Elsevier. |
| [${referVo.labelOrder}] | Schinner F, Öhlinger R, Kandeler E, Margesin R. 2012. Methods in Soil Biology[M]. New York: Springer. |
| [${referVo.labelOrder}] | Schulten H R, Schnitzer M. 1997. Chemical model structures for soil organic matter and soils[J]. Soil Science, 162(2) : 115–130. DOI:10.1097/00010694-199702000-00005 |
| [${referVo.labelOrder}] | Scott D T, McKnight D M, Blunt-Harris E L, et al. 1998. Quinone moieties act as electron acceptors in the reduction of humic substances by humics-reducing microorganisms[J]. Environmental Science & Technology, 32(19) : 2984–2989. |
| [${referVo.labelOrder}] | Skhonde M P, Herod A A, Van der Walt T J, et al. 2006. The effect of thermal treatment on the compositional structure of humic acids extracted from South African bituminous coal[J]. International Journal of Mineral Processing, 81(1) : 51–57. DOI:10.1016/j.minpro.2006.07.001 |
| [${referVo.labelOrder}] | Skiadas I V, Gavala H N, Lyberatos G. 2000. Modeling of the periodic anaerobic baffled reactor (PABR) based on the retaining factor concept[J]. Water Research, 34(15) : 3725–3736. DOI:10.1016/S0043-1354(00)00137-8 |
| [${referVo.labelOrder}] | Stevenson F J. 1994. 腐殖质化学[M]. 北京: 中国农业大学出版社. |
| [${referVo.labelOrder}] | Struyk Z, Sposito G. 2001. Redox properties of standard humic acids[J]. Geoderma, 102 : 329–346. DOI:10.1016/S0016-7061(01)00040-4 |
| [${referVo.labelOrder}] | Tan W F, Koopal L K, Weng L P, et al. 2008. Humic acid protein complexation[J]. Geochimica Et Cosmochimica Acta, 72(8) : 2090–2099. DOI:10.1016/j.gca.2008.02.009 |
| [${referVo.labelOrder}] | 陶祖贻, 陆长青. 1992. 核素迁移和腐殖酸[J]. 核化学与放射化学, 1992, 14(2) : 120–125. |
| [${referVo.labelOrder}] | Theng B K G, Scharpenseel H W.1975.The adsorption of 14C-labelled humic acid by montmorillonite[C].Proc Int Clay Conf.Mexico:643-653 |
| [${referVo.labelOrder}] | Thurman E M. 1985. Aquatic Humic Substances[M]. Netherlands: Springer. |
| [${referVo.labelOrder}] | Tipping E, Lofts S, Sonke J E. 2011. Humic ion-binding model Ⅶ:a revised parameterisation of cation-binding by humic substances[J]. Environmental Chemistry, 8(3) : 225–235. DOI:10.1071/EN11016 |
| [${referVo.labelOrder}] | Tomaszewski J E, Schwarzenbach R P, Michael S. 2011. Protein encapsulation by humic substances[J]. Environmental Science & Technology, 45(14) : 6003–6010. |
| [${referVo.labelOrder}] | Van der Zee F P, Cervantes F J. 2009. Impact and application of electron shuttles on the redox (bio) transformation of contaminants:a review[J]. Biotechnology Advances, 27(3) : 256–277. DOI:10.1016/j.biotechadv.2009.01.004 |
| [${referVo.labelOrder}] | 王镜岩, 朱圣庚, 徐长法. 2010. 生物化学(第3版)(上)[M]. 北京: 高等教育出版社. |
| [${referVo.labelOrder}] | 王一明, 林先贵, 徐江兵.2006.腐殖化进程中的微生物[C].第六届全国绿色环保肥料新技术、新产品交流会.南京 |
| [${referVo.labelOrder}] | Wang X, Ruengruglikit C, Wang Y W, et al. 2007. Interfacial interactions of pectin with bovine serum albumin studied by quartz crystal microbalance with dissipation monitoring:effect of ionic strength[J]. Journal of Agricultural & Food Chemistry, 55(25) : 10425–10431. |
| [${referVo.labelOrder}] | Wedding R T, Hansch C, Fukuto T R. 1967. Inhibition of malate dehydrogenase by phenols and the influence of ring substituents on their inhibitory effectiveness[J]. Archives of Biochemistry & Biophysics, 121(1) : 9–21. |
| [${referVo.labelOrder}] | Weemaes M, Grootaerd H, Simoens F, et al. 2000. Anaerobic digestion of ozonized biosolids[J]. Water Research, 34(99) : 2330–2336. |
| [${referVo.labelOrder}] | Weetall H H. 1974. Immobilized enzymes:analytical applications[J]. Analytical Chemistry, 46(7) : 602–615. |
| [${referVo.labelOrder}] | 许志诚, 罗微, 洪义国, 等. 2006. 腐殖质在环境污染物生物降解中的作用研究进展[J]. 微生物学通报, 2006, 33(6) : 122–127. |
| [${referVo.labelOrder}] | Yang Y, Li H, Li J. 2014. Variation in humic and fulvic acids during thermal sludge treatment assessed by size fractionation, elementary analysis, and spectroscopic methods[J]. Frontiers of Environmental Science & Engineering, 8(6) : 854–862. |
| [${referVo.labelOrder}] | Yang X, Du M A, Bai L, et al. 2012. Improved volatile fatty acids production from proteins of sewage sludge with anthraquinone-2, 6-disulfonate (AQDS) under anaerobic condition[J]. Bioresource Technology, 103(1) : 494–497. DOI:10.1016/j.biortech.2011.10.021 |
| [${referVo.labelOrder}] | Yan L, Wenfeng T, Koopal L K, et al. 2013. Influence of soil humic and fulvic acid on the activity and stability of lysozyme and urease[J]. Environmental Science & Technology, 47(10) : 5050–5056. |
| [${referVo.labelOrder}] | Yuan D, Wang Y. 2013. Effects of solution conditions on the physicochemical properties of stratification components of extracellular polymeric substances in anaerobic digested sludge[J]. Journal of Environmental Sciences, 25(1) : 155–162. DOI:10.1016/S1001-0742(12)60038-2 |
| [${referVo.labelOrder}] | Yu Z, Wen X, Xu M, et al. 2012. Anaerobic digestibility of the waste activated sludge discharged from large-scale membrane bioreactors[J]. Bioresource Technology, 126(12) : 358–361. |
| [${referVo.labelOrder}] | Zang X, Van Heemst J D H, Dria K J, et al. 2000. Encapsulation of protein in humic acid from a histosol as an explanation for the occurrence of organic nitrogen in soil and sediment[J]. Organic Geochemistry, 31(7) : 679–695. |
| [${referVo.labelOrder}] | 曾蕾, 易诚, 周崇文, 等. 2010. 洞庭湖沉积物腐殖酸的配位性与酸碱性研究[J]. 资源调查与环境, 2010, 29(2) : 136–143. |
| [${referVo.labelOrder}] | 张晋京, 窦森. 2008. 土壤胡敏素研究进展[J]. 生态学报, 2008, 28(3) : 1229–1239. |
| [${referVo.labelOrder}] | 张晋京, 窦森, 李翠兰, 等. 2004. 土壤腐殖质分组研究[J]. 土壤通报, 2004, 35(6) : 706–709. |
 2017, Vol. 37
2017, Vol. 37


