2. 中国建筑西北设计研究院有限公司, 西安 710018;
3. 西安工业大学建筑工程学院, 西安 710021
2. China Building Northwest Design and Research Institute Co., LTD, Xi'an 710018;
3. School of Civil Engineering and Architecture, Xi'an Technological University, Xi'an 710021
微生物作为流域生态系统的重要组成部分, 在碳、氮、磷等物质的循环转化过程中起着重要而独特的作用(Cébron et al., 2005).由于对环境变化十分敏感(Harnisz et al., 2011), 河流微生物群落的物种结构与数量还指示着流域生态系统的健康程度(Juan et al., 1987;张芝勍, 2011).随着分子微生物技术的发展, 人们对自然界微生物群落的认识迅速拓展.国内外有关淡水微生物的研究表明, 变形菌(Proteobacteria)、拟杆菌(Bacteroidetes)、放线菌(Actinobacteria)、蓝藻细菌(Cyanobacteria)、厚壁菌(Firmicutes)等微生物门类(Zwart et al., 2002;Crump et al., 2003)广泛存在于不同地区的地表水环境中.但微生物群落的多样性、具体物种构成及其相对丰度的时空变化特征, 在不同的河流与湖泊中表现出很大的差异(Huang et al., 2011;Lindstrom, 2000).目前, 我国基于分子技术对河流微生物开展的系统研究还十分有限, 且仅见于华北(董萍等, 2011)、华东(蔡林林等, 2012)、华南(Sun et al., 2014) 地区, 而对中西部黄土高原地区季节性河流的微生物生态状况的研究还鲜有报道.
渭河是黄河最大的支流, 地处中国中西部干旱半干旱区, 河流季节差异明显, 流域涉及世界上面积最大的黄土区--黄土高原, 是典型的季节性多泥沙河流.在自然地理环境上, 具有其独特的生态学研究意义.渭河干流陕西境内河段长502 km, 流域面积6.71万km2, 分别占渭河全长和总流域面积的61.4%和50.1%(司全印等, 2000).据陕西省统计局网上公报, 2015年渭河中下游地区(宝鸡、咸阳、铜川、西安、渭南)集中了陕西省62.9%的人口, 贡献了61.4%的粮食产量和53.8%的工业增加值, 是全省政治、经济、科技、文化发展的中心区域, 在国家西北地区的社会经济发展中具有重要的战略地位.由于气候变化和流域社会经济活动的影响, 渭河出现了径流锐减(Chang et al., 2014)、水质恶化、泥沙淤积、水土流失等生态环境问题(Wu et al., 2016), 成为了流域可持续发展不可忽视的制约因素.近10年来, 渭河的生态环境安全与健康问题日益受到重视, 但目前对渭河流域的研究多关注泥沙(Zhang et al., 2012)、水文(Zhao et al., 2016) 和水质(Jiake et al., 2011;Zhang et al., 2012), 而关于流域生物群落尤其微生物群落特征的认识还很匮乏.
因此, 本文采用T-rflp和高通量测序技术, 分析渭河(陕西段)及其重要支流的浮游细菌群落时空变化特性, 讨论微生物群落结构与关键环境因子的潜在关系, 这对于更好地认识和评估渭河(陕西段)水生态健康状况, 更有效地利用和保护渭河及相似河流的水环境资源具有非常重要的学术价值和实际意义.
2 材料与方法(Materials and methods) 2.1 样点布设及采样方法于2013年6月-2014年9月间的平水期(6月)、枯水期(12月)和丰水期(9月), 对渭河陕西段进行样品采集.采样点分布于渭河干流(上游至下游依次编号为W1~W6) , 以及渭河南北两岸的最大支流-黑河(编号H)和泾河(编号J).采样点地理位置见图 1.
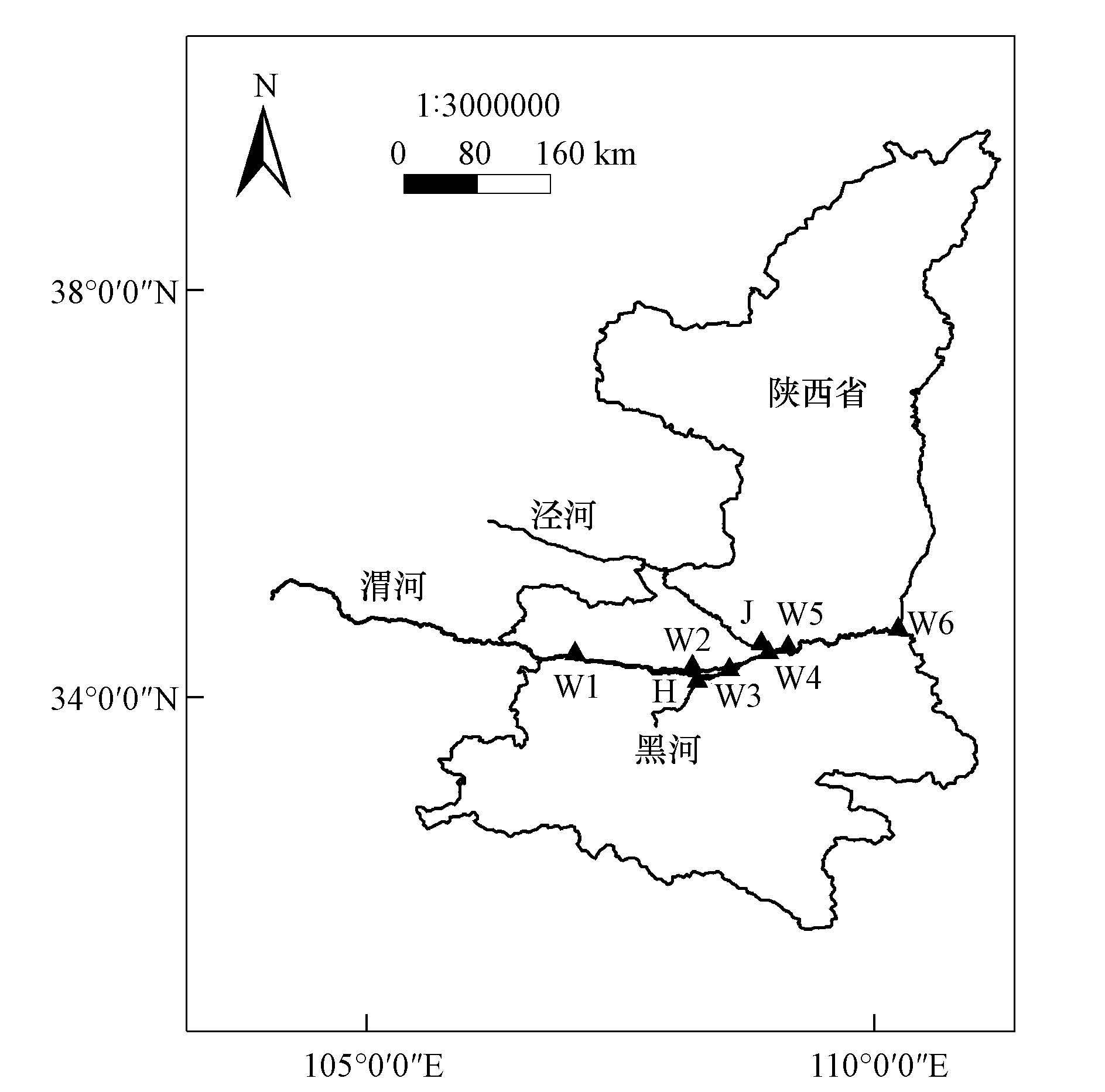 |
| 图 1 采样点地理位置分布 Fig. 1 Sampling sites of Weihe River |
水样用有机玻璃采水器于中泓垂线水面下0.5 m处采集, 分装于11个1 L灭菌聚乙烯细口瓶, 冰袋冷藏运输.运回到实验室后, 每个点位随机取3瓶水样于24 h内完成水质分析, 取均值作为最终结果.同时, 随机取3瓶以上水样适量混匀, 经0.2 μm滤膜过滤冻存于-20 ℃条件下, 尽快用于微生物分析.
2.2 理化指标分析方法使用水质多功能监测仪(HydrolabDS5X, HACH)现场测定河流水体pH、温度、浊度、DO、电导率、叶绿素a、蓝绿藻细胞数.采用国标法测定水样IMn(高锰酸盐指数)、CODCr、TN、TP、NH4+-N、NO3--N、NO2--N, 每个样本重复测定2次取均值作为结果.考虑到渭河含沙量较高(Zhang et al., 2012), IMn、CODCr、TN、TP 4个指标分别测定含颗粒悬浮物的原状水(混合态)和0.45 μm滤膜滤后水样(溶解态)两种状态.水样TOC采用德国耶拿TOC分析仪测定.
2.3 T-RFLP实验方法水体浮游细菌样品总DNA用E.Z.N.A. Water DNA Kit 基因组DNA提取试剂盒提取.细菌基因扩增使用通用引物27F(5′-GAGTTTGATCMTGG CTCAG-3′)/1492R(5′-GGTTACCTTGTTACGACTT-3′), 其中, 27F 5′端用6-羧基乙二酸荧光素(FAM)标记.采用50 μL PCR扩增体系:DNA模板10 μL, 2×Taq PCR Master Mix(天根公司)25 μL, 正反引物(赛百盛)各2 μL, ddH2O 11μL.扩增反应条件为:94 ℃预变性5 min; 94 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1.5 min, 30个循环;最后72 ℃延伸5 min;4 ℃保存.
用天根公司DNA产物纯化试剂盒(DP204-03) 对扩增产物进行纯化, 并采用20 μL酶切体系对纯化产物进行酶切:PCR纯化产物15 μL, 双蒸水2 μL, 10×M buffer 2 μL, 限制性内切酶HhaI (TaKaRa公司)1 μL.37 ℃培养箱放置2 h后, 70 ℃水浴15 min, 使酶失活.酶切产物避光寄送上海基康生物技术有限公司完成检测分析.
2.4 微生物数据统计方法T-RFLP实验结果采用美国爱达荷大学生物信息与进化研究院(Initiative for Bioinformatics and Evolutionary Studies, IBEST)2007年公开的微生物群落分析方法, 结合R语言、Primer软件完成微生物多样性统计.均匀度J、Shannon多样性指数H采用如下公式进行计算:

|
(1) |
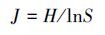
|
(2) |
式中, 物种数S为T-rflp结果分析得到的T-RF片段总数, 物种丰度Pi为各个片段的峰高占总峰高的比例.将T-RFLP分析结果中相对丰度大于5%的末端限制性片段(Terminal restrict fragment, T-RF)作为细菌群落的优势片段(王萃, 2013).
微生物群落结构与环境因子的相关关系通过Canoco 4.5结合SPSS进行分析.首先, 对T-RF片段相对丰度数据和标准化处理后的环境理化指标数据进行去趋势对应分析(DCA), 根据所得排序轴梯度长度, 选择采用典范对应分析(CCA)或冗余分析(RDA).然后依据环境因子影响程度的大小, 从27个候选指标中手动选出不存在共线性关系(O′Brien, 2007)的6个环境因子, 对渭河水体细菌群落中的优势T-RF片段进行约束性排序分析, 并对排序结果进行置换检验(499次).最后绘制出满足要求的水体优势细菌群落和关键环境驱动因子的三序图.汛期高通量测序分析由深圳华大Illumina MiSeq平台完成, 建库类型为16S rDNA V4 Amplicon 文库.
3 结果与讨论(Results and discussion) 3.1 渭河水体理化特性3期采样分析结果表明(表 1), 渭河(陕西段)水体理化特性具有明显的季节和空间差异.计算同季节各位点均值发现, 混合态有机物(IMn和CODCr)与TN含量为:丰水期>枯水期>平水期;混合态TP与TSS含量为:丰水期>平水期>枯水期;溶解态TOC和COD为:丰水期>枯水期>平水期;其它溶解态指标规律相反, 均呈现枯水期>平水期>丰水期的关系.在2011-2013年对渭河流域旱季和雨季的实测结果也呈现出相似的规律, 同时研究人员还发现, 雨季的水质同流域土地利用方式的相关系数低于旱季(Yu et al., 2016).渭河流域汛期径流带来了水体颗粒态有机物和氮磷的增加, 并进而提高了溶解态总有机物浓度, 但IMn、无机氮及溶解态TP的浓度并未随之升高.这一方面有赖于雨季水量增加后的物理稀释作用, 另一方面更反映出渭河水体在丰水期和平水期活跃的微生物活性.
| 表 1 渭河流域各采样点水质统计 Table 1 Water quality of Weihe Basin during the sampling time |
对渭河流域各样点的水质季节相对标准偏差计算均值, 可以看出, 未过滤水样的测值整体高于滤后水样, 说明颗粒物对渭河流域水质的季节变动具有重要影响.化学指标中, NH4+-N和滤前TP的季节变化最大, 平均季节变异系数分别为113.86%和111.76%;溶解态TN和NO3--N的季节变化最小, 平均季节变异系数分别为31.19%和24.70%.其中, 溶解态TN常年高于《地表水环境质量标准(GB3838-2002) 》中的Ⅴ类标准限值, 是流域内最主要的污染物.综合溶解态水质指标, 渭河干流平水期水质最优, 枯水期水质最差;考虑颗粒态物质浓度时, 干流各水质指标在汛期达到峰值.不同时期渭河水质的沿程变化趋势也存在差异.平水期和枯水期干流各类物质浓度呈现沿程增加的趋势, 并多在咸阳-西安段(W2~W5) 出现最高值;丰水期受上游来沙影响, 水质指标峰值多出现在W1点, 经上游河段显著削减后, 经西安段略有回升.
黑河水质全年优于邻近干流样点, 取样区多数水质指标保持在Ⅰ~Ⅱ类标准限值以内, 但TN常年处于或低于Ⅴ类浓度限值.泾河有机污染物, 尤其是难氧化的颗粒态有机污染物在平水和丰水期显著高于渭河干流邻近样点;TN和TP浓度仅在丰水期高于渭河干流.
3.2 浮游细菌群落多样性变化特征通过T-rflp技术, 在3个不同采样时期的渭河水体样本中共检出96种T-RF片段.其中, 半数以上的物种只在10%的样方中出现, 说明渭河水体细菌群落构成的季节和空间异质性较大.基于T-rflp分析结果, 3次采样期内渭河干流物种数S在12~24之间, 均匀度J在0.77~0.95之间, Shannon多样性指数H在2.05~2.91之间.黑河与泾河的测值同渭河干流之间的相对关系随季节变化.平水期黑河水体细菌物种数和多样性高于渭河干流邻近样点, 枯水期和丰水期低于干流邻近样点, 泾河的情况恰好相反.这是由于泾河在汛期接受北方黄土高原的来沙, 水质状况同渭河干流相似, 丰水期和枯水期的细菌群落多样性也相似;黑河在丰水期接受秦岭山北麓山区来水, 相对渭河干流与泾河水体营养物质含量很低, 因此, 雨季和紧随其后的枯水期细菌种类及多样性都较低.而在受汛期影响最小, 流域水质空间差异最低的汛前平水期, 泾河水体细菌多样性远低于黑河, 反映出工业和生活污染对泾河水体生态环境的影响(王菊翠等, 2012).
渭河流域不同水文期水体浮游细菌物种数S、均匀度J和多样性指数H趋势基本一致.Shannon多样性指数沿程变化如图 2所示.平水期和枯水期细菌群落物种数、均匀度和多样性指数的空间差异高于丰水期.枯水期和平水期多样性指数的变化都表现出上游河段逐渐增加, 到西安段(W3、W4、W5) 下降, 至下游又逐步回升的趋势.渭河干流咸阳-西安段是关中地区人口和产业最密集的区域, 城市排污及泾河等支流的汇入是该河段细菌多样性下降的主要原因(Zhang et al., 2012;Yu et al., 2016).在对2000-2008年渭河水质状况的研究中, 有研究者通过DO变化趋势, 推测渭河水生生物群落在下游河段开始恢复(Li et al., 2011).本文的微生物多样性数据为此观点提供了直接的支持.
 |
| 图 2 不同水文期渭河流域浮游细菌群落多样性沿程变化 (图中H为黑河样点, J为泾河样点; a.平水期;b.枯水期;c.丰水期) Fig. 2 Spatial variation of bacterial community diversity in Weihe River water column between different hydrological periods (H indicates site on Heihe River, J indicates site on Jinghe River; a. Normal, b. dry, c. wet) |
采用Bray-Curtis算法(Quaak et al., 2011)对不同水文期间的渭河流域浮游细菌群落进行相似性聚类分析, 并通过distance-decay的方法评估不同时期幂函数模型中的z值(Horner Devine et al., 2004).聚类分析结果呈现出按照不同季节分别聚类的形态(图 3), 说明渭河流域浮游细菌群落的季节性差异比空间差异更加显著.流域内浮游细菌群落Bray-Curtis相似性系数均值大小关系为:丰水期(62.6%)>枯水期(30.1%)>平水期(26.8%), distance-decay的z值大小关系为:丰水期(0.1086) <枯水期(0.1780) <平水期(0.2038) , 均表明丰水期渭河水体细菌群落空间差异最小, 平水期空间异质性最大.
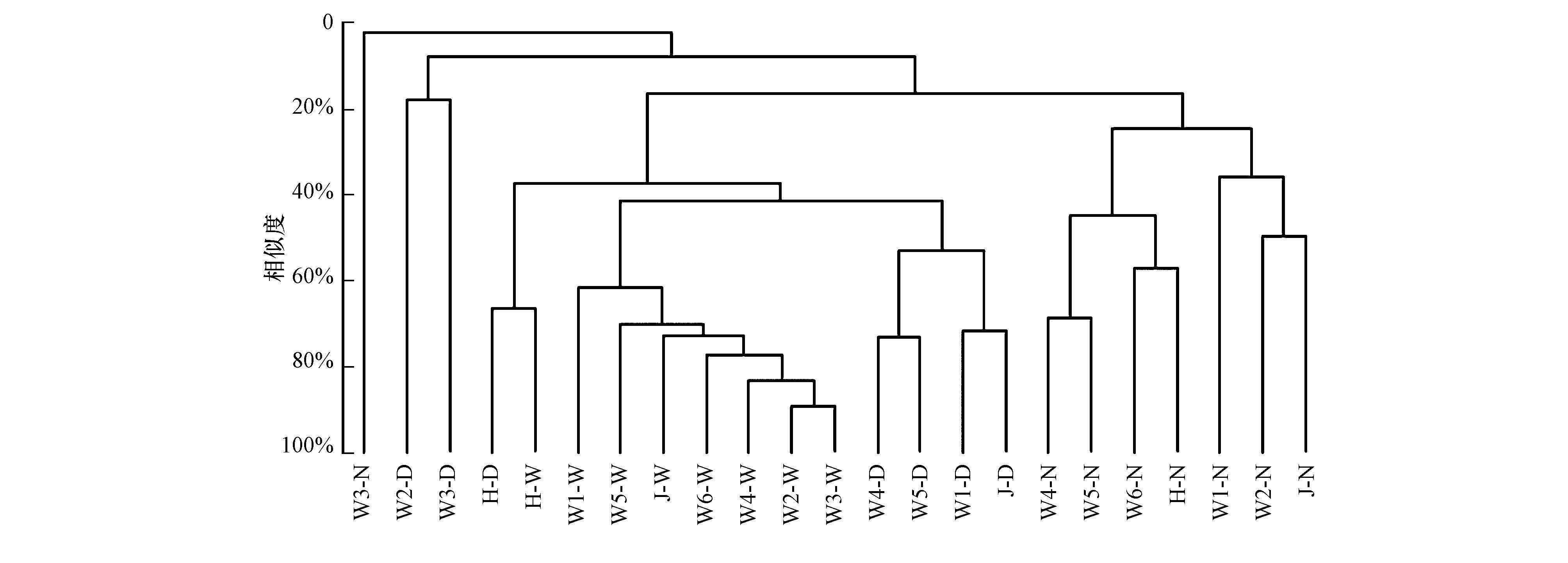 |
| 图 3 不同水文时期渭河流域浮游细菌群落结构聚类关系图 (N: 平水期, D: 枯水期, W: 丰水期) Fig. 3 Similarity clustering of bacteria communities in water column of Weihe River (N: Normal, D: Dry, W: Wet) |
平水期渭河干流W1、W2、W3位点的浮游细菌群落Bray-Curtis相似度指数大多低于10%, 而W4与W5、W5与W6样点的相似度分别达到68.6%和51.5%, 表明渭河干流浮游细菌群落自上游到下游空间差异逐渐减小, 丰富种构成逐渐趋于一致.枯水期渭河干流W4、W5与泾河J这3个样点之间的浮游细菌群落Bray-Curtis相似性系数均高于49.5%, W4与W5之间的相似性达到72.8%, 这3个样点所在的西安段是枯水期期渭河流域内浮游细菌群落结构空间差异最小的区域.W2与W3点同其它各点位浮游细菌群落之间的相似性指数分别均低于20%, 是同期渭河流域中微生物结构最特殊的2个点位.3个采样期中, 丰水期渭河各点位浮游细菌群落相似性最高, 除黑河测点外的各点位Bray-Curtis相似性系数均高于55%, 这可能同汛期水体悬浮泥沙带入了相似的外部生物信息有较大的关系.
计算渭河流域各样点浮游细菌群落结构的季节Bray-Curtis相似性系数均值, 干流各点位中, 咸阳段位点季节相似度最低(W2样点13.5%, W3样点5.5%), 浮游细菌群落的季节变化最为明显;西安段相似度最高, 浮游细菌群落季节差异相对最小(W4样点31.8%, W5样点33.1%).支流中, 泾河(季节相似度15.0%)的悬浮物细菌群落季节变化高于黑河(季节相似度30.9%).
3.4 浮游细菌优势T-RF片段在3个采样季节的所有水体样本里, 共发现优势细菌T-RF片段137条47种(图 4).78 bp和205 bp优势T-RF片段的检出频率最高, 分别被检出13次和14次.其中, 78 bp片断在W1和H测点的3个采样季节里都有检出, 是这2个位点的多季节优势片段, 且在枯水期和丰水期的黑河测点浮游细菌中的相对丰度分别达到36.4%和40.6%, 优势地位显著;205 bp优势T-RF片段是W4和W5测点的多季节优势片段, 且在平水期W4浮游细菌样品中的相对丰度超过33%.
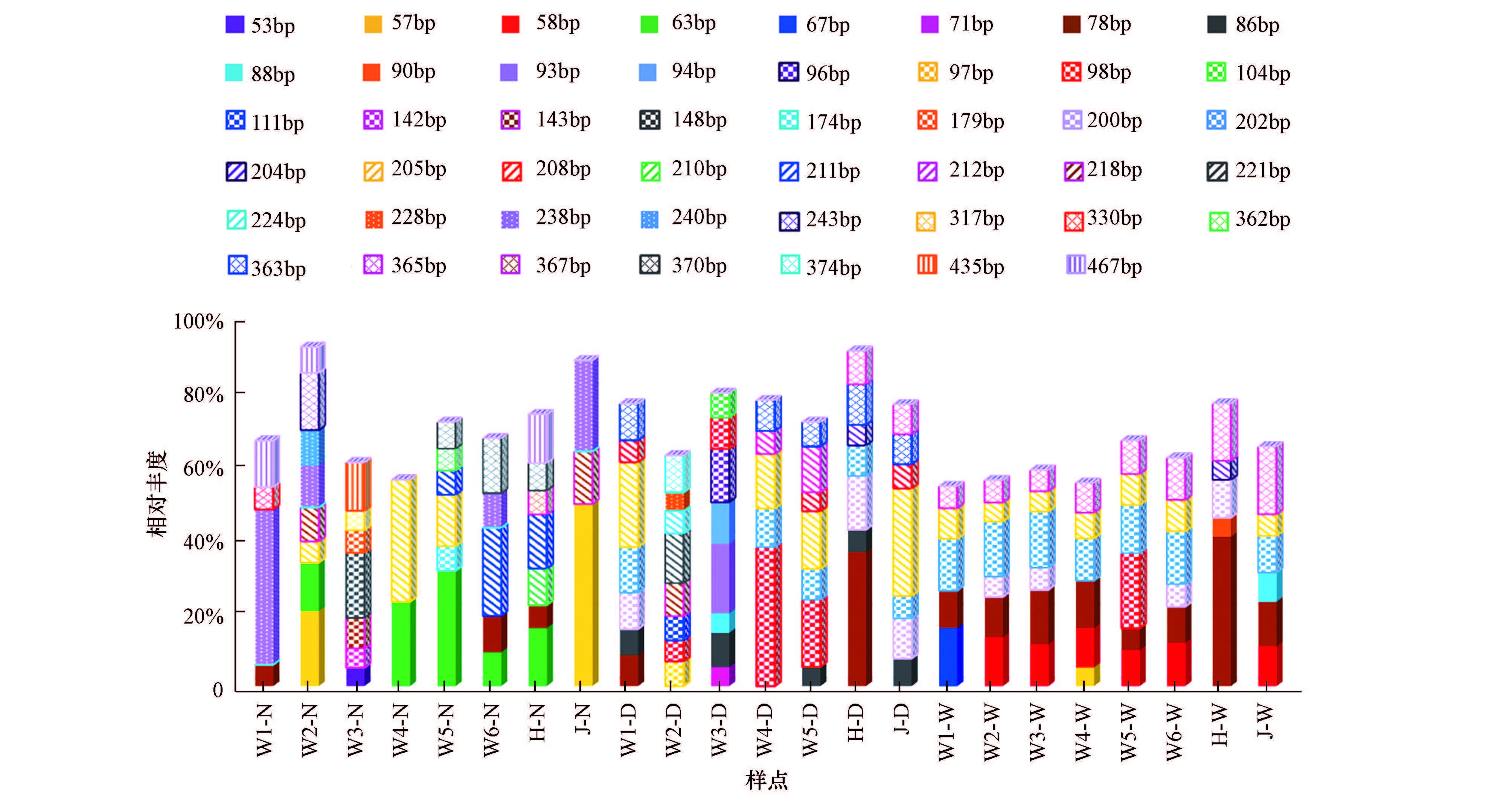 |
| 图 4 渭河浮游细菌群落优势T-RF片段相对丰度 (N: 平水期, D: 枯水期, W: 丰水期) Fig. 4 Relative abundance of bacteria T-RF of Weihe River in water column (N: Normal, D: Dry, W: Wet) |
平水期检出的23种渭河浮游细菌优势T-RF片段中, 有19种未出现在其它采样期的优势菌群中.其中, 63 bp优势T-RF片断在5个位点中被检出, 是渭河流域普遍存在的平水期特有优势种.同期, W2位点检测到8种优势T-RF片段, 在流域各样点中优势片段种类数最多.W4与J位点于平水期检出的优势T-RF片段种类数在全流域内最少, 分别为2种和3种, 即这2个位点的浮游细菌优势群落菌种比较单一.相应的, 在优势片段数量较少的点位, 优势片段的相对丰度较高.63 bp和205 bp优势下T-RF片断在W4点的相对丰度分别达到了23%和33.06%, 57 bp和238 bp优势T-RF片断在J位点的相对丰度分别为49.46%和24.82%, 这些特征片段指示的优势菌种, 在相应位点的浮游细菌群落中数量优势明显.
枯水期浮游细菌样本中共检出24种优势T-RF片段, 其中, 15种为季节特有优势片段, 季节特有优势片段占比较平水期有所降低.86 bp和363 bp优势T-RF片断在不同位点中均被检出过5次, 是渭河枯水期普遍存在的特有优势浮游细菌菌种.流域各采样点的浮游细菌优势T-RF片段数量在枯水期空间差异不大, 除W4点只有5种优势片断外, 其余各位点均为7~8种, 即枯水期渭河浮游细菌优势群落菌种构成比平水期更为丰富.W2和W3位点浮游细菌群落的优势T-RF片段中, 有75%为枯水期特有优势片段, 在流域所有样点中, 季节特有优势T-RF占比最高.结合平水期分析结果可以看出, W3位点浮游细菌群落优势菌种的季节变化程度最大, 对季节变化最为敏感.
丰水期渭河流域检出的浮游细菌优势T-RF片段种类数最低, 仅12种, 其中, 季节特有优势片段3种, 分别为58、67和90 bp片断.各位点检出的浮游细菌优势T-RF片段均为5~6种, 且每个位点都有1个丰水期特有的优势片段.78 bp和365 bp片断是丰水期渭河流域所有样点共有的浮游细菌优势T-RF片段, 202 bp和205 bp片断是除H测点之外的所有测点共有的浮游细菌优势T-RF片段, 58 bp片断在除W1和H测点之外的其余测点的优势片段统计结果中均有出现.由此可见, 丰水期渭河流域不同点位浮游细菌优势群落的构成较其它2个采样期更为相似.
3.5 水体细菌群落的关键环境影响因子识别渭河是典型的季节性河流, 水量和水质都呈现季节性的变化(Li et al., 2011).基于这一特点, 本文对不同采样期的数据分别进行多维排序分析, 以识别不同季节和水文条件下影响细菌群落的关键环境因子.
平水期渭河流域水体优势细菌群落和环境理化指标的CCA分析表明(图 5), pH、水温(Temp)、溶解态总磷(DTP)、悬浮颗粒物浓度(TSS)、藻细胞数(PCY)和溶解态碳氮比(DC/DN)与全部排序轴呈显著相关关系(p=0.03 < 0.05) .排序空间前4轴累计解释了81%的物种方差和85.9%的物种-环境方差.pH与第二排序轴显著正相关(相关系数0.9429) , 溶解性TP和PCY与第三排序轴显著正相关(相关系数为0.7148和0.8071) , 是优势菌群结构变化在排序空间的良好解释变量.205 bp片段是平水期渭河流域检出率最高的优势片段之一, 其相对丰度与水体DTP显著正相关, 相关系数达到0.900(p=0.002) , 是水体DTP的潜在指示菌群.pH与57、218 bp片段相对丰度呈显著正相关, 相关系数分别为0.800(p=0.017) 和0.717(p=0.045) ;而与370 bp片段相对丰度呈显著负相关, 相关系数为-0.714(p=0.046) .作为决定地表水细菌群落结构的关键因子, pH一方面可以直接影响细菌的生长状况, 另一方面也可以通过改变水体理化因子影响细菌群落结构和多样性(任丽娟等, 2013).PCY与78、330 bp片段相对丰度显著负相关, 相关系数分别为-0.792(p=0.019) 和-0.880(p=0.004) , 而与218 bp片段相对丰度显著正相关, 相关系数为0.728(p=0.041) .对湖泊(冯胜等, 2010;吕明姬等, 2011)和海洋(李祎等, 2012)微生物群落的研究均表明, 细菌与藻类之间存在相关关系.浮游植物的分泌物及残体可以为细菌提供营养物质, 而藻-共栖细菌系统对部分菌群可能存在抑制作用(林伟, 2005).210 bp和367 bp片段的相对丰度与溶解态碳氮比显著正相关, 相关系数均为0.964(p=0.000) .同长江河口(C/N=9~10) 、密西西比河(C/N=7~12) 等河流相比(赵军, 2011), 渭河水体氮污染严重且C/N比较低, 采样分析结果均在5以下.而相关研究结果表明, 在C/N比低于10~25的范围内, 环境中的C/N比与氨氧化细菌、nirK基因型反硝化细菌、芽孢杆菌、乳酸菌等微生物(王晓辉等, 2013;李静等, 2015;高磊等, 2013)的相对丰度及代谢活性呈正相关关系.
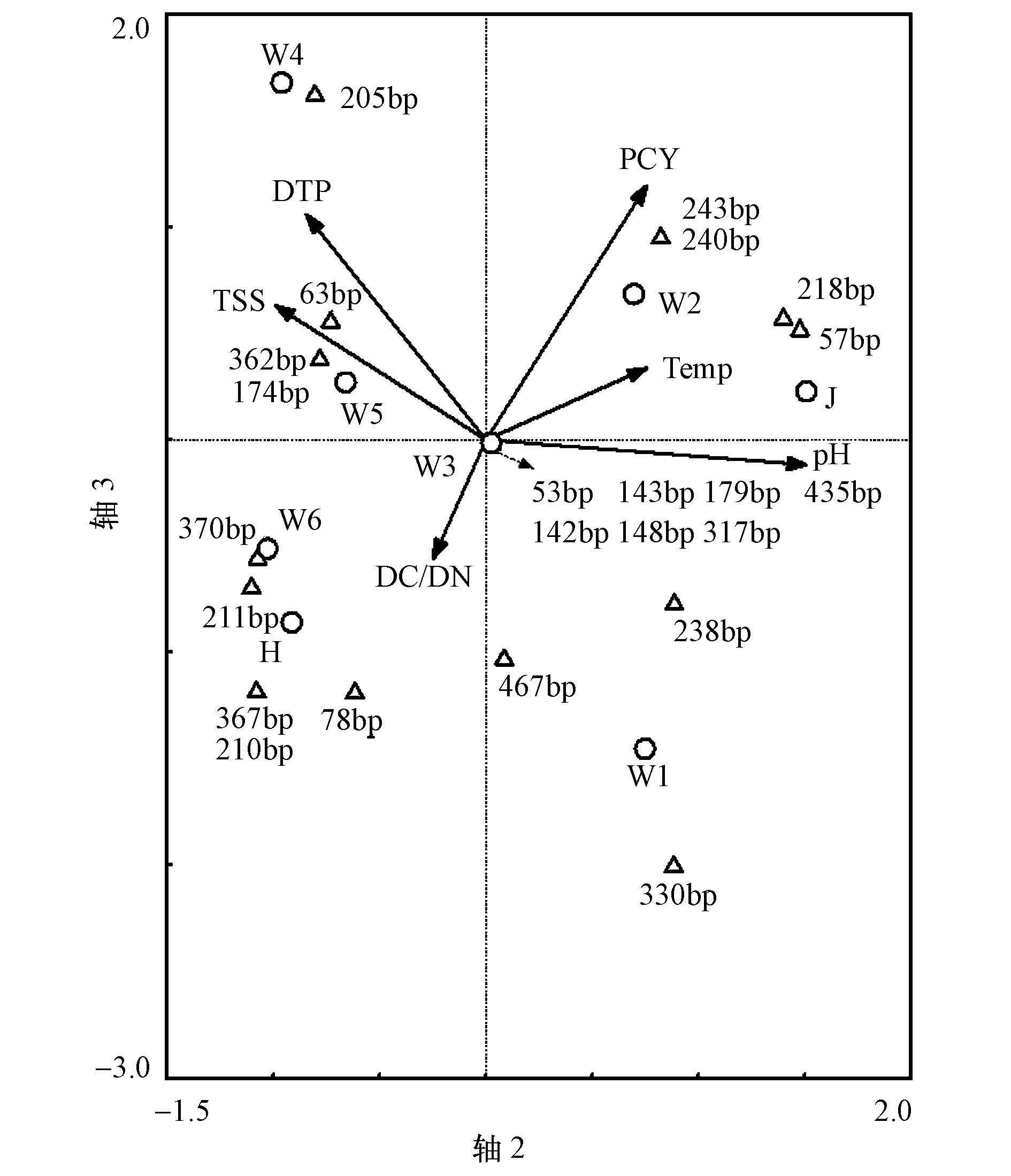 |
| 图 5 平水期渭河浮游细菌优势菌群与关键环境驱动因子的CCA三序图 Fig. 5 CCA triplot of samples, T-RFs and environmental factors of Weihe River in normal seasons |
枯水期渭河流域水体优势细菌群落变化可以用溶解态亚硝酸盐氮(NO2--N)、电导率(SpCond)、TSS、溶解态TP和原状水碳氮比(C/N)共同构成的CCA排序空间进行描述(p=0.0380<0.05) , 空间前4轴对物种变化的解释度为93.6%(图 6).溶解性NO2--N与78、200、204 bp片段相对丰度呈显著负相关关系, 相关系数分别为-0.888(p=0.008) 、-0.825(p=0.022) 和-0.841(p=0.018) .其中, 78 bp和200 bp片段在渭河多个样点中均有检出, 但以黑河样点的相对丰度最高, 而204 bp片段仅在黑河样点出现.结合水质分析结果, 黑河亚硝酸盐浓度最低, 微生物群落受到亚硝酸盐累积的影响最小.上述3个片段所代表的微生物类群是水体氮污染及低温亚硝酸盐累积的潜在指示菌群.溶解态TP与98 bp片段相对丰度显著正相关, 相关系数0.951(p=0.001) .98 bp片段在除渭河上游W1和黑河H测点外的其余各样点均有检出, 且在西安W4点位的相对丰度最高, 表征了人为活动带来的含磷物质对水体微生物生态造成的影响.电导率受到水温和溶质盐含量的影响, 冬季渭河水体中的优势片段(205 bp和208 bp)相对丰度与电导率呈显著正相关, 相关系数分别为0.829(p=0.021) 和0.834(p=0.020) , 说明溶解性营养盐对低温水体中的部分优势菌群具有积极影响.
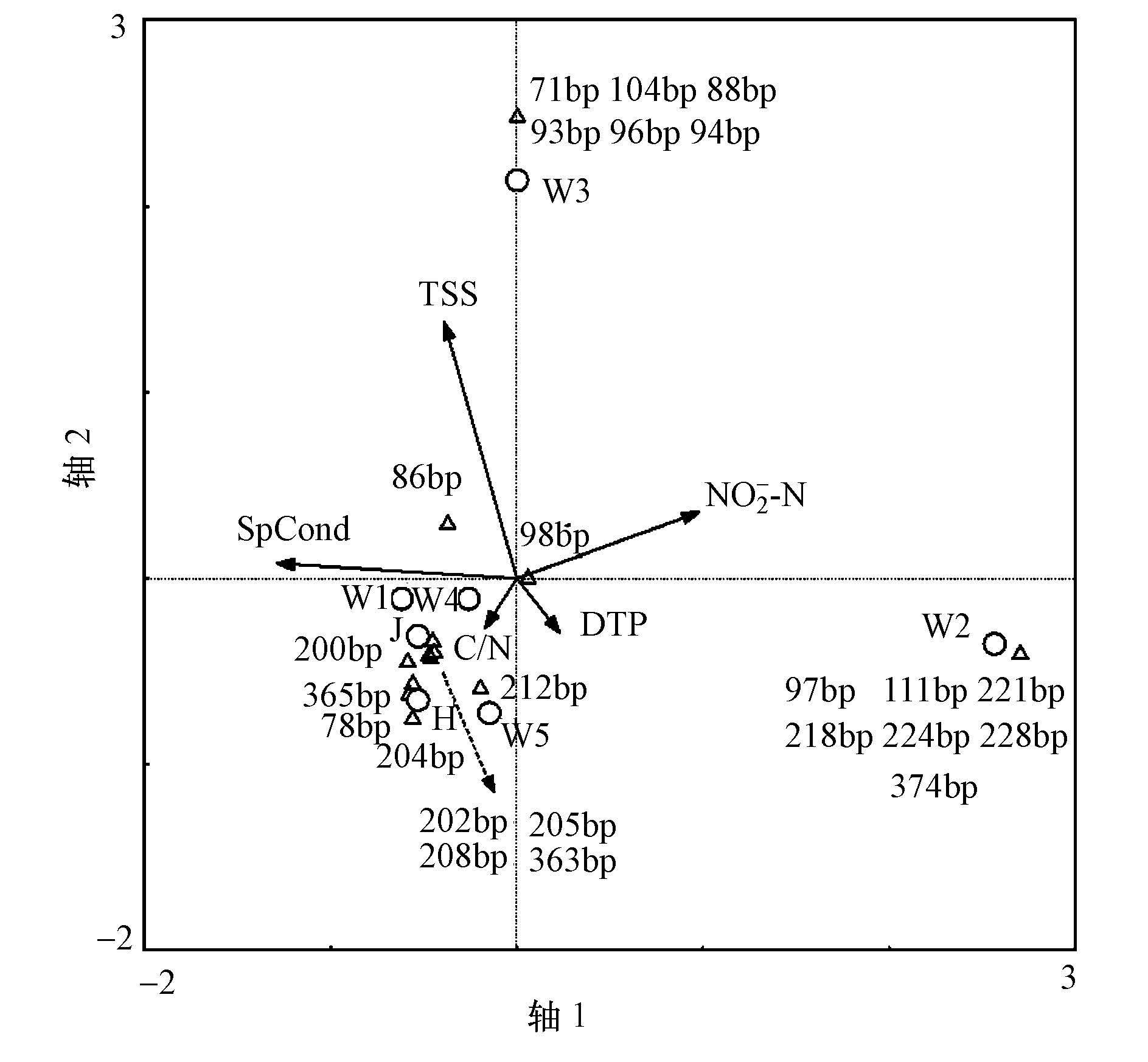 |
| 图 6 枯水期渭河浮游细菌优势菌群与关键环境驱动因子的CCA三序图 Fig. 6 CCA triplot of samples, T-RFs and environmental factors of Weihe River in dry seasons |
丰水期渭河水体水质和物种数据空间变化梯度较小, 采用RDA分析, 得出对渭河水体细菌群落变化解释度最高(前4轴解释度98.3%, p=0.006<0.05) 的环境因子组合为氮磷比(N/P)、溶解态NH4+-N、TSS、pH、溶解态碳氮比(DC/DN)和PCY(图 7).含沙水体氮磷比与第一排序轴的相关系数为0.9242, 表征了汛期随外源颗粒物进入河流的含氮含磷物质对水体微生物群落带来的重要影响.相关性统计分析得出, 氮磷比与细菌群落多样性显著负相关(r=-0.882, p=0.004) ;与优势片段(202 bp和205 bp)相对丰度显著负相关, 相关系数分别为-0.822(p=0.012) 和-0.850(p=0.008) ;且同时与优势片段(78 bp、200 bp)相对丰度显著正相关, 相关系数分别为0.929(p=0.001) 和0.871(p=0.005) .水质监测数据表明, 渭河水体混合态N/P比流域均值由非汛期的17.0~30.7下降为汛期的1.7, 溶解态N/P比流域均值由100.5~109.5下降为汛期的61.5, 更加接近微生物理论营养需求N/P比5∶1(顾夏声, 1998), 对部分优势菌的生长和整体细菌群落多样性的提升具有促进作用.98 bp片段相对丰度与NH4+-N浓度呈显著正相关关系, 相关系数为0.956(p=0.000) , 是汛期潜在的氨氮指示菌群.pH对88 bp优势片段指示的菌群具有积极影响(r=0.950, p=0.000) , 而对90 bp优势片段指示的菌群具有抑制作用(r=-0.721, p=0.044) .溶解态C/N比与88 bp片段相对丰度呈显著正相关(r=0.897, p=0.003) , 与90 bp片段相对丰度显著负相关(r=-0.752, p=0.031) .结合平水期和丰水期的分析可以看出, 相对单一的有机物指标, 细菌群落对水体C/N比的响应关系更为显著.
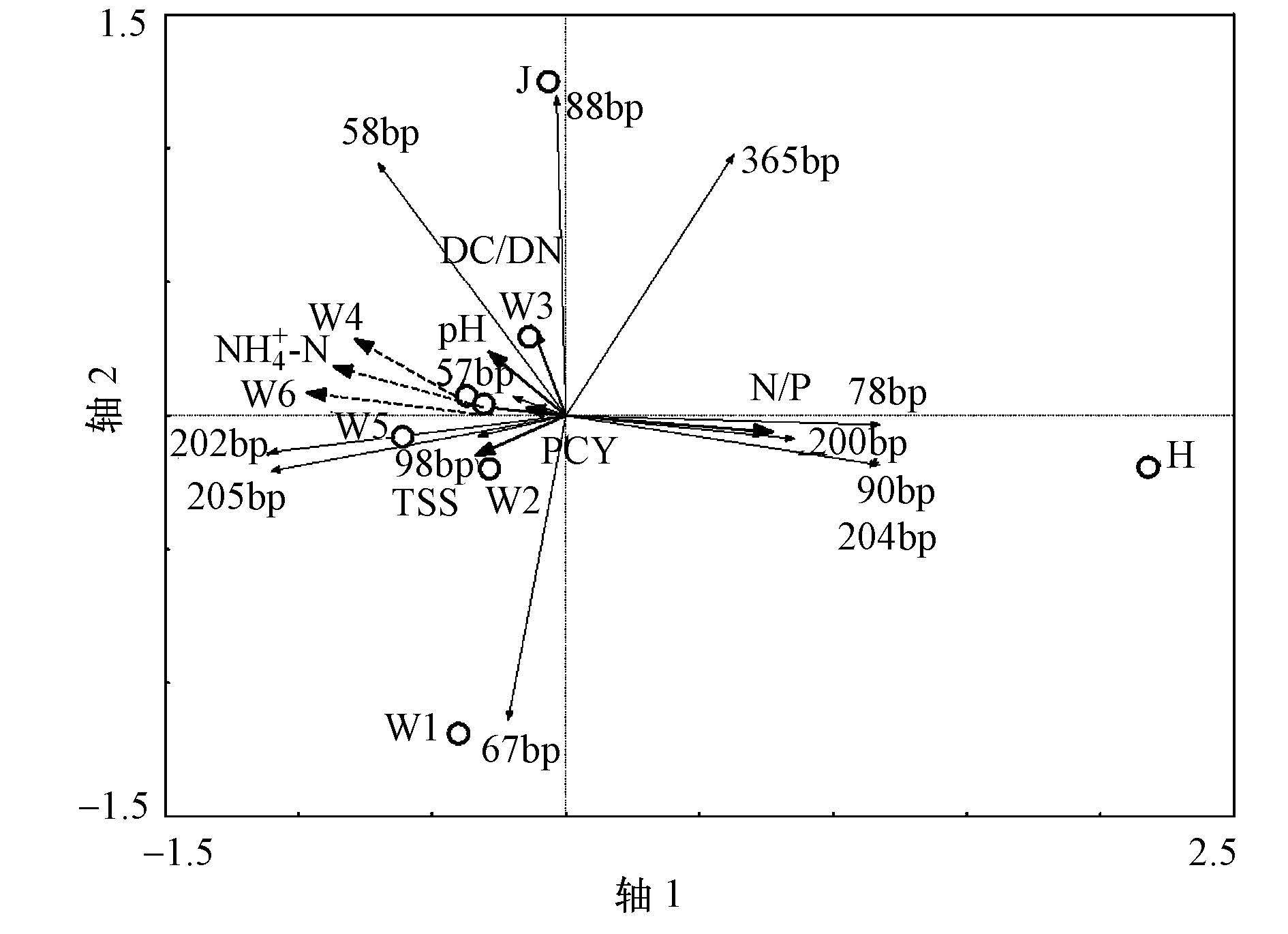 |
| 图 7 丰水期渭河浮游细菌优势菌群与关键环境驱动因子的RDA三序图 Fig. 7 RDA triplot of samples, T-RFs and environmental factors of Weihe River in wet seasons |
渭河流域水体中的TSS是不同采样期共同的环境驱动因子.通过偏分析得出, 平水期、枯水期和丰水期剔除其它理化指标的影响, 可以由TSS单独解释的细菌群落变化量分别为12.5%、23.52%和9.4%.在悬浮颗粒物浓度最低的枯水期, 细菌群落对颗粒物含量最敏感;而悬浮泥沙含量整体较高的汛期, 微生物群落的空间变化对TSS的响应相对较弱.水体TSS在平水期与渭河下游优势片段(174 bp)的相对丰度显著正相关, 相关系数为0.724(p=0.042) ;丰水期与渭河上游优势片段(67 bp)相对丰度显著正相关, 相关系数为0.807(p=0.015) .汛期及非汛期通过地表径流、雨水冲刷、大气沉降等方式进入河流的颗粒物, 在增加水体化学物质含量的同时, 也将陆地和大气中的生物信息带入水体, 并成为物质转化的媒介和微生物生长的载体, 不可避免地对河流中的微生物群落结构和多样性产生多重影响.
3.6 汛期渭河浮游细菌物种构成高通量测序结果表明, 丰水期渭河浮游细菌物种覆盖到了21个已知细菌门类和26个候选门类(图 8).变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)在渭河干流与两个支流各样点浮游细菌群落中的相对丰度分别达到了46%和27%以上, 是最主要的微生物类群.变形菌门下分的α、β、γ、δ、ε 5个变形菌纲在渭河流域的各个样点中均有检出, 其中, β-变形菌纲(Betaproteobacteria)在不同位点的相对丰度介于22.91%~36.93%之间, 是变形菌门中最重要的类群.此外, 渭河干流样点里相对丰度高于5%的纲水平细菌类群还包括:γ-变形菌纲(Gammaproteobacteria), 干流相对丰度为26.14%~29.19%;黄杆菌纲(Flavobacteriia), 干流相对丰度为5.76%~13.95%;鞘脂杆菌纲(Sphingobacteriia), 干流相对丰度为5.17%~9.58%;以及δ-变形菌纲(Deltaproteobacteria), 干流相对丰度为4.99%~6.09%.在不同地区的淡水湖泊与河流中, β-变形菌纲通常在变形菌门处于优势地位, 而α-变形菌纲和γ-变形菌纲的丰度和相对关系变动很大(Huang et al., 2011;Eiler et al., 2004;Liu et al., 2006).δ-变形菌纲和-变形菌纲虽然在其它地区的河流和湖泊也有检出, 但丰度水平通常较低, 与渭河干流相当的, 仅见于对巴西巴拿马河上游洪泛区水体中的研究(Lemke et al., 2009).
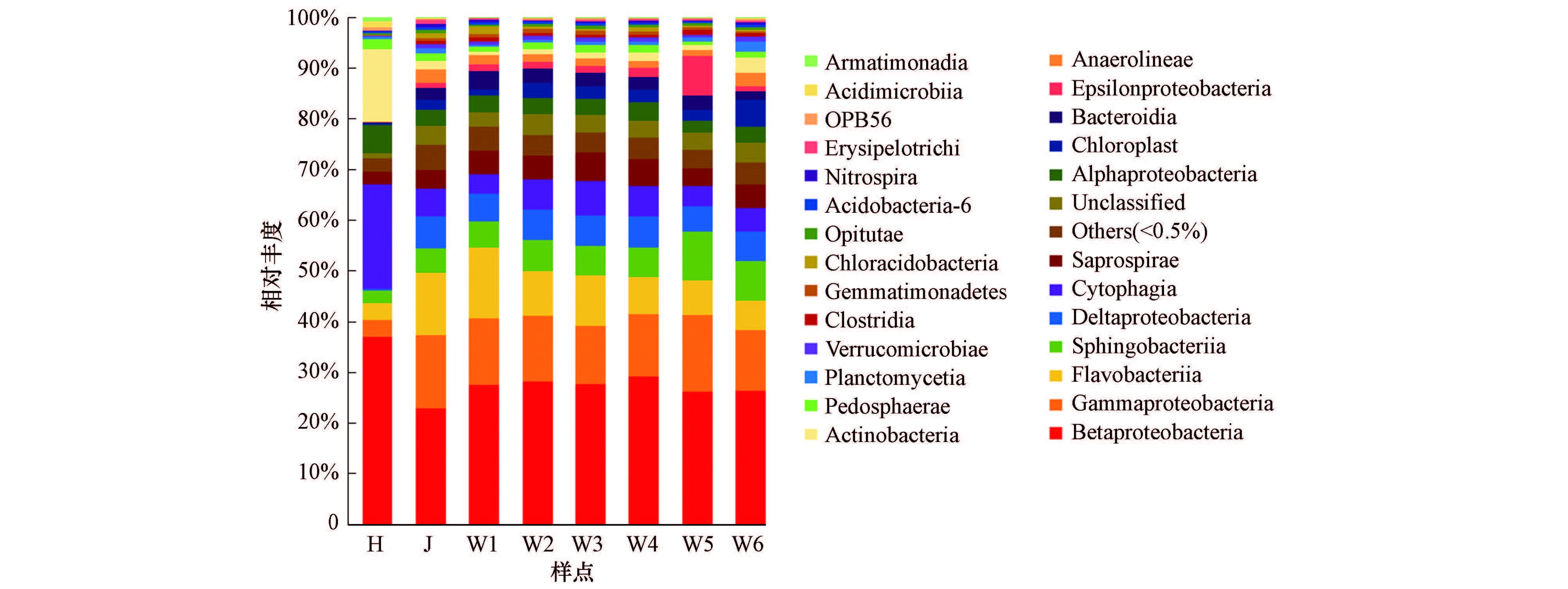 |
| 图 8 渭河流域各样点汛期水体细菌群落物种构成(纲水平) Fig. 8 Bacterial community of Weihe Basin in flood season (Class level) |
汛期渭河干流浮游细菌群落结构同泾河相似, 而与黑河存在明显差异.具体表现为γ-变形菌纲(Gammaproteobacteria)、黄杆菌纲(Flavobacteriia)、鞘脂杆菌纲(Sphingobacteriia)、δ-变形菌纲(Deltaproteobacteria)、-变形菌纲(Epsilonproteobacteria)等微生物类群的相对丰度在干流高于黑河, 而β-变形菌纲(Betaproteobacteria)、纤维粘网菌(Cytophagia)、α-变形菌纲(Alphaproteobacteria)、放线菌纲(Actinobacteria)、酸微菌纲(Acidimicrobiia)等微生物类群的相对丰度在干流低于黑河.由于流域上游黄土高原区土壤侵蚀严重, 汛期渭河干流与泾河泥沙含量倍增, 实测TSS浓度在2.3~16.3 g·L-1之间, 而黑河仅为0.12 g·L-1.结合前述TSS对微生物群落变化的影响可以推断, 丰水期渭河与泾河浮游细菌物种构成的高度一致性, 以及它们与黑河的显著差异性, 同汛期外源颗粒物的输入紧密相关.
渭河干流各样点浮游细菌群落的鉴定结果中, 在属水平(Genus)上还未能确定分类的物种丰度占比约60%左右.黑河样点属未定的物种丰度占比高达81.9%.说明渭河流域水环境中存在很多新的未知物种, 微生物信息资源丰富.
4 结论(Conclusions)1) 渭河陕西段水体浮游细菌群落多样性丰富, 并随不同水文时期发生明显的群落演替.干流细菌群落Shannon多样性指数在2.05~2.91之间, 丰水期多样性指数最高.细菌群落结构的空间差异在平水期最大, 丰水期最小.咸阳-西安段人口密集区的城市排污及泾河等支流的汇入, 使渭河中游水体优势菌群结构趋于单一化, 多样性指数下降, 在冬季枯水期尤为明显.冬季的低温环境虽然抑制了渭河流域浮游微生物整体的代谢活性, 但细菌群落的物种数和多样性与夏季平水期相比并没有显著降低.结合不同季节里渭河中下游微生物群落物种数和多样性发生回升的趋势, 可以推断渭河水体具有较强的微生物活性和自我修复潜力.
2) CCA和RDA分析表明, 不同季节影响渭河流域浮游细菌群落的关键环境因子存在差异也具有共性.TSS、溶解态TP和C/N比是渭河流域浮游细菌群落变化的长期驱动因子, 其中, TSS在平水期、枯水期和丰水期可以分别单独解释12.5%、23.52%和9.4%的细菌群落变化量.考虑到悬浮颗粒物通过影响河流水体理化因子对微生物细菌群落结构存在的间接影响, TSS对季节性高泥沙河流的微生物生态环境的作用不容忽视.
3) 高通量分析结果表明, 汛期渭河多泥沙水体中最主要的细菌类群从属于变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes), 变形菌门中又以β-变形菌纲(Betaproteobacteria)的相对丰度最高.汛期渭河干流细菌群落的趋同, 以及与支流之间表现出的物种差异, 与外源颗粒物的输入紧密相关.其中,具体影响机制和演化趋势, 尚有待更长期的监测及进一步的针对性实验研究进行讨论和分析.
致谢: 感谢北京大学环境学院谢曙光老师对本研究中分子微生物实验方法的指导.| [${referVo.labelOrder}] | Cébron A, Garnier J. 2005. Nitrobacter and Nitrospira genera as representatives ofnitrite-oxidizing bacteria:Detection, quantification andgrowth along the lower Seine River (France)[J]. Water Research, 39(20) : 4979–4992. DOI:10.1016/j.watres.2005.10.006 |
| [${referVo.labelOrder}] | 蔡林林, 周巧红, 王川, 等. 2012. 南淝河细菌群落结构的研究[J]. 环境科学与技术, 2012, 35(3) : 1–6. |
| [${referVo.labelOrder}] | Chang J X, Wang Y M, Istanbulluoglu E, et al. 2015. Impact of climate change and human activities on runoff in the Weihe River Basin, China[J]. Quaternary International, 380-381 : 169–179. DOI:10.1016/j.quaint.2014.03.048 |
| [${referVo.labelOrder}] | Crump B C, Kling G W, Bahr M, et al. 2003. Bacterioplankton community shifts in an Arctic Lake correlate with seasonal changes in organic matter source[J]. Applied And Environmental Microbiology, 69(4) : 2253–2268. DOI:10.1128/AEM.69.4.2253-2268.2003 |
| [${referVo.labelOrder}] | 董萍, 孙寓姣, 王红旗, 等. 2011. 利用T-RFLP技术对温榆河微生物群落结构研究[J]. 中国环境科学, 2011, 31(4) : 631–636. |
| [${referVo.labelOrder}] | Eiler A, Bertilsson S. 2004. Composition of freshwater bacterial communities associated with cyanobacterial blooms in four Swedish lakes[J]. Environmental Microbiology, 6(12) : 1228–1243. DOI:10.1111/emi.2004.6.issue-12 |
| [${referVo.labelOrder}] | 冯胜, 李定龙, 秦伯强. 2010. 太湖水华过程中微生物群落的动态变化[J]. 宁波大学学报(理工版), 2010, 23(1) : 7–12. |
| [${referVo.labelOrder}] | 高磊, 包卫洋, 张天文, 等. 2013. 水体碳氮比对芽孢杆菌、乳酸菌与弧菌生长、拮抗作用及菌体碳氮比的影响[J]. 中国海洋大学学报, 2013, 43(1) : 34–40. |
| [${referVo.labelOrder}] | Harnisz M, Gołaś I, Pietruk M. 2011. Tetracycline-resistant bacteria as indicators of antimicrobial resistance in protected waters-The example of the Drweca River Nature Reserve (Poland)[J]. Ecological Indicators, 11(2) : 663–668. DOI:10.1016/j.ecolind.2010.09.005 |
| [${referVo.labelOrder}] | Horner Devine M C, Lage M, Hughes J B, et al. 2005. A taxa-area relationship for bacteria[J]. Nature, 432(7018) : 750–753. |
| [${referVo.labelOrder}] | Huang Y, Zou L, Zhang S Y, et al. 2011. Comparison of bacterioplankton communities in three heavily polluted streams in China[J]. Biomed Environ Sci, 24(2) : 140–145. |
| [${referVo.labelOrder}] | Juan J, Miguel A, Antonio V, et al. 1987. Coliphages as an indicator of faecal pollution in water[J]. Its relationship with indicator and pathogenic microorganisms[J].Water Research, 21(12) : 1473–1480. |
| [${referVo.labelOrder}] | Lemke M J, Lienau E K, Rothe J, et al. 2009. Description of freshwater bacterial assemblages from the upper Paraná River floodpulse system, Brazil[J]. Microbial Ecology, 57(1) : 94–103. DOI:10.1007/s00248-008-9398-3 |
| [${referVo.labelOrder}] | Jiake L I, Huaien L I, Bing S, et al. 2011. Effect of non-point source pollution on water quality of the Weihe River[J]. International Journal of Sediment Research, 26(1) : 50–61. DOI:10.1016/S1001-6279(11)60075-9 |
| [${referVo.labelOrder}] | 李静, 陈芝兰, 李小卫. 2015. 西藏湿地生态系统中氮循环微生物数量和多样性研究[J]. 西藏科技, 2015(4) : 70–72,78. |
| [${referVo.labelOrder}] | 李祎, 杨彩云, 李东, 等. 2012. 厦门海域2011年中肋骨条藻和血红哈卡藻赤潮期间细菌群落结构变化[J]. 微生物学报, 2012, 52(10) : 1268–1281. |
| [${referVo.labelOrder}] | 林伟.2005.海洋微藻与细菌相互关系的研究-正负相互作用的几个例证[D].青岛:中国科学院海洋研究所.1-2 |
| [${referVo.labelOrder}] | Lindstrom E S. 2000. Bacterioplankton community composition in five lakes differing in trophic status and humic content[J]. Microbial Ecology, 40(2) : 104–113. |
| [${referVo.labelOrder}] | Liu Y Q, Yao T D, Jiao N Z, et al. 2006. Microbial community structure in moraine lakes and glacial meltwaters, mount everest[J]. FEMS Microbiology Letters, 265(1) : 98–105. DOI:10.1111/fml.2006.265.issue-1 |
| [${referVo.labelOrder}] | 吕明姬, 汪杰, 范铮, 等. 2011. 滇池浮游细菌群落组成的空间分布特征及其与环境因子的关系[J]. 环境科学学报, 2011, 31(2) : 299–306. |
| [${referVo.labelOrder}] | O'Brien R M. 2007. Caution regarding rules of thumb for variance inflation factors[J]. Quality & Quantity, 41(5) : 673–690. |
| [${referVo.labelOrder}] | Quaak F C A, Kuiper I. 2011. Statistical data analysis of bacterial t-RFLP profiles in forensic soil comparisons[J]. Forensic Science International, 210(1) : 96–101. |
| [${referVo.labelOrder}] | 任丽娟, 何聃, 邢鹏, 等. 2013. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 2013, 21(4) : 421–432. |
| [${referVo.labelOrder}] | 陕西省统计局.2015.2014年陕西省国民经济和社会发展统计公报[OL].2015-03-19.http://www.shaanxitj.gov.cn/site/1/html/126/132/141/10638.htm |
| [${referVo.labelOrder}] | 司全印, 冉新权, 周孝德, 等. 2000. 区域水污染控制与生态环境保护研究-西北地区水资源合理开发利用与生态环境保护研究[M]. 北京: 中国环境科学出版社: 108. |
| [${referVo.labelOrder}] | Sun W, Xia C Y, Xu M Y, et al. 2014. Diversity and distribution of planktonic anaerobic ammonium-oxidizing bacteria in the Dongjiang River, China[J]. Microbiological Research, 169(12) : 897–906. DOI:10.1016/j.micres.2014.05.003 |
| [${referVo.labelOrder}] | 王萃, 鲍林林, 王晓燕. 2013. 密云水库底泥和库滨区土壤中氨氧化细菌的多样性和丰度[J]. 环境科学学报, 2013, 33(12) : 3334–3340. |
| [${referVo.labelOrder}] | 王菊翠, 仵彦卿, 党碧玲, 等. 2012. 基于统计分析的陕西段泾河水质时空分布特征[J]. 自然资源学报, 2012, 27(4) : 674–685. |
| [${referVo.labelOrder}] | 王晓辉, 郭光霞, 郑瑞伦, 等. 2013. 生物炭对设施退化土壤氮相关功能微生物群落丰度的影响[J]. 土壤学报, 2013, 50(3) : 624–631. |
| [${referVo.labelOrder}] | Wu W, Xu Z X, Mark J, et al. 2016. Do human disturbance variables influence more on fish community structure and function than natural variables in the Wei River basin, China?[J]. Ecological Indicators, 61 : 438–446. DOI:10.1016/j.ecolind.2015.09.045 |
| [${referVo.labelOrder}] | Yu S Y, Xu Z X, Wu W, et al. 2016. Effect of land use types on stream water quality under seasonal variation and topographic characteristics in the Wei River basin, China[J]. Ecological Indicators, 60 : 202–212. DOI:10.1016/j.ecolind.2015.06.029 |
| [${referVo.labelOrder}] | Zhang Y Z, Huang C C, Pang J L, et al. 2012. Comparative study of the modern flood slackwater deposits in the upper reaches of Hanjiang and Weihe River Valleys, China[J]. Quaternary International, 282 : 184–191. DOI:10.1016/j.quaint.2012.03.056 |
| [${referVo.labelOrder}] | Zhang Z M, Wang X Y, Zhang Y., et al. 2012. The over polluted water quality assessment of weihe river based on kernel density estimation[J]. Procedia Environmental Sciences, 13 : 1271–1282. DOI:10.1016/j.proenv.2012.01.120 |
| [${referVo.labelOrder}] | 张芝勍. 2011. 利用微生物评价水质的研究进展[J]. 上海环境科学, 2011, 20(6) : 259–262. |
| [${referVo.labelOrder}] | Zhao A Z, Zhu X F, Liu X F, et al. 2016. Impacts of land use change and climate variability on green and blue water resources in the Weihe River Basin of northwest China[J]. Catena, 137 : 318–327. DOI:10.1016/j.catena.2015.09.018 |
| [${referVo.labelOrder}] | 赵军.2011.长江口与密西西比河口沉积物有机碳生物地球化学比较研究:以色素为生物标志物[D].青岛:中国海洋大学.50,66 |
| [${referVo.labelOrder}] | Zwart G, Crump B C, Agterveld M P, et al. 2002. Typicalfreshwater bacteria:an analysis of available 16S rRNA gene sequences from plankton of lakes and rivers[J]. Aquatic Microbial Ecology, 28(2) : 141–155. |
 2017, Vol. 37
2017, Vol. 37


