2. 中国科学技术大学生命科学学院, 合肥 230026
2. School of Life Sciences, University of Science and Technology of China, Hefei 230026
水体富营养化程度加剧导致有害蓝藻水华频发, 并造成严重的生态环境问题 (Li et al., 2015;O′Neilet al., 2012).蓝藻细胞生长旺盛时, 聚集堆积在水面, 散发出难闻的气味, 影响生态景观, 破坏水生态系统平衡;藻细胞衰亡后, 大量的蓝藻毒素及其衍生物释放进入水体, 对人畜饮用水安全构成严重威胁.微囊藻毒素 (Microcystins, MCs) 是一类主要由微囊藻 (Microcystis)、鱼腥藻 (Anabaena)、念珠藻 (Nostoc) 和颤藻 (Oscillatoria) 产生的环状七肽化合物, 在各类蓝藻毒素中检出率最高且危害最严重 (Pearson et al., 2010), 可与肝细胞中的蛋白磷酸酶 (PP1/ PP2A) 发生不可逆的共价结合, 造成细胞骨架系统的破坏, 致使细胞走向凋亡, 促发肝脏肿瘤.迄今为止, 已经发现近90种微囊藻毒素异构体, 其中以MC-LR、MC-RR和MC-YR 3种类型最为普遍 (Neilan et al., 2013).
研究表明, 富营养化湖库中同时存在微囊藻毒素产毒株与无毒株, 二者种群丰度的动态变化是影响水环境中微囊藻毒素含量的关键因素 (Kurmayer et al., 2003).微囊藻毒素产毒株基因组中均存在微囊藻毒素合成基因簇 (Microcystin synthesis gene cluster, mcy), 该基因家族编码一个以非核糖体肽类合成酶 (Non-Ribosomal Peptide Synthetases, NRPS) 和聚酮合成酶 (Polyketide sythetases, PKS) 两大复合体为主的复杂酶系统, 通过各种酶间的相互作用严格调控微囊藻毒素的合成 (Tillett et al., 2000).鉴于产毒株与无毒株在形态学上的不可区分性, 传统的显微观察法无法对二者进行有效区分.mcy基因结构和序列的明确, 促进了分子生物学方法在微囊藻毒素产毒株检测中的应用.近年来, 基于mcy基因碱基序列的荧光定量PCR法广泛应用于国内外微囊藻毒素的相关研究中 (Otten et al, 2015;Wang et al, 2013), 该方法可通过特异性扩增mcy基因家族某些成员, 快速定量环境样品中产毒株与无毒株的种群丰度, 能在较短时间内完成大量样品的分析.
本研究结合高效液相色谱和荧光定量PCR技术, 分析富营养化水库水华不同阶段微囊藻毒素的时空分布特征、产毒蓝藻及产毒微囊藻种群丰度的动态变化规律, 并识别关键环境因子的影响, 以期深入认识蓝藻水华产毒的内在机理, 为微囊藻毒素生态风险评估及防范提供理论依据.
2 材料与方法 (Materials and methods) 2.1 采样点设置洋河水库位于河北省秦皇岛市抚宁县北10 km处, 始建于1959年10月, 1961年8月建成蓄水, 总库容3.53亿m3, 兴利库容1.39亿m3, 平均水深5.7 m, 控制流域面积755 km2, 是一座以城市供水为主, 兼有防洪、发电、灌溉、养殖等功能的大Ⅱ型水库 (李凤彬, 2003).流域内属于温带季风性气候, 四季分明, 气候温和.水库来水主要依靠西洋河和东洋河2条入库支流, 西洋河发源于卢龙县北部的冯家沟, 东洋河发源于青龙县界岭下, 流域面积分别为343 km2和306 km2(张丽媛等, 2010).
洋河水库是秦皇岛市的重要饮用水源地之一, 自20世纪80年代以来, 水库污染负荷持续增加造成水质不断恶化, 水库富营养化现象日趋严重, 每年夏季都有较大规模的蓝藻爆发, 导致水库供水能力下降, 严重影响了居民的饮水质量.目前洋河水库富营养化研究多集中于水体、沉积物营养盐指标分析及污染负荷 (高天珩等, 2010;张丽媛等, 2010), 以及浮游植物组成及优势种演替 (赵伟等, 2011) 等方面, 涉及水库微囊藻毒素污染及相关饮水安全风险的研究较少.本研究共设置6个采样点位 (图 1), 其中, Y1、Y5位于西洋河口附近, Y3、Y4位于东洋河口附近, Y2位于库中心, Y6位于取水口.
 |
| 图 1 洋河水库采样点布设 Fig. 1 The distribution of sampling sites in Yanghe Reservoir |
于2015年5—10月每月采集样品1次, 采样时间均在月末.现场使用便携式水质参数测定仪 (YSI EXO2) 原位测定水温 (WT)、pH、溶解氧 (DO) 和电导率 (EC), 同时使用塞氏盘法测定透明度 (SD).使用有机玻璃采水器采集水下0.5m处水样3次, 均匀混合后取4 L水样避光冷藏保存后尽快送至实验室进行分析.
2.2.2 营养盐及叶绿素a浓度分析营养盐浓度分析参照相关国家标准进行 (《水和废水分析检测方法 (第4版)》), 用钼酸铵分光光度法测定总磷 (TP) 及正磷酸盐 (PO43--P), 紫外分光光度法测定总氮 (TN) 及硝酸盐氮 (NO3--N), N-(1-萘基)-乙二胺光度法测定亚硝酸盐氮 (NO2--N), 水杨酸-次氯酸盐光度法测定氨态氮 (NH4+-N), 重量法测定悬浮物 (SS), 高锰酸钾法测定高锰酸盐指数 (CODMn).叶绿素a (Chlorophyll a, Chla) 的测定使用荧光分光光度法 (李大命等, 2011).
2.2.3 微囊藻毒素浓度分析量取1 L水样经0.45 μm微孔滤膜过滤后, 滤液及滤膜分别用于溶解性微囊藻毒素 (Extracellular microcystins, EMCs) 和细胞内微囊藻毒素 (Intracellular microcystins, IMCs) 浓度的测定.
EMCs样品预处理方法:滤液经过已用10 mL甲醇和10 mL超纯水活化的C18固相萃取小柱 (Supelclean ENVI-18, 500 mg, 6 mL, America) 富集微囊藻毒素, 然后经10 mL超纯水、10 mL 10%(V/V) 甲醇溶液、10 mL 20%(V/V) 甲醇溶液依次淋洗, 最后用10 mL 80%(V/V) 甲醇溶液洗脱.洗脱液经小股氮气吹干后用55%(V/V) 甲醇溶液定容至500 μL, -20 ℃保存待测.
IMCs样品预处理方法:滤膜置于-20 ℃冰箱反复冻融3次, 使藻细胞充分破裂, 剪碎滤膜, 置于100 mL离心管中, 加入30 mL 80%(V/V) 甲醇溶液后放入恒温空气摇床内振荡3 h, 取出后立即离心, 收集上清液于250 mL烧杯中, 重复此提取过程2次, 合并3次上清液, 80 ℃恒温水浴蒸发去除上清液中的甲醇和一些热不稳定性杂质至10 mL左右, 冷却至室温后用0.45 μm微孔滤膜并过滤收集滤液, 使用EMCs样品预处理方法处理滤液.
微囊藻毒素检测采用高效液相色谱仪 (SHZMADZU LC-20AD), 配有紫外检测器.流动相组分及比例为水溶液 (含0.1%三氟乙酸):甲醇=45:55, 进样量20 μL, 柱温35 ℃, 流速0.8 mL · min-1, 检测波长238 nm, 分析时间15 min.MC-RR、MC-LR和MC-YR标准品均购自Sigma公司, 溶于适量甲醇中, -20 ℃保存备用.
2.2.4 藻类基因组提取及荧光定量PCR根据藻类生物量大小, 用0.2 μm硝酸纤维素滤膜过滤50~100 mL水样, -20 ℃保存滤膜, 参照文献 (Rinta Kanto et al, 2005) 上的方法进行藻类基因组的提取, 主要步骤为:裂解液 (40 mmol· L-1 EDTA、400 mmol· L-1 NaCl、50 mmol · L-1 Tris-HCl, pH 9.0) 重新悬浮滤膜上的细胞后, 加入溶菌酶 (1 mg· mL-1) 溶液, 37 ℃水浴20 min;取出后立即加入蛋白酶K溶液 (50 mg· mL-1) 及SDS溶液 (0.5%), 充分混匀后, 50 ℃水浴2 h, 冷却至室温;然后加入等体积酚/氯仿/异戊醇 (25 : 24 : 1) 溶液, 离心收集上层水相并向其中加入2倍体积无水乙醇和0.1倍体积醋酸铵溶液, 均匀混合后-20 ℃放置过夜, 次日离心收集基因组DNA, 溶于50 μL TE溶液后, 使用分光光度计 (NanoDrop-2000) 测定DNA溶液的浓度及纯度, -20 ℃保存备用.
荧光定量PCR所选用的引物序列及扩增片段大小如表 1所示.4组引物依次用于特异性扩增蓝藻16S rRNA (Rinta Kanto et al, 2005)、微囊藻藻蓝蛋白基因cpcB与cpcA转录间隔区 (Kim et al., 2010)、微囊藻毒素合成基因mcyA (Hisbergues et al., 2003) 及微囊藻毒素合成基因mcyB (Nonneman et al., 2002), 分别定量样品中蓝藻、微囊藻、产毒蓝藻及产毒微囊藻种群丰度.利用中国科学院水生生物研究所淡水藻种库 (FACHB) 提供的藻株M. aeruginosa PCC 7806, 参照文献 (Singh et al, 2015) 方法建立各目的基因拷贝数对数值与定量PCR反应循环阈值 (Ct) 之间的线性回归方程, 并计算扩增效率e=10-1/S-1, 其中, S为标准曲线斜率.共设置102~108 copies · mL-17个浓度梯度, 每个浓度3个平行.
| 表 1 各目的基因荧光定量PCR引物 Table 1 Primers used for quantitative real time PCR in this study |
定量PCR反应体系为25 μL, 其中含有SYBR Premix Ex Taq Ⅱ(2×) 混合液 (Takara RR820)12.5 μL, 上游及下游引物各1 μL, 模板1 μL, 超纯水9.5 μL.扩增反应在TaKaRa TP 800荧光定量PCR仪上完成, 扩增条件为:95 ℃预变性30 s;95 ℃变性5 s, 55 ℃退火10 s, 72 ℃延伸20 s, 共40个循环.根据标准曲线对样品中蓝藻、微囊藻、产毒蓝藻及产毒微囊藻种群丰度进行定量.
2.3 统计分析方法基础数据统计在Excel中完成, 采用SPSS Statistics22.0对微囊藻毒素、产毒株种群丰度和环境因子进行Pearson相关性分析, 相关分析前, 用K-S方法检验除pH外的变量是否满足正态分布, 不满足正态分布的变量进行对数转化.
3 结果 (Results) 3.1 洋河水库环境因子2015年5—10月洋河水库各采样点水体原位测定参数及营养盐浓度如表 2所示.采样期间, WT、pH和EC在各样点间无明显差异, pH值均大于7, 水体处于弱碱性状态.TN、TP、SS及CODMn在空间上呈现相似的分布, 浓度顺序表现为:Y6、Y5、Y1 > Y4、Y3 > Y2.各月水温差异较大, 变化范围为12.9~31.0 ℃;夏季CODMn高于秋季和春季, 变化范围为4.51~13.60 mg · L-1;TN和TP浓度分别为0.60~5.30 mg · L-1和0.02~0.47 mg · L-1(图 2).各采样点位氮的主要存在形式均为硝酸盐氮, 其中, Y2点和Y3点的浓度略低.其余营养盐指标各点位间差异不大, 均处于低浓度范围.
| 表 2 研究期间各采样点位环境参数 Table 2 Monthly average of environmental factors in each sampling site during the study period |
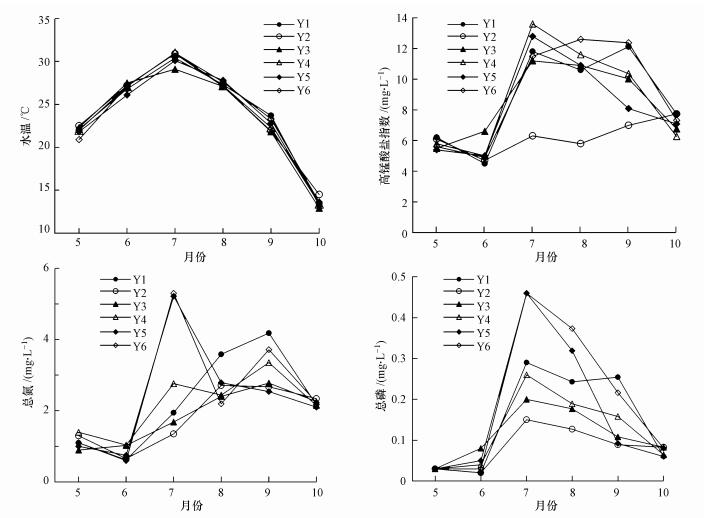 |
| 图 2 水温、高锰酸盐指数及总氮、总磷浓度的时空分布 Fig. 2 Spatio-temporal distribution of water temperature、permanganate index and the concentration of total nitrogen and phosphorus |
各点位叶绿素a (Chla) 及微囊藻毒素 (MCs) 浓度变化如图 3所示, 其中, MCs浓度为MC-RR、MC-LR和MC-YR浓度的总和.各点位Chla及MCs浓度时间变化上均呈现先增大后减小的趋势, 除Y1点外, 其余点位二者峰值均出现在水华严重爆发的7月.在空间分布上, 西洋河口附近区域Chla及MCs浓度高于东洋河口附近区域, Y5和Y6两点二者浓度高于其他点位.研究期间, 微囊藻毒素3种主要异构体MC-RR、MC-LR和MC-YR在各点位均有检出, 总体上各点位异构体组成均以MC-RR和MC-LR2种亚型为主, MC-YR所占比例均不足10%(图 4).
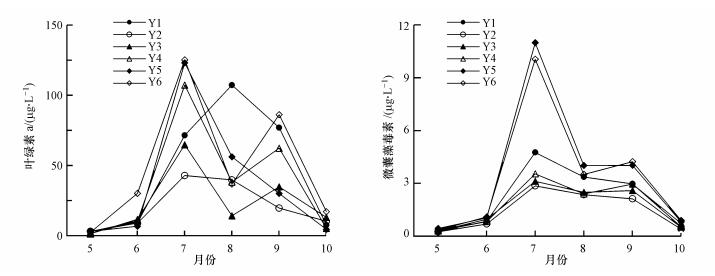 |
| 图 3 叶绿素a及微囊藻毒素浓度时空变化 Fig. 3 Temporal and spatial variation of chlorophyll a and microcystins concentration |
 |
| 图 4 研究期间各采样点位3种微囊藻毒素异构体比例分布 Fig. 4 Relative proportion of MC-RR、MC-LR and MC-YR in each sampling site during the study period |
标准品定量PCR结果显示, 扩增产物溶解曲线仅有一个变性温度峰值, 产物为目的基因, 无非特异性产物出现.根据标准品定量结果, 建立各目的基因拷贝数对数值与PCR反应Ct值之间的线性回归方程.Cyanobacteria 16S rRNA标准曲线方程为y=-3.7886 x+40.37, R2=0.9993, e=0.84;cpcBA基因标准曲线方程为y=-3.4507x+37.29, R2=0.9999, e=0.95;mcyA基因标准曲线方程为y=-3.453 x+37.3, R2=0.9998, e=0.95;mcyB基因标准曲线方程为y=-3.5117x+37.97, R2=0.9998, e=0.93.
如图 5所示, Y2和Y6点位蓝藻、微囊藻、产毒蓝藻及产毒微囊藻种群丰度季节变化趋势一致, 5—7月均逐渐增加, 7月达到最大值, 8月开始下降.产毒蓝藻在总蓝藻种群中所占比例Y2点为7%~36%, Y6点为14%~55%.产毒微囊藻在总微囊藻种群中所占比例Y2点为8%~37%, Y6点为14%~59%.与Y2点相比, Y6点蓝藻群落组成中微囊藻毒素产毒株更具优势, 藻毒素污染潜在风险更大.
 |
| 图 5 Y2点 (a) 及Y6点 (b) 蓝藻、微囊藻、产毒蓝藻及产毒微囊藻种群丰度的季节变化 Fig. 5 Seasonal variation of the population abundance of total cyanobacteria and Microcystis, toxic cyanobacteria and Microcystis in sampling site Y2 (a) and Y6 (b) |
洋河水库微囊藻毒素浓度与环境因子间的相关性分析结果如表 3所示, 研究期间, MCs与SD呈显著负相关 (p < 0.01), 与WT、SS、TN、TP、PO43--P、CODMn和Chla均呈显著正相关 (p < 0.01).
| 表 3 微囊藻毒素浓度与环境因子间的相关关系 (n=36) Table 3 Correlations between microcystins concentration and environmental factors (n=36) |
洋河水库产毒株种群丰度与微囊藻毒素和环境因子间的相关关系如表 4所示.蓝藻、微囊藻、产毒蓝藻及产毒微囊藻种群丰度与TN、TP、PO43--P、SS和Chla均存在显著相关关系;MCs与产毒株种群丰度及其所占比例均呈显著正相关 (p < 0.01).
| 表 4 产毒株种群丰度与MCs浓度及环境因子的相关关系 (n=12) Table 4 Correlations between microcystin-producing cells and microcystins concentration, environmental factors (n=12) |
洋河水库是一座典型的富营养化水库, 1990—2011年期间, 水库TN和TP的浓度常年超过国际公认湖库发生富营养化的浓度水平 (王丽平等, 2013).本次研究期间, 洋河水库水体TN和TP浓度的平均值分别为2.18 mg·L-1和0.14 mg·L-1, 远高于湖库富营养化氮磷浓度阈值.水库西南部富营养化程度高于东北部, 主要由于西洋河上游为白薯种植区, 每年秋季农民利用简陋的粉碎装置将白薯加工成淀粉, 产生大量含高浓度污染物的废水, 不经任何处理汇集于河道后流入水库 (赵伟等, 2011).蔡金傍等 (2006)曾对西洋河上游富贵庄入库淀粉废水中COD、TP、TN的浓度进行检测, 三者最大值分别达到1397.95、12.20、77.90 mg·L-1, 平均值分别为471.52、5.80、25.87 mg·L-1.淀粉废水的排入, 造成西洋河来水水质不断恶化, 导致水库富营养化程度出现空间差异.水体中Chla浓度与WT、TN和TP浓度呈显著正相关, 时间变化上主要受水温的影响, 表现出先增大后减小的趋势;空间分布上主要受营养盐浓度的影响, 西南部高于东北部.说明水温及水体富营养化程度是影响洋河水库浮游植物生物量的主要因素.
应用荧光定量PCR技术 (Yoshida et al., 2007) 对洋河水库不同水华阶段蓝藻与产毒蓝藻、微囊藻与产毒微囊藻种群丰度的动态变化进行研究, 所构建的4条标准曲线扩增效率及线性关系均满足实验要求, 可用于定量样品中各目的基因拷贝数.Y2及Y6点位荧光定量PCR结果表明, 洋河水库水华各阶段水体中均存在微囊藻毒素产毒株, 2个点位蓝藻与产毒蓝藻、微囊藻与产毒微囊藻种群丰度均随时间先增大后减小, 产毒蓝藻及产毒微囊藻所占比例也表现相同的时间变化趋势.空间分布上, 研究期间Y6点位产毒株种群丰度及其所占比例均高于Y2点位.
洋河水库MCs浓度的季节性分布特征为夏季>秋季>春季.5、6月水温逐渐上升, 藻细胞数量显著增加并上浮至表层水体, 产毒藻细胞合成毒素储存在自身的类囊体核区, MCs浓度呈增加趋势.7月水华全面爆发, 水面藻类聚集形成肉眼可见的绿色藻团, 透明度下降至0.3 m, 微囊藻为绝对优势种, 且产毒株更具竞争优势, MCs浓度迅速上升达到峰值.8、9月各点位MCs浓度的波动与当地8月多雨的气候条件有关, 大量雨水一方面稀释了水体中溶解性微囊藻毒素浓度, 另一方面减少了表层水体中藻细胞生物量, 造成细胞内微囊藻毒素浓度的下降.10月表层水温下降至15 ℃以下, 藻细胞大量衰亡, 微囊藻毒素及细胞内色素大量释放进入水体, 溶解性微囊藻毒素在周围环境因素的综合影响下发生自然降解.
MCs浓度空间分布与水体富营养化程度密切相关, 西洋河口附近MCs浓度显著高于其他区域.各点位主要毒素类型差异不大, 均以MC-RR和MC-LR为主, 与优势种微囊藻产毒的主要类型相一致 (Messineo et al., 2009), 夏、秋季MC-RR浓度的增加与此阶段水体的高温、高磷环境有关 (Oh et al., 2000).湖库间由于水华优势藻种及周围环境生态因子的不同, 藻毒素组成及分布往往存在差异, 如Song等 (2007)对太湖水体微囊藻毒素污染的研究发现, 梅梁湾区域内MC-RR为主导毒素, MC-LR含量较低, 而王菲凤等 (2011)的研究则表明, 福州山仔水库MC-LR的浓度在时间和空间分布上都占绝对优势.
湖库水体中产毒株种群丰度及微囊藻毒素浓度受地理位置、气象条件、水体理化参数等多种环境因素影响, 不同湖库间研究结果存在差异.在纽约Ronkonkoma湖, 产毒微囊藻所占比例为12%~100%, 水温及TP浓度的升高可显著促进产毒微囊藻的生长和MCs浓度的增加 (Davis et al, 2009).李大命等 (2011)对巢湖的调查则表明, MCs浓度与TN和TP呈显著正相关, 而产毒微囊藻种群丰度及其所占比例与营养盐浓度间无相关关系.本研究中, 洋河水库产毒蓝藻占总蓝藻种群丰度比例为7%~55%, 产毒微囊藻占总微囊藻种群丰度比例为8%~59%;产毒株种群丰度及MCs浓度均与水温、营养盐浓度 (TN、TP)、CODMn及Chla浓度呈显著正相关, 并且Chla浓度与水温、营养盐浓度、CODMn间也存在显著正相关关系.表明环境因子不仅直接影响蓝藻产毒, 还通过调节浮游植物的生物量间接影响产毒株种群丰度, 进而改变水体微囊藻毒素的污染程度.
鉴于现场调查监测结果的不一致性, 一些学者试图通过室内模拟实验揭示环境因子对蓝藻产毒的影响, 所涉及的环境因子包括光照、紫外辐射、营养盐和微量元素等理化因素 (Horst et al., 2014;Keabernick et al., 2000;Kuniyoshi et al., 2013;Sevilla et al, 2008;Yang et al., 2015), 也包括浮游动物摄食及噬藻体感染等生物因素 (Mendoza et al., 2014;Yoshida et al., 2008).这些环境因子独立作用时均能在一定程度上调控mcy基因家族某些成员的表达, 改变培养体系中MCs的浓度, 对探讨微囊藻毒素产生及释放机理具有一定意义.但由于自然水体中多种环境因子同时存在, 彼此之间存在错综复杂的关系, 许多野外监测的结果无法用室内模拟实验得出的结论合理解释.尽管目前关于环境因子对产毒株种群丰度变化的影响方式还没有一致的结论, 但多数研究表明温度的升高及氮磷浓度的增加能显著上调mcy基因的表达, 促进水体中MCs浓度的升高, 说明全球变暖和富营养化可能加剧有害蓝藻水华及MCs风险.
洋河水库水体中较高浓度的氮、磷是导致产毒藻类种群丰度及相对比例变化的主要因素, 水体中MCs浓度则受到产毒株种群丰度及环境条件的共同调控.为从源头上减少洋河水库产毒株种群丰度, 降低微囊藻毒素生态风险, 应有效控制水库外源输入, 并同时降低水库内营养盐的浓度.
5 结论 (Conclusions)1) 洋河水库水体中MCs浓度夏季显著高于秋季和春季, 空间分布上西洋河附近区域高于东洋河附近区域.藻毒素异构体组成无显著时空差异, 均以MC-RR和MC-LR2种亚型为主.7月MCs浓度达到最大值10.99 μg·L-1, 异构体中急性毒性最强的MC-LR浓度为1.15~3.48 μg·L-1, 对水库饮水安全构成潜在威胁.
2) 洋河水库水体中产毒株种群丰度夏季和秋季显著高于春季, 产毒株种群丰度及其相对比例受水体富营养化程度的影响.微囊藻为优势产毒蓝藻, MCs浓度与产毒微囊藻在总微囊藻种群中所占比例呈显著正相关, 取水口处该比值为14%~59%, 存在取水污染风险.
3) 水温、Chla浓度、营养盐 (TN、TP) 浓度和CODMn是影响洋河水库水体中MCs浓度与产毒株种群丰度动态变化的主要环境因子, 应有效控制水库外源输入, 降低水体中营养盐浓度.
| [${referVo.labelOrder}] | 蔡金傍, 李文奇, 刘娜, 等. 2006. 洋河水库污染源调查与分析[J]. 中国农村水利水电, 2006(9) : 51–54. |
| [${referVo.labelOrder}] | Davis T W, Berry D L, Boyer G L, et al. 2009. The effects of temperature and nutrients on the growth and dynamics of toxic and non-toxic strains of Microcystis during cyanobacterial bloom[J]. Harmful Algae, 8(5) : 715–725. DOI:10.1016/j.hal.2009.02.004 |
| [${referVo.labelOrder}] | 高天珩, 钱新, 储昭升, 等. 2010. 气候、水文和生态过程对洋河水库富营养化影响研究[J]. 水生态学杂志, 2010, 3(3) : 28–31. |
| [${referVo.labelOrder}] | 国家环境保护总局. 2002. 水和废水监测分析方法(第四版)[M]. 北京: 中国环境科学出版社. |
| [${referVo.labelOrder}] | Hisbergues M, Christiansen G, Rouhiainen L, et al. 2003. PCR-based identification of microcystin producing genotypes of different cyanobacterial genera[J]. Archives of Microbiology, 180(6) : 402–410. DOI:10.1007/s00203-003-0605-9 |
| [${referVo.labelOrder}] | Horst G P, Sarnelle O, White J D, et al. 2014. Nitrogen availability increases the toxin quota of a harmful cyanobacterium, Microcystis aeruginosa[J]. Water Research, 54 : 188–198. DOI:10.1016/j.watres.2014.01.063 |
| [${referVo.labelOrder}] | Kaebernick M, Neilan B A, Borner T, et al. 2000. Light and the transcriptional response of the microcystin biosynthesis gene cluster[J]. Applied and Environmental Microbiology, 66(8) : 3387–3392. DOI:10.1128/AEM.66.8.3387-3392.2000 |
| [${referVo.labelOrder}] | Kim S G, Joung S H, Ahn C Y, et al. 2010. Annual variation of Microcystis genotypes and their potential toxicity in water and sediment from a eutrophic reservoir[J]. FEMS Microbiology Ecology, 74(1) : 93–102. DOI:10.1111/j.1574-6941.2010.00947.x |
| [${referVo.labelOrder}] | Kuniyoshi T M, Sevilla E, Bes M T, et al. 2013. Phosphate deficiency (N/P 40:1) induces mcyD transcription and microcystin synthesis in Microcystis aeruginosa PCC 7806[J]. Plant Physiology and Biochemistry, 65 : 120–124. DOI:10.1016/j.plaphy.2013.01.011 |
| [${referVo.labelOrder}] | Kurmayer R, Kutzenberger T. 2003. Application of real-time PCR for quantification of microcystin genotypes in a population of the toxic cyanobacterium Microcystis sp[J]. Applied and Environmental Microbiology, 69(11) : 6723–6730. DOI:10.1128/AEM.69.11.6723-6730.2003 |
| [${referVo.labelOrder}] | Li R N, Chen Q W, Zhang X Q, et al. 2015. Effects of temperature and macronutrients on phytoplankton communities across three largely different lakes identified by a time-space trade-off approach[J]. Ecological Informatics, 29 : 174–181. DOI:10.1016/j.ecoinf.2014.09.004 |
| [${referVo.labelOrder}] | 李大命, 孔繁翔, 阳振, 等. 2011. 巢湖夏季和冬季有毒微囊藻和无毒微囊藻种群丰度研究[J]. 环境科学学报, 2011, 31(12) : 2672–2680. |
| [${referVo.labelOrder}] | 李凤彬. 2003. 洋河水库富营养化的现状和对策探讨[J]. 给水排水, 2003, 29(8) : 16–19. |
| [${referVo.labelOrder}] | Pineda Mendoza R M, Zuniga G, Martinez Jeronimo F, et al. 2014. Infochemicals released by Daphnia magna fed on Microcystis aeruginosa affect mcyA gene expression[J]. Toxin, 80 : 78–86. |
| [${referVo.labelOrder}] | Messineo V, Bogialli S, Melchiorre S, et al. 2009. Cyanobacterial toxins in Italian freshwater[J]. Limnologica, 39 : 95–106. DOI:10.1016/j.limno.2008.09.001 |
| [${referVo.labelOrder}] | Neilan B A, Pearson L A, Muenchhoff J, et al. 2013. Environmental conditions that influence toxin biosynthesis in cyanobacteria[J]. Environmental Microbiology, 15(5) : 1239–1253. DOI:10.1111/emi.2013.15.issue-5 |
| [${referVo.labelOrder}] | Nonneman D, Zimba P V. 2002. A PCR-based test to assess the potential for microcystin occurrence in channel catfish production ponds[J]. Journal of Phycology, 38 : 230–233. DOI:10.1046/j.1529-8817.2002.01138.x |
| [${referVo.labelOrder}] | Oh H M, Lee S J, Jang M H, et al. 2000. Microcystin production by Microcystis aeruginosa in a phosphorous-limited chemostat[J]. Applied and Environmental Microbiology, 66 : 176–179. DOI:10.1128/AEM.66.1.176-179.2000 |
| [${referVo.labelOrder}] | O'Neil J M, Davis T W, Burford M A, et al. 2012. The rise of harmful cyanobacteria blooms:The potential roles of eutrophication and climate change[J]. Harmful Algae, 14 : 313–334. DOI:10.1016/j.hal.2011.10.027 |
| [${referVo.labelOrder}] | Otten T G, Crosswell J R, Mackey S, et al. 2015. Application of molecular tools for microbial source tracking and public health risk assessment of a Microcystis bloom traversing 300km of the Klamath River[J]. Harmful Algae, 46 : 71–81. DOI:10.1016/j.hal.2015.05.007 |
| [${referVo.labelOrder}] | Pearson L, Mihali T, Moffitt M, et al. 2010. On the chemistry, toxicology and genetics of the cyanobacterial toxins, microcystin, nodularin, saxitoxin and cylindrospermopsin[J]. Marine Drugs, 8(5) : 1650–1680. DOI:10.3390/md8051650 |
| [${referVo.labelOrder}] | Rinta Kanto J M, Ouellette A J A, Boyer G L, et al. 2005. Quantification of toxic Microcystis spp.during the 2003 and 2004 blooms in western Lake Erie using quantitative real-time PCR[J]. Environmental Science & Technology, 39(11) : 4198–4205. |
| [${referVo.labelOrder}] | Sevilla E, Martin Luna B, Vela L, et al. 2008. Iron availability affects mcyD expression and microcystin-LR synthesis in Microcystis aeruginosa PCC7806[J]. Environmental Microbiology, 10(10) : 2476–2483. DOI:10.1111/j.1462-2920.2008.01663.x |
| [${referVo.labelOrder}] | Singh S, Rai P K, Chau R, et al. 2015. Temporal variations in microcystin-producing cells and microcystin concentrations in two fresh water ponds[J]. Water Research, 69 : 131–142. DOI:10.1016/j.watres.2014.11.015 |
| [${referVo.labelOrder}] | Song L R, Chen W, Peng L, et al. 2007. Distribution and bioaccumulation of microcystins in water columns:A systematic investigation into the environmental fate and the risk associated with microcystins in Meiliang Bay, Lake Taihu[J]. Water Research, 41 : 2853–2864. DOI:10.1016/j.watres.2007.02.013 |
| [${referVo.labelOrder}] | Tillett D, Dittmann E, Erhard M, et al. 2000. Structural organization of microcystin biosynthesis in Microcystis aeruginosa PCC7806:an integrated peptide-polyketide synthetase system[J]. Chemistry and Biology, 7(10) : 753–764. DOI:10.1016/S1074-5521(00)00021-1 |
| [${referVo.labelOrder}] | Wang X Y, Sun M J, Xie M J, et al. 2013. Differences in microcystin production and genotype composition among Microcystis colonies of different sizes in Lake Taihu[J]. Water Research, 47(15) : 5659–5669. DOI:10.1016/j.watres.2013.06.040 |
| [${referVo.labelOrder}] | 王菲凤, 仝川, 杨芳, 等. 2011. 福州山仔水库水华微囊藻毒素时空分布特征[J]. 环境科学学报, 2011, 31(3) : 533–546. |
| [${referVo.labelOrder}] | 王丽平, 郑丙辉. 2013. 洋河水库富营养化发展趋势及其关键影响因素[J]. 生态学报, 2013, 33(3) : 1011–1017. |
| [${referVo.labelOrder}] | Yang Z, Kong F X, Shi X L, et al. 2015. Effects of UV-B radiation on microcystin production of a toxic strain of Microcystis aeruginosa and its competitiveness agianist a non-toxic strain[J]. Journal of Hazardous Materials, 283 : 447–453. DOI:10.1016/j.jhazmat.2014.09.053 |
| [${referVo.labelOrder}] | Yoshida M, Yoshida T, Takashima Y, et al. 2007. Dynamics of microcystin-producing and non-microcystin-producing Microcystis populations is correlated with nitrate concentration in a Japanese lakes[J]. FEMS Microbiology Letters, 266(1) : 48–53. |
| [${referVo.labelOrder}] | Yoshida M, Yoshida T, Kashima A, et al. 2008. Ecological dynamics of the toxic bloom-forming cyanobacterium Microcystis aeruginosa and its cyanophages in freshwater[J]. Applied and Environmental Microbiology, 74(10) : 3269–3273. DOI:10.1128/AEM.02240-07 |
| [${referVo.labelOrder}] | 张丽媛, 王圣瑞, 储昭升, 等. 2010. 洋河水库流域土壤与库区沉积物中磷形态特征研究[J]. 中国环境科学, 2010, 30(11) : 1529–1536. |
| [${referVo.labelOrder}] | 赵伟, 李涵, 许秋瑾, 等. 2011. 洋河水库水华优势种演替的原因分析[J]. 环境工程学报, 2011, 5(9) : 1989–1993. |
 2017, Vol. 37
2017, Vol. 37


