溶解性有机物 (Dissolved Organic Matter,DOM) 是指水体中能通过0.45 μm滤膜并在后续处理过程中不因蒸发而损失的那部分有机物 (Aiken et al., 2011).DOM是全球碳循环的重要组成,对水体中的碳、生源要素等的生物地球化学循环具有重要意义 (甘淑钗等, 2013).其组分主要有腐殖酸、亲水性有机酸、氨基酸、碳水化合物及脂类等 (Leenheer et al., 2003),DOM可能来自人类社会排放的污染物,也有部分来自土壤和水中的浮游生物分泌物和残体的降解 (钟润生等, 2008).DOM是水体中色、嗅、味的主要来源,在很大程度上影响着水质感官指标.水处理过程中,DOM的存在会影响混凝效果,加速滤床、滤膜的堵塞,并会和氯反应生成三卤甲烷等消毒副产物 (郭瑾等, 2007).此外,DOM作为环境中一种天然络合剂和吸附载体,对重金属和有机污染物在环境中的迁移转化和生物有效性起着至关重要的作用 (Tejeda Agredano et al., 2014).
近年来,现代仪器分析技术迅猛发展,如核磁共振波谱、红外光谱、荧光光谱、紫外光谱、元素组成分析等.这些分析技术的发展把DOM的研究提高到了一个新的水平,使得对于DOM量的改变和质的变化都能做出明确的分析.在这些分析方法中,紫外分光光度法具有操作简单、精密度好、灵敏度高、测定范围广等优点.紫外分光光度法的基本原理遵循朗伯-比尔定律,即溶液的吸光度与吸光物质的浓度及吸收厚度成正比.带有共轭键和苯环的芳香族化合物在紫外区有特征吸收现象,因而可以通过紫外-可见吸收光谱图的变化分析DOM中含有共轭双键结构物质的含量和特性变化 (Fuentes et al., 2006).荧光光谱技术具有灵敏度高、选择性好,且不破坏样品结构的优点 (热合曼江·吾甫尔等,2014),被广泛用于定性或定量测定有机物的物理化学特性 (冯伟莹等, 2013; Zhu et al., 2014).三维荧光光谱 (Three-Dimensional Excitation Emission Matrix Fluorescence Spectrum, 3DEEM) 能够表示激发波长 (Excitation Wavelength, λEx) 和发射波长 (Emission Wavelength, λEm) 同时变化时的荧光强度信息,用于水质测定时能够揭示有机污染物的分类及其含量信息.通过荧光光谱图中荧光峰的位置、数量、强度的变化,能够对DOM的种类、分布和来源进行判断 (钟润生等, 2008).同步荧光法 (Synchronous Fluorescence Spectroscop,简称SFS) 是在扫描过程中使激发波长 (λEx) 和发射波长 (λEm) 保持固定的波长间隔 (Δλ =λEm-λEx =常数),它适合对多组分混合物的分析 (何立芳等, 2004; Guo et al., 2013).紫外-可见光谱扫描能够反映DOM的官能团结构,对于DOM而言,由于官能团较多,互相之间存在干扰,因此,DOM的紫外-可见光谱扫描曲线通常无特征吸收峰,随着波长的增加吸收逐渐降低 (郭瑾等, 2007).荧光光谱能够反映DOM的结构和官能团情况.光谱中波长较大、荧光强度偏低的部分对应着DOM中的不饱和结构;吸电子官能团将降低DOM中芳环结构的荧光强度;羧基取代体、羟基和烷氧基将使产生荧光吸收的波长变大;随着DOM分子尺寸的增加,荧光强度将减小 (郭瑾等, 2007).
由于泥沙本身含有相当数量的黏土矿物和胶体物质,可以吸附种类繁多的污染物.在水环境系统中泥沙作为载体,通过对污染物的吸附与解吸来影响污染物在水、泥沙间的赋存状态,进而影响污染物在水体中的迁移转化及水生态环境状态 (黄海强, 2008).当污染物进入河流后,大部分都会被水中悬浮泥沙吸附并随同泥沙颗粒一起运动或沉积在河流底部,形成有一定厚度的含各种污染物的沉积物层;同时,沉积物会在一定水流作用下发生冲刷和再悬浮,这时大量的污染物会被释放出来,造成水体的二次污染.因此,研究大多数污染物在水环境中迁移转化时就必须把泥沙的运动考虑在内 (黄岁梁等, 1998).目前,国内外已经开展了大量有关沉积物对溶解性有机物吸附性能的影响研究 (张海平等, 2001; Chiou, 2002),Sun等 (2007)利用荧光光谱研究了沉积物中腐殖质的荧光特性;Sierra等 (2005)利用三维荧光光谱分析了滨海沉积物中腐殖酸和富里酸的来源和结构组成;罗固源等 (2011)通过红外光谱和荧光光谱对嘉陵江重庆段沉积物中的腐殖酸的化学组成和结构特征进行了研究.然而,针对泥沙沉降过程对水体中溶解性有机物的影响却未见文献报道.泥沙沉降是泥沙运动力学的基本问题之一 (蔡玲等, 2009).泥沙沉降作用对于降低水中污染物的含量具有重要作用,在很大程度上可以提高水环境容量 (黄海强, 2008).因此,本研究以沈阳市新开河河水为研究对象,考察泥沙沉降对水体中DOM的含量及光谱学特性的影响.DOM作为污染物和污染物的载体对水环境造成污染.研究成果有助于人们了解泥沙沉降条件下,自然水体中DOM的变化规律,为进一步了解水体中污染物质的迁移和转化积累基础数据,并对水体中污染物的控制起到指引作用,进而对水环境改善具有重要的指导作用.
2 材料与方法 (Materials and methods) 2.1 样品采集泥沙样品采集于沈阳市于洪区英守村丁香湖.丁香湖水域面积3.1 km2,是沈阳最大的人工湖,泥沙含量十分丰富.2015年10月中旬,在英守村丁香湖采样点采集表层泥沙10 kg,去除大块杂质后装入塑料袋中带回,采样工具为铁铲.通过筛分、滤膜过滤方法,分别将泥沙样品中 < 0.20 mm、 < 0.10 mm、 < 0.02 mm和 < 0.01 mm粒径的泥沙分离出来,并根据河流泥沙颗粒分析规程SL42-92,分析各粒径泥沙的质量分数,结果见表 1.将泥沙于蒸馏水中反复冲洗,去除杂质后,再用质量分数6%的H2O2处理,去除泥沙中有机物 (陈洪松等, 2001).测定H2O2处理泥沙过后的洗脱液,待其DOC值恒定在极低 ( < 1 mg·L-1) 水平,则认为泥沙中有机物已被彻底去除.将处理后的泥沙置于烘箱中烘干至恒重后过100目筛网,去除颗粒较大的泥沙后,在低温下密封保存备用.
| 表 1 实验所用泥沙的级配组成 Table 1 Size gradation of sediment sample |
水样采集于沈阳市新开河,水样性质见表 2.新开河位于沈阳市城区北部, 是1914年开挖的人工灌溉渠道.东起东陵引水闸,西至767库专用线,全长27.7 km (王法东等, 2003).1997年沈阳市政府对新开河进行了综合治理,河底加宽到28 m,设计流量48 m3·s-1,承担沈阳市北部城区雨水排放的功能 (郭勇, 2016),同时兼具农村灌溉、地下水补给、城区景观河流等功能 (岳杰, 2011).本实验采样点位于皇姑区长江园 (41°50′15″N,123°24′17″E) 附近河段.在河流两岸分别设置采样点位,用采样器采集距水面0.5 m处水样.为了不受水面悬浮物和油粒等的影响,应注意样品避免受水表面1~2 cm处的干扰 (丁辉, 2005).
| 表 2 新开河河水水质情况 Table 2 Water quality data for Xinkai River |
河流中泥沙的沉降是自上而下的过程,为了更好地模拟静水条件下河流中泥沙的沉降过程,本试验采用特制的有机玻璃沉降反应柱 (柱高150 cm,直径15 cm),在距底部20 cm和100 cm处分别设置取样口A和B,反应柱内加入水样至1.2 m刻度处.A0和B0分别为对应取样口对照样品,不做泥沙沉降处理.实验共分为4组,第1组1~6号样品取样时间分别为0.08、0.16、0.75、1.5、3、6 h,泥沙投加量105 g;第2组7~11号样品分别加入泥沙,使反应柱内泥沙浓度分别为0.6、1.2、2.4、4.8、9.6 kg·m-3,沉降时间为0.75 h;第3组12~14号样品分别用盐酸 (6 mol·L-1) 和NaOH溶液 (6 mol·L-1) 调节pH至5、7、9,泥沙投加量105 g,沉降时间均为0.75 h;第4组15~17号样品加入NaCl,使水样盐度分别为5‰、7.5‰、10‰,泥沙投加量105 g,沉降时间均为0.75 h.将上述处理后的样品取出后过0.45 μm滤膜,用棕色玻璃瓶收集,置于4 ℃冰箱内保存.
2.3 分析方法 2.3.1 DOCDOC采用Shimadou TOC-5000(日本岛津公司) 型总有机碳分析仪测定.
2.3.2 紫外-可见吸收光谱分析调节水样pH=7.0,然后将水样置于1 cm石英比色皿中,用紫外-可见分光光度计 (Cary 50, 美国Varian公司) 进行紫外-可见扫描,扫描范围为190~900 nm,用超纯水作空白.
2.3.3 三维荧光光谱分析三维荧光光谱用CARY Eclipse荧光分光光度计 (美国Varian公司) 测定.测定荧光光谱时,先根据已测得的DOC值,将各待测水样DOC用超纯水稀释至2.0 mg·L-1.测定荧光光谱时用光程为1 cm的石英荧光比色皿盛装样品.激发和发射狭缝宽度均为5 nm,扫描速度为1200 nm·min-1,三维荧光光谱图的激发波长扫描范围为220~400 nm,发射波长扫描范围为280~550 nm,扫描间隔为1 nm.同步荧光光谱的波长扫描范围为190~600 nm,所采用的扫描间隔为60 nm.EEM数据采用Origin9.0软件进行处理,以等高线图表征,每条等高线间隔代表 4个单位荧光强度.
3 结果与讨论 (Results and discussion) 3.1 不同泥沙沉降条件下水体中DOC含量的变化由图 1可以看出,A和B取样口样品DOC含量不同,但变化规律相似.由图 2可知,在相同沉降条件下,A取样口DOC含量变化要大于B取样口.A取样口第1组1~6号样品随着沉降时间的增加,DOC含量呈现出先上升后下降的趋势.沉降时间为0.16 h时,DOC含量达到最大值6.61 mg·L-1.当沉降时间为6 h时,DOC含量达到最小值3.87 mg·L-1,与对照样品A0相比,降低了0.88 mg·L-1.B取样口第1组样品在沉降6 h后,DOC含量达到最小值3.94 mg·L-1,与对照样品B0相比,DOC含量降低了0.28 mg·L-1.与相同沉降时间条件下A取样口水样ΔDOC相比,少0.6 mg·L-1.第2组7~11号样品随着泥沙含量的增加,DOC含量呈现先下降后上升的趋势.由图 2可知,A、B两取样口的ΔDOC呈现先增大后减小的趋势,但A取样口的变化量要明显大于B取样口变化量.A取样口在泥沙含量为2.4 kg·m-3时,DOC含量降到最低,为2.93 mg·L-1,与对照样品A0相比,降低了1.82 mg·L-1,之后随着泥沙含量的增加,DOC含量逐渐增加,到泥沙含量为9.6 kg·m-3时,DOC含量达到4.64 mg·L-1.B取样口在泥沙含量为0.6 kg·m-3时,DOC含量达到最大,与对照样品B0相比,增加了0.18 mg·L-1,之后变化规律与A取样口相同.第3组12~14号样品随着pH的增加,DOC含量逐渐增加,ΔDOC则逐渐降低,且ΔDOC均大于0 mg·L-1,说明各水样的DOC含量均小于其对照样品A0与B0处的DOC值.A取样口样品DOC含量与对照样品A0相比,分别减少了1.77、0.93、0.27 mg·L-1;B取样口12~14号样品ΔDOC分别为1.31、0.58、0.43 mg·L-1.A取样口第4组样品DOC含量随着盐度的增加而逐渐减小,ΔDOC则逐渐增大;在盐度为5‰时,DOC含量最大为4.62 mg·L-1,当盐度为10‰时DOC含量为4.17 mg·L-1,与对照样品A0相比,降低了0.58 mg·L-1.B取样口DOC含量的变化规律与A取样口相似,在盐度为5‰时,DOC含量为最大,4.32 mg·L-1,与对照样品B0相比,增加了0.1 mg·L-1;当盐度为7.5‰和10‰时,DOC含量逐渐降低,与对照样品B0相比,分别降低了0.07、0.2 mg·L-1.
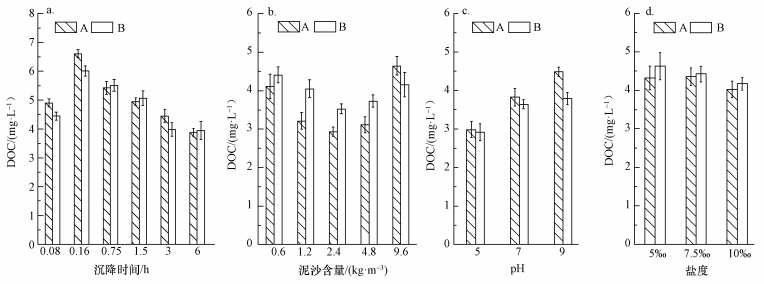 |
| 图 1 不同沉降时间 (a)、泥沙含量 (b)、pH (c)、盐度 (d) 条件下泥沙沉降导致的水体中DOC含量的变化 Fig. 1 Changes in DOC in water caused by sediment subsiding with different sedimentation time (a), different sediment concentration (b), different pH (c), and different salinity (d) |
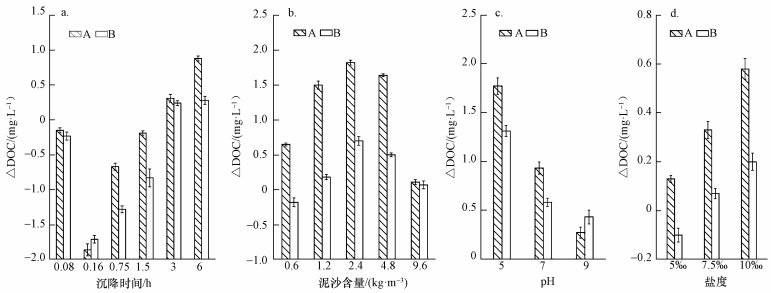 |
| 图 2 不同沉降时间 (a)、泥沙含量 (b)、pH (c)、盐度 (d) 条件下泥沙沉降前后水体中DOC含量的差值 Fig. 2 The difference of DOC in water before and after sediment subsiding with different sedimentation time (a), different sediment concentration (b), different pH (c), and different salinity (d) |
由实验结果分析可知,在悬浮泥沙存在的水体中,可溶性的腐殖酸易与疏水性有机物结合,使水体中可溶性有机质的含量增加 (Kile et al., 1989).随着泥沙沉降过程的不断进行,泥沙在水体中与溶解性有机物充分接触,从而使泥沙对水中溶解性有机物的吸附量不断增加.当泥沙浓度达到最大时,可溶解性有机碳吸附量降低,可能是因为随着泥沙浓度的增加,泥沙之间相互碰撞的几率增大,泥沙颗粒物是具有官能团的聚合体,因碰撞会发生絮凝,使比表面积减少,吸附点位减少 (吴振国, 2010),从而使其对溶解性有机碳的吸附量降低;还可能是由于腐殖酸是一类密度较低的高分子有机化合物, 当泥沙通过桥联作用与其结合在一起时,因泥沙颗粒周围包覆了腐殖酸而发生絮凝,使絮团密度降低,沉速减慢.泥沙的沉降会使水体呈现紊动状态,而天然河道的水体一般呈现紊动状态.研究表明,在紊动条件下泥沙对物质的吸附效果较好,原因是水流处于紊动状态时,泥沙和水中的物质接触更加充分 (应一梅等, 2012).但随着沉速减慢,水体中紊动状态变弱,使得泥沙对水体中溶解性有机物质吸附能力减弱.蒋国俊等 (2012)认为,水流对细颗粒泥沙絮凝沉降的影响在低流速时表现为促进絮凝作用,有助于泥沙沉降,在高流速作用时表现为阻滞絮凝作用.随着pH的不断增加,水中溶解性有机碳的酸性官能团羧基和酚羟基不断地解离,溶解性有机碳所带的负电荷逐渐增多,同时水体中H+的含量不断降低,而OH-含量不断增加,使得DOC在水体中排斥力增强 (杨毅等, 2015),不利于带负电荷的颗粒泥沙对DOC进行吸附.在不同盐度水体中,由于盐絮凝作用使细颗粒泥沙发生絮凝沉降 (吴荣荣等, 2007),正离子使颗粒泥沙产生絮团 (金鹰等, 2002),有利于对带负电荷的DOC进行吸附.对比A、B两取样口处的水样可知,下层水体中DOC含量的变化量要明显高于上层水体,这可能是由于泥沙沉降是自上而下的过程,下层水体与泥沙接触更加充分,更有利于泥沙对水体中可溶解性有机碳的吸附.
3.2 不同泥沙沉降条件下水体中DOM的紫外-可见光谱特性的变化DOM对光的吸收特性,可通过紫外-可见吸收光谱等光谱学手段进行表征 (Mladenov et al., 2010).虽然紫外可见光谱只能对DOM物质进行半定量的检测,但由于其方法简单且对样品无消耗和破坏,在DOM的研究中得到比较广泛的应用 (Nishijima et al., 2004).UV-254是指在波长为254 nm处的单位比色皿光程下的紫外吸光度,其值能够反映所测样品中腐殖质类大分子有机物及含C=C双键和C=O双键的芳香族化合物的多少 (Leenheer et al., 2003).ΔUV-254表示各水样反应前后254 nm处紫外吸光度的差值,其值为正,则表示所测样品中腐殖质类大分子有机物及含C=C双键和C=O双键的芳香族化合物的含量与对照样品相比减少;反之,则增加.特定波长下紫外吸收值对可溶性有机碳的比值 (SUVA) 可用来区分可溶性有机物组成 (Buffle et al., 1982).SUVA常被用于表征腐殖质样品中的芳香性结构,其值越高芳香性越强 (Mcknight et al., 2001).E2/E3是250 nm和365 nm处的紫外吸收值之比,有研究认为,E2/E3可以较好地反映腐殖酸的腐殖化、团聚化程度和分子量分布情况,E2/E3越小,则水溶性有机物的分子质量越大 (Artinger et al., 2000).
由图 3和图 4可以看出,A和B取样口第1组1~6号水样的UV-254先增大后减小,SUVA呈先增大后逐渐平衡的状态.说明在UV-254增加阶段,DOC的增加幅度不如UV-254的增加幅度明显,而在UV-254降低阶段两者的变化幅度相近.两取样口的E2/E3都在5号样品处达到最低,说明沉降3 h时,DOM的分子量达到最大.由图 5可以看出,A、B取样口水样的UV-254均在泥沙沉降时间为1.5 h时达到最大,分别为5.2和5.4 m-1,与对照样品A0和B0相比,分别增加了0.7和1.1 m-1.第2组7~11号样品的UV-254先减小后增大,这与DOC的变化趋势一致.SUVA则先增大后减小,说明水中芳香性有机物的含量先增多后减少,E2/E3则不断降低,说明分子量不断增大.A和B两取样点分别在泥沙含量为2.4和4.8 kg·m-3时,ΔUV-254达到最大,分别为0.9和0.6 m-1,说明此时所测样品中腐殖质类大分子有机物及含C=C双键和C=O双键的芳香族化合物的含量达到最低.第3组12~14号样品的UV-254和SUVA值变化趋势一致,呈增大趋势.A和B两取样口的E2/E3不断增大,说明水体中DOM中分子量在不断变小,这是因为随pH值增大,水体中DOM所带的负电荷逐渐增多,使得分子间排斥力增强,DOM分子体系共轭程度减弱而使DOM粒子聚合度降低,DOM的酸性官能团羧基和酚羟基不断地解离 (杨毅等, 2015).从图 5可知,A和B两取样点处各样品ΔUV-254逐渐降低,相同pH条件下,A取样点的ΔUV-254要大于B取样点处ΔUV-254.第4组15~17号样品的UV-254和SUVA随着盐度的增加而减小,说明水体的芳香性物质减少.E2/E3逐渐增大,说明水体中DOM分子量不断减小.这可能是因为带有正电荷的Na+使泥沙产生絮团,对带有负电荷的DOM具有很好的吸附作用,吸附作用破坏了DOM分子原本疏散的结构,使其成为分散的小分子.由图 5可知,当盐度为10‰时,A和B两取样口处的ΔUV-254达到最大,分别为1.0和0.6,说明下层水体的UV-254变化量要大于上层水体.
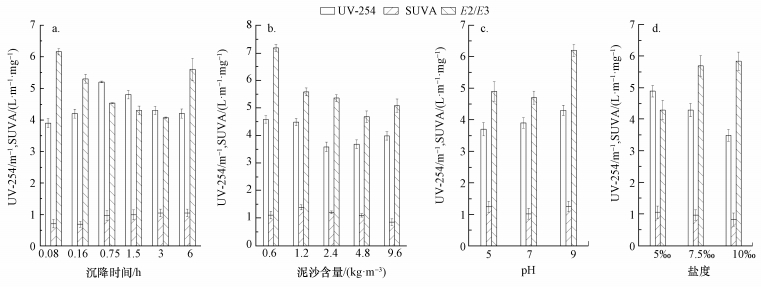 |
| 图 3 不同沉降时间 (a)、泥沙含量 (b)、pH (c)、盐度 (d) 条件下泥沙沉降导致的A取样口的UV-254、SUVA、E2/E3值的变化 Fig. 3 Changes in values of UV-254、SUVA、E2/E3 in sample point A caused by sediment subsiding with different sedimentation time (a), different sediment concentration (b), different pH (c), and different salinity (d) |
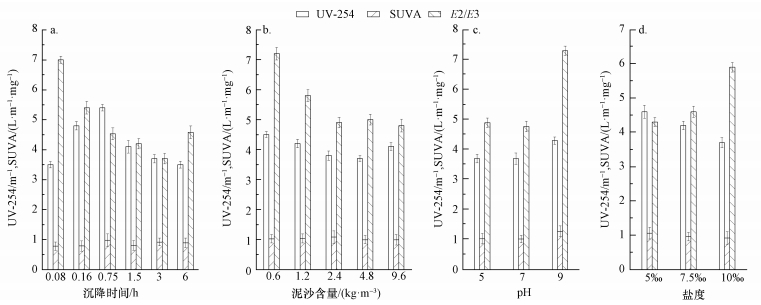 |
| 图 4 不同沉降时间 (a)、泥沙含量 (b)、pH (c)、盐度 (d) 条件下泥沙沉降导致的B取样口的UV-254、SUVA、E2/E3值的变化 Fig. 4 Changes in values of UV-254、SUVA、E2/E3 in sample point B caused by sediment subsiding with different sedimentation time (a), different sediment concentration (b), different pH (c), and different salinity (d) |
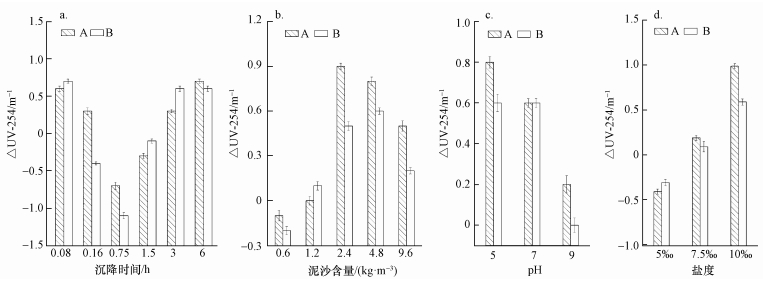 |
| 图 5 不同沉降时间 (a)、泥沙含量 (b)、pH (c)、盐度 (d) 条件下泥沙沉降前后水体中UV-254的差值 Fig. 5 The difference of UV-254 in water before and after sediment subsiding with different sedimentation time (a), different sediment concentration (b), different pH (c), and different salinity (d) |
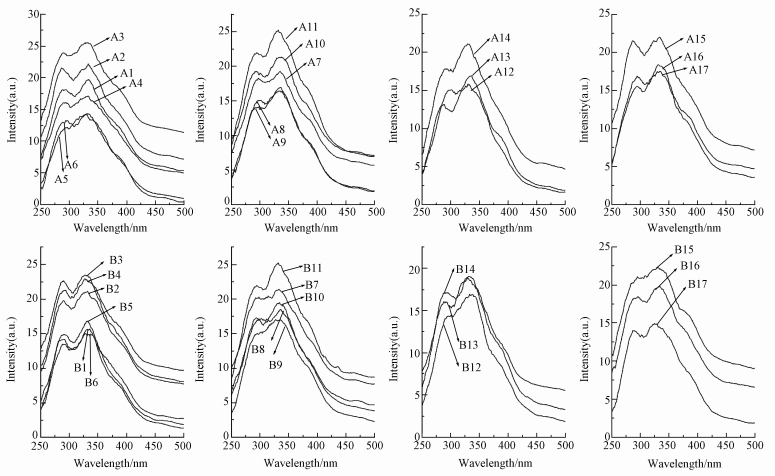
三维荧光光谱能够获得激发波长和发射波长同时变化时的荧光强度信息,能够揭示有机物的分类及其含量信息,并且可对多组分复杂体系中荧光光谱重叠的对象进行光谱识别和表征 (Chen et al., 2002).图 6各样品的三维荧光光谱图显示有2个显著荧光峰和2片“峰肩”.第1个峰在λEx/λEm=290~330 nm/410~440 nm区域内,是类腐殖酸荧光峰;第2个荧光峰在λEx/λEm=240~260 nm/405~440 nm区域内,是类富里酸荧光峰;第3个荧光峰在λEx/λEm=280~285 nm/330~345 nm区域内,是类溶解性微生物代谢产物荧光峰;第4个峰分布在激发波长 < 240 nm的区域内,是类芳香族蛋白质荧光峰.在本次实验中,类溶解性微生物代谢产物荧光峰和类芳香族蛋白质荧光峰以“峰肩”的形式存在.以上4个荧光区域中均有相应荧光峰出现,但类富里酸荧光峰和类腐殖酸荧光峰较为明显.这两类荧光峰来源于水体中DOM的腐殖过程,其强弱和峰位置与腐殖质的腐殖化程度有关 (Zhong et al., 2008),属于难降解DOM荧光区 (姚璐璐等, 2013).类蛋白荧光峰由DOM中的酪氨酸和色氨酸引起,与水体中微生物活动有关 (Zhong et al., 2008),属于易降解DOM荧光区.表 3给出了不同泥沙沉降条件下,样品各主要荧光峰位置和强度.由图 6和表 3可知,各荧光峰的强度均发生了变化,说明不同条件下泥沙沉降过程使水体中DOM组分中荧光物质的含量发生了变化.
 |
| 图 6 不同泥沙沉降条件下各样品中DOM的三维荧光谱图 Fig. 6 Three-dimensional fluorescence spectra of DOM in each sample with different sediment subsiding conditions |
| 表 3 不同泥沙沉降条件下各样品中DOM荧光峰的位置和强度 Table 3 Position and intensity of fluorescence peaks of DOM in each sample with different sediment subsiding conditions |
图 6中1~6号样品反映了泥沙经过不同沉降时间后,A和B取样口水样DOM的荧光光谱结果.由结果可以看出,经过不同泥沙沉降时间,水样的各荧光峰强度呈现先增大后减小的趋势.在沉降6 h后,A6和B6各荧光峰强度均达到最低 (图 6和表 3).在A3和B2样品中,类腐殖酸荧光峰和类富里酸荧光峰均发生了红移,红移主要是由羰基、羟基、氨基及羧基等官能团的增加引起的.这也进一步证明了在泥沙存在的水体环境中,溶解性腐殖酸易与疏水性有机物结合,使水体中可溶性有机物含量增加的结论.A和B的7~11号样品反映了经不同泥沙含量的泥沙沉降后,水体中DOM的三维荧光光谱结果.A9在泥沙含量为2.4 kg·m-3时,与A0相比,类腐殖酸荧光峰、类富里酸荧光峰、类溶解性微生物代谢产物荧光峰和类芳香族蛋白质荧光峰强度由39.91、52.41、33.33、44.16变为41.12、57.17、31.54、42.15,由此可以看出,类腐殖酸和类富里酸荧光物质增加,类溶解性微生物代谢产物荧光物质和类芳香族蛋白质荧光物质减少.这是因为泥沙和腐殖质通过桥联作用结合在一起 (刘启贞等, 2008),但因腐殖质所带的官能团不同,与泥沙的结合效果有所区别,泥沙与类溶解性微生物代谢产物荧光物质和类芳香族蛋白质荧光物质的结合要更好.当泥沙含量增加到9.6 kg·m-3时,A11和B11水样的各荧光峰强度均达到最大,由表 3可知,A11水样的类腐殖酸荧光峰和类富里酸荧光峰强度与A0相比,分别增加了25%和27%,而B11所对应的两处峰强与B0相比,则分别增加了20%和19%,这说明在泥沙沉降过程中,下层水体中荧光物质强度的变化要高于上层水体.
图 6中12~14号样品反映了在不同pH条件下,泥沙沉降后水体中DOM的三维荧光光谱结果.随着pH的增加,A和B两取样口的DOM的荧光峰强度均逐渐增加.从表 3可以看出,A14在pH=9的条件下,经过泥沙沉降作用,其类腐殖酸荧光峰红移至λEx/λEm=320 nm/419 nm处,荧光峰强度为42.93.类富里酸荧光峰强度与pH=5处的A12样品相比增加了3.57%.B14样品的类腐殖酸、类富里酸、类溶解性微生物代谢产物和类芳香族蛋白质荧光峰强度和B12相比,分别增加了12.77%、12.99%、8.88%和21.7%.由此可以看出,酸性条件更有利于泥沙对水体中DOM的吸附,且类芳香族蛋白质荧光物质受水体中pH值变化的影响最大,这可能与其理化性质有关.A和B取样口15~17号样品反映了不同盐度下泥沙沉降后水体中DOM的三维荧光光谱结果.从图 6和表 3可以看出,A和B取样口各荧光峰强度随着盐度的增加逐渐降低.A17在盐度为10‰的情况下,经泥沙沉降,类腐殖酸发生了蓝移,由未沉降时的λEx/λEm=330 nm /411 nm蓝移至310 nm /411 nm,荧光峰强度和未沉降时相比降低了13.9%.蓝移主要是由大分子有机物分解为小分子有机物或者分解破坏了稠环芳烃的多环结构等原因引起的 (Coble et al., 1990).这与在泥沙沉降情况下,随着盐度的增加,DOM分子量逐渐减小的结论相一致.
3.4 不同泥沙沉降条件下水体中DOM的同步荧光光谱特性的变化三维荧光光谱包含了DOM的全部指纹,但由于DOM的组分十分复杂,多种组分的荧光光谱发生重叠,对三维荧光光谱中包含的DOM结构的潜在信息进行识别比较困难.而同步荧光分析法具有谱图简化、选择性提高、光散射干扰减少等特点,并且不需要预分离,操作简便,可节省分析成本、缩短分析时间,尤其适合对多组分混合物的分析 (吴晓红等, 2008).
同步荧光法在扫描过程中使激发波长和发射波长彼此间保持固定的波长间隔 (Δλ=λem-λex=常数)(Chen et al., 2003).在同步荧光法中,Δλ的选择十分重要,这将直接影响到同步荧光光谱的形状、带宽和信号强度.在可能条件下,选择等于斯托克斯位移的Δλ(何立芳等, 2004).本次实验Δλ=60 nm.
由图 7可以看出,各样品DOM同步荧光光谱图中均显示2个明显的特征峰Ⅰ(λsyn=280~300 nm) 和峰Ⅱ(λsyn=330~350 nm).与图 6对比可知,峰Ⅰ位于类溶解性微生物代谢产物荧光区,有研究认为,此处代表了芳香性氨基酸 (色氨酸、酪氨酸和苯丙氨酸) 类物质及含有芳香性氨基酸的蛋白质 (Alberts et al., 2004);峰Ⅱ位于类腐殖酸荧光区,由图 6和图 7对比可知,该峰在两图中均是主要荧光峰.除以上2个显著特征峰外,在λsyn=375~390 nm处可以观察到一片“峰肩”,根据Smith等 (1999)的研究结果显示,该峰可能表示含有稠环结构的芳香性物质.从图 6和图 7可以看出,A、B两取样口中,第1组和第2组水样的特征峰变化趋势一致,但变化量有明显差别,由此可知,泥沙沉降时间和泥沙含量对水体DOM中荧光物质均有一定影响,但深度不同,影响度不同;第3组和第4组水样的特征峰变化规律相似,在pH和盐度不同的情况下,泥沙沉降对不同深度的水样中各荧光物质的影响均较为显著,因而变化规律相似.
 |
| 图 7 不同泥沙沉降条件下各样品中DOM的同步荧光谱图 Fig. 7 Synchronous fluorescence spectra of DOM in each sample with different sediment subsiding conditions |
1) 泥沙沉降条件下,水体中DOC随泥沙沉降时间的增长而先增大后减小,随泥沙含量的增加而先减小后增大,随pH的增大而增大,随盐度的增大而减小.
2) 随着pH的增大,水体中DOM的芳香性增强;随着盐度的增大,水体中DOM的芳香性降低.
3) 随着泥沙沉降时间的增长,DOM中各类荧光物质的含量先增加后减少.
4) 随着泥沙含量的增加,DOM中类腐殖酸和类富里酸荧光物质增加,类溶解性微生物代谢产物荧光物质和类芳香族蛋白质荧光物质减少.
| [${referVo.labelOrder}] | Aiken G R, Hsu Kim H, Ryan J N. 2011. Influence of dissolved organic matter on the environmental fate of metals, nanoparticles, and colloids[J]. Environmental Science & Technology, 45(8) : 3196–3201. |
| [${referVo.labelOrder}] | Alberts J J, Takács M. 2004. Comparison of the natural fluorescence distribution among size fractions of terrestrial fulvic and humic acids and aquatic natural organic matter[J]. Organic Geochemistry, 35(10) : 1141–1149. DOI:10.1016/j.orggeochem.2004.06.010 |
| [${referVo.labelOrder}] | Artinger R, Buckau G, Geyer S, et al. 2000. Characterization of groundwater humic substances:influence of sedimentary organic carbon[J]. Applied Geochemistry, 15(1) : 97–116. DOI:10.1016/S0883-2927(99)00021-9 |
| [${referVo.labelOrder}] | Buffle J, Deladoey P. 1982. Analysis and characterization of natural organic matters in freshwaters[J]. Aquatic Sciences, 44(2) : 363–391. DOI:10.1007/BF02502298 |
| [${referVo.labelOrder}] | 蔡玲, 尹则高, 张晓军, 等. 2009. 泥沙沉降研究现状浅析[J]. 中国水运月刊, 2009, 9(8) : 193–194. |
| [${referVo.labelOrder}] | 陈洪松, 邵明安. 2001. 有机质对细颗粒泥沙静水絮凝沉降特性的影响[J]. 泥沙研究, 2001(3) : 35–39. |
| [${referVo.labelOrder}] | Chen J, Gu B, Leboeuf E J, et al. 2002. Spectroscopic characterization of the structural and functional properties of natural organic matter fractions[J]. Chemosphere, 48(1) : 59–68. DOI:10.1016/S0045-6535(02)00041-3 |
| [${referVo.labelOrder}] | Chen J, Leboeuf E J, Dai S, et al. 2003. Fluorescence spectroscopic studies of natural organic matter fractions[J]. Chemosphere, 50(5) : 639–647. DOI:10.1016/S0045-6535(02)00616-1 |
| [${referVo.labelOrder}] | Chiou C T.2002.Partition and Adsorption of Organic Contaminants in Environmental Systems[M].Hoboken, New Jersey:John Wiley & Sons, Inc.124-128 |
| [${referVo.labelOrder}] | Coble P G, Green S A, Blough N V, et al. 1990. Characterization of dissolved organic matter in the Black Sea by fluorescence spectroscopy[J]. Nature, 348(29) : 432–435. |
| [${referVo.labelOrder}] | 丁辉. 2005. 大沽排污河POPs归趋行为[D]. 天津: 天津大学. 1-155 |
| [${referVo.labelOrder}] | 冯伟莹, 焦立新, 张生, 等. 2013. 乌梁素海沉积物溶解性有机质荧光光谱特性[J]. 中国环境科学, 2013, 33(6) : 1068–1074. |
| [${referVo.labelOrder}] | Fuentes M, González Gaitano G, Garcia Mina J M. 2006. The usefulness of UV-visible and fluorescence spectroscopies to study the chemical nature of humic substances from soils and composts[J]. Organic Geochemistry, 37(12) : 1949–1959. DOI:10.1016/j.orggeochem.2006.07.024 |
| [${referVo.labelOrder}] | 甘淑钗, 吴莹, 鲍红艳, 等. 2013. 长江溶解有机质三维荧光光谱的平行因子分析[J]. 中国环境科学, 2013, 33(6) : 1045–1052. |
| [${referVo.labelOrder}] | 郭瑾, 马军. 2007. 天然有机物提取及表征技术近期发展动态[J]. 现代化工, 2007, 27(2) : 12–16. |
| [${referVo.labelOrder}] | Guo X J, Yuan D H, Jiang J Y, et al. 2013. Detection of dissolved organic matter in saline-alkali soils using synchronous fluorescence spectroscopy and principal component analysis[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 104(3) : 280–286. |
| [${referVo.labelOrder}] | 郭勇. 2016. 沈阳市新开河省政府示范段水生态治理[J]. 中国高新技术企业, 2016(4) : 83. |
| [${referVo.labelOrder}] | 何立芳, 林丹丽, 李耀群. 2004. 同步荧光分析法的应用及其新进展[J]. 化学进展, 2004, 16(6) : 879–885. |
| [${referVo.labelOrder}] | 黄海强. 2008. 三峡库区泥沙沉降对浮游生物的影响研究[D]. 重庆: 西南大学. 1-71 |
| [${referVo.labelOrder}] | 黄岁梁, WaiO W H. 1998. 水环境污染物迁移转化研究与泥沙运动[J]. 水科学进展, 1998, 9(3) : 205–211. |
| [${referVo.labelOrder}] | 蒋国俊, 姚炎明, 唐子文. 2002. 长江口细颗粒泥沙絮凝沉降影响因素分析[J]. 海洋学报, 2002, 24(4) : 51–57. |
| [${referVo.labelOrder}] | 金鹰, 王义刚, 李宇. 2002. 长江口粘性细颗粒泥沙絮凝试验研究[J]. 河海大学学报:自然科学版, 2002, 30(3) : 61–63. |
| [${referVo.labelOrder}] | Kile D E, Chiou C T. 1989. Water solubility enhancements of DDT and trichlorobenzene by some surfactants below and above the critical micelle concentration[J]. Environmental Science Technology, 23(7) : 832–838. DOI:10.1021/es00065a012 |
| [${referVo.labelOrder}] | Leenheer J A, Croué J P. 2003. Characterizing aquatic dissolved organic matter[J]. Environmental Science & Technology, 37(1) : 18–26. |
| [${referVo.labelOrder}] | 刘博, 杨爱. 2007. 多泥沙河流中泥沙与污染物相互作用机理研究进展[J]. 江苏环境科技, 2007, 20(z2) : 101–103. |
| [${referVo.labelOrder}] | 刘启贞, 李九发, 徐灿华, 等. 2008. 盐度和腐殖酸共同作用下的长江口泥沙絮凝过程研究[J]. 海洋学报:中文版, 2008, 30(3) : 140–147. |
| [${referVo.labelOrder}] | 罗固源, 朱虹, 许晓毅, 等. 2011. 嘉陵江重庆段沉积物中腐殖酸的特性研究[J]. 光谱学与光谱分析, 2011, 31(6) : 1663–1667. |
| [${referVo.labelOrder}] | Lyon B A, Cory R M, Weinberg H S. 2014. Changes in dissolved organic matter fluorescence and disinfection byproduct formation from UV and subsequent chlorination/chloramination[J]. Journal of Hazardous Materials, 264(2) : 411–419. |
| [${referVo.labelOrder}] | Mcknight D M, Boyer E W, Westerhoff P K, et al. 2001. Spectrophotometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology & Oceanography, 46(1) : 38–48. |
| [${referVo.labelOrder}] | Mladenov N, Zheng Y, Miller M P, et al. 2010. Dissolved organic matter sources and consequences for iron and arsenic mobilization in Bangladesh aquifers[J]. Environmental Science & Technology, 44(1) : 123–128. |
| [${referVo.labelOrder}] | Nishijima W, Speitel G E. 2004. Fate of biodegradable dissolved organic carbon produced by ozonation on biological activated carbon[J]. Chemosphere, 56(2) : 113–119. DOI:10.1016/j.chemosphere.2004.03.009 |
| [${referVo.labelOrder}] | 热合曼江·吾甫尔, 刘英, 包安明, 等. 2014. 博斯腾湖沉积物孔隙水中溶解有机质的三维荧光光谱特征[J]. 干旱区研究, 2014, 31(1) : 176–181. |
| [${referVo.labelOrder}] | Sierra M M D, Giovanela M, Parlanti E, et al. 2005. Fluorescence fingerprint of fulvic and humic acids from varied origins as viewed by single-scan and excitation/emission matrix techniques[J]. Chemosphere, 589(6) : 715–733. |
| [${referVo.labelOrder}] | Smith D S, Kramer J R. 1999. Fluorescence analysis for multi-site aluminum binding to natural organic matter[J]. Environment International, 25(2/3) : 295–306. |
| [${referVo.labelOrder}] | Sun W L, Ni J R, Xu N, et al. 2007. Fluorescence of sediment humic substance and its effect on the sorption of selected endocrine disruptors[J]. Chemosphere, 66(4) : 700. DOI:10.1016/j.chemosphere.2006.07.078 |
| [${referVo.labelOrder}] | Tejeda Agredano M C, Mayer P, Ortega Calvo J J. 2014. The effect of humic acids on biodegradation of polycyclic aromatic hydrocarbons depends on the exposure regime[J]. Environmental Pollution, 184(104) : 435–442. |
| [${referVo.labelOrder}] | 王法东, 黄勇, 李旭东, 等. 2003. 沈阳市新开河综合治理工程的改造[J]. 沈阳建筑大学学报:自然科学版, 2003, 19(3) : 221–223. |
| [${referVo.labelOrder}] | 吴荣荣, 李九发, 刘启贞, 等. 2007. 钱塘江河口细颗粒泥沙絮凝沉降特性研究[J]. 海洋湖沼通报, 2007(3) : 29–34. |
| [${referVo.labelOrder}] | 吴晓红, 高生平. 2008. 同步荧光技术的应用进展[J]. 光谱实验室, 2008, 25(4) : 651–654. |
| [${referVo.labelOrder}] | 吴振国. 2010. 长江万州段悬浮泥沙颗粒物对邻苯二甲酸酯的吸附解吸特性研究[D]. 重庆: 重庆大学. 1-65 |
| [${referVo.labelOrder}] | 杨毅, 杨霞霞, 马新培, 等. 2015. pH对城市污水二级出水中溶解性有机物的荷电、聚集与光谱特性的影响[J]. 环境化学, 2015, 34(10) : 1804–1808. |
| [${referVo.labelOrder}] | 姚璐璐, 涂响, 于会彬, 等. 2013. 三维荧光区域积分评估城市污水中溶解性有机物去除[J]. 环境工程学报, 2013, 7(2) : 411–416. |
| [${referVo.labelOrder}] | 应一梅, 李海华, 秦馨. 2012. 静态和紊动条件下黄河泥沙对砷的吸附规律[J]. 人民黄河, 2012, 34(7) : 85–86. |
| [${referVo.labelOrder}] | 岳杰. 2011. 沈阳城市运河污染分析及治理措施研究[J]. 中国水运月刊, 2011, 11(12) : 146–147. |
| [${referVo.labelOrder}] | 张海平, 朱宜平, 陈玲, 等. 2008. 悬浮泥沙对酚类化合物的吸附特性研究[J]. 环境科学, 2008, 29(1) : 71–76. |
| [${referVo.labelOrder}] | Zhong R S, Zhang X H, Guan Y T. 2008. Three-dimensional fluorescence fingerprint for source determination of dissolved organic matters in polluted river[J]. Spectroscopy and Spectral Analysis, 28(2) : 347–351. |
| [${referVo.labelOrder}] | Zhu G C, Yin J, Zhang P, et al. 2014. DOM removal by flocculation process:Fluorescence excitation-emission matrix spectroscopy (EEMs) characterization[J]. Desalination, 346(8) : 38–45. |
 2017, Vol. 37
2017, Vol. 37


