2. 中国环境科学研究院环境基准与风险评估国家重点实验室, 北京 100012
2. State Key Laboratory of Environmental Criteria and Risk Assessment, Chinese Research Academy of Environmental Sciences, Beijing 100012
随着纳米材料种类和在各个领域使用的不断增加, 势必导致纳米材料通过水体、大气等途径进入环境 (Auffan et al., 2009; Bai et al., 2010; Colvin, 2003; Fiorino, 2010; O′Brien et al., 2011).随着材料尺寸不断减小到达纳米尺度时, 其表面积和表面可达到宏观材料的几十到几百万倍 (Cao et al., 2011).较高的表面能导致排放到环境的纳米材料更容易与环境中的有机、无机组分发生物理化学反应, 干扰生物的生理代谢过程, 导致其显著的环境风险 (Auffan et al., 2009; Godinez et al., 2011; Hu et al., 2010; Moore, 2006; Zhang et al., 2009; Zhang et al., 2008).许多研究表明, 纳米材料能在生物体内蓄积, 导致细胞癌变、组织、器官功能紊乱 (Dhawan et al., 2010; Magrez et al., 2006; Sharifi et al., 2012).
纳米材料在水体中的迁移过程是影响其环境风险的重要因素之一.水体中影响纳米材料迁移扩散的主要因素有天然有机质、无机金属离子和水体酸碱度 (Aiken et al., 2011; Philippe et al., 2014).有研究表明, 有机质吸附在纳米材料表面能增加其颗粒间的静电斥力, 从而增加其环境稳定性, 促进纳米材料在水体中的扩散 (Johnson et al., 2009).而自然水体中Na+、Mg2+、Ca2+的浓度和分布因地质结构、气候及水文等特征而存在差异, 目前, 有关水体中常规金属离子 (Na+、Mg2+、Ca2+) 影响纳米材料迁移过程的研究较少.仅有的部分研究表明, 作为离子强度, Na+、Mg2+、Ca2+随着浓度的增加可以导致纳米材料水合离子半径增加, 进而使其发生沉降;但各金属离子对不同纳米材料的聚沉作用有显著差异, 其间作用机理尚不清楚 (Badawy et al., 2010; Li et al., 2014; Phenrat et al., 2007).
因此, 本研究以Fe3O4 MNPs为目标, 借助紫外可见光谱技术研究Na+、Mg2+、Ca2+、Sr2+和Ba2+对其沉降的动力学过程的影响, 分析不同pH条件下, 金属离子的浓度梯度、价态及原子量对该纳米材料的沉降作用的影响机理.
2 实验材料与方法 (Materials and methods) 2.1 实验材料NaOH (AR级) 和HCl (36.0%~38.0%) 购置于北京化工厂;FeCl2.4H2O (AR级) 和氨水 (25%~28%) 购置于汕头市西陇化工厂有限公司;FeCl3·6H2O、NaCl、MgCl2·6H2O、CaCl2·2H2O、SrCl2·4H2O、BaCl2·4H2O均为AR级, 购置于国药集团化学试剂有限公司;所有实验用水由Millipore integral 5超纯水系统提供, 出水电导率为18.2 MΩ·cm.
2.2 纳米材料制备和分析方法本研究依据相关文献 (Zhao et al., 2008) 采用水热合成法制备Fe3O4 MNPs.用超纯水清洗纳米颗粒5~6次, 以去除Na+的干扰, 并用离子选择电极测得Na+浓度小于0.5 mmol·L-1.将清洗后的Fe3O4 MNPs定容得到20 mg·mL-1的混合液.本研究借助透射电镜 (Transmission Electron Microscope, TEM, Hitachi, Japan) 对Fe3O4 MNPs进行表征, 工作电压为80 kV.沉降实验操作过程:分别向20 mL浓度为0、1.0、10.0、100.0 mmol·L-1的金属离子 (Na+、Mg2+、Ca2+、Sr2+和Ba2+) 溶液中加入50 μL上述Fe3O4 MNPs混合液, 用HCl (1.0 mol·L-1) 和NH3·H2O (1.0 mol·L-1) 调节各样品pH至5.0±0.1和9.0±0.1, 将样品摇匀并超声分散后, 用紫外可见分光光度计 (Agilent 8453 UV-visible spectrometer) 连续测定Fe3O4 MNPs的沉降动力学过程.红外光谱表征样品制备:向1.0 L 1.0 mmol·L-1的各金属溶液中分别加入2.5 mL 20 mg·L-1的Fe3O4 MNPs水分散液, 分别调节pH为5.0±0.1和9.0±0.1, 当各样品pH稳定后, 在外加磁场保护下, 移除上清液, 样品经冷冻干燥后, 100 ℃下再次干燥4 h, 进行红外光谱表征 (Thermo Scientific Nicolet iS5 FT-IR Spectrometer).
3 结果与讨论 (Results and discussion) 3.1 纳米材料表征和分析采用水热合成法得到的MNPs粒径约为10 nm, 颗粒尺寸均匀 (图 1a), 由于纳米材料尺寸较小, 表面张力较大, 导致纳米颗粒稍有团聚 (Wang et al., 2015; Zhao et al., 2008).MNPs的红外光谱图表明 (图 1b), 在570 nm处有很强的吸收峰, 表明合成的MNPs符合实验要求.采用紫外可见分光光度计测定Fe3O4 MNPs (图 1c), 结果表明,溶液中Fe3O4 MNPs的悬浮浓度和381 nm处的紫外吸收强度具有显著线性关系 (R2=0.9998, p < 0.01).因此, 采用紫外可见分光光谱仪能够满足定量分析纳米MNPs实验要求.
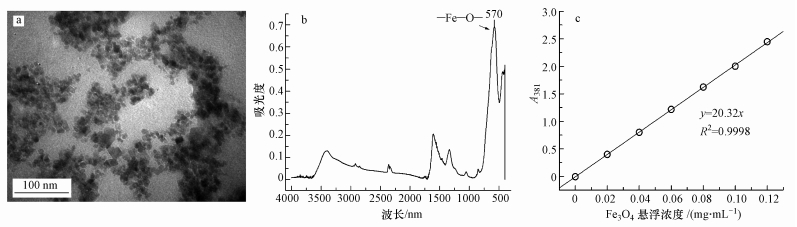 |
| 图 1 Fe3O4 MNPs表征及分析标线 (a.透射电镜图, b.红外光谱图, c.紫外可见光光谱标线图) Fig. 1 Characterization and calibration curve of Fe3O4 MNPs (a. TEM image, b.FT-IR image, c. calibration curve with UV-visible spectroscopy) |
当pH为5.0时, 水溶液中的Fe3O4 MNPs随着时间延长发生沉降 (图 2a、c、e、g和i).但随着各金属离子浓度的增加, 5种金属离子对Fe3O4 MNPs沉降的促进作用整体上表现为先减弱后增强.当MNPs溶液未添加金属离子时, Fe3O4 MNPs 2 h内悬浮颗粒量比例约为90%, 表明自然沉降率约为10%;当Fe3O4 MNPs溶液中分别加入1.0 mmol·L-1的Na+、Mg2+、Ca2+、Sr2+和Ba2+时, 2 h后悬浮的Fe3O4 MNPs比例分别为94.7%、93.1%、92.0%、87.3%和85.3%;当Fe3O4 MNPs溶液中分别加入10.0 mmol·L-1的上述5种金属离子时, 2 h后悬浮的Fe3O4 MNPs比例分别为92.1%、91.2%、91.0%、86.2.4 %和84.5%;加入100.0 mmol·L-1上述5种金属离子时, 对应的悬浮颗粒比例分别为60.4%、72.9%、71.8%、71.4%、65.5%.表明酸性条件下, 当金属离子浓度小于10.0 mmol·L-1时, 各金属离子对MNPs的沉降作用不显著.有研究表明, Fe3O4 MNPs的等电点约为7.2;当pH小于等电点时, 纳米材料表面因静电作用吸附阳离子而带正电, 随着溶液中金属离子浓度增加, 较强的离子强度导致纳米材料表面的双电层被显著压缩, 导致纳米颗粒间的静电斥力减弱而发生团聚, 因此, 当金属离子浓度大于10.0 mmol·L-1时, 金属离子对Fe3O4 MNPs的沉降较为显著.值得注意的是, 随着各金属离子浓度的增加, 5种金属离子对Fe3O4 MNPs的沉降作用存在差异.较未添加金属离子的MNPs溶液, 原子量较小的金属离子在低浓度 (1.0、10.0 mmol·L-1) 时促使Fe3O4 MNPs沉降率变慢, 一定程度上增加了Fe3O4 MNPs的水相稳定性;然而随着原子量增加, 这种稳定作用逐渐消失, 如1.0 mmol·L-1和10.0 mmol·L-1的Ba2+未呈现出对Fe3O4 MNPs的促进稳定作用.表明环境中低浓度的Na+、Mg2+、Ca2+有助于MNPs的迁移;同时, 随着原子量增加, 5种金属离子对MNPs的沉降作用存在递变性, 可能与离子强度、金属离子的水合能及溶液中H+的竞争吸附相关.
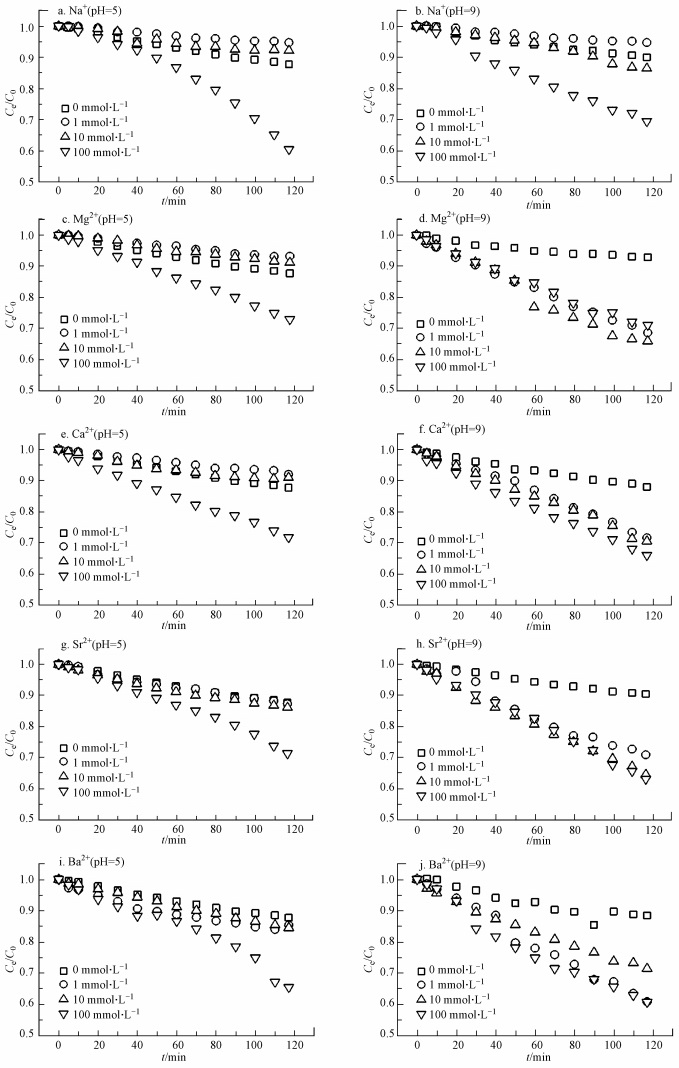 |
| 图 2 各金属离子对Fe3O4 MNPs沉降动力学过程的影响 Fig. 2 Effect of metal cations on dynamical sedimentation of Fe3O4 MNPs |
当溶液pH为9.0时, 随着时间延长, Fe3O4 MNPs逐渐发生沉降 (图 2b、d、f、h和j).未添加金属离子的Fe3O4 MNPs 2 h后悬浮颗粒比例为89.9%±1.9%, 自然沉降率约为10%, 这和酸性条件下Fe3O4 MNPs的自然沉降率相同.5种金属离子对Fe3O4 MNPs的沉降作用表现出显著差异.Na+对Fe3O4 MNPs的沉降作用随着金属离子浓度的增加先减弱后显著增强;1.0 mmol·L-1和10.0 mmol·L-1的Na+未显著影响Fe3O4 MNPs的沉降, 而100.0 mmol·L-1的Na+导致Fe3O4 MNPs的沉降率显著增加.二价金属离子对Fe3O4 MNPs的沉降作用在各浓度梯度未表现明显差异, 说明碱性条件下, 金属离子的价态显著影响Fe3O4 MNPs的沉降作用.各浓度梯度的碱土金属对Fe3O4 MNPs的沉降作用未表现显著差异, 可能原因是各碱土金属离子对Fe3O4 MNPs的聚沉浓度不超过1.0 mmol·L-1, 当溶液中金属离子浓度大于1.0 mmol·L-1时, Fe3O4 MNPs表面和周围分布较多的电解质离子显著压缩Fe3O4 MNPs的双电层, 在较强的范德华引力作用下, MNPs彼此发生团聚, 因此, 大于1.0 mmol·L-1的碱土金属离子对Fe3O4 MNPs的沉降效果相同 (Pashley, 1981; Pashley et al., 1984).依据Schulze-Hardy规律, 一价和二价金属离子导致MNPs团聚的浓度与其价态的倒数的6次方成反比, 即约为100:1.5 (Chowdhury et al. 2013).当pH为9.0时, 本研究中Na+导致Fe3O4 MNPs沉降加速的浓度为100.0 mmol·L-1, 而碱土金属离子促进Fe3O4 MNPs沉降加速的浓度为1.0 mmol·L-1, 符合该定律.
3.3 斜率拟合分析和讨论金属离子对Fe3O4 MNPs的沉降作用随着时间的推移呈现线性降低, 其线性斜率即为Fe3O4 MNPs的沉降速率.由于Fe3O4 MNPs的沉降速率随金属离子浓度和种类的不同而呈现差异性, 因此, 本研究分析了不同浓度的金属离子对Fe3O4 MNPs的沉降影响.如图 3所示, 酸性 (pH=5) 和碱性 (pH=9) 条件下, 各碱土金属离子对Fe3O4 MNPs的聚沉显著不同.当pH为5.0时, 5种金属离子导致Fe3O4 MNPs的沉降速率随着原子量的增加而增加.由于酸性条件下, Fe3O4 MNPs因吸附阳离子 (H+、碱金属和碱土金属离子等), 导致其表面带正电, 形成双电层;此时不仅受到颗粒间的静电斥力和范德华引力作用, 同时还与溶液中的其他金属离子发生静电作用等;此外, 随着离子强度增加, Fe3O4 MNPs表面双电层逐渐压缩, 导致纳米材料聚沉, 因此, 其间作用机理较为复杂.这可能是由于原子量较大的金属离子更容易失去结合的水分子, 促使其更易吸附在Fe3O4 MNPs表面, 导致其聚沉较为显著.值得注意的是, 在酸性条件和碱性条件下, Fe3O4 MNPs的沉降速率差异较大 (图 3), 可能原因就是H+与本研究的5种金属离子之间的竞争吸附引起的.相比之下, 当pH为9.0时, 没有H+的干扰, Fe3O4 MNPs表面因吸附OH-等阴离子带负电.由于Fe3O4 MNPs与碱土金属离子之间的静电引力较强, 导致其表面负电荷持续消弱, 随着Fe3O4 MNPs在范德华引力作用下相互靠近而逐渐发生团聚, 导致其聚沉.
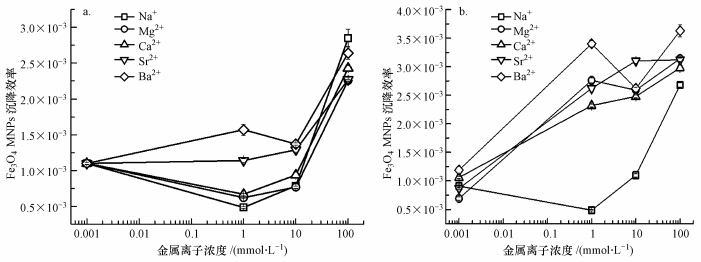 |
| 图 3 金属离子浓度对Fe3O4 MNPs的沉降效率的影响 (a.pH=5, b.pH=9) Fig. 3 Effect of the concentration of metal cations on the sedimentation rate of Fe3O4 MNPs (a.pH=5, b.pH=9) |
水环境中, Fe3O4 MNPs表面官能团与水体中的H+和OH-结合形成羟基官能团 (Heston et al., 1960; Wang et al., 2013).当加入Na+、Mg2+、Ca2+、Sr2+和Ba2+时, 在静电引力和范德华力的共同作用下, 这些金属离子吸附在Fe3O4 MNPs表面, 与被吸附的H+在Fe3O4 MNPs表面形成竞争作用 (Banerjee et al., 2007).如图 4所示, 当pH为5.0时, 1.0 mmol·L-1各金属离子与Fe3O4 MNPs作用表现为:随着原子量的增加, Fe3O4 MNPs表面的羟基缔合峰 (3415 cm-1) 逐渐增加.由于各金属离子在Fe3O4 MNPs表面吸附, 形成氧化物, 在631 cm-1处形成吸收特征峰, 该峰随着Na+、Mg2+、Ca2+、Sr2+和Ba2+而逐渐增强, 表明Fe3O4 MNPs对原子量大的金属离子可能有较强的吸附能力 (杨南如等, 2000);同时, 吸附在Fe3O4 MNPs表面的各金属离子在400~440 cm-1形成一个吸收峰平台, 该平台也随着金属离子原子量的增加而增强 (Qiu et al., 2003; 刘国良等, 2010).当pH为9.0时, 5种金属离子与Fe3O4 MNPs相互作用的红外吸收峰及递变规律与酸性条件基本一致, 表现为随着金属原子量的增加, 在3415 cm-1处的羟基缔合峰逐渐增强;同时, 对应的金属离子在630 cm-1附近和在400~440 cm-1处的吸收峰也逐渐增强.但在碱性条件下, 样品的红外吸收峰较酸性条件弱, 可能是由于Fe3O4 MNPs发生团聚, 导致二价金属离子或者Fe3O4 MNPs表面结合的羟基减弱.基于上述FTIR分析表明, 当加入1.0 mmol·L-1的各金属离子时, Fe3O4 MNPs表面的羟基特征峰和金属离子结合特征峰随着金属原子量增加而增加;导致Fe3O4 MNPs表面羟基官能团增加的可能原因是Fe3O4 MNPs对原子量较大的金属离子的吸附较强, 被吸附的金属离子与水体中的OH-发生吸附或者与水分子形成结合水, 导致Fe3O4 MNPs表面有很强的羟基红外吸收特征峰.已有研究表明, Na+、Mg2+、Ca2+、Sr2+和Ba2+与水分子的结合能大小依次为Mg2+>Ca2+>Sr2+>Ba2+≈Na+, 因此, 水结合能弱的金属离子更易于失去外层吸附的水分子, 有利于吸附在Fe3O4 MNPs表面, 导致Fe3O4 MNPs表面对各金属离子的吸附量随着原子量的增加而增加 (Pham et al., 2009; Rodgers et al., 2016; Rodriguez Cruz et al., 1999).但这一过程的相互作用较为复杂, 需要进一步深入开展相关研究.
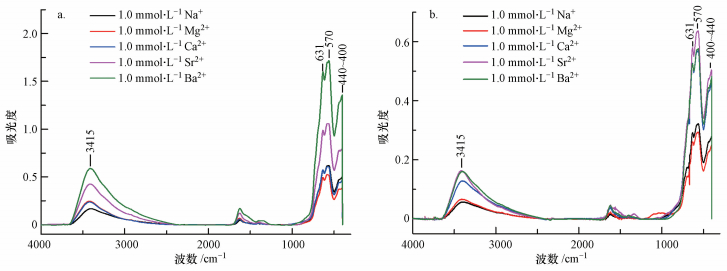 |
| 图 4 1.0 mmol·L-1的各金属离子与Fe3O4 MNPs相互作用的FTIR表征 (a.pH=5, b.pH=9) Fig. 4 FTIR spectrum characteristics of Fe3O4 MNPs with 1.0 mmol·L-1 metal cations at pH 5.0(a) and 9.0(b) |
1) 酸性条件下, Na+、Mg2+、Ca2+、Sr2+和Ba2+对Fe3O4 MNPs沉降的影响受到H+的干扰.低于1.0 mmol·L-1的Na+、Mg2+、Ca2+能增加Fe3O4 MNPs的稳定性, 有助于纳米材料在水环境中的扩散.
2) 碱性条件下, 碱土金属离子能促进Fe3O4 MNPs沉降, 相比之下, 低于1.0 mmol·L-1的Na+能增加Fe3O4 MNPs的水相稳定性, 有助于纳米材料的迁移.
3) Na+、Mg2+、Ca2+、Sr2+和Ba2+对Fe3O4 MNPs的沉降作用随着原子量的增加而增加, 水合能、电负性可能是影响该过程的潜在原因.
| [${referVo.labelOrder}] | Aiken G R, Hsu Kim H, Ryan J N. 2011. Influence of dissolved organic matter on the environmental fate of metals, nanoparticles, and colloids[J]. Environmental Science & Technology, 45(8) : 3196–3201. |
| [${referVo.labelOrder}] | Auffan M, Rose J, Bottero J Y, et al. 2009. Towards a definition of inorganic nanoparticles from an environmental, health and safety perspective[J]. Nature Nanotechnology, 4(10) : 634–641. DOI:10.1038/nnano.2009.242 |
| [${referVo.labelOrder}] | Badawy A M E, Luxton T P, Silva R G, et al. 2010. Impact of environmental conditions (pH, ionic strength, and electrolyte type) on the surface charge and aggregation of silver nanoparticles suspensions[J]. Environmental Science & Technology, 44(4) : 1260–1266. |
| [${referVo.labelOrder}] | Bai Y, Lin D, Wu F, et al. 2010. Adsorption of Triton X-series surfactants and its role in stabilizing multi-walled carbon nanotube suspensions[J]. Chemosphere, 79(4) : 362–367. DOI:10.1016/j.chemosphere.2010.02.023 |
| [${referVo.labelOrder}] | Banerjee S S, Chen D H. 2007. Fast removal of copper ions by gum arabic modified magnetic nano-adsorbent[J]. Journal of Hazardous Materials, 147(3) : 792–799. DOI:10.1016/j.jhazmat.2007.01.079 |
| [${referVo.labelOrder}] | Cao G, Wang Y. 2011. Nanostructures and Nanomaterials:Synthesis, Properties and Applications[M]. Singapore: Word Scientific Publishing Co.Pte.Ltd. |
| [${referVo.labelOrder}] | Chowdhury I, Duch M C, Mansukhani N D, et al. 2013. Colloidal properties and stability of graphene oxide nanomaterials in the aquatic environment[J]. Environmental Science & Technolog, 47(12) : 6288–6296. |
| [${referVo.labelOrder}] | Colvin V L. 2003. The potential environmental impact of engineered nanomaterials[J]. Nature Biotechnology, 21(10) : 1166–1170. DOI:10.1038/nbt875 |
| [${referVo.labelOrder}] | Dhawan A, Sharma V. 2010. Toxicity assessment of nanomaterials:methods and challenges[J]. Analytical and Bioanalytical Chemistry, 398(2) : 589–605. DOI:10.1007/s00216-010-3996-x |
| [${referVo.labelOrder}] | Fiorino D J.2010.Voluntary initiatives, regulation, and nanotechnology oversight:charting a path[Z].Project on Emerging Nanotechnologies, 19 |
| [${referVo.labelOrder}] | Godinez I G, Darnault C J G. 2011. Aggregation and transport of nano-TiO2 in saturated porous media:Effects of pH, surfactants and flow velocity[J]. Water Research, 45(2) : 839–851. DOI:10.1016/j.watres.2010.09.013 |
| [${referVo.labelOrder}] | Heston W M, Iler R K, Sears G W. 1960. The adsorption of hydroxyl ions from aqueous solution on the surface of amorphous silica[J]. The Journal of Physical Chemistry, 64(1) : 147–150. DOI:10.1021/j100830a035 |
| [${referVo.labelOrder}] | Hu J, Zevi Y, Kou X, et al. 2010. Effect of dissolved organic matter on the stability of magnetite nanoparticles under different pH and ionic strength conditions[J]. Science of the Total Environment, 408(16) : 3477–3489. DOI:10.1016/j.scitotenv.2010.03.033 |
| [${referVo.labelOrder}] | Johnson R L, Johnson G O B, Nurmi J T, et al. 2009. Natural organic matter enhanced mobility of nano zerovalent iron[J]. Environmental Science & Technology, 43(14) : 5455–5460. |
| [${referVo.labelOrder}] | Li W, Liu D, Wu J, et al. 2014. Aqueous aggregation and surface deposition processes of engineered superparamagnetic iron oxide nanoparticles for environmental applications[J]. Environmental Science & Technology, 48(20) : 11892–11900. |
| [${referVo.labelOrder}] | 刘国良, 朱一民, 房鑫, 等. 2010. 不同粒度纳米氧化镁的制备及其红外吸收特性[J]. 东北大学学报 (自然科学版), 2010, 31(8) : 1192–1195. |
| [${referVo.labelOrder}] | Magrez A, Kasas S, Salicio V, et al. 2006. Cellular toxicity of carbon-based nanomaterials[J]. Nano Letters, 6(6) : 1121–1125. DOI:10.1021/nl060162e |
| [${referVo.labelOrder}] | Moore M N. 2006. Do nanoparticles present ecotoxicological risks for the health of the aquatic environment?[J]. Environment International, 32(8) : 967–976. DOI:10.1016/j.envint.2006.06.014 |
| [${referVo.labelOrder}] | O'Brien N J, Cummins E J. 2011. A risk assessment framework for assessing metallic nanomaterials of environmental concern:Aquatic exposure and behavior[J]. Risk Analysis, 31(5) : 706–726. DOI:10.1111/risk.2011.31.issue-5 |
| [${referVo.labelOrder}] | Pashley R M. 1981. DLÜO and hydration forces between mica surfaces in Li+, Na+, K+, and Cs+ electrolyte solutions:A correlation of double-layer and hydration forces with surface cation exchange properties[J]. Journal of Colloid and Interface Science, 83(2) : 531–546. DOI:10.1016/0021-9797(81)90348-9 |
| [${referVo.labelOrder}] | Pashley R M, Israelachvili J N. 1984. Dlvo and hydration forces between mica surfaces in Mg2+, Ca2+, Sr2+, and Ba2+ chloride solutions[J]. Journal of Colloid and Interface Science, 97(2) : 446–455. DOI:10.1016/0021-9797(84)90316-3 |
| [${referVo.labelOrder}] | Pham M, Mintz E A, Nguyen T H. 2009. Deposition kinetics of bacteriophage MS2 to natural organic matter:Role of divalent cations[J]. Journal of Colloid and Interface Science, 338(1) : 1–9. DOI:10.1016/j.jcis.2009.06.025 |
| [${referVo.labelOrder}] | Phenrat T, Saleh N, Sirk K, et al. 2007. Aggregation and sedimentation of aqueous nanoscale zerovalent iron dispersions[J]. Environmental Science & Technology, 41(1) : 284–290. |
| [${referVo.labelOrder}] | Philippe A, Schaumann G E. 2014. Interactions of dissolved organic matter with natural and engineered inorganic colloids:A review[J]. Environmental Science & Technology, 48(16) : 8946–8962. |
| [${referVo.labelOrder}] | Qiu L, Xie R, Ding P, et al. 2003. Preparation and characterization of Mg (OH)2 nanoparticles and flame-retardant property of its nanocomposites with EVA[J]. Composite Structures, 62(3/4) : 391–395. |
| [${referVo.labelOrder}] | Rodgers M T, Armentrout P B. 2016. Cationic noncovalent interactions:Energetics and periodic trends[J]. Chemical Reviews, 116(9) : 5642–5687. DOI:10.1021/acs.chemrev.5b00688 |
| [${referVo.labelOrder}] | Rodriguez Cruz S E, Jockusch R A, Williams E R. 1999. Hydration energies and structures of alkaline earth metal ions, M2+(H2O) n, n=5-7, M= Mg, Ca, Sr, and Ba[J]. Journal of the American Chemical Society, 121(38) : 8898–8906. DOI:10.1021/ja9911871 |
| [${referVo.labelOrder}] | Sharifi S, Behzadi S, Laurent S, et al. 2012. Toxicity of nanomaterials[J]. Chemical Society Reviews, 41(6) : 2323–2343. DOI:10.1039/C1CS15188F |
| [${referVo.labelOrder}] | Wang H, Zhao X, Meng W, et al. 2015. Cetyltrimethylammonium bromide-coated Fe3O4 magnetic nanoparticles for analysis of 15 trace polycyclic aromatic hydrocarbons in aquatic environments by ultraperformance, liquid chromatography with fluorescence detection[J]. Analytical Chemistry, 87(15) : 7667–7675. DOI:10.1021/acs.analchem.5b01077 |
| [${referVo.labelOrder}] | Wang S, Sun H, Ang H M., et al. 2013. Adsorptive remediation of environmental pollutants using novel graphene-based nanomaterials[J]. Chemical Engineering Journal, 226 : 336–347. DOI:10.1016/j.cej.2013.04.070 |
| [${referVo.labelOrder}] | 杨南如, 岳文海. 2000. 无机非金属材料图谱手册[M]. 武汉: 武汉工业大学出版社. |
| [${referVo.labelOrder}] | Zhang Y, Chen Y, Westerhoff P, et al. 2009. Impact of natural organic matter and divalent cations on the stability of aqueous nanoparticles[J]. Water Research, 43(17) : 4249–4257. DOI:10.1016/j.watres.2009.06.005 |
| [${referVo.labelOrder}] | Zhang Y, Chen Y, Westerhoff P, et al. 2008. Stability of commercial metal oxide nanoparticles in water[J]. Water Research, 42(8/9) : 2204–2212. |
| [${referVo.labelOrder}] | Zhao X, Shi Y, Wang T, et al. 2008. Preparation of silica-magnetite nanoparticle mixed hemimicelle sorbents for extraction of several typical phenolic compounds from environmental water samples[J]. Journal of Chromatography A, 1188(2) : 140–147. DOI:10.1016/j.chroma.2008.02.069 |
 2017, Vol. 37
2017, Vol. 37


