2. 安徽师范大学国土资源与旅游学院, 芜湖 241000;
3. 湖南省农业科学院土壤肥料研究所, 长沙 410125;
4. 中国科学院亚热带农业生态研究所, 亚热带农业生态过程重点实验室, 长沙 410125
2. College of Territorial Resources and Tourism, Anhui Normal University, Wuhu 241000;
3. Soil and Fertilizer Institute of Hunan Academy of Agricultural Sciences, Changsha 410125;
4. Key Laboratory of Agro-ecological Processes in Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Changsha 410125
氮素流失已成为当今全球环境面临的重大挑战之一.据估计, 目前全球经河流输出的总氮量高达30~36 Mt·a-1, 其中, 无机氮占了31%~37%(Boyer et al., 2006), 并且未来仍有不断增加的趋势 (Nixon et al., 1995).近年来, 由于化石燃料燃烧、污水排放及农业生产活动的影响, 使河流水体富营养化严重和氮素负荷明显增加 (Seitzinger et al., 1998).尤其在农业流域, 为追求过高的单位面积粮食产量, 农业生产活动大量施用氮肥, 而农田土壤对氮素的利用率仅为30%~40%(朱兆良等, 2002), 这种低效高投入的施肥模式导致未被利用的氮素在地表径流、淋溶等作用下进入河道水体而流失.高氮负荷不仅会引起水体富营养化 (Seitzinger et al., 1998), 还会增加水体氮氧化物N2O的释放量 (高秀文, 2003).研究显示, 目前大气中来源于河流的N2O量已占到人为排放的10% (Beaulieu et al., 2011), 据估算, 到2050年N2O排放通量将达到4.9 Tg·a-1(胡骥, 2015).氮氧化物N2O释放量的增加对全球温室效应、大气光化学反应及臭氧层破坏具有重要影响 (Ravishankara et al., 2009).因此, 开展农业流域氮素输入、转化及输出对全球环境可持续发展具有重要意义.
氮素流失会随化肥氮施用量的增加而增加 (俞映倞等, 2011).研究指出, 农田区氮素流失与化肥施用量间呈显著正相关关系 (赵冬等, 2012), 即每公顷农田增加1 kg氮肥会引起0.56~0.72 kg·hm-2氮素流失.大量氮素流失进入水体引起水体高氮负荷, 刺激了水体硝化与反硝化作用, 促进N2O产生.袁淑方等 (2012)发现, 南苕溪N2O释放主要来源于硝态氮的反硝化作用.另有研究表明, 大量外源氮的输入对湿地N2O输出具有正激发效应, 促使N2O释放高达170多倍 (牟晓杰等, 2012).目前, 国内外大多数文献主要是关于农田氮素流失或河流N2O释放单方面的研究 (张羽等, 2016;杨峰等, 2012;Hayakawa et al., 2006), 对整个农业流域可溶性氮素周转结合N2O释放的研究还鲜有报道.脱甲河作为亚热带典型农业小流域区域, 农业活动频繁, 农田施用的大量化肥氮会通过地下水和农田排水沟渠等进入河道, 引起水体氮负荷的不断累积, 进而增加N2O释放量.因此, 本文通过对脱甲河流域稻田-岸坡-沉积物土壤及水体氮素浓度和排放通量进行观测, 分析各形态氮素输出的时空变化特征, 揭示亚热带农业小流域氮素周转间的相互关系, 旨在为指导农业生产活动、制定合理措施控制农业面源氮素流失提供科学依据.
2 材料与方法 (Materials and methods) 2.1 研究区概况脱甲河作为亚热带典型农业小流域丘陵区域, 位于长沙县金井镇境内 (112°56′~113°36′E, 27°55′~28°40′N), 流域面积52.12 km2, 海拔为56.0~434.8 m, 年均温17.2 ℃, 年均降水量1200~1400 mm.脱甲河流域从上游至下游依次经历水库、林地、耕地、茶园及城镇居民用地等土地利用类型的变迁, 其中, 耕地面积范围较大, 以种植水稻为主, 主要沿脱甲河分布.脱甲河流域除上游地势起伏较大外, 中、下游农田及居民区地势较为平缓.为方便农业生产活动及城镇居民生活, 在农田区和城镇居民区修建大坝、农田排水沟渠及排污管道等设施.此外, 在农田区和城镇居民区部分地段, 河岸两边修建人工石堤, 地表裸露面积比例大.据统计, 流域内水稻种植面积占32%, 水稻种植施用氮素化肥为374 kg·hm-2·a-1(宋立芳等, 2014), 大量外源氮输入会在地表径流的作用下通过沟渠等设施大量流进河流.流域沿线居民点密集, 并零星分布有小型工厂和畜牧养殖场, 因此, 脱甲河水质受农业生产、工业废水、生活污水及畜牧业废弃物等综合影响.
2.2 样地设置根据脱甲河流域水系分级特征及土地利用类型, 将研究区分为S1、S2、S3、S4不同级别的4级河段.其中, S1为源头支流, S2和S3分别为2级和3级支流, S4则属于脱甲河干流及流域出口所在河段;S1河段土地利用方式为林地, S3河段则以稻田为主, 而S2与S4河段则是城镇居民住宅区与稻田复合分布.针对每级河段, 分别在其上游、中游和下游设定1个观测点, 总共设置了12个采样点 (张羽等, 2016)(图 1).
 |
| 图 1 脱甲河流域及采样点分布 Fig. 1 Tuojia River and sampling stations |
在研究期内, 每周在流域各级河段上、中、下游3个观测点采集表层 (0~20 cm) 水样, 3个重复.为避免日照强度对水样的影响, 每次采样均在上午8:00—11:00进行.采集水样时, 尽量避免扰动水生植物和河床沉积物, 以及在使用水样采集器的过程中最低限度地晃动采集器中的水样.用60 mL注射器从水样采集器中抽取30 mL水样, 水样采集器中剩余水样装在清洗过的棕色塑料瓶内, 低温保存.取得的水样在3 h内迅速转移到实验室.注射器中水样用于测定N2O浓度 (Agilent 7890A, 美国), 棕色塑料瓶内水样用于测定NH4+-N、NO3--N浓度.
同时, 在流域内利用土样采集器采集4级河段稻田、岸坡及河流沉积物3个梯度0~15 cm土柱.频率为每月1次, 每个样点3个重复.每级河段3个梯度土样的采集固定在一个方向上, 避免范围过大带来土样理化性质的不确定性.采集的土样装入保鲜袋进行标记保存, 3 h内转移到实验室.对采集土样测定NH4+-N和NO3--N含量.水温 (℃) 由多功能便携式水质参数仪 (Thermo Scientific公司, 新加坡) 现场测定.
2.3 研究方法野外采集河水水样, 测定水体溶存N2O浓度,具体操作流程如图 2所示.采样时, 首先用水样采集器采集表层 (0~20 cm) 水体 (采集过程中应避免采集器中水样过分晃动), 接着用60 mL医用注射器抽取采集器中30 mL水样;水样带回实验室后, 从装有高纯氦气 (纯度>99.999%) 的气样袋中抽取30 mL气体注入水样注射器, 使其中水样上方形成气室;将水-气混合的注射器装入滤网袋中放在振荡器上, 在室温下剧烈振荡5 min, 使溶存的N2O气体析出进入注射器上端, 静置10 min, 使气液两相达到平衡;最后将注射器上端析出的N2O推入12 mL真空瓶, 利用气相色谱仪 (Agilent 7890A, 美国) 测定N2O浓度.
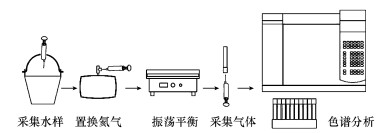 |
| 图 2 水体溶存N2O浓度测定过程示意图 Fig. 2 Schematic diagram for the procedures of measuring dissolved N2O |
水体中溶存N2O浓度及通量计算的具体过程如下:
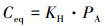
|
(1) |
式中, Ceq为脱甲河当前大气的气体分压与实际水温条件下的纯水达到平衡时水体中N2O的浓度 (μmol·L-1);PA为N2O气体的大气分压, 约为0.20265 Pa;KH为采样时水温条件下的气体Henry常数 (μmol·L-1·atm-1)(1 atm=1.01325×105 Pa), 其值根据公式 (2) 实际水温计算确定.

|
(2) |
式中, Tθ值取298 K;TK为实际水温绝对温度 (K);KHθ为298 K和1 atm条件下的Henry常数, N2O取值为24714 μmol·L-1·atm-1;KT为表征Henry常数随温度变化的参数, N2O取值为1750.
根据气象色谱仪分析出的N2O浓度, 由公式 (3) 计算水样中N2O原始浓度Cobs.
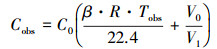
|
(3) |
式中, Cobs为平衡前水样的N2O浓度 (μmol·L-1);C0为平衡后测定的气相N2O浓度 (μmol·L-1);V0为平衡器气室的气体体积 (30 mL);V1为平衡器气室的水样体积 (30 mL);22.4是气体的摩尔体积 (L·mol-1);R为理想气体状态常数, 取值为0.083 L·Pa·mol-1·K-1;Tobs为平衡过程实际水温 (K);β为N2O的Bunsen溶解系数 (L·L-1·atm-1).β值由公式 (4) 计算得出.
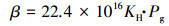
|
(4) |
式中, Pg为N2O纯气压, 即1.01325 Pa.
根据计算出的N2O原始浓度Cobs, 分别采用LM86、W92a、W92b和RC01确定KW值, 然后采用公式 (5) 所示的双层扩散模型计算水-气界面CH4的交换通量.

|
(5) |
式中, Fs为N2O交换通量 (μg·m-2·h-1);c为量纲转换系数;KW为N2O交换速率 (cm·s-1).
Wanninkhof (1992)给出了水体中N2O的Schmidt指数 (Sc) 与水温 (T) 的关系式:

|
(6) |
式中, Sc为水的动力粘度与N2O气体分子扩散速率之比, T为0~30 ℃范围内温度 (℃).
棕色塑料瓶中的水样用0.45 μm滤膜过滤后, 采用流动注射仪法测定水体NH4+-N和NO3--N浓度.
2.4 数据处理利用SPSS 17.0软件对数据进行统计分析与处理, 利用微软Excel 2010进行绘图.
3 结果 (Results) 3.1 脱甲河流域氨氮浓度变化特征脱甲河流域稻田-岸坡-河底沉积物土壤及水体各形态氮素浓度动态变化如图 3所示.岸坡土壤NH4+-N含量为0.39~56.28 mg·kg-1, 均值为 (7.38±0.62) mg·kg-1, NO3--N含量为0.03~26.52 mg·kg-1, 均值为 (3.98±0.44) mg·kg-1.河底沉积物NH4+-N含量均值为 (16.49±1.70) mg·kg-1, NO3--N含量均值为 (1.25±0.31) mg·kg-1.稻田土壤NH4+-N和NO3--N含量表现出跟岸坡土壤和河底沉积物相反的模式, 即NO3--N含量高于NH4+-N含量.总体来看, 脱甲河流域稻田-岸坡-河底沉积物土壤NH4+-N含量是呈逐渐增加的趋势, NO3--N含量逐渐降低, 其中, 各个梯度间NH4+-N含量和NO3--N含量均差异显著 (p < 0.01).
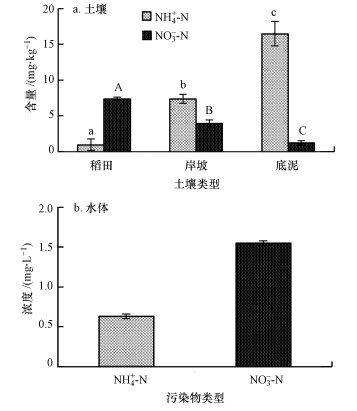 |
| 图 3 脱甲河流域NH4+-N和NO3--N变化特征 (图a中小写字母表示NH4+-N含量差异显著 (p < 0.05), 大写字母表示NO3--N含量差异显著 (p < 0.05)) Fig. 3 Variation characteristics of NH4+-N and NO3--N in Tuojia River basin |
水体NH4+-N浓度为0.12~5.25 mg·L-1, 均值为 (0.63±1.70) mg·L-1, NO3--N浓度为0.02~4.00 mg·L-1, 均值为 (1.55±0.03) mg·L-1, 表明脱甲河水体中的氮主要以NO3--N为主.根据国家地表水环境质量标准 (GB 3838—2002), S1(NH4+-N浓度为0.28 mg·L-1) 达到Ⅱ类水标准 (≤0.5 mg·L-1), S2(NH4+-N浓度为0.90 mg·L-1)、S3(0.66 mg·L-1) 和S4(0.67 mg·L-1) 均为Ⅲ类水标准 (≤1 mg·L-1), 4级河段NH4+-N浓度均值为0.63 mg·L-1, 脱甲河水质总体为Ⅲ类水质标准, 但S2河段水质可能已受到了污染.
3.2 N2O浓度时空变化特征在研究期内, N2O浓度范围在0.005~7.37 μmol·L-1之间, 均值为 (0.54±0.05) μmol·L-1.由图 4可见, N2O浓度具有明显的时空变化差异.脱甲河水体N2O浓度有2个明显的活跃期 (第1个活跃期为4—5月, 第2个活跃期为7—8月), 第1个活跃期N2O平均浓度为 (0.49±0.07) μmol·L-1, 稍低于研究期N2O浓度均值;第2个活跃期N2O平均浓度为 (1.49±0.05) μmol·L-1, 是研究期N2O浓度均值的近3倍.从2015年9月至2016年1月, N2O浓度呈波动降低趋势, 最低值出现在2015年12月, 均值仅为 (0.04±0.004) μmol·L-1.在平面分布上, N2O浓度随河流4级河段污染负荷梯度增加而上升, 最大值出现在S2河段, 平均浓度为 (0.68±0.10) μmol·L-1, 其次分别为S3河段 ((0.67±0.11) μmol·L-1) 和S4河段 ((0.66±0.11) μmol·L-1), 最后是S1河段, 仅为 (0.22±0.05) μmol·L-1.脱甲河上游水体溶存N2O浓度与中、下游存在显著差异 (p < 0.01).
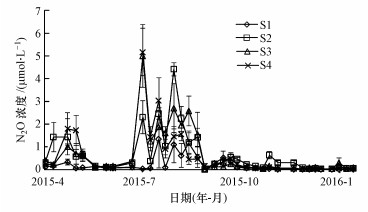 |
| 图 4 河流溶存N2O浓度变化特征 Fig. 4 Variation characteristics of N2O concentration in river |
脱甲河N2O扩散通量表现出与浓度一致的时空变化差异 (图 5).研究期内脱甲河流域N2O扩散通量在-1.11~1811.29 μg·m-2·h-1之间, 均值为 (130.10±12.04) μg·m-2·h-1.除在2015年8月31日S2河段上游 (均值-1.11 μg·m-2·h-1) 和2015年9月9日S3河段中游 (均值-0.06 μg·m-2·h-1) 出现负通量外, 脱甲河总体表现为大气N2O的释放源.早稻生长季前期, 从4月至6月N2O扩散通量逐渐降低.4月是早稻育秧栽种时节, N2O扩散通量为 (150.83±32.72) μg·m-2·h-1, 6月抽穗期降至 (37.32±6.23) μg·m-2·h-1.随着温度逐渐升高, 7、8月是1年中该流域温度最高时段, N2O扩散通量出现排放高峰, 尤其在7月, N2O扩散通量高达 (428.39±64.59) μg·m-2·h-1, 7、8月N2O扩散通量是研究期内其他月份N2O扩散通量总和的1.79倍.N2O扩散通量从8月至12月由 (312.93±41.65) μg·m-2·h-1下降至 (7.44±1.10) μg·m-2·h-1, 之后在2016年1月小幅上升, 这与水体溶存N2O浓度变化趋势一致, 说明通量与浓度间呈显著正相关 (p < 0.01).
 |
| 图 5 河流N2O通量时空变化特征 (图中1、2、3分别代表河段上游、中游、下游) Fig. 5 Temporal and spatial variation of N2O flux in river |
在空间分布上, 位于林地的S1河段N2O扩散通量最低, 均值仅为 (50.68±12.69) μg·m-2·h-1, 最大值出现在城镇居民区和稻田复合区的S2河段, 均值为 (163.54±24.81) μg·m-2·h-1, 是S1河段的2.23倍.其中, 每级河段上、中、下游N2O扩散通量也有差异, 上游河段N2O扩散通量最低, 下游河段最高.在对脱甲河N2O扩散通量和各形态氮素的比较中可以看出, 4级河段N2O扩散通量大致与NH4+-N和NO3--N浓度变化趋势一致.
3.4 脱甲河流域N2O总扩散量估算根据脱甲河流域N2O扩散通量均值 (130.10±12.04) μg·m-2·h-1计算出流域内每公顷土地每年N2O释放量, 再通过此值乘以流域面积, 估算流域N2O总扩散通量 (李飞跃等, 2011).通过估算, 脱甲河农业小流域水系N2O总扩散通量达59378.60 kg·a-1(表 1).
| 表 1 脱甲河流域N2O总扩散通量 Table 1 N2O emission flux in Tuojia River |
研究发现, 氮肥进入稻田后, 除土壤和水稻吸附外, 其余大部分氮素会损失.其中, 氨挥发损失占11%, 硝化、反硝化损失占34%, 剩余的氮素会通过淋溶、径流等水文过程迁移转化进入流域水体 (朱兆良等, 2003).本试验中岸坡土壤及河底沉积物中NO3--N平均浓度滞后于NH4+-N浓度, 一方面是NH4+-N经硝化细菌氧化, 生成NO3--N, 这需要一段时间 (李永梅等, 2003);另一方面, NO3--N和土壤胶体均带负电荷, NH4+-N自身携带正电荷, 故土壤胶体主要吸收氮肥中的NH4+-N (冯明磊, 2010).此外, 施用有机肥会促进铵态氮向硝态氮转化 (Müller et al., 2003), 尤其在加入氨基酸类有机氮化合物后, 硝态氮主要来自铵态氮和有机氮异养硝化 (Zhang et al., 2014).
脱甲河水体NO3--N浓度高于NH4+-N, 这与宋立芳等 (2014)认为脱甲河流域水体以NH4+-N为主 (占TN的58.5%) 有较大差异.本试验测得脱甲河表层水体溶解氧浓度较高 (7.53 mg·L-1), 在好氧状态下, 反硝化作用受到抑制, 沉积物及水体中NH4+-N和NH3容易被氧化为NO3--N (冯明磊, 2010;袁淑方等, 2012;杨金玲等, 2005), 因此, 出现高NO3--N、低NH4+-N的现象.脱甲河水体NH4+-N和NO3--N浓度在2015年8月和2015年10—12月均出现高值.8月是脱甲河流域早稻收割和晚稻栽种的交替季节, 期间对早稻田进行犁耕、排水和对晚稻种植进行施肥, 丰富的有机质经疏松土壤下渗和地表径流进入地下水和河道, 导致8月脱甲河水体氮素水平较高.在2015年10—12月是脱甲河流域枯水期, 河床水位较浅, 且流域内建有拦水大坝调控蓄水, 水流较慢, 流量小, 水体本身自净能力下降, 外源氮输入的累积引起NH4+-N和NO3--N浓度在此期间出现高值.在空间上, S1河段各形态氮素浓度均低于其他3级河段, 原因可能是S1河段处于山间林地, 森林植被一方面能够涵养水源、减少地表径流氮素损失, 另一方面植被生长能够吸收部分氮素, 而脱甲河中、下游3级河段位于农田及居民生活区, 受农业氮素面源污染和生活废水双重影响, 故而水体氮素浓度较高.
4.2 脱甲河水体N2O扩散通量时空变化分析河流N2O主要产生于硝化作用与反硝化作用.硝化作用是NH4+经硝化细菌的氧化, 生成NO3-的过程 (Otte et al., 1999), 反硝化作用是反硝化细菌在溶解氧较低的情况下, 将NO3-还原成N2的过程 (Bakken et al., 2012), N2O均作为中间产物产生.本研究中NH4+-N和NO3--N含量是影响N2O扩散通量的重要因子.通过Pearson相关分析发现 (表 2), 4级河段N2O扩散通量与NH4+-N (r=0.869, p < 0.01) 和NO3--N (r=0.803, p < 0.01) 含量呈显著正相关, 这与牟晓杰等 (2012)、孙文凭等 (2010)及Beaulieu等 (2010)认为水体NH4+-N和NO3--N浓度增加对河流N2O释放有正效应的研究一致.
| 表 2 脱甲河N2O排放通量与影响因子间的相关关系 Table 2 Relationship between N2O flux and influence factors |
温度是影响河流水体N2O释放通量的重要因素.研究表明, 温度升高会促进水体微生物活性增加, 有利于水体反硝化作用的发生, 其影响程度达52%(Zimmerman et al., 1994;袁淑方等, 2012;谭永洁, 2014), 促进水体N2O扩散通量上升.通过Pearson相关分析发现, 脱甲河N2O扩散通量与温度间具有显著正相关关系 (r=0.743, p < 0.01), 这与模拟实验发现温度在6~23 ℃情况下, N2O释放量逐渐升高一致 (Liikanen et al., 2002).脱甲河N2O释放主要集中在7—8月, 这与大多数研究发现的河流水体N2O扩散通量夏高冬低结果吻合 (Beaulieu et al., 2010; Wang et al., 2006).因为在脱甲河流域夏季水稻种植需施用大量氮肥, 残留的氮肥会在降雨的作用下进入水体, 使水体中NO3--N上升, 加之温度高, 进而加强反硝化作用的进行 (李飞跃等, 2009).高浓度的NO3-既能提高反硝化速率, 又能抑制N2O还原酶的活性, 限制反硝化过程中N2O向N2转换 (Beaulieu et al., 2008).由图 3b和图 5a可知, 脱甲河各形态氮素在7月末8月初浓度与水温较高, 有利于反硝化进行, 因此, 7、8月份N2O扩散通量显著高于其他月份 (p < 0.01).
脱甲河水质污染负荷随流域土地利用类型的变迁而发生变化.除S4河段外, 脱甲河N2O扩散通量随河流氮素污染负荷程度增加而上升, 即源头区至中、下游农田及城镇居民区N2O扩散通量增加.S4河段氮素污染程度高于S3河段, 但N2O扩散通量低于S3河段 (17.87 μg·m-2·h-1), 原因可能是S4河段位于城镇及河流出口区, 大坝及沟渠的修建导致流量小、流速慢有关 (袁淑方等, 2012).
4.3 脱甲河流域氮素输出氮素输入主要有大气沉降、化肥氮施用、生物固氮及畜禽养殖等方式, 氮素输出主要以氨挥发、径流流失、氮素淋溶及氧化亚氮排放为主 (吴萍萍, 2008).研究期内, 就岸坡土壤氮素而言, 从2015年11月的 (13.99±2.69) mg·kg-1骤降至2016年1月的 (2.44±0.46) mg·kg-1.脱甲河水体氮素输出主要以N2O和NH4+-N、NO3--N形式为主, 本试验测得脱甲河每年向大气输出N2O量为11.40 kg·hm-2·a-1, 远高于句容水库农业流域 (0.38 kg·hm-2·a-1) 和太湖流域源头溪流 (1.95 kg·hm-2·a-1) N2O扩散通量 (袁淑芳等, 2012;李飞跃等, 2011).这主要是因为脱甲河流域作为亚热带典型农业小流域, 水稻种植面积广泛, 每年因水稻种植施用氮肥约374 kg·hm-2(宋立芳等, 2014), 农业流域中只有35%的氮素被作物吸收, 其余约65%的氮素会通过氨挥发、硝化与反硝化及淋溶进入大气和河流水体而流失, 其中, 硝化、反硝化占34%(朱兆良等, 2003;Xing et al., 2012).丰富的外源氮输入导致水体氮浓度较高, 利于消化与反硝化作用的进行, 促进N2O释放.丁洪等 (2004)的研究进一步表明, 在茄子菜田中每年施氮肥300 kg·hm-2, N2O排放造成的氮素流失占到总施氮量的8.6%.宋立芳等 (2014)发现, 脱甲河总氮月输出通量为1.67 kg·hm-2, 本研究只对水体NH4+-N和NO3--N浓度进行了测定, 由于缺乏脱甲河降雨量和流量数据, 因而未对NH4+-N和NO3--N通量进行计算, 这也是今后要进一步深入解决的问题.
5 结论 (Conclusions)1) 脱甲河岸坡土壤和沉积物中的氮素主要以NH4+-N为主, 稻田土壤及水体则是NO3--N占主导.
2) 脱甲河每年向大气输出N2O量为11.40 kg·hm-2.在时间上, N2O释放活跃期主要集中在早稻收割和晚稻栽种的交替时节;在空间上, 除S4河段, N2O通量随河流污染负荷程度的增加而增加.表明外源氮输入和外源污染是造成脱甲河N2O通量时空差异的主要原因.
3) N2O扩散通量与水体NH4+-N和NO3--N浓度及水温呈显著正相关, 而流域内稻田-岸坡-河底沉积物及水体NH4+-N和NO3--N浓度间相关性不显著.
4) 本文研究表明, 脱甲河农业流域存在严重的氮素流失风险.因此, 应制定科学合理的农田氮肥施用标准, 对养殖污水进行净化处理, 降低河流水质污染程度, 从而降低农业面源污染, 为区域生态环境保护提供科学依据.
| [${referVo.labelOrder}] | Bakken L R, Bergaust L, Liu B, et al. 2012. Regulation of denitrification at the cellular level: a clue to the understanding of N2O emissions from soils[J]. Philosophical Transaction of the Royal Rociety-Biological Science, 367(1593) : 1226–1234. DOI:10.1098/rstb.2011.0321 |
| [${referVo.labelOrder}] | Beaulieu J J, Arango C P, Hamilton S K, et al. 2008. The production and emission of nitrous oxide from headwater streams in the Midwestern United States[J]. Global Change Biology, 14 : 878–894. |
| [${referVo.labelOrder}] | Beaulieu J J, Shuster W D, Rebholz J A. 2010. Nitrous oxide emissions from a large, impounded River:The Ohio River[J]. Environmental Science & Technology, 44(19) : 7527–7533. |
| [${referVo.labelOrder}] | Beaulieu J J, Tank J L, Hamilton S K, et al. 2011. Nitroous oxide emission from denitrification in stream and river networks[J]. Proceedings of the National Academy of Sciences, 108(1) : 214–219. DOI:10.1073/pnas.1011464108 |
| [${referVo.labelOrder}] | Boyer E W, Howarth R W, Galloway J N, et al. 2006. Riverine nitrogen export from the continents to the coasts[J]. Globle Biogeochemical Cycles, 20(1) : 1–91. |
| [${referVo.labelOrder}] | 丁洪, 王跃思, 项虹艳, 等. 2004. 菜田氮素反硝化损失与氧化亚氮排放的定量评价[J]. 园艺学报, 2004, 31(6) : 762–766. |
| [${referVo.labelOrder}] | 窦培谦, 王晓燕, 王丽华. 2006. 非点源污染中氮磷迁移转化机理研究进展[J]. 首都师范大学学报 (自然科学版), 2006, 27(2) : 94–98. |
| [${referVo.labelOrder}] | 冯明磊. 2010. 三峡地区小流域氮循环及其对水体氮含量的影响[D]. 武汉: 华中师范大学. 1-148 |
| [${referVo.labelOrder}] | 高秀文. 2003. 华北高产梁区土壤温室气体排放及碳氮平衡研究[D]. 北京: 中国农业大学. 1-53 http://cdmd.cnki.com.cn/Article/CDMD-10019-2003092615.htm |
| [${referVo.labelOrder}] | 国家环保总局, 国家质量监督检验检疫总局. 2002. GB3838-2002地表水环境质量标准[S]. 北京: 中国环境科学出版社 |
| [${referVo.labelOrder}] | 胡骥. 2015. 若尔盖高原河流三种温室气体排放及时空动态[D]. 杨凌: 西北农林科技大学. 1-56 http://cdmd.cnki.com.cn/Article/CDMD-10712-1015333482.htm |
| [${referVo.labelOrder}] | Hayakawa A, Shimizu M, Woli K P, et al. 2006. Evaluating stream water quality through land use analysis in two grassland catchments:impact of wetlands on stream nitrogen concentrations[J]. Journal of Environmental Quality, 35(2) : 617–627. DOI:10.2134/jeq2005.0343 |
| [${referVo.labelOrder}] | 李飞跃, 杨绒, 遆超普, 等. 2009. 秦淮河流域句容水库农业流域水体沉积物的反硝化作用[J]. 环境科学学报, 2009, 29(4) : 854–860. |
| [${referVo.labelOrder}] | 李飞跃, 汪建飞, 李孝良, 等. 2011. 江苏句容水库农业流域水塘和河流N2O排放速率的研究[J]. 环境科学学报, 2011, 31(9) : 2022–2027. |
| [${referVo.labelOrder}] | 李永梅, 杜彩琼, 林春苗, 等. 2003. 铵态氮肥施入土壤中的转化[J]. 云南农业大学学报, 2003, 18(1) : 26–29. |
| [${referVo.labelOrder}] | Liikanen A N U, Murtoniemi T, Tanskanen H, et al. 2002. Effects of temperature and oxygen availability on greenhouse gas and nutrient dynamics in sediment of a eutrophic mid-boreal lake[J]. Biogeochemistry, 59(3) : 269–286. DOI:10.1023/A:1016015526712 |
| [${referVo.labelOrder}] | 牟晓杰, 刘兴土, 仝川, 等. 2012. 闽江河口短叶茳芏湿地CH4和N2O排放对氮输入的短期响应[J]. 环境科学, 2012, 33(7) : 2482–2489. |
| [${referVo.labelOrder}] | Müller C, Stevens R J, Laughlin R J. 2003. Evidence of carbon stimulated N transformations in grassland soil after slurry application[J]. Soil Biology & Biochemistry, 35(35) : 285–293. |
| [${referVo.labelOrder}] | Nixon S W. 1995. Coastal marine eutrophication:a definition, social causes, and future concerns[J]. Ophelia, 41(1) : 199–219. DOI:10.1080/00785236.1995.10422044 |
| [${referVo.labelOrder}] | Otte S, Schalk J, Kuenen J Q, et al. 1999. Hydroxylamine oxidation and subsequent nitrous oxide production by the heterotrophic ammonia oxidizer Alcaligenes faecalis[J]. Applied Microbiology and Biotechnology, 51(2) : 255–261. DOI:10.1007/s002530051390 |
| [${referVo.labelOrder}] | Ravishankara A R, Daniel J S, Portmann R W. 2009. Nitrous oxide (N2O):the dominant ozone-depleting substance emitted in the 21st century[J]. Science, 326(5949) : 123–125. DOI:10.1126/science.1176985 |
| [${referVo.labelOrder}] | 宋立芳, 王毅, 吴金水, 等. 2014. 水稻种植对中亚热带红壤丘陵区小流域氮磷养分输出的影响[J]. 环境科学, 2014, 35(1) : 150–156. |
| [${referVo.labelOrder}] | 孙文凭, 徐继荣, 殷建平, 等. 2010. 三亚河与三亚湾溶存N2O分布特征与影响因素研究[J]. 海洋与湖沼, 2010, 41(2) : 266–273. |
| [${referVo.labelOrder}] | Seitzinger S P, Kroeze C. 1998. Global distribution of nitrous oxide production and N inputs in freshwater and coastal marine ecosystems[J]. Global Biogeochemical Cycles, 12(1) : 93–113. DOI:10.1029/97GB03657 |
| [${referVo.labelOrder}] | 谭永洁. 2014. 上海市河流沉积物温室气体的排放与产生机制[D]. 上海: 华东师范大学. 1-187 |
| [${referVo.labelOrder}] | 吴萍萍. 2008. 不同施肥制度下红壤稻田氨挥发与氧化亚氮排放的研究[D]. 南京: 南京农业大学. 1-77 http://cdmd.cnki.com.cn/Article/CDMD-10307-2009076605.htm |
| [${referVo.labelOrder}] | Wang H J, Wang W D, Yin C Q, et al. 2006. Littoral zones as the "hotspots" of nitrous oxide (N2O) emission in a hyper-eutrophic lake in China[J]. Atmospheric Environment, 40(28) : 5522–5527. DOI:10.1016/j.atmosenv.2006.05.032 |
| [${referVo.labelOrder}] | Xing G X, Yan X Y. 1999. Direct nitrous oxide emissions from agricultural field in China estimated by the revised 1966 IPCC guidelines for national greenhouse gases[J]. Environmental Sciences and Policy, 2(3) : 355–361. DOI:10.1016/S1462-9011(99)00025-8 |
| [${referVo.labelOrder}] | 杨峰, 王鹏举, 杨姗姗, 等. 2012. 城郊农业区小流域土地利用结构对氮素输出的影响[J]. 环境科学, 2012, 33(8) : 2652–2658. |
| [${referVo.labelOrder}] | 杨金玲, 张甘霖. 2005. 皖南低山丘陵地区流域氮磷径流输出特征[J]. 农村生态环境, 2005, 21(3) : 34–37. |
| [${referVo.labelOrder}] | 杨晶, 张桂玲, 赵玉川, 等. 2011. 胶州湾河口潮滩沉积物中N2O的产生和释放及其影响因素[J]. 环境科学学报, 2011, 31(12) : 2723–2732. |
| [${referVo.labelOrder}] | 俞映倞, 薛利红, 杨林章. 2011. 不同氮肥管理模式对太湖流域稻田土壤氮素渗漏的影响[J]. 土壤学报, 2011, 48(5) : 988–995. |
| [${referVo.labelOrder}] | 袁淑方, 王为东. 2012. 太湖流域源头溪流氧化亚氮 (N2O) 释放特征[J]. 生态学报, 2012, 32(20) : 6279–6288. |
| [${referVo.labelOrder}] | 张羽, 秦晓波, 廖育林, 等. 2016. 亚热带农业小流域N2O扩散通量及其影响因素[J]. 农业工程学报, 2016, 32(7) : 215–223. |
| [${referVo.labelOrder}] | 赵冬, 颜延梅, 乔俊, 等. 2012. 太湖地区稻田氮素损失特征及环境效应分析[J]. 生态环境学报, 2012, 21(6) : 1149–1154. |
| [${referVo.labelOrder}] | 朱兆良, 邢光熹. 2002. 氮循环[M]. 北京: 清华大学出版社. |
| [${referVo.labelOrder}] | Zhang J B, Sun W J, Zhong W H, et al. 2014. The substrate is an important factor in controlling the significance of heterotrophic nitrification in acidic forest soils[J]. Soil Biology and Biochemistry, 76 : 143–148. DOI:10.1016/j.soilbio.2014.05.001 |
| [${referVo.labelOrder}] | Zimmerman A R, Benner R. 1994. Denitrification, nutrient regeneration and carbon mineralization in sediments of Galveston Bay, Texas, USA[J]. Marine Ecology Progress Series, 114(3) : 275–288. |
 2017, Vol. 37
2017, Vol. 37


