3, 4-二氯三氟甲苯 (3, 4-dichlorobenzotrifluoride,3, 4-DCBTE) 是一种无色透明液体,有卤代苯气味,不溶于水,能与乙醇、乙醚混溶,常被用来合成农药除草剂 (张博,2008).随着近年来除草剂的大量使用,3, 4-二氯三氟甲苯也越来越多地进入环境水体之中,因其稳定性强,如处理不当则会对环境和人类健康造成极大影响 (林静,2012).
目前,国内外处理此类污染水体常用的方法有化学法、物理法和生物法 (曹宇,2012).而化学法中的高级氧化技术则因应用范围广、氧化能力强而得到广泛应用.其中,较为人们熟知的是Fenton试剂,其作用的实质是 (Hou et al., 2016),在酸性环境中,H2O2在Fe2+的催化作用下能产生具有很强氧化能力的·OH,具体如式 (1)、(2)(Methatham et al., 2015) 中所示.
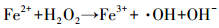
|
(1) |
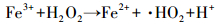
|
(2) |
杨智临等 (2015)利用Fenton氧化工艺降解3, 4-二氯三氟甲苯也取得了较好的效果,但由于其体系中是Fe2+/H2O2,发生反应后铁离子回收困难,使得溶液中铁离子浓度较高,从而使得其色度和电导率升高,增加了后续处理的难度和操作成本.而用铁氧化物来代替Fe2+能有效地解决上述缺点,大量研究表明 (Wang et al., 2010; Jing et al., 2011; Zhang et al., 2014),Fe3O4是催化活性较好的固相非均相类Fenton催化剂,但由于其在作用过程中较不稳定,容易发生团聚现象,因此,降低了其自身的催化活性 (Zhu et al., 2011).本研究拟把Fe3O4、TiO2与H2O2三者结合在一起,形成类芬顿体系,以提高Fe3O4的稳定性.研究表明,Fe3O4/TiO2常被用作光催化剂来催化降解4-硝基酚 (赵冉等,2013) 和甲基橙 (陈汝芬等,2014) 等污染物,且其同族氧化物Fe3O4/CeO2(Xu et al., 2012) 通过类Fenton体系对4-氯酚也有较好的降解效果.但光催化也有其局限性,不适合于处理大范围环境水体中的有机物.因此,本研究采用Fe3O4/TiO2-H2O2非均相类Fenton体系对3, 4-二氯三氟甲苯进行降解,除具有传统Fenton反应的优点之外,还可拓宽pH适用范围、加快反应速度等 (He et al., 2016).最后,本文利用X-射线衍射仪和电镜对Fe3O4/TiO2复合物进行表征,并研究不同因素对3, 4-二氯三氟甲苯降解效率的影响.
2 实验材料与方法 (Materials and methods) 2.1 实验材料与仪器实验所用药品和试剂:钛酸四丁酯、乙酸、HNO3、硫酸、甲醇、乙醇、氢氧化钠、硫酸亚铁、浓硫酸、硫酸铁均为分析纯;3, 4-二氯三氟甲苯溶液、过氧化氢 (质量分数为30%,分析纯).
仪器:高速冷冻离心机 (GL-20M,TGL-16M,TDL-5) 购自上海卢湘仪离心机仪器有限公司;SHA-B型恒温水浴振荡器 (SHA-B) 购自国华企业;Waters高效液相色谱仪 (检测器型号为waters2487,泵型号为waters1525) 购自美国Waters公司;Thermo pH计 (STAR A211);X-射线衍射仪 (D8 Advance).
2.2 检测方法3, 4-DCBTE采用高效液相色谱Waters1525测定,测定条件为 (杨智临等,2015):流动相为甲醇:水=80.0:20.0(体积比,乙酸调节pH至3.0左右);设定流速为1.0 mL·min-1;进样量20.0 μL,检测波长为254.0 nm.以D8 Advance型X-射线衍射仪对样品进行表征 (Cu靶,X光管电压40.0 kV,电流40.0 mA).
2.3 纳米Fe3O4/TiO2复合物的制备 2.3.1 纳米TiO2的制备采用水热法制备纳米二氧化钛 (Arcadipane et al., 2016),具体操作为:在装有17.0 mL乙醇的烧杯中缓慢加入钛酸四丁酯2.8 mL,持续搅拌40 min,缓慢加入1.1 mL乙酸,继续搅拌30 min,分别加入0.15 mL HNO3和1.1 mL去离子水,继续搅拌6 h;然后把所制得溶液放入恒温箱中进行凝胶,将所得凝胶转移至内衬为聚四氟乙烯的高压反应釜中,120 ℃恒温箱中反应24 h,用去离子水和乙醇清洗3~4遍,干燥,备用.
2.3.2 纳米Fe3O4/TiO2的制备采用浸渍法制备纳米Fe3O4/TiO2复合物 (Bai et al., 2013).首先将恒温水浴锅调至80 ℃预热,称取一定量的纳米TiO2粉末放入四口圆底烧瓶反应器中;然后加入100 mL 0.2 mol·L-1的NaOH溶液,并将100 mL浓度均为0.01 mol·L-1的Fe2(SO4)3和FeSO4·7H2O混合溶液缓慢滴入反应器中,反应过程中持续搅拌并通入氮气使反应器处于无氧状态;持续滴加反应90 min后,继续搅拌30 min以保证反应充分;最后将所得纳米Fe3O4/TiO2复合物静置,离心,洗涤,干燥以备用.
2.4 Fe3O4/TiO2的表征 2.4.1 Fe3O4/TiO2的XRD图谱对所制备的纳米Fe3O4/TiO2进行XRD图谱分析,结果如图 1所示.由图 1可知,XRD图谱分别在2θ为26°、37°、48°、55°、56°、62°、69°、71°、75°处出现明显的衍射峰,表明催化剂中含有锐钛矿型TiO2(PDF#84-1285).在35.7°、59°、63°处也出现明显的衍射峰,表明催化剂中同时也含有Fe3O4(PDF#76-0956).
 |
| 图 1 Fe3O4/TiO2的XRD图谱 Fig. 1 The X-ray diffraction patterns of Fe3O4/TiO2 |
图 2为所制得纳米Fe3O4/TiO2的SEM图,从图中可以清晰地看出,所制材料由许多表面附着不规则小颗粒的球形颗粒组成,粒径在50~200 nm之间,这与Chen等 (2005)所制备的Fe3O4/TiO2相似.除此之外,还可看出颗粒分布较为均匀,且因其表面能较高呈现了一定的团聚性 (代先祥等, 2011).
 |
| 图 2 Fe3O4/TiO2电镜图 Fig. 2 The SEM image of Fe3O4/TiO2 |
将200.0 mL浓度为4 mg·L-1的3, 4-DCBTE溶液加入到200.0 mL反应瓶中,用0.1 mol·L-1的HCl和NaOH调节pH至一定值,并依次加入一定量的Fe3O4/TiO2催化剂及H2O2溶液,测定不同时间下溶液中3, 4-DCBTE的浓度.
3 结果与讨论 (Results and discussion) 3.1 不同催化体系对反应的影响分别考察单独H2O2、纳米TiO2-H2O2、纳米复合物Fe3O4/TiO2及纳米复合物Fe3O4/TiO2-H2O2 4种不同的催化体系对3, 4-DCBTE的降解率,结果如图 3所示.在相同的反应条件下,单独H2O2体系对3, 4-DCBTE的去除率较低,不足10.0%,说明相比于·OH,H2O2的氧化能力较弱 (Hu et al., 2011);而在Fe3O4/TiO2和TiO2-H2O2体系中,其处理效率均为15.0%左右,在这2个体系中,3, 4-DCBTE的去除主要依靠Fe3O4和TiO2的吸附 (Chang et al., 2005; Li et al., 1999),而去除效果较差说明3, 4-DCBTE可能是疏水性有机化合物,而Fe3O4和TiO2表面是亲水性的.在Fe3O4-H2O2体系中的去除率为41.0%,而在Fe3O4/TiO2-H2O2体系中3, 4-DCBTE浓度却在30 min内出现了大幅的下降,与其他体系相比,Fe3O4/TiO2-H2O2体系表现出了较好的活性,说明在降解体系中Fe3O4、TiO2、H2O2三者可能具有协同作用,其中的H2O2吸附到Fe3O4/TiO2催化剂的表面形成了表面络合物,而后处于激发态的表面络合物发生解离并释放·OH到体系中,而其协同作用加快了·OH在反应位点的传质速率 (Hua et al., 2014),使得·OH可以发挥其强氧化性从而把目标污染物降解.且相较于传统Fenton法降解3, 4-DCBTE,Fe3O4/TiO2-H2O2体系基本达到完全除去,在去除率方面有一定的提高 (杨智临等,2015).
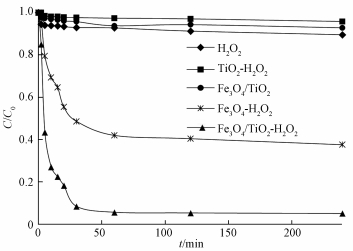 |
| 图 3 不同催化体系下3, 4-二氯三氟甲苯的降解效果 Fig. 3 Degradation of 3, 4-DCBTE in different catalytic conditions |
在传统的Fenton反应中,pH是影响其中铁离子和过氧化氢反应的重要因素,本实验研究了在pH分别为2.0、3.0、4.0、5.0、7.0条件下,pH对去除效率的影响,结果如图 4所示.从图中可以看出,随着pH值的升高去除效率先增加后降低,在pH=3.0时降解效率最佳.研究表明,在均相体系中,H2O2/Fe2+降解有机污染物的最佳pH为3.0左右 (Arnold et al., 1995),说明该体系与传统的Fenton反应具有共性.然而与传统Fenton体系不同的是,该体系在偏中性环境中对3, 4-DCBTE的降解也有作用,说明羟基自由基不仅可以与溶液中的铁离子发生反应,还可以在催化剂表面发生反应 (Zou et al., 2014),因此,拓宽了该体系的pH值适用范围.而当pH值低于3.0时,溶液中铁离子以[Fe (H2O)6]2+的形式存在,而这种形式相比于其他形式来说与过氧化氢的反应速度较慢 (Xu et al., 2009).当pH=3.0时,溶液中的酸性环境加速了催化剂表面的Fe2+的溶解性及催化剂表面不同活性位点的活性,从而提升了催化剂的催化效果 (Fayazi et al., 2016).由经典Haber-Weiss机制可知,H2O2产生·OH是整个降解过程的关键.而随着pH的不断升高,一方面会使得Fe3O4/TiO2表面·OH的生成受到抑制,溶液中·OH的数量下降,从而使得体系的氧化能力下降;另一方面,当溶液pH > 5.0时,生成的沉淀消耗了Fe2+的量,其催化效果降低.
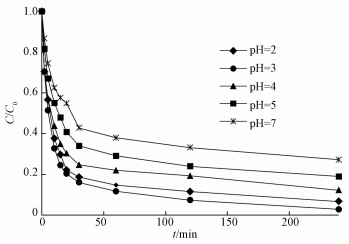 |
| 图 4 初始pH对3, 4-二氯三氟甲苯降解效率的影响 Fig. 4 Effect of initial pH on the removal rate of 3, 4-DCBTE |
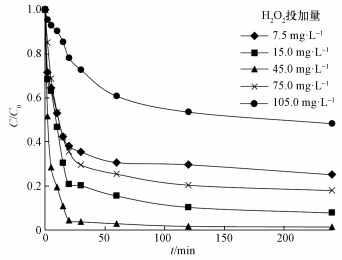
Kwan等 (2003)认为,·OH的产生速率与铁氧化物的表面积和H2O2浓度的乘积有关.为研究H2O2投加量对3, 4-DCBTE降解的影响,本文在反应温度为30.0 ℃、摇床转速为150.0 r·min-1、Fe3O4/TiO2催化剂投加量为0.5 g·L-1、pH=3.0条件下,分别考察了H2O2浓度为7.5、15.0、45.0、75.0、105.0 mg·L-1时,对3, 4-DCBTE的降解效率的影响.如图 5所示,当过氧化氢投加量为45.0 mg·L-1时,3, 4-DCBTE的去除率达到最大值,为98.9%.当H2O2投加量低于或高于45.0 mg·L-1时,3, 4-DCBTE的去除率皆降低.大量研究表明,H2O2不仅可以与Fe2+反应生成·OH,同时也可以与Fe3+反应重新产生Fe2+,因此,当H2O2浓度低于45.0 mg·L-1时,随着其浓度的增加溶液中所产生的·OH的量随着增加从而加快了反应的进行;当H2O2浓度超过一定值时,一方面,溶液中过量的H2O2会通过式 (3) 发生自身的分解,从而造成浪费;另一方面,溶液中突然产生过量的·OH (Ghatak, 2014),其中一部分会通过式 (4)、(5)(Wang et al., 2016) 中的反应因自身相互作用被消耗,造成H2O2无效分解,虽然反应会生成HO2·和O2,但其氧化能力较低,且对于降解3, 4-DCBTE效果较差.

|
(3) |
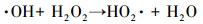
|
(4) |

|
(5) |
 |
| 图 5 H2O2浓度对3, 4-二氯三氟甲苯的降解效率的影响 Fig. 5 Removal rate of 3, 4-DCBTE on the conditions of different amout of H2O2 |
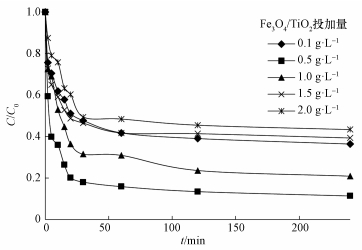
在Fe3O4/TiO2-H2O2体系中,Fe3O4/TiO2的投加量对溶液中·OH的产生量有着决定性的作用.在温度为30.0 ℃、pH=3.0、H2O2投加量为45.0 mg·L-1条件下,Fe3O4/TiO2投加量由0.1 g·L-1增加至2.0 g·L-1,探究其对3, 4-DCBTE降解效率的影响,结果如图 6所示.当催化剂投加量由0.1 g·L-1依此增加至2.0 g·L-1时,溶液中3, 4-DCBTE的去除率分别为63.5%、88.6%、79.0%、60.6%和56.6%,其中,当催化剂投加量为0.5 g·L-1时,3, 4-DCBTE的去除率达到最大,为88.6%;当催化剂投加量开始增加时,降解效率增加可能是因为随着催化剂投加量的增加,一方面为H2O2提供了更多的催化活性位点,另一方面溶液中Fe2+浓度增大.如图 7中所示,在pH=2.0条件下,溶液是强酸性环境,使得溶液中二价铁离子浓度约为0.7 mg·L-1;当pH=7.0时,溶液中铁离子浓度随着反应时间的增加有所增加,最大约为0.3 mg·L-1,使得H2O2能够分解产生更多的·OH,从而提高了3, 4-DCBTE的降解效率,但当催化剂的投加量过大时,一方面团聚现象加重,使得活性位点减少.此外,Fe3O4的增加会使得体系中发生如式 (6)(Pi et al., 2014) 中的反应,从而消耗溶液中的羟基自由基,影响其催化活性,导致催化效率下降.
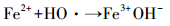
|
(6) |
 |
| 图 6 不同Fe3O4/TiO2投加量下3, 4-二氯三氟甲苯去除效果 Fig. 6 Removal rate of 3, 4-DCBTE on the different amout of Fe3O4/TiO2 |
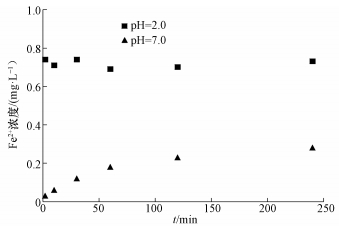 |
| 图 7 溶液中Fe2+浓度 Fig. 7 The concentration of Fe2+ in the solution |
为探究Fe3O4/TiO2掺杂比对体系催化效果的影响,把其分别添加在温度、pH值、H2O2投加量都相同的体系中,不同Fe3O4/TiO2掺杂比对3, 4-DCBTE的降解效率见图 8.由图 8可知,当Fe3O4:TiO2=1:1时,催化效果最好,反应240 min后去除率可达96.5%.Fenton反应的机理很早就被报道过,虽然在溶液中不存在Fe2+和Fe3+的情况下H2O2也能够产生·OH,但其生成速率远远小于前者,可能因为Fe3O4是唯一一个同时包含Fe2+和Fe3+的铁氧化物,因此,Fe3O4被称为Fenton反应中催化效率最高的催化剂 (Watts et al., 1996).当Fe3O4:TiO2=2:1时,催化效率不高可能是因为Fe3O4在催化反应中较不稳定,易团聚,使得其比表面积减小,不利于·OH的产生.当Fe3O4:TiO2=1:1时,TiO2量增加可以使Fe3O4附着于其表面,提高稳定性的同时也提高了比表面积,从而提高了其催化效率.当Fe3O4:TiO2=1:2时,负载TiO2的浓度过高,易发生脱落现象,溶液中TiO2颗粒之间的碰撞机率增加,使得其发生团聚的可能性增加,导致催化效率下降.
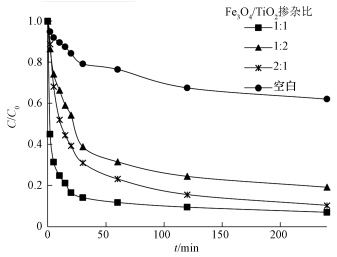 |
| 图 8 不同掺杂比催化剂降解3, 4-二氯三氟甲苯效果 Fig. 8 Removal rate of 3, 4-DCBTE by the different doping ratio catalyst |
温度对3, 4-DCBTE降解的影响如图 9所示,随着反应温度的上升,3, 4-DCBTE的去除率增加,且根据阿伦尼乌斯定律 (唐玉朝等,2002;吴彦瑜等,2010) 可得出其Ea=36.9 kJ·mol-1,而一般扩散控制反应的表观活化能为10~13 kJ·mol-1,其值略高,说明在本体系中起主导作用的是在催化剂表面的反应而不是传质速率.且据图中的动力学模拟结果显示,该反应符合一级反应动力学方程 (Xue et al., 2009),且随着温度的升高,反应速率常数k值由0.0115 min-1增加到0.0599 min-1,说明3, 4-DCBTE降解反应是吸热反应,温度升高,加快了体系中离子的布朗运动速率 (袁基刚等,2015),H2O2与Fe2+及Fe3+碰撞频率增加,从而使得体系中·OH数量增加,有利于·OH与3, 4-DCBTE的取代基发生反应.然而,较高的温度可能会加速H2O2自身的分解.虽然从结果来看,该反应较适合于高温反应,但不难看出在常温下该反应效果也较好.因此,该体系在去除自然水体中的有机物方面有较好的应用前景.
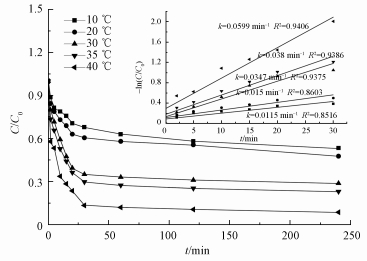 |
| 图 9 不同温度下3, 4-二氯三氟甲苯的降解效果及其动力学拟合 Fig. 9 Removal rate of 3, 4-DCBTE and the fitting of pseudo-first order equation on the different temperature |
通过上述的动力学拟合,根据Arrhenius定律、Eyring方程对3, 4-DCBTE的降解反应进行热力学模拟 (Babuponnusami et al., 2011),拟合结果如图 10所示.然后根据其计算出的反应的焓变△H、反应的熵变△S、反应活化能Ea及反应的吉布斯自由能△G如表 1所示.当反应活化能低于40.0 kJ·mol-1时,反应可在室温下快速进行.由表 1可知,3, 4-DCBTE降解反应的表观活化能为36.88 kJ·mol-1,所以该反应在室温下较易发生 (傅献彩等,1990).
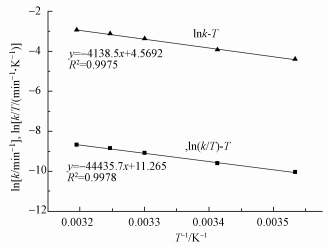 |
| 图 10 Fe3O4/TiO2去除3, 4-二氯三氟甲苯反应的热力学模拟 Fig. 10 Thermodynamic simulation of degrade 3, 4-DCBTE by Fe3O4/TiO2 |
| 表 1 Fe3O4/TiO2去除3, 4-二氯三氟甲苯反应的热力学参数值 Table 1 Result of activation thermodynamics of degrade 3, 4-DCBTE by Fe3O4/TiO2 |
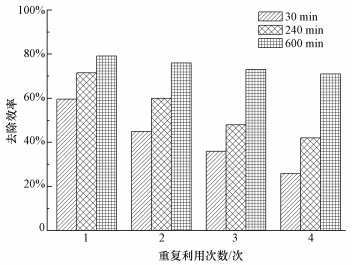
传统Fenton反应中铁离子不易回收利用,从而造成二次污染,本研究利用Fe3O4的磁性将其回收并测定重复利用率.由图 11可知,第1次重复利用时,3, 4-DCBTE的去除速率较快,在30 min时其去除率达到60.1%;第2次重复利用时,反应240 min后,去除效率相较于第1次下降了约11.5%;除此之外,在240 min内,相较于前1次重复利用,后1次都降低了约11.8%.由此可以推测,可能是反应过程中的副产物占据了催化剂的活性位点,也或者是在反应或洗涤过程中催化剂产生了损失.总之,由图 11可以看出,当延长反应时间至600 min时,4次重复利用效率相差不大,平均为75.3%,说明Fe3O4/TiO2有较好的应用前景.
 |
| 图 11 催化剂重复使用降解3, 4-DCBTE效果 Fig. 11 Reuse of the catalyst for four consecutive experiments |
取Fe3O4/TiO2-H2O2类Fenton体系最优条件处理的3, 4-DCBTE样品进行离子色谱检测,得出的结果如图 12所示,所测得的F-和Cl-浓度分别为0.052和0.021 mmol·L-1.
 |
| 图 12 反应过程中F-和Cl-浓度变化 Fig. 12 hanges of concentration of F- and Cl- |
1) Fe3O4/TiO2催化剂对3, 4-二氯三氟甲苯有较好的降解效果.3, 4-二氯三氟甲苯的降解率随着温度的升高而增加,Fe3O4/TiO2催化剂的最适投加量为0.5 g·L-1,240 min后3, 4-二氯三氟甲苯的降解效率可达到99.1%.
2) Fe3O4/TiO2-H2O2体系所适用的pH范围是3.0~7.0, 相比于传统Fenton反应拓宽了pH的适用范围.
3) 根据热力学拟合,Fe3O4/TiO2降解3, 4-二氯三氟甲苯反应所需的Ea为36.88 kJ·mol-1,在室温下能够快速发生,该反应符合一级动力学.
| [${referVo.labelOrder}] | Arcadipane E, Sanz R, Miritello M, et al. 2016. TiO2 nanowires on Ti thin film for water purification[J]. Materials Science in Semiconductor Processing, 42 : 24–27. DOI:10.1016/j.mssp.2015.07.055 |
| [${referVo.labelOrder}] | Arnold S M, Hickey W J, Harris R F. 1995. Degradation of atrazine by Fenton's reagent:condition optimizationand productquantification[J]. Environmental Science and Technology, 29(8) : 2083–2089. DOI:10.1021/es00008a030 |
| [${referVo.labelOrder}] | Babuponnusami A, Muthukumar K. 2011. Degradation of phenol in aqueous solution by fenton, sono-fenton and sono-photo-fenton methods[J]. Clean-Soil, Air, Water, 39(2) : 142–147. DOI:10.1002/clen.201000072 |
| [${referVo.labelOrder}] | Bai C, Xiao W, Feng D, et al. 2013. Efficient decolorization of Malachite Green in the Fenton reaction catalyzed by[J]. Chemical Engineering Journal, 215 : 227–234. |
| [${referVo.labelOrder}] | 曹宇. 2012. 湿式氧化技术处理氟磺胺草醚农药废水的研究[D]. 北京: 中国地质大学 (北京). 2-7 |
| [${referVo.labelOrder}] | Chang Y C, Chen D H. 2005. Preparation and adsorption properties of monodisperse chitosan-bound Fe3O4 magnetic nanoparticles for removal of Cu (Ⅱ) ions[J]. Journal of Colloid and Interface Science, 283(2) : 446–451. DOI:10.1016/j.jcis.2004.09.010 |
| [${referVo.labelOrder}] | Chen C T, Chen Y C. 2005. Fe3O4/TiO2 core/shell nanoparticles as affinity probes for the analysis of phosphopeptides using TiO2 surface-assisted laser desorption/ionization mass spectrometry[J]. Analytical Chemistry, 77(18) : 5912–5919. DOI:10.1021/ac050831t |
| [${referVo.labelOrder}] | 陈汝芬, 张云, 刘辉. 2014. Fe3O4-TiO2复合材料的制备及光催化降解性能[J]. 河北师范大学学报 (自然科学版), 2014(4) : 15. |
| [${referVo.labelOrder}] | 代先祥, 陈洪, 何海建, 等. 2011. 磁性纳米TiO2/Fe3O4的制备及光催化去除甲基紫的研究[J]. 四川师范大学学报:自然科学版, 2011, 34(6) : 889–893. |
| [${referVo.labelOrder}] | Fayazi M, Taher M A, Afzali D, et al. 2016. Enhanced Fenton-like degradation of methylene blue by magnetically activated carbon/hydrogen peroxide with hydroxylamine as Fenton enhancer[J]. Journal of Molecular Liquids, 216 : 781–787. DOI:10.1016/j.molliq.2016.01.093 |
| [${referVo.labelOrder}] | 傅献彩, 沈文霞, 姚天扬. 1990. 物理化学(第4版)[M]. 北京: 高等教育出版社. |
| [${referVo.labelOrder}] | Ghatak H R. 2014. Advanced oxidation processes for the treatment of biorecalcitrant organics in wastewater[J]. Critical Reviews in Environmental Science and Technology, 44(11) : 1167–1219. DOI:10.1080/10643389.2013.763581 |
| [${referVo.labelOrder}] | He J, Yang X, Men B, et al. 2016. Interfacial mechanisms of heterogeneous Fenton reactions catalyzed by iron-based materials:A review[J]. Journal of Environmental Sciences, 39 : 97–109. DOI:10.1016/j.jes.2015.12.003 |
| [${referVo.labelOrder}] | Hou L, Wang L, Royer S, et al. 2016. Ultrasound-assisted heterogeneous Fenton-like degradation of tetracycline over a magnetite catalyst[J]. Journal of Hazardous Materials, 302 : 458–467. DOI:10.1016/j.jhazmat.2015.09.033 |
| [${referVo.labelOrder}] | Hu X, Liu B, Deng Y, et al. 2011. Adsorption and heterogeneous Fenton degradation of 17α-methyltestosterone on nano Fe3O4/MWCNTs in aqueous solution[J]. Applied Catalysis B Environmental, 107(3) : 274–283. |
| [${referVo.labelOrder}] | Hua Z, Ma W, Bai X, et al. 2014. Heterogeneous Fenton degradation of bisphenol A catalyzed by efficient adsorptive Fe3O4/GO nanocomposites[J]. Environmental Science and Pollution Research, 21(12) : 7737–7745. DOI:10.1007/s11356-014-2728-8 |
| [${referVo.labelOrder}] | Ijpelaar G F, Groenendijk M, Kruithof J C, et al. 2002. Fenton process for the combined removal of iron and organic micropollutants in groundwater treatment[J]. Water Science and Technology:Water Supply, 2(2) : 229–236. |
| [${referVo.labelOrder}] | Jiang J, Zou J, Zhu L, et al. 2011. Degradation of methylene blue with H2O2 activated by peroxidase-like Fe3O4 magnetic nanoparticles[J]. Journal of Nanoscience and Nanotechnology, 11(6) : 4793–4799. DOI:10.1166/jnn.2011.4192 |
| [${referVo.labelOrder}] | Kathe M V, Empfield A, Na J, et al. 2016. Hydrogen production from natural gas using an iron-based chemical looping technology:Thermodynamic simulations and process system analysis[J]. Applied Energy, 165 : 183–201. DOI:10.1016/j.apenergy.2015.11.047 |
| [${referVo.labelOrder}] | Kwan W P, Voelker B M. 2003. Rates of hydroxyl radical generation and organic compound oxidation in mineral-catalyzed Fenton-like systems[J]. Environmental Science & Technology, 37(6) : 1150–1158. |
| [${referVo.labelOrder}] | Li C, Han J, Zhang Z, et al. 1999. Preparation of TiO2-Coated Al2O3 particles by chemical vapor deposition in a rotary reactor[J]. Journal of the American Ceramic Society, 82(8) : 2044–2048. |
| [${referVo.labelOrder}] | 林静. 2012. 除草剂类农药废水的氧化-还原预处理技术研究[D]. 北京: 中国地质大学 (北京). 67-83 |
| [${referVo.labelOrder}] | Methatham T, Bellotindos L M, Chen T E, et al. 2015. Factors affecting treatment of TFT-LCD wastewater by fenton and electro-Fenton processes[J]. Environmental Progress & Sustainable Energy, 35(2) : 368–373. |
| [${referVo.labelOrder}] | Pi Y, Feng J, Song M, et al. 2014. Degradation potential of ofloxacin and its resulting transformation products during Fenton oxidation process[J]. Chinese Science Bulletin, 59(21) : 2618–2624. DOI:10.1007/s11434-014-0293-7 |
| [${referVo.labelOrder}] | 唐玉朝, 胡春, 王怡中. 2002. TiO2光催化反应机理及动力学研究进展[J]. 化学进展, 2002, 14(3) : 192–199. |
| [${referVo.labelOrder}] | Wang J, Yao Z, Yang M, et al. 2016. A Fe3O4/FeAl2O4 composite coating via plasma electrolytic oxidation on Q235 carbon steel for Fenton-like degradation of phenol[J]. Environmental Science and Pollution Research, 23 : 14927–14936. DOI:10.1007/s11356-016-6613-5 |
| [${referVo.labelOrder}] | Wang N, Zhu L, Wang M, et al. 2010. Sono-enhanced degradation of dye pollutants with the use of H2O2 activated by Fe3O4 magnetic nanoparticles as peroxidase mimetic[J]. Ultrasonics Sonochemistry, 17(1) : 78–83. DOI:10.1016/j.ultsonch.2009.06.014 |
| [${referVo.labelOrder}] | Watts R J, Dilly S E. 1996. Evaluation of iron catalysts for the Fenton-like remediation of diesel-contaminated soils[J]. Journal of Hazardous Materials, 51(1) : 209–224. |
| [${referVo.labelOrder}] | 吴彦瑜, 郑可, 陈东宇, 等. 2010. Fenton试剂氧化降解腐殖酸动力学[J]. 环境科学, 2010, 31(9) : 2085–2091. |
| [${referVo.labelOrder}] | Xu L, Wang J. 2012. Magnetic nanoscaled Fe3O4/CeO2 composite as an efficient Fenton-like heterogeneous catalyst for degradation of 4-chlorophenol[J]. Environmental Science & Technology, 46(18) : 10145–10153. |
| [${referVo.labelOrder}] | Xu X R, Li X Y, Li X Z, et al. 2009. Degradation of melatonin by UV, UV/H2O2, Fe2+/H2O2 and UV/Fe2+/H2O2processes[J]. Separation and Purification Technology, 68(2) : 261–266. DOI:10.1016/j.seppur.2009.05.013 |
| [${referVo.labelOrder}] | Xue X, Hanna K, Abdelmoula M, et al. 2009. Adsorption and oxidation of PCP on the surface of magnetite:kinetic experiments and spectroscopic investigations[J]. Applied Catalysis B:Environmental, 89(3) : 432–440. |
| [${referVo.labelOrder}] | 杨智临, 张鲁宁, 陈海, 等. 2015. Fenton氧化工艺降解废水中3, 4二氯三氟甲苯[J]. 净水技术, 2015, 34(3) : 30–35. |
| [${referVo.labelOrder}] | 袁基刚, 刘兴勇, 李敏. 2015. 改性粉煤灰吸附沼液中氨氮的动力学和热力学研究[J]. 中国给水排水, 2015, 31(9) : 96–99. |
| [${referVo.labelOrder}] | 张博. 2008. 含氟二苯醚类除草剂氣氟草醚乙酯的合成工艺研究[D]. 北京: 北京化工大学. 45-60 |
| [${referVo.labelOrder}] | 张国卿, 王罗春, 徐高田, 等. 2004. Fenton试剂在处理难降解有机废水中的应用[J]. 工业安全与环保, 2004, 30(3) : 17–19. |
| [${referVo.labelOrder}] | Zhang X, He M, Liu J H, et al. 2014. Fe3O4/C nanoparticles as high-performance Fenton-like catalyst for dye decoloration[J]. Chinese Science Bulletin, 59(27) : 3406–3412. DOI:10.1007/s11434-014-0439-7 |
| [${referVo.labelOrder}] | 赵冉, 马宏瑞, 吕向菲, 等. 2013. 包覆性TiO2/Fe3O4光催化剂的合成及光催化性能研究[J]. 化学研究与应用, 2013, 25(11) : 1554–1558. |
| [${referVo.labelOrder}] | Zhu M, Diao G. 2011. Synthesis of porous Fe3O4 nanospheres and its application for the catalytic degradation of xylenol orange[J]. The Journal of Physical Chemistry C, 115(39) : 18923–18934. DOI:10.1021/jp200418j |
| [${referVo.labelOrder}] | Zou X, Zhou T, Mao J, et al. 2014. Synergistic degradation of antibiotic sulfadiazine in a heterogeneous ultrasound-enhanced Fe0 persulfate Fenton-like system[J]. Chemical Engineering Journal, 257 : 36–44. DOI:10.1016/j.cej.2014.07.048 |
 2017, Vol. 37
2017, Vol. 37


