由于人口数量增加和经济发展,石油等化石燃料消耗量急剧上升.化石燃料燃烧造成全球气候变暖、环境污染等问题, 迫使人们寻找能够替代化石燃料的清洁能源 (Nigam et al., 2011).木质纤维素废弃物作为一种常见的农林固体废弃物,一般通过室外燃烧进行处理,然而燃烧过程中释放出大量温室气体和颗粒物,会对环境造成严重破坏 (Zhang et al., 2015).研究发现,木质纤维素废弃物可以通过一系列的技术转化为生物燃料 (Menon and Rao, 2012).纤维素酶通常作为水解酶加入预处理后的木质纤维素材料中,将纤维素酶分解成可发酵的单糖.未来随着生物燃料的商业化生产,酶的需求量将大大增加 (Yoon et al., 2015).然而,现今的商业酶不仅活力低而且价格贵,难以实现工业化应用.所以通过筛选出纤维素酶产量高,具有较高酶活性的纤维素菌株,是降低生物燃料成本的有效手段.现今,大多数的纤维素酶都是从真菌中获得,从真菌中获得的纤维素酶产量高、活性高,并且其作为胞外酶易于分离和提取 (刘洁丽和王婧,2008;Chaurasia et al., 2015).但细菌有较高的生长速率, 使得其在生产纤维素酶中具有很大的潜力 (Nagendran et al., 2009;Paudel and Qin 2015).因此,研究者从各种环境中如土壤、堆肥及废水中分离出能够合成纤维素酶的细菌 (Tai et al., 2004、Lee et al., 2008、Yang et al, 2014).其中,高温环境中筛选的嗜热纤维素酶产生菌由于其能够在较高温度下生长,培养过程不易受到污染,并且纤维素酶活性高,热稳定性强,因而具有很好的应用前景.因此,本研究从温泉区筛选出具有生产嗜热性纤维素酶的菌株,并对其纤维素酶性质进行分析.另外,为进一步降低产酶成本,试验使用经过碱处理的木质纤维素废弃物作为替代碳源生产纤维素酶,旨在为耐高温纤维素酶的开发和生产提供一定依据.
2 材料与方法 (Materials and methods) 2.1 实验材料土壤样品:样品采自中国湖南省郴州市汝城县热水镇60.5 ℃温泉泥水混合样,pH值为7.0.
培养基:为尽可能富集具有产纤维酶能力的菌株,采用营养丰富的Mendel and Resse培养基 (MR培养基) 作为富集培养基 (Acharya et al., 2008),另外还选取常用的Minimum Salt培养基 (MS培养基)(Berg et al., 1972)、Bushnell Hanns培养基 (BH培养基) (Lo et al., 2009) 作为比较.
木质纤维素材料:收集稻杆、甘蔗渣及水葫芦,60 ℃烘干并粉碎后,过40目筛,于室温下密封保存,以备后续实验使用.
2.2 实验方法 2.2.1 产纤维素酶嗜热菌的筛选向含有100 mL富集培养基的250 mL锥形瓶中加入10 mL泥水样品,将锥形瓶置于60 ℃的摇床中以170 r · min-1培养24 h.从锥形瓶中移取1 mL的菌液到新的培养基中,在相同条件下继续培养24 h,重复此过程一个星期后,将菌液稀释后并取0.1 mL涂布于平板筛选培养基中,于60 ℃下培养24 h.菌落长出后,挑取单个菌落进行平板划线培养,重复划线使菌株得以分离和纯化.对菌株进行初步筛选后,将筛选的菌株点种于平板筛选培养基中,于60 ℃下培养24 h.用1%的刚果红溶液对平板在室温下染色15 min后再用1 mol · L-1 NaCl溶液进行脱色.挑选平板中周围出现透明圈的菌落进行复筛.
2.2.2 16S rRNA基因和系统发育分析使用基因组提取试剂盒对菌株的基因组DNA进行提取.并采用细菌通用引物27F (5′-AGTTTGATCCTGGCTCAG-3′) 和1492R (5′-GGTTACCTTGTTACGACTT-3′) 进行PCR扩增.PCR程序为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火55 s,72 ℃延伸100 s,35个循环,72 ℃延伸10 min,最后保持在4 ℃.对上述PCR步骤所得的目标扩增产物送样至生工生物工程 (上海) 股份有限公司测序,将测序返回结果在NCBI网站使用BLAST程序进行匹配,录入相似菌株序列.用Clustal软件进行序列对比,使用MEGA程序进行系统发育树的构建,采用邻接法获得分支系统树,并通过自举分析进行拓扑结构置信度的检测,自举数据集为1000次.
2.2.3 酶活力及蛋白质浓度的测定羧甲基纤维素酶 (CMCase) 活性的测定使用3,5-二硝基水杨酸 (DNS) 法 (Miller, 1959).酶活力单位 (U) 定义为1 min水解底物产生1 μmol葡萄糖所需要的酶量.蛋白质浓度的测定使用考马斯亮蓝法 (Bradford, 1976).
2.2.4 纤维素酶的纯化将菌株接种于富集培养基中于60 ℃下培养48 h后,将菌液在10000 r · min-1下离心20 min,以去除细胞和残余培养基.取上清液,加入饱和度为80%的硫酸铵于4 ℃搅拌24 h后在10000 r · min-1下离心20 min.收集蛋白沉淀,重悬后再于4 ℃透析24 h.使用截留分子量为10 kD的超滤管对样品进行浓缩后于阴离子交换柱进行层析.收集洗脱液并在280 nm下测定其吸光度以检测蛋白质出峰情况.对具有纤维素酶活性的洗脱液进行酶活力测定和蛋白质含量分析,酶的比活性为总酶活 (U)/总蛋白质含量 (mg), 纯化倍数为纯化后酶的比活性/粗酶液比酶活比值表示,将具有最高比活性的洗脱液于4 ℃下密封保存以备后续分析.
2.2.5 蛋白质酶谱分析对纯化过程中得到的样品及分子量蛋白质标准分别进行SDS-PAGE蛋白电泳,采用15%分离胶和5%浓缩胶.电泳结束后,用考马斯蓝R-250染色液进行染色1 h,然后脱色2 h观察蛋白条带.为检测特定蛋白质活性,在制作凝胶时,将1%(W/V, g · mL-1) CMC溶液加入到聚丙烯酰胺中,操作温度为4 ℃.电泳结束后,将复性后的凝胶用0.2%(W/V, g · mL-1) 刚果红溶液进行染色,最后用2 mol · L-1 NaCl溶液脱色显示透明带.
2.2.6 产酶条件研究碱处理稻杆、甘蔗渣和水葫芦:将干燥后的稻杆、甘蔗渣及水葫芦以固液比为1/20(W/V, g · mL-1) 于50 ℃条件下在3%(W/V, g · mL-1) 的NaOH溶液中浸泡2 h.反应结束后,将溶液过滤并水洗至中性后回收滤渣,将滤渣置于105 ℃下干燥后密封保存用于产酶发酵, 并对处理前后木质纤维素的组成成分如纤维素、半纤维素及木质素进行分析 (张耿崚等,2016).
不同培养基对菌株产纤维素酶的影响:将分离的菌株在含100 mL富集培养基的250 mL锥形瓶中于170 r · min-1、60 ℃下培养至指数生长期后,将20 mL菌液移至含有100 mL不同培养基 (MR培养基、MS培养基和BH培养基) 的250 mL锥形瓶中, 于60 ℃培养72 h,最后测定菌株CMCase活性.
不同培养时间对菌株产纤维素酶的影响:将培养至指数生长期的20 mL菌液移至含有100 mL最佳培养基的250 mL锥形瓶中,置于170 r · min-1、60 ℃下培养,分别测定26~168 h菌株的CMCase活性.
不同碳源对菌株产纤维素酶的影响:将分离的菌株在含100 mL用经碱处理的稻杆、甘蔗渣和水葫芦替代CMC的富集培养基的250 mL锥形瓶中培养至指数生长期后,将20 mL菌液移至100 mL新培养基中于60 ℃以170 r · min-1下培养,分别测定26~168 h菌株的CMCasa活性.
2.2.7 酶学性质分析酶的最适pH:取适量纯化后的酶液加入含1% CMC底物的不同pH的醋酸 (浓度为100 mmol · L-1, pH为3.0~6.0)、磷酸 (浓度为100 mmol · L-1, pH为7.0~8.0) 和Tris-HCl (浓度为100 mmol · L-1, pH为9.0~10.0) 缓冲溶液中,于50 ℃下培养60 min后采用DNS法测定其酶活性,并以最高酶活力作为100%计算相对活性.
酶的最适温度及热稳定性:取适量纯化后的酶液加入含有1% CMC底物的磷酸 (浓度为100 mmol · L-1, pH=7.0) 缓冲溶液中,将其置于30~90 ℃不同温度下培养60 min,采用DNS法测定其酶活性.而测定其热稳定性时,取适量纯化后的酶液加入磷酸 (浓度为100 mmol · L-1, pH=7.0) 缓冲溶液中,将其置于30~90 ℃条件下培养时间6 h,每隔60 min测定其残余CMCase活力,并以最高酶活力作为100%计算相对活性.
3 结果 (Results) 3.1 菌株的筛选和纯化经过3~4次平板分离纯化后,有5株菌株在CMC筛选培养基经染色脱色后出现透明圈.通过测定菌株胞外酶活进行复核后,选取具有最高酶活力的菌株作进一步研究.该菌株革兰氏染色结果显示为阳性,在显微镜下的形状为杆状.利用BLAST程序对菌株的16S rDNA核苷酸序列进行同源性分析结果显示 (图 1),该菌株与嗜热芽孢杆菌DSM405(Bacillus DSM405) 的同源性达99%,初步确定该菌株为嗜热地芽孢杆菌HTA426 (Geobacillus kaustophilus sp. HTA 426).
 |
| 图 1 嗜热地芽孢杆菌HTA 426的系统发育树 Fig. 1 Phylogenetic tree of Geobacillus kaustophilus sp.HTA 426 |
粗酶提取液经硫酸铵沉淀纯化后,结果显示蛋白质总量为1013.03 mg,CMCase总活性为3009.54 U,比酶活为2.97 U · mg-1.经过DEAE-纤维素柱进一步纯化后,酶液的比酶活上升到6.76 U · mg-1,是粗酶提取液的5.12倍,而酶回收率为10.14%(表 1).SDS-PAGE凝胶电泳分析结果显示,在经过硫酸铵沉淀提纯后,酶液中含有较多杂蛋白,而通过超滤管浓缩并经DEAE-纤维素柱层析纯化后,蛋白条带较为集中,表明酶液达到进一步纯化.与标准蛋白质图谱比较,在约40 kDa分子量下有明显蛋白条带.并且在含CMC凝胶片中,在同样位置发现明显的空白带,表明在此处的蛋白具有降解CMC的活性的功能 (图 2).
| 表 1 纤维素酶纯化结果 Table 1 The result of purification of cellulase |
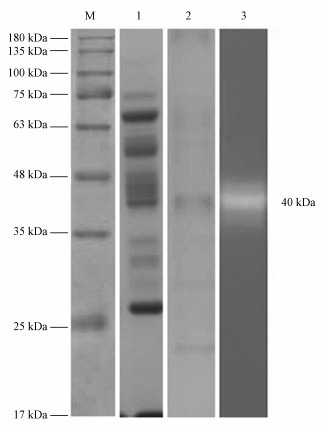 |
| 图 2 纤维素酶纯化过程的SDS-PAGE电泳图 (M.标准蛋白, 1.硫酸铵沉淀上清液, 2.含酶活性的离子交换层析液, 3.具有纤维素酶活性的纯化酶) Fig. 2 SDS-PAGE analysis of purified cellulase (M.protein marker, 1.Ammonium sulfate precipitate of culture supernatant, 2.fraction with cellulase activity collected from ion exchange chromatography, 3.the purified enzyme with the cellulase activity) |
不同培养基对菌株产酶的影响如图 3a所示,在不同培养基培养72 h后菌液CMCase活性依次为54.99(MR)、46.70(MS) 和36.94 U · mL-1(BH).这可能由于在MS和BH培养基中以硝酸盐作为氮源对菌株产纤维素酶具有一定的抑制作用 (Rajmane and Korekar, 2012; Chaurasia et al., 2015), 而MR培养基中的NH4SO4是一种优质无机氮源,与蛋白胨形成复合氮源,有利于菌株的吸收和利用 (杨捷等,2013).对3种培养基中菌株的酶活性结果进行显著性检验发现, 3种不同培养基之间对菌株产酶的影响并无显著差异 (p > 0.05,n=3).这说明在有足够的碳源和氮源下,培养基成分的差异并不会对菌株产酶造成显著影响.
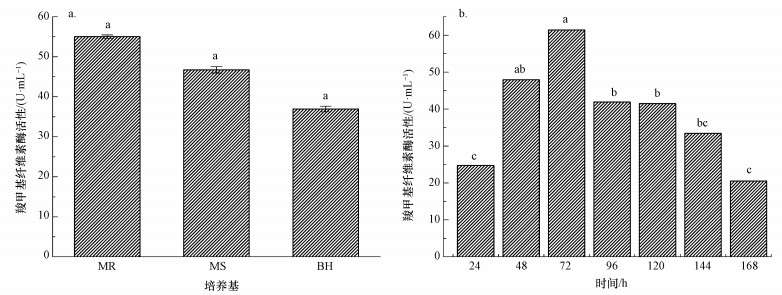 |
| 图 3 不同培养基 (a) 和培养时间 (b) 对菌株产酶影响 (不同字母代表各组间在Duncan′s Multiple Range Test下具有显著性差异 (p < 0.05, n=3),部分数据标准偏差较小,未能显示误差棒,下同) Fig. 3 Effect of different medium (a) and incubation time (b) on the strains producing enzyme (The different letters indicate significant difference between each group according to the Duncan′s Multiple Range Test (p < 0.05, n =3), some error bars represented standard diviation are too small to been seen, the same below) |
不同培养时间下菌株产酶情况如图 3b所示,在培养24 h后,经过对培养基各营养成分的适应后开始进入快速生长期,菌体大量繁殖且不断合成大量的酶,菌液CMCase活性显著上升 (p < 0.05,n=3),于72 h时活性达到最高后显著下降 (p < 0.05,n=3),并在96~168 h缓慢下降.这是因为在72 h后营养物质不足及菌株生长过程中有害代谢产物的持续积累,使得菌株繁殖速度变慢,死亡量逐渐高于繁殖量,并且酶的热稳定性也是导致培养后期酶活逐渐下降的因素.由此可得,为了获得理想数量和活性的纤维素酶,最适合收集的时间为48~72 h.
稻杆、甘蔗渣及水葫芦进行碱处理前后的主要成分如表 2所示.而不同木质纤维素废弃物 (稻杆、甘蔗渣、水葫芦) 及不同添加量 (1%、3%、5%(W/V, g · mL-1)) 作为碳源对菌株产酶的影响如图 4所示.与图 3b对比可发现,加入生物质替代CMC碳源后菌液CMCase活性最高出现时间会相对推迟48~72 h,这可能由于细菌适应生物质碳源需要更长的时间,而CMC结构相对较简单,且溶于培养液有利于细菌吸收利用, 所以菌株能够在较短时间内进入对数生长期,菌液酶活快速升高.为了探讨不同生物质替代CMC碳源对菌株产酶的影响,选取图 3b和图 4中CMCase活性最高值对稻杆、甘蔗渣、水葫芦、CMC之间的显著差异进行比较,结果显示, 在以甘蔗渣为碳源下CMCase活性显著高于稻杆、CMC及水葫芦 (p < 0.05,n=3),分别高38.7%、68.7%和88.1%;稻杆也显著高于水葫芦和CMC (p < 0.05,n=3),水葫芦与CMC无显著差别 (p > 0.05,n=3).根据成分分析结果显示,经过碱预处理后甘蔗渣、稻杆中的纤维素显著高于水葫芦,而木质素则相反 (表 2)(p < 0.05,n=3),纤维素含量高,碳源充足,有利于菌株生长繁殖,符合酶活性的比较结果,由此说明生物质作为替代碳源其成分对菌株产酶具有显著影响.然而,甘蔗渣与稻杆中纤维素和木质素成分无显著差别 (p > 0.05,n=3), 而酶活性差别显著 (p < 0.05,n=3),由此可推测有其他因素影响菌株产酶.碱处理不仅能够去除大部分木质素,还能改变木质纤维素结构 (Sation et al., 2016),具体因素还需要作进一步的研究.
| 表 2 未处理和碱处理木质纤维素生物质成分 Table 2 The composition of untreated and alkali-treated lignocellulose biomass |
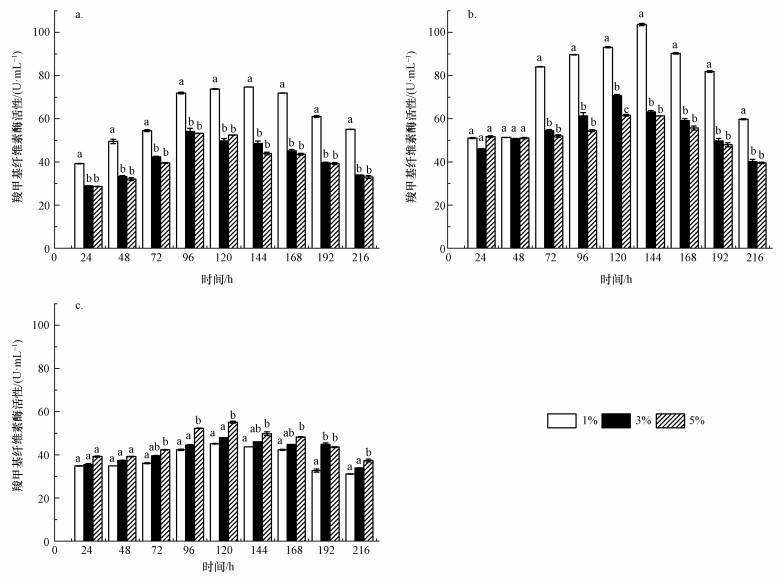 |
| 图 4 不同碳源对菌株产酶影响 (a.稻杆、b.甘蔗渣c.水葫芦) Fig. 4 Effect of different carbon source, rice straw (a), sugarcane (b) and water hyacinth (c) on the strains producing enzyme |
此外,还对同一时间下不同生物质添加量的结果进行显著差异分析,对于稻杆 (图 4a),添加量为1%时CMCase活性显著高于其余添加量 (p < 0.05,n=3),而添加量为3%与5%之间并无明显差异 (p > 0.05,n=3).而对于甘蔗渣、水葫芦 (图 4b、4c),在24~48 h内生物质添加量对CMCase活性并无显著影响 (p > 0.05,n=3).这可能是由于菌株处于适应培养基阶段,还未能进行快速繁殖,所以不同生物质添加量的影响并未显现.在48 h后,对于甘蔗渣,添加量为1%时的酶活性显著高于添加量为3%和5%时 (p < 0.05,n=3),原因与碳源为稻杆时相似.而碳源为水葫芦时,添加量为5%的酶活性显著高于添加量为1%,添加量为3%时的酶活性与其余两者无显著差异,这可能是因为经过碱处理的水葫芦中纤维素含量显著低于稻杆和甘蔗渣 (表 2),需要更高的添加量才能提供充足碳源.对比图 4a、4b、4c还可以得出, 菌株更易适应以稻杆为碳源的培养基,尽管最高CMCase活性显著低于甘蔗渣 (p < 0.05,n=3).
3.4 酶学性质分析pH对酶活性的影响如图 5a所示.纯化后的酶活性在pH为7时最高 (p < 0.05, n=3).在pH为5~7内酶活均能够保持在70%以上,而pH大于7时,酶活显著下降至65%以下 (p < 0.05, n=3),而pH为10时,酶活急剧下降至34%.这说明HTA426菌株合成的纤维素酶在中性偏酸性下具有良好的活性,适合于中性条件下反应.并且pH为5~8条件下活性依然能够保持在60%以上,说明此酶有较宽的pH适用范围.
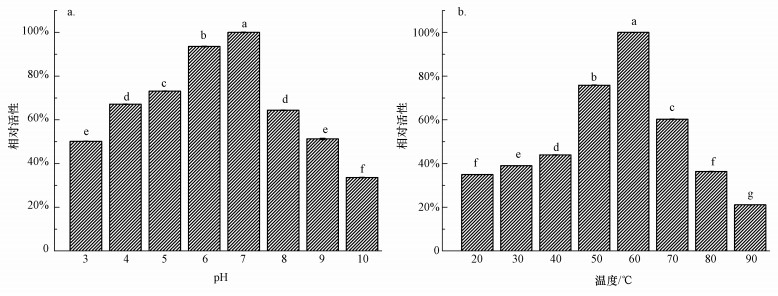 |
| 图 5 pH (a) 和温度 (b) 对酶活性的影响 Fig. 5 Effects of pH (a) and temperature (b) on the enzyme activity |
温度对酶活性的影响如图 5b所示.纯化后的酶在60 ℃下具有最高活性,在50 ℃和70 ℃下酶活性都显著下降 (p < 0.05, n=3),但活性能够保持在60%以上.温度的升高对酶活性影响非常大,从40 ℃升高至60 ℃的酶活由44%显著提升至最高活性 (p < 0.05, n=3),而从70 ℃升高至80 ℃时,活性由61%显著下降至36%(p < 0.05, n=3),温度继续升高至90 ℃时活性只有21%,显著低于80 ℃(p < 0.05, n=3).由此可得, 此酶在50~70 ℃具有良好的活性并对高温具有一定的适应性,适合在60 ℃反应,但在80 ℃以上温度下酶失活较大.这与Priya等 (2016)从温泉中筛选的嗜热脱氮芽孢杆菌 (Geobacillus thermodenitrificans) 相似.
温度对酶的稳定性影响如图 6所示.结果显示, 对于温度为20~90 ℃,酶的残余活性在0~3 h显著下降 (p < 0.05, n=3),在3 h后40~70 ℃下残余酶活保持相对稳定 (p > 0.05,n=3),而在30 ℃下残余酶活缓慢下降,对于80 ℃在4 h内仍显著下降 (p < 0.05,n=3),此时酶活几乎完全丧失.对于20 ℃,酶的残余活性在0~2 h内显著下降后以较慢速度继续下降,而在90 ℃下酶的残余酶活在0~2 h显著下降后,在3 h酶活几乎完全丧失.这是因为在低温下对酶会形成抑制作用,但作用效果较缓慢,而高温会破坏酶的蛋白结构,使酶迅速丧失活性.由此可得,此酶在20~30 ℃在5 h酶活性依然无法保持稳定,会缓慢下降;而40~70 ℃在3 h后保持稳定,在80~90 ℃在4 h后活性几乎完全丧失.
 |
| 图 6 温度对酶稳定性的影响 Fig. 6 Effects of temperature on the enzyme stability |
综上所述,在本实验提取的纤维素酶在pH为7、60 ℃下具有较高的CMCase活性和热稳定性.并在pH为5~8,温度为50~70 ℃时具有很好的适应性.
4 讨论 (Discussion)地芽孢杆菌属 (Geobacillus) 是2001年新命名的高温菌新属,它由芽孢杆菌属 (bacillus) 分支的几种菌种和新发现的菌种组成 (Nazina et al., 2001).地芽孢杆菌属 (Geobacillus) 通常具有优越的耐高温性,已有研究者筛选出具有产纤维素酶能力的嗜热地芽孢杆菌属 (Geobacillus)(Assareh et al., 2012、Alrumman, 2016).嗜热地芽孢杆菌HTA426(Geobacillus kaustophilus HTA426) 因其良好的热稳定性而一般作为嗜热基因源或工程菌进行利用 (Suzuki et al., 2013; 2015),而鲜有关于其具有产纤维素酶能力的报道.在本实验中筛选出的菌株HTA426能够生产较高酶活力的耐高温纤维素酶,开拓了嗜热地芽孢杆菌属 (Geobacillus) 的应用范围.
以木质纤维素生物质作为培养基碳源不仅能够有效降低生产成本,还能够处理日益增多的木质纤维素废弃物,减少对环境的污染,实现人类的可持续发展.Sadhu等 (2013)利用从牛粪中筛选的芽孢杆菌 (Bacillus sp.) 降解CMC、甘蔗渣及稻杆等未处理木质纤维素生物质产纤维素酶,发现以1%(W/V, g · mg-1) CMC、甘蔗渣及稻杆为碳源, 在相同条件下培养后纤维素酶比酶活分别为0.73、0.18和0.11 U · mg-1,CMC条件下的比酶活远高于甘蔗渣和稻杆,而甘蔗渣与稻杆并无明显差异.本研究采用经过碱处理的生物质作为替代碳源,与Sadhu等研究条件不相同,但通过对比发现,本试验中以甘蔗渣、稻杆作为碳源的菌液中纤维素酶比酶活远高于CMC,这是因为甘蔗渣等生物质经过碱处理的膨化作用后,木质素大部分溶解于处理液中,木质素阻隔作用的去除能够促进菌株对生物质的利用.并且纤维素含量得到提高,为菌株生长和产酶提供充足碳源 (Li et al., 2014).这说明利用碱处理后的生物质替代CMC作为碳源具有很大的可行性.试验结果中碱处理后的甘蔗渣和稻杆之间纤维素和木质素并无明显差别,而稻杆的半纤维素更高,如果菌株能够利用半纤维素,稻杆的产酶效果应该更佳,然而结果相反.所以此时纤维素、半纤维素及木质素的含量并不是导致产酶结果出现差异的原因.而纤维素酶是一种诱导性酶,不同生物质对菌株产酶的诱导性也不相同.有研究者曾利用死亡谷芽孢杆菌 (Bacillus vallismortis) 以甘蔗渣、米糠、麦麸、稻壳及玉米糠作为碳源生产纤维素酶,结果发现以甘蔗渣为碳源时酶活性最高,米糠和稻壳的效果小于甘蔗渣,麦麸和玉米糠的效果最差,研究者认为甘蔗渣、稻壳及米糠对菌株产酶具有不同程度的诱导性 (Gaur and Tiwari 2015).碱处理对木质纤维素中的表面结构和纤维素的结晶结构同样具有很大的改变,不同生物质在经过碱处理后结构同样存在差异,所以未来在对其具体原因作进一步的研究时需要从微观结构角度进行开展 (Sindhu et al., 2014;Sation et al., 2016).
有研究者 (Gbekeloluwa et al., 1991;Jadhav et al., 2013) 在利用稻壳等农业废弃物作为碳源生产纤维素酶时发现,生物质添加量为1%~3%时,菌液纤维素酶酶活性显著升高,添加量为5%时,酶活性反而开始显著降低,而继续添加无明显变化.研究者认为出现下降的原因是在较高添加量时,菌株利用生物质时累积过多的纤维二糖和纤维糊精,对菌株产酶具有抑制作用.Meng等 (2014)利用枯草杆菌 (Bacillus subtilis) 以未处理的稻杆和玉米秆等生物质作为碳源时也发现,随着碳源添加量的增大,菌液酶活出现先增加后下降的趋势.本试验中水葫芦条件下的变化趋势与上述研究结果基本一致,但甘蔗渣和稻杆作为碳源时则不相同.这可能由于本研究中稻杆和甘蔗渣经碱处理后纤维素含量有大幅度提升,在较低添加量下就能达到菌株的最大利用水平,而水葫芦因纤维素含量较低, 需要更高添加量才达到最佳碳源量.上述研究者采用未处理生物质作为碳源,其添加量一般达3%~5%时菌液酶活达到最高,这是因为未处理生物质中纤维素含量相对较低,另外, 半纤维素和木质素的阻隔作用使得在发酵中只有在较高添加量下才能提供足够碳源,这与本实验中水葫芦的结果相似.然而以生物质作为替代碳源,由于其不具有CMC溶于培养液的特性,所以添加量的升高会造成培养液过于黏稠,影响菌株的生长 (程爱芳等,2015).而经过碱处理后的甘蔗渣和稻杆在较低添加量下就能够达到最佳碳源量,能够为菌株生长提供良好条件,进一步促进菌株的产酶效果.所以碱处理后的稻杆和甘蔗渣作为替代碳源具有很大的优势.
产纤维素酶菌株的pH、温度适应范围及热稳定性对其应用于工业化生产纤维素酶具有重要意义.通常地芽孢杆菌属 (Geobacillus) 所生产的纤维素酶最适pH、温度分别为5~7和50~70 ℃,如Tai等 (2004)报道的一株嗜热地芽孢杆菌T4(Geobacillus thermoleovorans T4),其合成的纤维素酶在pH为7, 温度为70 ℃条件下具有较高的纤维素酶活性,在30~70 ℃下酶活性在1 h内均保持在90%以上,但温度高于70 ℃,在1 h内显著下降至35%以下;Assareh等 (2012)也报道过一株地芽孢杆菌T1(Geobacillus sp. T1),提纯的酶在pH为6.5,温度为70 ℃下具有最高活性,50~70 ℃下在1 h内活性也保持在80%以上,但在80 ℃下显著下降至60%,pH为5.5~6.5时活性能保持在60%以上.本试验筛选的HTA426菌株合成的纤维素酶在pH为7,温度为60 ℃下活性达到最高,与上述研究报道相比温度较低,但符合其生长环境温度和筛选温度, 其热稳定性和pH适应范围与T1菌株相似.Rastogi等 (2010)曾在70 ℃堆肥中筛选出一株具有产纤维素酶的地芽孢杆菌 (Geobacillus sp.), 菌株最适温度和pH分别为70 ℃和7,而其生产的酶在70 ℃下培养1 d后残余活性仍能够保持在78%以上,表现出优异的热稳定性.但本试验进行热稳定性研究采用的是经二级纯化后的纤维素酶,而Rastogi等采用的是未经纯化的酶,所以稳定性会有一定差异.有关纯化前后酶的热稳定性差异的系统研究鲜有文献报道,结合上述研究者的结果分析,尽管纯化后的纤维素的比酶活得到一定的提升,但热稳定性也相对地下降.所以在实际运用中需要权衡活力和热稳定性的关系,以达到最佳的利用效果.
5 结论 (Conclusions)1) 本试验从温泉区筛选出一株具有产纤维素酶能力的新型嗜热地芽孢杆菌HTA426(Geobacillus kaustophilus HTA426),其在pH为7.0, 温度为60 ℃下在MR培养基下培养72 h时,CMCase活性达到最大.在碳源和氮源足够情况下,培养基的类型对菌株产酶情况无明显差异.而CMCase经二级纯化后,其回收率和纯化倍数分别为10.14%和5.12,纯化后的分子量为40 kDa.
2) 以经过碱处理的木质纤维素废弃物替代CMC作为碳源的实验中, 甘蔗渣对菌株产酶效果显著高于稻杆和水葫芦,最佳添加量为1%,最大活性可达103.67 U · mL-1.
3) HTA426菌株所生产的CMCase在pH为7.0、温度为60 ℃下具有最高活性,在温度为50~70 ℃时具有较好的热稳定性,并在pH为5~8时具有很好的适应性.
| [${referVo.labelOrder}] | Acharya P B, Acharya D K, Modi H A. 2008. Optimization for cellulase production by Aspergillus niger using saw dust as substrate[J]. African Journal of Biotechnology, 7(22) : 4147–4152. |
| [${referVo.labelOrder}] | Alrumman S A. 2016. Enzymatic saccharification and fermentation of cellulosic date palm wastes to glucose and lactic acid[J]. Brazilian Jouranl of Microbiology, 47(1) : 110–119. DOI:10.1016/j.bjm.2015.11.015 |
| [${referVo.labelOrder}] | Assareh R, Zahiri H S, Noghabi K A, et al. 2012. Characterization of the newly isolated Geobacillus sp[J]. T1, the efficient cellulase-producer on untreated barley and wheat straws[J]. Bioresource Technology, 120(17) : 99–105. |
| [${referVo.labelOrder}] | Berg B, Hofsten B V, Pettersson G. 1972. Growth and cellulase formation by Cellvibrio fulvus[J]. Journal of Applied Bacteriology, 35(2) : 201–214. DOI:10.1111/jam.1972.35.issue-2 |
| [${referVo.labelOrder}] | Bradford M M. 1976. A rapid and sensitive for the quantitation of microgram quantitites of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 72(1/2) : 248–254. |
| [${referVo.labelOrder}] | 程爱芳, 邓政东, 陈文, 等. 2015. 多粘类芽孢杆菌HD-1产纤维素酶的条件优化[J]. 食品工业科技, 2015, 36(10) : 173–177. |
| [${referVo.labelOrder}] | Chaurasia A K, Chaurasia S, Chaurasia S, et al. 2015. Influence of culture conditions on cellulase prodcution by sclerotium rolfsii sacc[J]. International Journal of Multidisciplinary Research and Development, 2(5) : 41–49. |
| [${referVo.labelOrder}] | Gaur R, Tiwari S. 2015. Isolation, production, purification and characterization of an organic-solvent-thermostable alkalophilic cellulase from Bacillus vallismortis RG-07[J]. Bmc Biotechnology, 15(19) : 1–12. |
| [${referVo.labelOrder}] | Gbekeloluwa B O, Moo Young M. 1991. Production and properties of β-glucosidase by Neurospora sitophila[J]. World Journal of Microbiology and Biotechnology, 7(1) : 4–11. DOI:10.1007/BF02310911 |
| [${referVo.labelOrder}] | Jadhav A R, Girde A V, More S M, et al. 2013. cellulase production by utilizing agricultural waste[J]. Research Journal of Agriculture and Forestry Science, 1(7) : 6–9. |
| [${referVo.labelOrder}] | Lee Y J, Kim B K, Lee B H, et al. 2008. Purification and characterization of cellulase produced by Bacillus amyoliquefaciens DL-3 utilizing rice hull[J]. Bioresource Technology, 99(2) : 378–386. DOI:10.1016/j.biortech.2006.12.013 |
| [${referVo.labelOrder}] | Li Q, Guo C, Liu C Z. 2014. Dynamic microwave-assisted alkali pretreatment of cornstalk to enhance hydrogen production via co-culture fermentation of Clostridium thermocellum and Clostridium thermosaccharolyticum[J]. Biomass and Bioenergy, 64(3) : 220–229. |
| [${referVo.labelOrder}] | 刘洁丽, 王靖. 2008. 生物产纤维素酶研究进展[J]. 化学与生物工程, 2008, 25(12) : 9–12. DOI:10.3969/j.issn.1672-5425.2008.12.003 |
| [${referVo.labelOrder}] | Lo Y C, Saratalea G D, Chen W M, et al. 2009. Isolation of cellulose-hydrolytic bacteria and applications of the cellulolytic enzymes for cellulosic biohydrogen production[J]. Enzyme Microbial Technology, 44(6/7) : 417–425. |
| [${referVo.labelOrder}] | Meng F, Ma L, Ji S, et al. 2014. Isolation and characterization of Bacillus subtilis strain BY-3, a thermophilic and efficient cellulase-producing bacterium on untreated plant biomass[J]. Letter in Applied Microbiology, 59(3) : 306–312. DOI:10.1111/lam.2014.59.issue-3 |
| [${referVo.labelOrder}] | Menon V, Rao M. 2012. Trends in bioconversion of lignocellulose: Biofuels, platform chemicals & biorefinery concept[J]. Progress in Energy and Combustion Science, 38(4) : 522–550. DOI:10.1016/j.pecs.2012.02.002 |
| [${referVo.labelOrder}] | Miller G L. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Chemistry, 31(3) : 426–428. DOI:10.1021/ac60147a030 |
| [${referVo.labelOrder}] | Nagendran S, Hallen Adams H E, Paper J M, et al. 2009. Reduced genomic potential for secreted plant cell wall degrading enzymes in the ectomycorrhizal fungus Amanita bisporigera, based on the secretome of Trichoderma reesei[J]. Fungal Genetics and Biology, 46(5) : 427–435. DOI:10.1016/j.fgb.2009.02.001 |
| [${referVo.labelOrder}] | Nazina T N, Tourova T P, Novikova E V, et al. 2001. gen. nov., sp. nov. and Geobacillus uzenensis sp. nov. from petroleum reservoirs and transfer of Bacillus stearothermophilus, Bacillus thermocatenulatus, Bacillus thermoleovorans, Bacillus kaustophilus, Bacillus thermoglucosidasius to Geobacillus as the new combinations G. stearothermophilus, G. thermocatenulatus[J]. International Journal of Systematic and Evolutionary Microbiology, 51(Pt 2) : 433–446. |
| [${referVo.labelOrder}] | Nigam P S, Singh A. 2011. Production of liquid from renewable resources[J]. Progress in Energy and Combustion Science, 37(1) : 52–68. DOI:10.1016/j.pecs.2010.01.003 |
| [${referVo.labelOrder}] | Paudel Y P, Qin W S. 2015. Characterization of novel cellulase-producing bacterial isolated from rotiing wood samples[J]. Applied Biochemistry and Biotechnology, 177(5) : 1186–1198. DOI:10.1007/s12010-015-1806-9 |
| [${referVo.labelOrder}] | Payne C M, Knott B C, Mayes H B, et al. 2015. Fungal cellulases[J]. Chemical Reviews, 115(3) : 1308–1448. DOI:10.1021/cr500351c |
| [${referVo.labelOrder}] | Priya I, Dhar M K, Bajaj B K, et al. 2016. Cellulolytic activity of thermophilic isolated from Tattapani hot spring sediment in north west himalayas[J]. Indian Journal of Microbiology, 56(2) : 228–231. DOI:10.1007/s12088-016-0578-4 |
| [${referVo.labelOrder}] | Rajmane S D, Korekar S L. 2012. Cellulase enzyme production of post-harvest fungi under the influence of carbon and nitrogen sources[J]. Current Botany, 3(2) : 13–15. |
| [${referVo.labelOrder}] | Rastogi G, Bhalla A, Adhikari, et al. 2010. Characterization of thermostable cellulase produced by Bacillus and Geobacillus strains[J]. Bioresource Technology, 101(22) : 8798–8806. DOI:10.1016/j.biortech.2010.06.001 |
| [${referVo.labelOrder}] | Sadhu S, Saha P, Sen S K, et al. 2013. Production, purification and characterization of a novel thermotolerant endoglucanase (CMCase) from Bacillus strain isolated from cow dung[J]. SpringerPlus, 2 : 10. DOI:10.1186/2193-1801-2-10 |
| [${referVo.labelOrder}] | Sation K, Horikawa Y, Sugiyama J, et al. 2016. Effect of thermochemical pretreatment on lignin alteration and cell wall microstructure degradation in Eucalyptus globulus: comparison of acid, alkali, and water pretreatment[J]. Journal of Wood Science, 62(3) : 276–284. DOI:10.1007/s10086-016-1543-x |
| [${referVo.labelOrder}] | Sindhu R, Sukumaran R K, Kuttiraja M, et al. 2014. Physicochemical characterization of alkali pretreated sugarcane tops and optimization of enzymatic saccharification using response surface methodology[J]. Renewable Energy, 62(3) : 362–368. |
| [${referVo.labelOrder}] | Suzuki H, Kobayashi J, Wada K, et al. 2015. Thermoadaptation-directed enzyme evolution in an error-prone thermophile derived from Geobacillus kaustophilus HTA426[J]. Appiled and Enviromental Microbiology, 81(1) : 149–158. DOI:10.1128/AEM.02577-14 |
| [${referVo.labelOrder}] | Suzuki H, Yoshida K, Ohshima T. 2013. Polysaccharide-degrading thermophiles generated by heterologous gene expression in Geobacillus kaustophilus HTA426[J]. Appiled and Enviromental Microbiology, 79(17) : 5151–5158. DOI:10.1128/AEM.01506-13 |
| [${referVo.labelOrder}] | Tai S K, Lin H P P, Kuo J, et al. 2004. Isolation and characteriaztion of a cellulolytic Geobacillus thermoleovorans T4 strain from sugar refinery wastewater[J]. Extremophiles, 8(5) : 345–349. DOI:10.1007/s00792-004-0395-2 |
| [${referVo.labelOrder}] | Yang J K, Zhang J J, Yu H Y, et al. 2014. Cummunity composition and cellulase activity of cellulolytic bacteria from forest soils planted with broad-leaved deciduous and evergreen trees[J]. Applied Microbiology and Biotechnology, 98(3) : 1449–1458. DOI:10.1007/s00253-013-5130-4 |
| [${referVo.labelOrder}] | Yoon L W, Ang T N, Ngoh G C, et al. 2015. Fungal solid-state fermentation and various methods of enhancement in cellulase production[J]. Biomass and Bioenergy, 67 : 319–338. |
| [${referVo.labelOrder}] | 杨捷, 严芬, 叶秀云, 等. 2013. 一株产高温纤维素酶曲霉菌的发酵条件及培养基优化[J]. 福州大学学报 (自然科学版), 2013, 41(1) : 115–120. |
| [${referVo.labelOrder}] | Zhang T R, Wooster M J, Green D C, et al. 2015. New field-based agricultural biomass burning trace gas, PM2.5, and black carbon emission ratios and factors measured in situ at crop residue fires in Eastern China[J]. Atmospheric Enviroment, 121 : 22–34. DOI:10.1016/j.atmosenv.2015.05.010 |
| [${referVo.labelOrder}] | 张耿崚, 陈细妹, 韩业钜, 等. 2016. 表面活性剂辅助离子液体预处理稻秆的酶解动力学与结构变化分析[J]. 环境科学学报, 2016, 37(2) : 686–693. |
 2017, Vol. 37
2017, Vol. 37


