水体富营养化是一个影响水体质量的重要问题, 而磷 (P) 元素是引起水体富营养化的一种重要元素 (Zheng et al., 2014).强化生物除磷 (EBPR) 系统是目前我国污水处理厂应用最广泛、最经济且可持续的生物除磷手段 (Lv et al., 2014).
由于抗生素的使用量过大且只有少部分能够真正被生物体所利用, 因此, 大量的剩余抗生素通过各种途径排放至水体环境中, 尤其是污水处理厂中 (Kümmerer, 2009).目前, 污水处理厂中普遍存在的抗生素有四环素、红霉素、土霉素及磺胺甲恶唑, 其浓度大约在ng·L-1~μg·L-1级.但在某些制药废水当中,抗生素浓度可以达到mg·L-1级别.抗生素存在于污水处理系统中可能对系统中的微生物, 尤其是功能性微生物如聚磷菌、硝化菌和反硝化菌等产生不良影响, 从而导致系统的污水处理能力下降.因此, 研究抗生素对污水处理厂中各种生化过程的影响具有重要意义.
在污水处理厂的众多生化过程中, 营养物质碳 (C)、氮 (N) 和磷 (P) 的去除过程是十分重要的.目前, 大量的研究集中于抗生素对C和N去除过程的影响, 而忽略了抗生素对P去除过程的影响 (Katipoglu Yazan et al., 2015; Collado et al., 2013; Meng et al., 2015).虽然有研究表明, 0.4 μg·L-1的环丙沙星能够在一个反应周期内对EBPR系统的除磷过程产生影响, 但这还不足以全面地理解抗生素对EBPR系统的作用 (Motlagh et al., 2015).
红霉素和土霉素是目前应用较为广泛的2种抗生素, 主要通过抑制细菌蛋白质的合成来实现抗菌作用 (Alighardashi et al., 2009).红霉素是一种广谱性抗生素, 但其抗菌性主要是针对革兰氏阳性菌.目前, 红霉素作用于活性污泥系统的相关研究已经展开, 如Alighardashi等 (2009)的研究表明, 当系统中的红霉素浓度达到5 mg·L-1时, 硝化过程就会受到抑制, 当红霉素浓度达到20 mg·L-1时, 整个硝化过程将受到严重抑制, 并且污泥絮状体分解, 丝状细菌破碎.Louvet等 (2010)研究了红霉素对法国2个污水处理厂污泥的抑制作用, 结果表明, 10 mg·L-1的红霉素使得COD的去除效率降低了80%, 然而对于硝化过程2个污水处理厂的污泥表现出完全相反的效果.由此可知, 红霉素的抗菌效果具有一定选择性.另外, 也有学者从基因层面研究了红霉素对活性污泥系统的作用 (Fan et al., 2011).
相比于红霉素, 土霉素的抗菌范围更广, 对大多数革兰氏阴性菌和革兰氏阳性菌均有很好的抑制作用.有学者研究了土霉素对颗粒化厌氧氨氧化系统的影响, 结果表明, 土霉素的半数抑制浓度 (IC50) 为517.5 mg·L-1(Yang et al., 2013);同时, 也有学者的研究结果指出, 活性污泥系统中土霉素的的半数效应浓度 (EC50) 为17.9 mg·L-1(Kolar et al., 2014).对于不同的系统, 土霉素的抑制作用表现出明显差异.
然而, 有关红霉素和土霉素对EBPR系统的抑制效果及其机理尚未研究透彻.从作用时间上分析, 抑制因子对于活性污泥的作用通常有2种研究思路, 分别是长期低浓度的抑制作用和短期高浓度的冲击作用.第1种研究思路是基于污水处理厂中长期存在的相对应浓度的抑制因子而进行的研究;第2种研究思路是基于污水处理厂中可能出现的由于管理不善所导致的短期内突发性的高浓度抑制因子的存在而进行的研究.
本文从除磷过程、污泥总磷 (TP) 含量、挥发性脂肪酸 (VFA) 的消耗过程、聚羟基脂肪酸酯 (PHAs) 的合成与消耗过程、胞外聚合物 (EPS) 的总量变化过程及比呼吸速率 (SOUR) 的变化过程等多个角度出发, 比较系统地研究高浓度红霉素和土霉素对EBPR系统短期内的冲击影响.该研究对生物处理红霉素与土霉素具有重要的理论价值与实践指导意义.
2 材料与方法 (Materials and methods) 2.1 抗生素材料纯度为97%的红霉素 (CAS NO. 114-07-8) 和土霉素 (CAS NO. 6153-54-6) 均从上海阿拉丁试剂有限公司购买.
2.2 试验废水及试验用泥本试验的反应器接种污泥取自杭州市七格污水处理厂的曝气池出口, 采用丙酸和乙酸交替作为单独碳源的方法来富集聚磷菌 (PAOs), 整个富集过程持续了90 d.试验所用废水为人工合成的模拟废水, 其中的营养物质含量如下:COD为600 mg·L-1, NH4+-N为45 mg·L-1, PO43--P为30 mg·L-1.EBPR系统排水比为1:3, 所以进入系统之后各营养物质的浓度降低为原来的1/3, C/N/P比值为200/15/10.该人工合成模拟废水当中所使用的碳源为乙酸和丙酸的混合碳源, 比例为乙酸:丙酸=1:3, 氮源为NH4Cl, 磷源为K2HPO4和KH2PO4.详细的配水方案如下, 每升人工合成模拟废水成分为:CH3COONa 0.256 g、CH3CH2COOH 0.4 mL、NH4Cl 0.2293 g、KH2PO4 0.0875 g、K2HPO4·3H2O 0.147 g、MgSO4·7H2O 0.09 g、CaCl2 0.0222 g、蛋白胨0.0015 g、酵母浸出粉0.0015 g、烯丙基硫脲0.0072 g、微量元素液0.6 mL.加入烯丙基硫脲是为了抑制硝化细菌的生长.微量元素储备液成分配比参考文献 (Smolders et al., 1994).
2.3 试验装置本试验均在5 L的SBR反应器中进行, 并且保持室内温度为 (21±1) ℃, 每天运行3个周期, 每周期8 h.反应周期设置为:进水5 min、厌氧搅拌120 min、好氧曝气180 min、沉淀25 min、排水5 min、静置150 min.每周期进水体积为1.67 L, 即反应器排水比为1:3, 以控制系统水力停留时间 (HRT) 为24 h, 控制系统污泥浓度 (MLSS) 为2500 mg·L-1, 污泥停留时间 (SRT) 为8~10 d.反应器采用机械搅拌, 搅拌器的转动速率控制在150~200 r·min-1之间.本试验利用5 mol·L-1 NaOH和5 mol·L-1 HCl控制系统运行过程水相中pH值在7.0~7.5之间.厌氧阶段溶解氧 (DO) 浓度为0 mg·L-1, 控制好氧阶段DO为6~7 mg·L-1.
2.4 试验条件为了探索不同抗生素在不同浓度下对EBPR系统的影响, 设置了7套规格相同的反应器用于富集PAOs, 其运行条件如2.3节介绍.其中, R1为空白组不加抗生素, 剩余6套反应器分别加入不同种类和浓度的抗生素, 具体见表 1.抗生素在每个周期的进水阶段与反应器进水同时加入至反应器当中.
| 表 1 各反应器抗生素种类及进水抗生素浓度分布 Table 1 The types and influent concentrations of antibiotics in each reactor |
每个周期各分析指标的取样点见表 2, SOUR的数据仅在实验的第3周期进行分析, 其余数据在实验的第1、第2和第3周期均进行测定.所有水样测定前均经孔径为0.22 μm的中速定性滤纸过滤.过滤之后, 测定水相中的可溶性正磷酸盐 (SOP)、污泥相中的混合液悬浮固体 (MLSS) 及挥发性悬浮固体 (MLVSS) 等.具体测定方法参考《水和废水监测分析方法》(第4版)(魏复盛, 2002).同时, 利用气相色谱配合火焰离子化检测器的方法测定水相中的VFA (Albuquerque et al., 2011), 分别利用lowry法和蒽酮法测定活性污泥EPS中蛋白质 (PN) 和多糖 (PS) 的含量 (曹秀芹等, 2010), 利用气质联用的方法测定污泥相中PHAs的含量 (Oehmen et al., 2005), 利用呼吸法测定污泥的SOUR (Zhang et al., 2015).
| 表 2 系统周期内各指标取样点 Table 2 The sample location of every index in each cycle |
抗生素对EBPR系统除磷过程 (包括厌氧释磷、好氧吸磷及除磷效率) 的影响如表 3~5所示, 以下分别为厌氧释磷Q1(式 (1))、好氧吸磷Q2(式 (2)) 及磷去除效率R(式 (3)) 的计算公式.
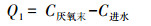
|
(1) |
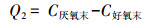
|
(2) |
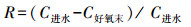
|
(3) |
| 表 3 红霉素对EBPR系统厌氧释磷、好氧吸磷及除磷效率的影响 Table 3 Erythromycin inhibition effect on the P-release, P-uptake and P-removal efficiency |
| 表 4 EBPR系统污泥中总磷的变化情况 Table 4 The concentration of TP in each EBPR system′s sludge |
| 表 5 土霉素对EBPR系统厌氧释磷、好氧吸磷及除磷效率的影响 Table 5 Oxytetracycline inhibition on the P-release, P-uptake and P-removal efficiency |
式中, C进水、C厌氧末、C好氧末分别为进水完成后、厌氧末 (120 min)、好氧末 (180 min) 系统水相磷酸盐浓度 (mg·L-1).
首先分析红霉素对除磷过程的影响.由表 3可知, 在实验的第1周期系统的除磷过程并未受到冲击.然而, 当实验进行到第2和第3周期时, E2和E3反应器中的磷酸盐已经不能在好氧阶段被全部吸收.由表 3还可知, E2和E3的除磷效率在第2周期分别下降至95.2%和71.2%, 在第3周期继续下降至88.9%和63.3%.由此可知, 高浓度红霉素 (10 mg·L-1) 对EBPR系统在短期内就能产生明显的冲击作用.另一方面, E3系统中污泥总磷的含量为60.2 mg·g-1(以每g VSS中所含的P (mg) 计, 下同), 此数值远低于R1的75.5 mg·g-1(表 4), 说明系统中污泥储存磷的能力已经出现了明显下降.
土霉素对EBPR系统中除磷过程的影响也十分明显.由表 5可知, 在实验的第1周期中各反应器的除磷过程均未受到显著冲击.在实验的第2周期中, O2和O3系统中的除磷效率分别下降至82.6%和80.7%, 在第3周期中继续下降至65.6%和61.2%.除磷效率的下降主要是由于土霉素对于好氧吸磷过程产生了影响.同时, O2和O3系统中总磷的含量在第2周期也分别下降至66.4和60.2 mg·g-1, 在第3周期中继续下降至58.2和54.1 mg·g-1(表 4).
3.2 抗生素对VFA消耗过程的影响抗生素对EBPR系统中VFA消耗过程的影响如图 1所示.在厌氧阶段, PAOs通过多聚磷酸盐的水解获得能量, 并利用部分能量将VFA转化成PHAs贮存在体内.如图 1a~c所示, 在厌氧阶段, VFA的消耗量并未受到红霉素的影响, 即使是在E3反应器中, VFA的消耗率也将近97%.然而, 红霉素的作用使得EBPR系统中VFA的消耗速率有所下降, VFA的消耗过程相对滞后.
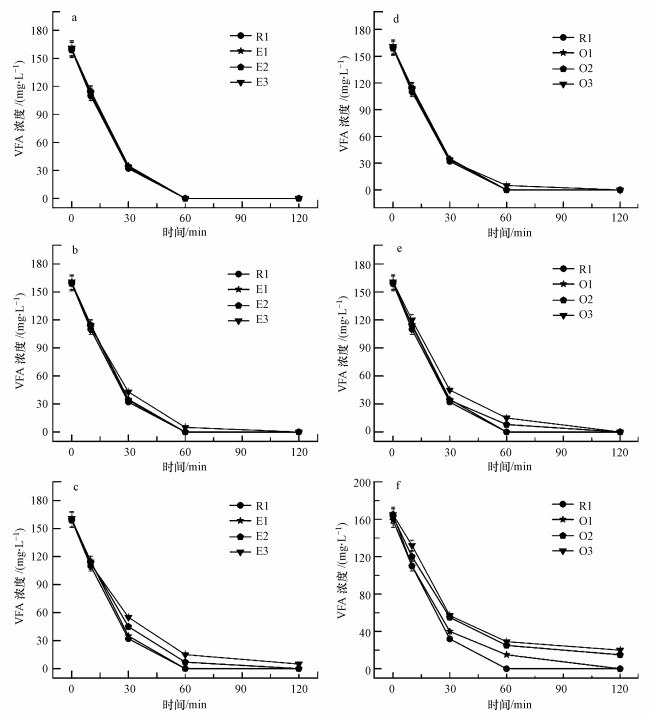 |
| 图 1 红霉素和土霉素对系统水相中VFA消耗过程的影响 (a, d.第1周期;b, e.第2周期;c, f.第3周期) Fig. 1 Erythromycin and oxytetracycline inhibition on the VFA (a, d.first cycle, b, e.second cycle, c, f.third cycle) |
如图 1d~f所示, 土霉素对EBPR系统中VFA消耗过程的影响并不显著, 即使是在O3反应器中, VFA在厌氧阶段的消耗率也达到85%.另一方面, EBPR系统中VFA的消耗速率有所下降.在R1反应器中VFA在30 min内完成转化过程, 然而, 在实验第3周期的O2和O3反应器中, VFA消耗过程分别持续60和120 min.
3.3 抗生素对PHAs的产生与消耗过程的影响PHAs是PAOs在好氧阶段的重要能源物质, 为PAOs在好氧阶段的吸磷和EPS的合成等过程提供能源.抗生素对EBPR系统中PHAs合成与消耗过程的影响如图 2所示 (合成量与消耗量均以每mg MLVSS中的PHAs计).首先分析红霉素对EBPR系统中PHAs合成与消耗过程的影响.由图 2c可知, 在第3周期, E3反应器中PHAs消耗量出现了下降, 下降率为29.2%, 其他反应器中PHAs的消耗量没有出现明显下降.另一方面, PHAs厌氧合成过程也受到了高浓度 (10 mg·L-1) 红霉素的显著影响, 下降率为24.4%.土霉素对EBPR系统中PHAs合成与消耗过程的影响如图 2d~f所示.由图 2f可知, 在实验的第3周期, PHAs合成与消耗过程均受到土霉素的影响.相比于空白组, O1、O2及O3中PHAs的消耗量分别下降了9.6%、31.6%及33.3%.另一方面, 在实验的第3周期, 相比于对照组, O2和O3反应器中PHAs在厌氧阶段的合成量分别下降了26.5%和27.2%.
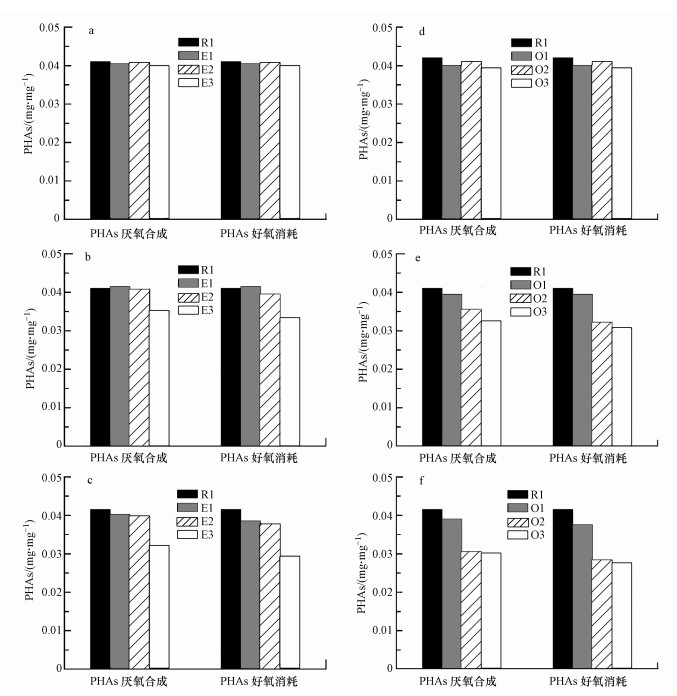 |
| 图 2 红霉素和土霉素对系统污泥中PHAs合成与消耗的影响 (a, d.第1周期;b, e.第2周期;c, f.第3周期) Fig. 2 Erythromycin and oxytetracycline inhibition on the production and consumption of PHAs (a, d.first cycle, b, e.second cycle, c, f.third cycle) |
EPS是由EBPR系统中微生物产生的一类复杂的高分子聚合物, 其主要作用是为了保持污泥的结构完整及保护微生物免受毒性物质的冲击 (Xu et al., 2013; Sheng et al., 2008).抗生素对EBPR系统中EPS的影响如图 3所示, 本实验测定的EPS包括蛋白质 (PN) 和多糖 (PS).
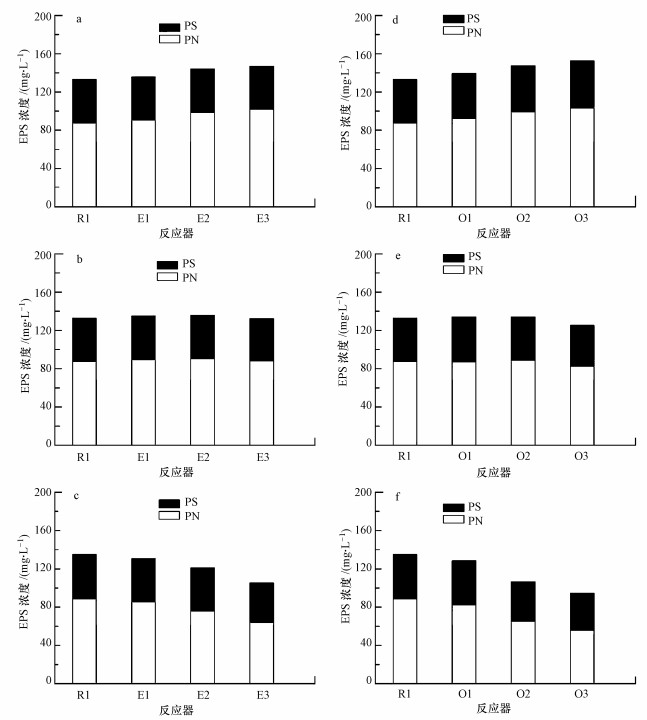 |
| 图 3 红霉素和土霉素对系统污泥中EPS合成的影响 (a, d.第1周期;b, e.第2周期;c, f.第3周期) Fig. 3 Erythromycin and oxytetracycline inhibition on the EPS (a, d.first cycle, b, e.second cycle, c, f.third cycle) |
首先分析红霉素对EBPR系统中EPS的影响.由图 3a可知, 在试验的第1周期, EPS总量随着红霉素浓度的增加呈上升趋势, 从R1的145.7 mg·L-1上升至E3的159.4 mg·L-1, 增长了9.4%.对比PN和PS在第1个周期中的数据可知, EPS总量的增长主要是由PN总量的增加引起的.然而, PS在EPS中的含量并未出现明显变化.在实验的第2周期, E1、E2和E3反应器中EPS的总量分别为146.6、148.6和144.9 mg·L-1(图 3b), 该数据在第3周期继续下降至142.7、134.0和117.7 mg·L-1(图 3c).相比于第1周期, E3反应器中EPS总量出现了明显下降, 主要是由于PN总量的快速下降.PS的含量除E3反应器在第3周期中有一定下降之外, 其余反应器均基本保持不变.
土霉素对EBPR系统中EPS的总量也存在显著影响.由图 3d可知, 在实验的第1周期,EPS的总量随着土霉素浓度的增加呈明显上升趋势, 从R1的145.7 mg·L-1上升至O3的165.2 mg·L-1, 增长了13.4%.对比PN和PS在第1周期中的数据可知, EPS总量的增长主要是由PN总量的增加引起的.虽然PS的含量也有所增加, 但并不明显.在实验的第2周期, O1、O2和O3反应器中EPS的总量分别为146.2、147.0和137.8 mg·L-1(图 3e), 该数据在第3周期继续下降至140.5、119.4和107.2 mg·L-1(图 3f).相比于第1周期, E3反应器中EPS总量出现了明显下降, 主要原因是PN总量的急剧下降.相比于第1周期, E2和E3反应器中PS的合成量在第2和第3周期均出现了下降.
3.5 抗生素对SOUR的影响SOUR是一种基于呼吸抑制数据, 评价抑制因子对活性污泥毒性作用的经典方法.抗生素对EBPR系统中SOUR的影响如图 4所示.由图 4可知, 经过红霉素24 h作用之后, E1、E2和E3中的SOUR分别下降至14.8、14.0和13.1 mg·g-1·h-1(以每g VSS每小时消耗O2量 (mg) 计, 下同).与空白组的15.6 mg·g-1·h-1相比, 分别下降了5.1%、9.0%和16.0%.土霉素对EBPR系统中SOUR也有明显的抑制作用.由图 4可知, 经过24 h土霉素作用之后, O1、O2和O3中的SOUR分别下降至14.5、12.2和10.4 mg·g-1·h-1.与空白组的15.6 mg·g-1·h-1相比, 分别下降了7.1%、21.8%和33.3%.
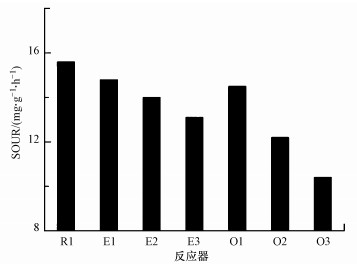 |
| 图 4 抗生素对EBPR系统中污泥SOUR的影响 Fig. 4 Antibiotics inhibition on the SOUR of sludge in EBPR system |
由除磷过程的数据分析可得, 高浓度 (10 mg·L-1) 的红霉素与土霉素均能对EBPR系统的除磷过程产生明显的抑制作用.除磷效率下降的同时, 厌氧释磷和好氧吸磷过程均受到不同程度的抑制.对比红霉素和土霉素的抑制效果可知, 相同浓度的土霉素对EBPR系统的除磷过程抑制程度更高.进一步分析数据可得, 短期实验内, 10 mg·L-1的红霉素能够对EBPR系统形成明显冲击, 而当土霉素的浓度达到5 mg·L-1时就能对系统形成显著影响, 说明系统中的PAOs对于土霉素更为敏感.同时, 1 mg·L-1的红霉素和土霉素对EBPR系统中的除磷过程均无显著作用, 可能是由于抗生素浓度过低, 导致其大部分被系统中的微生物转化为其他物质, 因此, 未能对系统中的PAOs产生抑制 (Fernandez Fontaina et al., 2015).
另外, 对比厌氧释磷和好氧吸磷的数据可知, 在整个抑制过程中好氧吸磷过程首先受到抑制.在之前关于其他抑制因子对EBPR系统抑制的研究中也得出过相似的结论 (Zheng et al., 2013a; 2013b).这可能是由于在好氧阶段发挥吸磷作用的酶更容易受到抑制.另外, 相比较于重金属离子, 抗生素对EBPR系统除磷过程的抑制作用相对较弱 (Chen et al., 2012; Fang et al., 2014), 这可能是由于两种抑制因子的抑制途径不同.
分析VFA消耗过程的数据可知, 红霉素与土霉素对EBPR系统中VFA消耗过程均无明显抑制作用.经过抗生素24 h的作用之后, E3和O3反应器中VFA的消耗比例仍然在87.0%以上.通过以上分析可得, 抗生素对EBPR系统的厌氧释磷过程产生了抑制, 证明多聚磷酸盐的水解过程受到了影响, 厌氧阶段所能提供的能量有所下降.然而, VFA的消耗量并未受到红霉素的影响, 即使是在E3和O3反应器中, VFA在厌氧阶段的消耗率也超过87.0%.以上现象表明, 虽然由多聚磷酸盐水解产生的能量有所下降, 但依然足够VFA转化所需.另外, 虽然抗生素未能对EBPR系统中VFA的消耗量产生影响, 但抗生素的作用使得VFA的消耗速率降低了2倍以上.此现象表明, EBPR系统中微生物的活性受到了抗生素的抑制, 但抑制还不完全.另一种解释是由于抗生素的作用, 系统中PAOs受到了抑制, 但系统中其他相对少量的异养菌可能产生竞争优势, 进而在厌氧阶段吸收和利用VFA, 促使VFA有较高的消耗率 (Cetecioglu et al., 2014).
分析PHAs合成与消耗过程的变化可得, 高浓度 (10 mg·L-1) 红霉素与土霉素均能对EBPR系统PHAs的消耗过程产生明显的抑制作用.PHAs的消耗过程与PAOs的吸磷过程均发生在好氧阶段.由于抗生素的存在使得PAOs部分失活, 从而导致PHAs消耗量下降, 同时使得好氧阶段的磷酸盐不能被完全吸收.对比红霉素和土霉素对EBPR系统中PHAs消耗过程的影响可得, 相同浓度下, 土霉素对EBPR系统中PHAs的消耗过程抑制更为显著.同时, 红霉素和土霉素对PHAs消耗过程产生抑制的浓度分别为10和5 mg·L-1.另外, 在实验的第3周期, O3反应器中VFA的转化率为87.9%, PHAs在厌氧阶段合成量的下降率为27.2%, 说明在厌氧阶段VFA对PHAs的转化率显著下降.
由EPS数据分析可得, 在实验第1周期,各反应器中EPS总量尤其是PN的量均出现明显的上升.这可能是由于EBPR系统中微生物受到抗生素的冲击, 系统中的微生物自主分泌出更多的EPS来保护自身免受抗生素的冲击.由以上分析可知, 除磷过程、VFA消耗过程及PHAs的合成与消耗过程在实验的第1周期均没有表现出明显的抑制效果, 这可能与EPS在实验第1周期的过量分泌有关.当实验进入到第2及第3周期时, 高浓度 (5 mg·L-1) 抗生素反应器中EPS总量尤其是PN的量出现了明显的下降.由于红霉素和土霉素均是通过抑制细胞蛋白质合成的方式抑制细菌的生长, 因此, 在实验的第2和第3周期中PN的量出现了明显下降.另外, 相比于PN, PS在EPS中的含量相对稳定.对比红霉素与土霉素对EBPR系统EPS合成量的影响可知, 土霉素对EPS的合成过程抑制更为显著.
分析SOUR数据可得, 红霉素和土霉素对EBPR系统中微生物的呼吸速率均有抑制作用.对比红霉素和土霉素对EBPR系统中SOUR的抑制效果可知, 土霉素的抑制效果更强.由于EBPR系统中占大多数的菌种是变形菌门 (Proteobacteria), 而Proteobacteria属于革兰氏阴性菌.土霉素对革兰氏阴性菌的抑制要比红霉素更强, 因此, 土霉素对EBPR系统中微生物呼吸作用的抑制效果更强.
抗生素对于EBPR系统中微生物的影响存在明显的差异性, 首先, 由红霉素和土霉素对系统除磷过程的影响可知, 当红霉素和土霉素的进水浓度分别达到10 mg·L-1和5 mg·L-1时, 会对除磷过程产生显著抑制作用.其次, VFA的消耗量并未受到显著影响, 说明系统中部分非PAOs的异氧菌未受到抗生素的冲击, 依然具有较强的活性.最后, 由系统中SOUR的变化过程分析可得, 1 mg·L-1的抗生素也能在短期内对EBPR系统中的部分微生物产生冲击作用.
5 结论 (Conclusions)1) 经过24 h的实验, 发现红霉素和土霉素对EBPR系统的除磷过程均有明显的抑制作用, 系统的除磷效率分别下降至63.3%和61.2%.虽然在厌氧阶段抗生素未能对系统中VFA的消耗量产生明显抑制, 但其消耗和合成速率均有所下降.
2) EPS在实验第1个周期大量分泌以抵抗抗生素的冲击, 但在第2和第3周期中, 由于红霉素和土霉素的抗菌特性, EPS的合成量尤其是PN的合成量均有显著下降.
3) 抗生素能够明显抑制EBPR系统中微生物的呼吸速率.另外, 由于EBPR系统中革兰氏阴性菌如Proteobacteria占多数, 因此, 土霉素对EBPR系统中微生物呼吸速率抑制效果更强.
4) 相比于厌氧阶段, EBPR系统的好氧阶段更易受到抗生素的冲击.
| [${referVo.labelOrder}] | Alighardashi A, Pandolfi D, Potier O, et al. 2009. Acute sensitivity of activated sludge bacteria to erythromycin[J]. Journal of Hazardous Materials, 172(2/3) : 685–692. |
| [${referVo.labelOrder}] | Albuquerque M G E, Martino V, Pollet E, et al. 2015. Mixed culture polyhydroxyalkanoate (PHA) production from volatile fatty acid (VFA)-rich streams:Effect of substrate composition and feeding regime on PHA productivity, composition and properties[J]. Journal of Biotechnology, 151(1) : 66–76. |
| [${referVo.labelOrder}] | 曹秀芹, 赵自玲. 2010. 胞外聚合物 (EPS) 构成的影响因素分析[J]. 环境科学与技术, 2010, 33(12F) : 420–424. |
| [${referVo.labelOrder}] | Cetecioglu Z, Ince B, Ince O, et al. 2014. Acute effect of erythromycin on metabolic transformations of volatile fatty acid mixture under anaerobic conditions[J]. Chemosphere, 124(1) : 129–135. |
| [${referVo.labelOrder}] | Chen Y G, Chen H, Zheng X, et al. 2012. The impacts of silver nanoparticles and silver ions on wastewater biological phosphorous removal and the mechanisms[J]. Journal of Hazardous Materials, 239-240(18) : 88–94. |
| [${referVo.labelOrder}] | Collado N, Buttiglieri G, Marti E, et al. 2013. Effects on activated sludge bacterial community exposed to sulfamethoxazole[J]. Chemosphere, 93(1) : 99–106. DOI:10.1016/j.chemosphere.2013.04.094 |
| [${referVo.labelOrder}] | Fan C A, He J Z. 2011. Proliferation of antibiotic resistance genes in microbial consortia of sequencing batch reactors (SBRs) upon exposure to trace erythromycin or erythromycin-H2O[J]. Water Research, 45 : 3098–3106. DOI:10.1016/j.watres.2011.03.025 |
| [${referVo.labelOrder}] | Fang J, Sun P D, Xu S J, et al. 2014. Impact of Cr (Ⅵ) on P removal performance in enhanced biological phosphorus removal (EBPR) system based on the anaerobic and aerobic metabolism[J]. Bioresource Technology, 121(121) : 379–85. |
| [${referVo.labelOrder}] | Fernandez Fontaina E, Gomes I B, Aga D S, et al. 2015. Biotransformation of pharmaceuticals under nitrification, nitratation and heterotrophic conditions[J]. Science of the Total Environment, 541 : 1439–1447. |
| [${referVo.labelOrder}] | Katipoglu Yazan T, Merlin C, Pons M N, et al. 2015. Chronic impact of tetracycline on nitrification kinetics and the activity of enriched nitrifying microbial culture[J]. Water Research, 72(3) : 227–238. |
| [${referVo.labelOrder}] | Kolar B, Arnuš L, Jeretin B, et al. 2014. The toxic effect of oxytetracycline and trimethoprim in the aquatic environment[J]. Chemosphere, 115(1) : 75–80. |
| [${referVo.labelOrder}] | Kümmerer K. 2009. The presence of pharmaceuticals in the environment due to human use-present knowledge and future challenges[J]. Journal of Environmental Management, 90(8) : 2354–2366. DOI:10.1016/j.jenvman.2009.01.023 |
| [${referVo.labelOrder}] | Louvet J N, Giammarino C, Potier O, et al. 2010. Adverse effects of erythromycin on the structure and chemistry of activated sludge[J]. Environmental Pollution, 158(3) : 688–693. DOI:10.1016/j.envpol.2009.10.021 |
| [${referVo.labelOrder}] | Lv X M, Shao M F, Li C L, et al. 2014. A comparative study of the bacterial community in denitrifying and traditional enhanced biological phosphorus removal processes[J]. Microbes & Environments, 29(4) : 261–268. |
| [${referVo.labelOrder}] | Meng L W, Li X K, Wang K, et al. 2015. Influence of the amoxicillin concentration on organics removal and microbial community structure in an anaerobic EGSB reactor treating with antibiotic wastewater[J]. Chemical Engineering Journal, 274 : 94–101. DOI:10.1016/j.cej.2015.03.065 |
| [${referVo.labelOrder}] | Motlagh A M, Bhattacharjee A S, Goel R. 2015. Microbiological study of bacteriophage induction in the presence of chemical stress factors in enhanced biological phosphorus removal (EBPR)[J]. Water Research, 81 : 1–14. DOI:10.1016/j.watres.2015.04.023 |
| [${referVo.labelOrder}] | Oehmen A, Keller-Lehmann B, Zeng R J, et al. 2005. Optimisation of poly-β-hydroxyalkanoate analysis using gas chromatography for enhanced biological phosphorus removal systems[J]. Journal of Chromatography A, 1070(1/2) : 131–136. |
| [${referVo.labelOrder}] | Sheng G P, Zhang M L, Yu H Q. 2008. Characterization of adsorption properties of extracellular polymeric substances (EPS) extracted from sludge[J]. Colloids & Surfaces B Biointerfaces, 62(1) : 83–90. |
| [${referVo.labelOrder}] | 魏复盛. 2002. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社. |
| [${referVo.labelOrder}] | Xu J, Sheng G P, Ma Y, et al. 2013. Roles of extracellular polymeric substances (EPS) in the migration and removal of sulfamethazine in activated sludge system[J]. Water Research, 47(14) : 5298–5306. DOI:10.1016/j.watres.2013.06.009 |
| [${referVo.labelOrder}] | Xu W H, Zhang G, Li X D, et al. 2007. Occurrence and elimination of antibiotics at four sewage treatment plants in the Pearl River Delta (PRD), South China[J]. Water Research, 41(19) : 4526–4534. DOI:10.1016/j.watres.2007.06.023 |
| [${referVo.labelOrder}] | Yang G F, Zhang Q Q, Jin R C. 2013. Changes in the nitrogen removal performance and the properties of granular sludge in an Anammox system under oxytetracycline (OTC) stress[J]. Bioresource Technology, 129(129C) : 65–71. |
| [${referVo.labelOrder}] | Zhang J, Dong Q, Liu Y, et al. 2015. Response to shock load of engineered nanoparticles in an activated sludge treatment system:Insight into microbial community succession[J]. Chemosphere, 144 : 1837–1844. |
| [${referVo.labelOrder}] | Zheng X L, Sun P D, Lou J Q, et al. 2013a. Inhibition of free ammonia to the granule-based enhanced biological phosphorus removal system and the recoverability[J]. Bioresource Technology, 148 : 343–351. DOI:10.1016/j.biortech.2013.08.100 |
| [${referVo.labelOrder}] | Zheng X L, Sun P D, Lou J Q, et al. 2013b. The long-term effect of nitrite on the granule-based enhanced biological phosphorus removal system and the reversibility[J]. Bioresource Technology, 132 : 333–341. DOI:10.1016/j.biortech.2013.01.042 |
| [${referVo.labelOrder}] | Zheng X L, Sun P D, Han J Y, et al. 2014. Inhibitory factors affecting the process of enhanced biological phosphorus removal (EBPR)-A mini-review[J]. Process Biochemistry, 49(12) : 2207–2213. DOI:10.1016/j.procbio.2014.10.008 |
 2017, Vol. 37
2017, Vol. 37


