2. 环境保护部华南环境科学研究所, 广州 510655
2. South China Institute of Environmental Science, Minisry of Environmental Protection, Guangzhou 510665
水稻土砷主要来源于自然本底与人类活动,其中,矿山开采、金属冶炼和灌溉等人类活动是造成砷污染的主要原因.水稻土砷污染使得长期以水稻为主食的东南亚居民的身体健康受到威胁 (Seyfferth et al., 2014).铁矿物在自然界中广泛存在,主要包括水铁矿、针铁矿、赤铁矿等,在土壤砷的迁移转化过程中扮演重要角色.大量研究报道,水铁矿表面未饱和、结晶度低、比表面积大、活性高;针铁矿处于亚稳态,表面具有较多的羟基基团;赤铁矿的结构最稳定,结晶度高 (Legg et al., 2014; Matsumoto et al., 2016; Soltis et al., 2016; Wang et al., 2016).砷在铁矿物表面覆盖率为低、中、高时能分别形成单核单齿、单核双齿、双核双齿表面螯合物 (Beak et al., 2006; Jang et al., 2008),且配位键数越多则螯合物越稳定 (Catalano et al., 2008; Takeuchi et al., 2013).其中,螯合物又可分为内圈螯合物 (砷与铁矿物表面的羟基进行配体交换) 和外圈螯合物 (砷与羟基的氧或氢连接),内圈螯合物稳定性比外圈螯合物更高 (Redman et al., 2002; Bolanz et al., 2013),因而砷与铁矿物的螯合方式影响着铁矿物对砷的稳定化效果.水铁矿可以老化为针铁矿,水/针铁矿又可直接或者进一步老化为赤铁矿,老化后的铁矿物结晶度提高,且伴有砷的析出,但部分能通过二次沉淀及重吸附使砷储存在铁矿物内部微孔中或嵌入到铁矿物结构中 (Nielsen et al., 2014),这与老化后铁矿物提供砷的吸附点位减少有关 (Wang et al., 2015).同样,砷能通过专性掩盖水铁矿上的活性位点或留在铁矿物结构中抑制铁矿物的相态转变 (Erbs et al., 2010).
铁矿物可以通过表面螯合而影响水稻土砷的赋存形态和环境化学行为,有进一步研究发现,水淹条件下土壤溶液砷浓度的提高与铁矿物的还原溶解有关 (Ohtsuka et al., 2013).水铁矿吸附的砷容易释放,这可能与水铁矿结晶度较低、易被还原引起砷释放有关 (Ohtsuka et al., 2013);针铁矿的结晶度较高、稳定性好,但可以被微生物活化而溶解 (黎慧娟等, 2011);赤铁矿风化程度高且稳定性较好,不易还原溶解 (Mamindy-Pajany et al., 2011; Yu et al., 2013),因而水淹缺氧条件下水稻土中铁矿物对砷的稳定化效果与铁矿物类型紧密相关,且土壤溶液亚铁和总铁的浓度能有效地反映铁矿物对砷的稳定化效果.因此,本文对水淹缺氧条件下不同铁矿物类型对于水稻土砷的稳定化效果进行研究和评估,以期为水稻土砷污染防治提供科学依据和理论指导.
2 材料与方法 (Materials and methods) 2.1 实验材料水铁矿制备:将1 mol·L-1NaOH一滴滴地加入到500 mL 0.2 mol·L-1FeCl3溶液中,直至pH为7.0,随后将悬液离心20 min (2100 g,20 ℃),并用高温灭菌的去离子水洗脱多余的盐,即刻真空冷冻干燥 (Jiang et al., 2013);针铁矿 (α-FeOOH) 制备:将180 mL 5.0 mol·L-1NaOH溶液加入到100 mL 1.0 mol·L-1FeCl3溶液中,得到的悬浮液用去离子水稀释到2 L后于70 ℃下老化72 h,待冷却至室温后离心20 min (2100 g,20 ℃),并用双去离子水重复洗涤至无过量的盐存在,随即冷冻干燥,并置于4 ℃下保存备用 (Huang et al., 2011);赤铁矿 (α-Fe2O3) 制备:5 min内缓慢将50 mL 2 mol·L-1FeCl3溶液加入到搅拌中的50 mL 5.4 mol·L-1NaOH溶液中,得到的胶体于101 ℃下老化8 d.老化完成后将其冷却到室温,把悬液转移到聚丙烯离心瓶中离心25 min (2100 g,20 ℃),随即用双去离子水重复洗涤直至悬浮液电导率小于5 μS·cm-1,最后于50 ℃下烘干并在使用前于4 ℃下贮存备用 (Christl et al., 2012).
供试水稻土采自广西贺州市老虎山周边砷污染区 (111.56349°N,24.49240°E),总砷含量为109.35 mg·kg-1.土样自然风干,挑除杂草、石头等杂质,研磨过100目筛后,贮存.土壤基本理化性质见表 1.
| 表 1 供试水稻土基本理化性质 Table 1 Physicochemical properties of tested paddy soil |
以1:100和2:100的质量比往100 g农田土壤中分别加入1.0 g和2.0 g水铁矿、针铁矿、赤铁矿,充分混匀;再以1:7的固液比分别加入700 mL 20 mmol·L-1的PIPES缓冲液 (pH=7.0),充分搅拌,并采用100%高纯氩气排氧25 min,然后用橡胶塞压紧,并立即压铝盖密封,最后样品放置于厌氧手套箱 (25±2) ℃培养,每次设置3组平行实验并设置空白对照组.
2.3 测定方法土壤无定型铁采用草酸铵提取 (Rayment et al., 2011),即取1.0 g土壤,按1:50的固液比加入2.0 mol·L-1的草酸铵提取液 (pH=3.00±0.02),在振荡器中20 ℃下避光振荡2 h,土壤提取液使用0.45 μm滤膜过滤;土壤总铁采用连二亚硫酸钠-柠檬酸钠-重碳酸钠法 (DCB) 提取 (Mehra et al., 2012),取4.0 g土壤,加入40 mL 0.3 mol·L-1柠檬酸溶液和5 mL 1 mol·L-1碳酸氢钠溶液,水浴加热至80 ℃后,加入1 g连二亚硫酸钠, 得到的混合物持续搅拌1 min,之后间隔15 min搅拌,并加入10 mL饱和氯化钠促进絮凝;结晶型铁含量为总铁含量减去无定型铁含量;土壤溶液中亚铁和总铁的测定参照菲洛嗪法,总铁先用10%盐酸羟胺还原 (Liu et al., 2015),其中, 二价铁采用紫外分光光度计 (UV-1800,岛津) 测定.
砷形态含量分析采用改进的Wenzel连续提取法 (Niazi et al., 2011),具体操作步骤见表 2.其中,步骤1重复2次,每个提取步骤完成后用0.05 mol·L-1 NaCl溶液冲洗,除去每次提取过后夹带溶液中的As,以便最大限度地降低步骤之间As的重叠部分及As的再吸附和沉淀.每个提取步骤之后,提取液离心分离 (3000 r·min-1,15 min),上层液利用0.45 μm滤膜过滤以便砷浓度分析.
| 表 2 改进的Wenzel连续提取法步骤 Table 2 Procedures of improved Wenzel sequential extraction method |
土壤溶液氧化还原电位 (Eh) 采用ORP计 (Bante930) 测定,pH采用多参数分析仪 (DZS-708) 测定,砷浓度采用原子荧光 (AFS-52) 测定,不同类型铁矿物的物相分析采用X射线衍射仪 (X′Pert Powder,荷兰),外表面的特征采用扫描电镜 (S-3400N, Japan),铁矿物比表面积和微孔孔径分析采用全自动比表面积及微孔孔隙分析仪 (麦克,ASAP 2460).
3 结果与讨论 (Results and discussion) 3.1 铁矿物微孔与表面特征分析由图 1a可知,水铁矿表面较为粗糙不规则,且有小颗粒物团聚而呈现出表面不连续,这可能与水铁矿容易粘附的物理性质有关;针铁矿形貌最为规则,且为分散性较好的长针状晶体 (图 1b);由图 1c可知,赤铁矿外表面较为规则,具有较好的连续性.相应地,由表 3可知,3种铁矿物的比表面积大小依次为:水铁矿 (192.54 m2·g-1)>针铁矿 (74.70 m2·g-1)>赤铁矿 (36.07 m2·g-1),这与先前的大量研究结果一致 (Takeuchi et al., 2013;Jang et al., 2008;Redman et al., 2002).一般而言,水铁矿具有最高的比表面积 (Takeuchi et al., 2013),针铁矿比表面通常根据具体生成环境不同而变化,变化范围为10~132 m2·g-1(Jang et al., 2008),赤铁矿则比表面积最小 (Redman et al., 2002).这说明水铁矿的表面能提供更多的吸附点位,对砷具有最大的吸附量,也直接决定不同铁矿物对土壤砷的稳定化效果.同样,水铁矿、针铁矿和赤铁矿的微孔孔容大小也依次降低,其中, 水铁矿的最大孔容可达0.069 cm3·g-1,一定程度上提高了水铁矿的比表面积和吸附性能.
 |
| 图 1 水铁矿 (a)、针铁矿 (b) 和赤铁矿 (c) 的扫描电镜图 Fig. 1 Scanning electron microscope of ferrihydrite (a), goethite (b) and hematite (c) |
| 表 3 不同铁矿物的比表面积、孔容与孔径 Table 3 Surface area, pore volume and pore diameter of different iron minerals |
由图 2可知,水铁矿衍射峰少,宽化散漫,水铁矿的铁氧化物衍射峰主要出现在2θ=16.11°、26.18°、28.10°和39.26°处,其结晶度最低;针铁矿衍射峰较多,其铁氧化物的衍射峰则主要出现在2θ=26.77°、31.72°、35.20°、39.06°、45.48°和55.93°处,且衍射峰尖锐具有较高强度,结晶度较高;赤铁矿同样具有较多的衍射峰和较高的强度值,且在2θ=21.37°、33.32°、34.63°、36.67°、41.05°、53.14°和58.98°时为铁氧化物衍射峰,其结晶度较好.
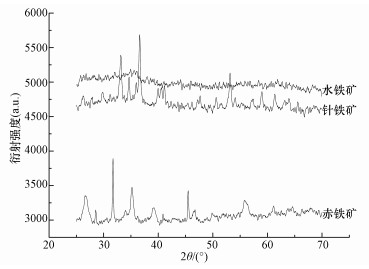 |
| 图 2 种类型铁矿物的XRD图谱 Fig. 2 XRD pattern of the three iron minerals |
由图 3a可知,水淹缺氧条件下对照组土壤溶液氧化还原电位 (Eh) 下降,Eh从-235.6 mV降低至-422.6 mV,同时土壤砷不断地释放至土壤溶液,第21 d开始Eh趋于稳定,pH则与Eh呈相反趋势,pH值从6.71升至7.03,这与Rinklebe等 (2016)的研究一致.Ohtsuka等 (2013)同样证明氧化还原电位从500 mV下降至100 mV时,砷主要以3价砷形式从土壤中释放至土壤溶液.同样,Honma等 (2016)进一步研究表明土壤溶液砷浓度与Eh和pH存在一定关系,[As]=5.84exp (-0.0144Eh) 和[As]=3.56×10-12exp (4.72pH).这说明水淹缺氧条件下,Eh的降低伴随着土壤溶液砷浓度的提高,当Eh达到最低值时,砷的释放量最大.相比于空白对照组,水铁矿、针铁矿和赤铁矿处理组Eh提高幅度依次降低,pH降幅依次降低,其中,Eh从-227.0 mV降至-410.1 mV,pH变化范围为6.71~6.98,说明施加不同铁矿物对土壤溶液的Eh和pH值产生不同的影响.
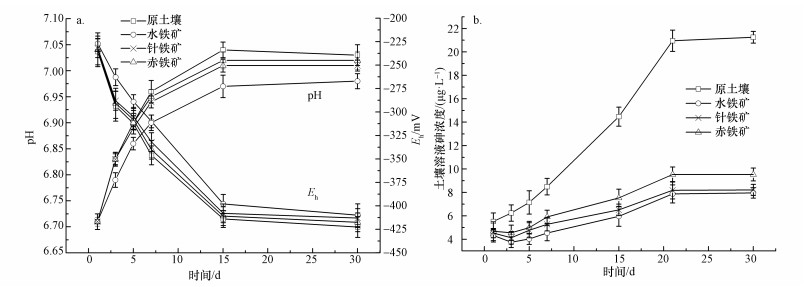 |
| 图 3 不同铁矿物 (投加量2.0%) 对氧化还原电位 (Eh) 和pH值 (a) 及土壤溶液砷浓度 (b) 的影响 Fig. 3 Effects of the application of different iron minerals (at a dosage of 2.0%) on arsenic content in soil solution and changes in redox potential as well as pH |
由图 3b可知,空白处理土壤溶液砷浓度逐渐提高,而施用2.0%水铁矿、针铁矿和赤铁矿处理均在第3 d时土壤溶液砷浓度达到最低,第3 d之后土壤溶液砷浓度逐渐增长,直至第21 d砷含量开始趋于稳定.其中,施用2.0%水铁矿土壤溶液砷最低,砷浓度相比于空白处理组降低了62.55%,这与水铁矿具有最大比表面积 (192.54 m2·g-1) 和微孔孔容 (0.069 cm3·g-1) 有关.林志灵等 (2013)指出, 水铁矿添加量为0.5%~5%时,土壤有效态砷含量下降幅度达到5.67%~64.15%.水铁矿表面活性高,这与表面有较高的单配位—OH位点密度有关,Hiemstra等 (2013)进一步指出水铁矿的—OH/Fe接近0.18,这有利于砷与水铁矿表面发生配位体交换,促进水铁矿对砷的吸持稳定化.相比于空白处理组,施用2.0%针铁矿后土壤溶液砷浓度降低了61.36%,这与针铁矿表面存在一种羟基与一种水和离子基团,可以与砷发生配位体交换有关 (Liu et al., 2014; Soltis et al., 2016).赤铁矿处理相比于空白土壤能降低土壤溶液砷浓度55.16%, 这可能与赤铁矿表面具有饱和配位位点、比表面积较低和结晶度较高有关.有进一步的研究报道,赤铁矿具有3种不同羟基基团,只有在较高的温度下才能去除,而砷被稳定的赤铁矿螯合时也更为稳定 (Seyfferth et al., 2014; Legg et al., 2014; Matsumoto et al., 2016).这也说明铁矿物的比表面积、结晶度和表面活性基团能够影响铁矿物对砷的稳定化效果.
3.4 土壤铁矿物对砷形态的影响由图 4可知,施用3种铁矿物后,土壤有效态和专属吸附态砷含量都降低,其中, 施加水铁矿的效果最显著,有效态和专属吸附态砷含量分别降低0.28 mg·kg-1和1.90 mg·kg-1,其余依次为针铁矿和赤铁矿,且有效态和专属吸附态砷都转化为无定形铁结合态砷和结晶型铁结合态砷,其中,施加水铁矿处理组表现为有效态和专属吸附态砷主要转化为无定型铁结合态砷,针铁矿和赤铁矿依次降低.相比于空白对照组,施用水铁矿、针铁矿和赤铁矿处理组中无定型铁结合态砷占总砷的含量百分比分别增长了1.73%、1.02%和0.41%,这与卢聪等 (2013)研究一致,施用FeSO4作为稳定剂时,无定型铁和结晶型铁结合态砷分别提高1.4%和2.6%.同样,胡立琼等 (2014)研究表明,FeCl3和FeCl2能明显降低土壤易溶态砷含量,相比于对照组可降低86.4%和63.6%,且易溶态砷向铁结合态砷转换,当FeCl3施加量为2.00 g·kg-1时,铁结合态砷相比于对照组增加了28.3%.费杨等 (2015)研究指出,在饱和持水量土壤中施加Fe2O3、Nano-Fe2O3和铁锰双金属氧化物可分别使无定形铁+结晶型铁结合态砷含量提高1.7%、28.9%和28.1%.其中,添加Fe2O3和Nano-Fe2O3主要向结晶型铁结合态砷转换,其占总砷的比例分别增加了2.4%和24%.相比于原土壤,添加3种铁矿物后土壤中草酸铵提取铁和结晶型铁含量均有不同程度增加,施加相同剂量的赤铁矿、针铁矿和水铁矿的土壤中草酸铵提取铁依次增加.相似地,胡立琼等 (2014)研究表明,Fe0在添加量为8.0 g·kg-1时,土壤中氧化锰结合态铁和无定型铁显著提高,相比于对照组分别增加了169%和94.4%.
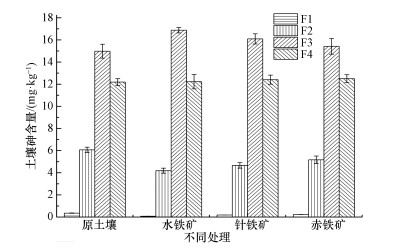 |
| 图 4 不同铁矿物 (投加量2.0%) 对土壤砷形态的影响 Fig. 4 Effects of the application of different iron minerals (at a dosage of 2.0%) on arsenic speciation in soil |
由图 5可知,土壤无定形铁结合态砷与土壤无定型铁矿物呈正相关关系 (r=0.879,p=0.009),这与先前Niazi等 (2011)证明砷污染土壤中无定型铁含量与无定型铁结合态砷的含量呈正相关性 (r=0.63,p<0.001) 的研究相符.而土壤无定型铁含量与土壤溶液砷含量呈负相关性 (r=-0.895,p=0.006),这说明水淹条件下,铁矿物能够吸附释放至土壤溶液中的砷,同时促进了土壤可交换态和专属吸附态砷向无定型铁结合态砷转换.李芳柏等 (2015)进一步研究指出,无定型铁矿物结合砷含量与糙米和秸秆中的砷呈显著负相关 (r=-0.555,p < 0.001;r=-0.604,p < 0.001),而与可交换态和专属吸附态砷二者总量 (F1+F2) 呈正相关关系 (r=0.694,p<0.001).同样的研究表明,施用铁氧化物能够降低水稻谷粒累积量,这与无定型铁矿物对砷具有吸附性能有关 (Matsumoto et al., 2016).由图 5可以看出,结晶型铁与土壤结晶型铁结合态砷存在正相关关系 (r=0.797,p=0.032),这说明土壤砷能被贮存在结晶型铁矿物中.这可能与土壤老化有关,其主要特征是土壤铁矿物结晶度提高,且部分砷更牢固地嵌入到铁矿物的结构中 (Xu et al., 2015).同样,铁矿物 (针铁矿、赤铁矿) 结晶度较高,能够提供的吸附砷的配位点位更少,相应地, 土壤结晶型铁相比于无定型铁对于有效态砷的截留能力较差 (Wang et al., 2015).因此,土壤中的铁矿物是砷的重要吸附载体,而不同铁矿物 (如水铁矿、针铁矿、赤铁矿) 对砷的吸附作用与稳定化效果有所差异,这与铁矿物的结晶度和表面性质紧密相关.
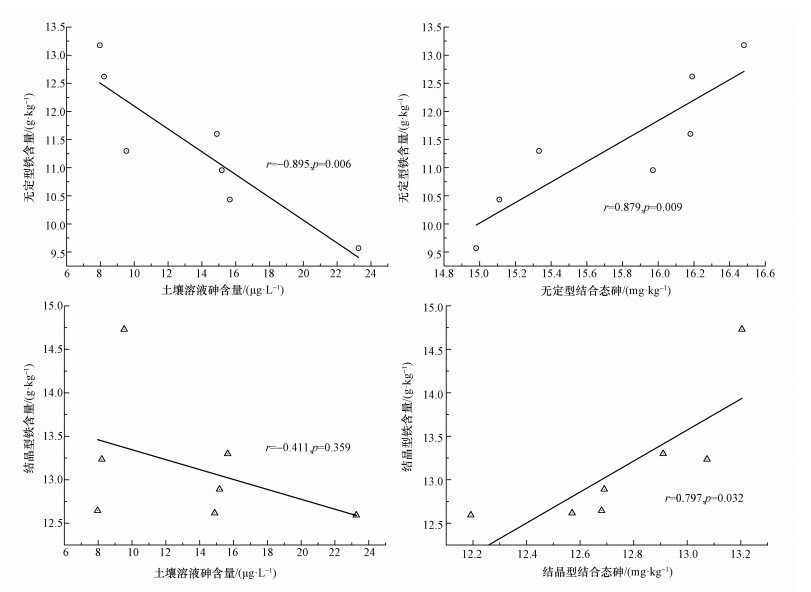 |
| 图 5 土壤铁矿物和土壤铁矿物结合态砷与溶液中砷的相关性 Fig. 5 Correlations between soil iron mineral content and soil iron mineral bound arsenic content in soil solution |
由图 6可以看出,相比于空白对照组,往供试土壤中加入3种铁矿物后,土壤溶液亚铁和总铁浓度均呈现出增长的趋势,其中,添加水铁矿增幅最大,针铁矿和赤铁矿处理组的增幅依次降低.这说明水铁矿在水淹缺氧条件下更易溶解,可能导致部分砷释放;相反,Jiang等 (2015)通过水铁矿对砷的吸附机制研究表明,水铁矿对砷的吸附首先是通过表面螯合进行的,而溶液中Fe3+与吸附在水铁矿表面砷的结合可以使溶液中砷再次通过表面螯合而被吸附,因而溶解Fe3+的存在可能有利于水铁矿对砷的稳定化.相比于空白对照组,针铁矿处理组中土壤溶液Fe2+和总铁均有小幅度的提高,可能与针铁矿结晶度较高有关,这与黎慧娟等 (2011)的研究一致.针铁矿表面与砷的螯合物存在3类,并以双齿双核为主,当砷 (Ⅴ) 在铁矿表面的覆盖度低时,主要形成单齿螯合物;覆盖度高时,主要形成双齿螯合物 (Li et al., 2011),砷 (Ⅲ) 可以以双齿双核的桥接形式在针铁矿表面形成螯合物 (Xu et al., 2014),生成内圈或外圈螯合物,一般生成内圈螯合物的情况更多 (Catalano et al., 2008).赤铁矿处理组中土壤溶液Fe2+和总铁略低于针铁矿处理组,这可能与赤铁矿同针铁矿均具有较高的结晶度而不易被土壤微生物还原有关.且赤铁矿可以类似于水铁矿、针铁矿与砷形成表面螯合物,同时也可以把砷 (Ⅴ) 嵌入到自身的结构中,从而长期储存砷 (Ⅴ) 并显示出一种类似于脆砷铁矿簇的短距离排列,在赤铁矿中外延生长 (Bolanz et al., 2013).大量研究报道, 无定型铁矿物的施用可以抑制土壤砷被还原而有效降低砷污染,这与吸持在铁矿物的砷能被有效地延长还原的半衰期有关 (Kludze et al., 1993;Jang et al., 2016),因而施用铁矿物将大幅度降低砷直接被还原的速率,其中,Huang等 (2011)指出,水铁矿相比于针铁矿更有利于降低砷直接被还原的半衰期,所以相比于溶液中砷的还原,铁矿物结合态砷的直接还原是可以忽略的.且有进一步研究说明水淹条件下,无定型铁矿物的还原只是一小部分,且在耕种期间,只有少于1%的草酸铵提取铁被还原 (Zhang et al., 2016).相反,结晶型铁更不易被微生物异化还原,长期的稳定性更好 (Li et al., 2011).因而当施加铁矿物时,可以有效截留土壤溶液中的砷,降低砷的有效性和毒性,而一定程度上砷的释放取决于水铁矿、针铁矿和赤铁矿被铁还原菌还原的可能性.
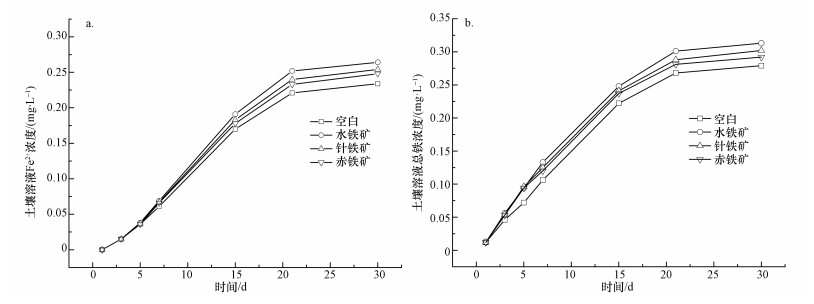 |
| 图 6 土壤溶液中亚铁 (a) 和总铁 (b) 的浓度变化 (投加量2.0%) Fig. 6 Change in ferrous (a) and total (b) iron content of soil solution (at a dosage of 2.0%) |
1) 水淹缺氧条件下,施用3种铁矿物对土壤砷具有一定的稳定化作用,其中,水铁矿的稳定化最高,其余依次为针铁矿和赤铁矿.这与铁矿物的表面性质和铁矿物结晶度有关,其中,水铁矿具有最大的比表面积 (192.54m2·g-1) 和孔容积 (0.069 cm3·g-1),结晶度最低;而针铁矿的比表面积和孔容积相比于水铁矿较低,结晶度最高,赤铁矿则具有最小比表面积和较高的孔容积.
2) 土壤无定型铁含量与无定型铁结合态砷含量呈正相关性 (r=0.879,p=0.009),同样, 结晶型铁含量和结晶型铁结合态砷呈正相关关系 (r=0.797,p=0.032),施用不同铁矿物后土壤中无定型铁和结晶型铁含量提高,这有利于容易释放至土壤溶液的砷被截留从而转化为无定型铁结合态砷和结晶型铁结合态砷.且施用铁矿物作为稳定材料能有效地减少土壤砷的释放量,降低农田土砷污染.
| [${referVo.labelOrder}] | Beak D G, Basta N T, Kirk G, et al. 2006. Bioaccessibility of arsenic (Ⅴ) bound to ferrihydriteusing a simulated gastrointestinal system[J]. Environmental Science and Technology, 40(4) : 1364–1370. DOI:10.1021/es0516413 |
| [${referVo.labelOrder}] | Bolanz R M, Wierzbickawieczorek M, Čaplovičová M, et al. 2013. Structural incorporation of As5+ into hematite[J]. Environmental Science and Technology, 47(16) : 9140–9147. DOI:10.1021/es305182c |
| [${referVo.labelOrder}] | Catalano J G, Park C Y, Fenter P, et al. 2008. Simultaneous inner-and outer-sphere arsenate adsorption on corundum and hematite[J]. Geochimica et Cosmochimica Acta, 72(8) : 1986–2004. DOI:10.1016/j.gca.2008.02.013 |
| [${referVo.labelOrder}] | Christl I, Brechbühl Y, Graf M, et al. 2012. Polymerization of silicate on hematite surfaces and its influence on arsenic sorption[J]. Environmental Science and Technology, 46(24) : 13235–13243. DOI:10.1021/es303297m |
| [${referVo.labelOrder}] | Erbs J J, Berquo T S, Reinsch B C, et al. 2010. Reductive dissolution of arsenic-bearing ferrihydrite[J]. Geochimica et Cosmochimica Acta, 74(12) : 3382–3395. DOI:10.1016/j.gca.2010.01.033 |
| [${referVo.labelOrder}] | 费杨, 阎秀兰, 廖晓勇, 等. 2015. 不同水分条件下铁基氧化物对土壤砷的稳定化效应研究[J]. 环境科学学报, 2015, 35(10) : 3252–3260. |
| [${referVo.labelOrder}] | Liu H B, Chen T H, Frost R L. 2014. An overview of the role of goethite surfaces in the environment[J]. Chemosphere, 103 : 1–11. DOI:10.1016/j.chemosphere.2013.11.065 |
| [${referVo.labelOrder}] | Hiemstra T. 2013. Surface and mineral structure of ferrihydrite[J]. Geochimica et Cosmochimica Acta, 105 : 316–325. DOI:10.1016/j.gca.2012.12.002 |
| [${referVo.labelOrder}] | Honma T, Ohba H, KanekoKadokura A. 2016. Optimal soil Eh, pH, andwater management for simultaneously minimizing arsenic and cadmium concentrations in rice grains[J]. Environmental Science and Technology, 50(8) : 4178–4185. DOI:10.1021/acs.est.5b05424 |
| [${referVo.labelOrder}] | 胡立琼, 曾敏, 雷鸣, 等. 2014a. 含铁材料对污染水稻土中砷的稳定化效果[J]. 环境工程学报, 2014a, 8(4) : 1559–1604. |
| [${referVo.labelOrder}] | 胡立琼, 曾敏, 雷鸣, 等. 2014b. 零价铁固定稻田土壤砷的持久性研究[J]. 水土保持学报, 2014b, 28(2) : 267–271. |
| [${referVo.labelOrder}] | Huang J H, Voegelin A, Pombo S A, et al. 2011. Influence of arsenate adsorption to ferrihydrite, goethite, andboehmite on the kinetics of arsenate reduction by Shewanellaputrefaciens strain CN-32[J]. Environmental Science and Technology, 45(18) : 7701–7709. DOI:10.1021/es201503g |
| [${referVo.labelOrder}] | Jiang X L, Peng C J, Fu D, et al. 2015. Removal of arsenate by ferrihydrite via surface complexation and surface precipitation[J]. Applied Surface Science, 353 : 1087–1094. DOI:10.1016/j.apsusc.2015.06.190 |
| [${referVo.labelOrder}] | Jang J H, Dempsey B A. 2008. Coadsorption of arsenic (Ⅲ) and arsenic (Ⅴ) onto hydrous ferric oxide:effects on abiotic oxidation of arsenic (Ⅲ), extraction efficiency, andmodel accuracy[J]. Environmental Science and Technology, 42(8) : 2893–2898. DOI:10.1021/es702318f |
| [${referVo.labelOrder}] | Jiang S H, Lee J H, Kim D H, et al. 2013. Differential arsenic mobilization from As-bearing ferrihydrite by iron-respiring Shewanellastrains with different arsenic-reducing activities[J]. Environmental Science and Technology, 47(15) : 8616–8623. |
| [${referVo.labelOrder}] | Takeuchi H, Omogo B, Heyes C D. 2013. Are bidentate ligands really better than monodentateligands for nanoparticles[J]. Nano Letters, 13(10) : 4746–4752. DOI:10.1021/nl4023176 |
| [${referVo.labelOrder}] | Kludze H K, DeLaune R D, Patrick W H. 1993. Aerenchyma formation and methane and oxygen exchange in rice[J]. Soil Science Society of America Journal, 57(2) : 368–391. |
| [${referVo.labelOrder}] | Legg B A, Zhu M Q, Comolli L R, et al. 2014. Determination of the three-dimensional structure of ferrihydritenanoparticle aggregates[J]. Langmuir, 30(33) : 9931–9940. DOI:10.1021/la502128d |
| [${referVo.labelOrder}] | 黎慧娟, 彭静静. 2011. 水稻土中铁还原菌多样性[J]. 应用生态学报, 2011, 22(10) : 2705–2710. |
| [${referVo.labelOrder}] | Li W, Harrington R, Tang Y, et al. 2011. Differential pair distribution function study of the structure of arsenate adsorbed on nanocrystalline γ-alumina[J]. Environmental Science and Technology, 45(22) : 9687–9692. DOI:10.1021/es200750b |
| [${referVo.labelOrder}] | 林志灵, 曾希柏, 张杨珠, 等. 2013. 人工合成铁、铝矿物和镁铝双金属氧化物对土壤砷的钝化效应[J]. 环境科学学报, 2013, 33(7) : 1953–1959. |
| [${referVo.labelOrder}] | Liu C P, Yu H Y, Liu C S, et al. 2015. Arsenic availability in rice from a mining area:Is amorphous iron oxide-bound arsenic a source or sink[J]. Environmental Pollution, 199 : 95–101. DOI:10.1016/j.envpol.2015.01.025 |
| [${referVo.labelOrder}] | 卢聪, 李青青, 罗启仕, 等. 2013. 场地土壤中有效态砷的稳定化处理及机理研究[J]. 中国环境科学, 2013, 33(2) : 298–304. |
| [${referVo.labelOrder}] | Mamindy-Pajany Y, Hurel C, Marmier N, et al. 2011. Arsenic (Ⅴ) adsorption from aqueous solution onto goethite, hematite, magnetite and zero-valent iron:effects of pH, concentration and reversibility[J]. Desalination, 281(20) : 93–99. |
| [${referVo.labelOrder}] | Matsumoto S, Kasuga J, Makino T, et al. 2016. Evaluation of the effects of application of iron materials on the accumulation and speciation of arsenic in rice grain grown on uncontaminated soil with relatively high levels of arsenic[J]. Environmental and Experimental Botany, 125 : 42–51. DOI:10.1016/j.envexpbot.2016.02.002 |
| [${referVo.labelOrder}] | Matsumoto S, Kasuga J, Taiki N, et al. 2015. Inhibition of arsenic accumulation in Japanese rice by the application of iron and silicate materials[J]. Catena, 135 : 328–335. DOI:10.1016/j.catena.2015.07.004 |
| [${referVo.labelOrder}] | Mehra O P, Jackson M L. 1960. Iron oxide removal from solid clays by a dithionite-citrate system buffered with sodium bicarbonate[J]. Clays Clay Mineral, 7 : 317–327. |
| [${referVo.labelOrder}] | Niazi N K, Singh B, Shah P. 2011. Arsenic speciation and phytoavailability in contaminated soils using a sequential extraction procedure and XANES spectroscopy[J]. Environmental Science and Technology, 45(17) : 7135–7142. DOI:10.1021/es201677z |
| [${referVo.labelOrder}] | Nielsen S S, Kjeldsen P, Hansen H C B, et al. 2014. Transformation of natural ferrihydrite aged in situ in As, Cr and Cu contaminated soil studied by reduction kinetics[J]. Applied Geochemistry, 51 : 293–302. DOI:10.1016/j.apgeochem.2014.10.014 |
| [${referVo.labelOrder}] | Ohtsuka T, Yamaguchi N, Makino T. 2013. Arsenic dissolution from Japanese paddy soil by a dissimilatoryarsenate-reducing bacterium Geobacter sp.OR 1[J]. Environmental Science and Technology, 47(12) : 6263–6271. |
| [${referVo.labelOrder}] | Rawson J, Prommer H, Siade A. 2016. Numerical modeling of arsenic mobility during reductive iron-mineral transformations[J]. Environmental Science and Technology, 50(5) : 2459–2467. DOI:10.1021/acs.est.5b05956 |
| [${referVo.labelOrder}] | Rayment G E, Lyons D J. 2011. Soil Chemical Methods Australasia[M]. Australia: CSIRO Publishing: 1–482. |
| [${referVo.labelOrder}] | Redman A D, Macalady D L, Ahmann D. 2002. Natural organic matter affects arsenic speciation and sorption onto hematite[J]. Environmental Science and Technology, 36(13) : 2889–2896. DOI:10.1021/es0112801 |
| [${referVo.labelOrder}] | Rinklebe J, Shaheen S M, Yu K. 2016. Release of As, Ba, Cd, Cu, Pb, andSr under pre definite redox conditions in different rice paddy soils originating from the U.S.A.and Asia[J]. Geoderma, 270 : 21–32. DOI:10.1016/j.geoderma.2015.10.011 |
| [${referVo.labelOrder}] | Seyfferth A L, McCurdy S, Schaefer M V, et al. 2014. Arsenic concentrations in paddy soil and rice and health implications for major rice-growing regions of Cambodia[J]. Environmental Science and Technology, 48(9) : 4699–4706. DOI:10.1021/es405016t |
| [${referVo.labelOrder}] | Soltis J A, Feinberg J M, Gilbert B, et al. 2016. Phase transformation and particle-mediated growth in the formation of hematite from 2 Line ferrihydrite[J]. Crystal Growth and Design, 16(2) : 922–932. DOI:10.1021/acs.cgd.5b01471 |
| [${referVo.labelOrder}] | Wang Y, Liu X H, Si Y B, et al. 2016. Release and transformation of arsenic from As-bearing iron minerals by Fe-reducing bacteria[J]. Chemical Engineering Journal, 295 : 29–38. DOI:10.1016/j.cej.2016.03.027 |
| [${referVo.labelOrder}] | Wang Z H, Xiao D X, Bush R T, et al. 2015. Coprecipitated arsenate inhibits thermal transformation of 2-line ferrihydrite:Implications for long-term stability of ferrihydrite[J]. Chemosphere, 122 : 88–93. DOI:10.1016/j.chemosphere.2014.11.017 |
| [${referVo.labelOrder}] | Xu J, Li J J, Wu F, et al. 2014. Rapid photooxidation of As (Ⅲ) through surface complexation with nascent colloidal ferric hydroxide[J]. Environmental Science and Technology, 48(1) : 272–278. DOI:10.1021/es403667b |
| [${referVo.labelOrder}] | Xu L Y, Wu X, Wang S F, et al. 2015. Speciation change and redistribution of arsenic in soil under anaerobic microbial activities[J]. Journal of Hazardous Materials, 301 : 538–546. |
| [${referVo.labelOrder}] | Yu B, Jia S Y, Liu Y, et al. 2013. Mobilization and re-adsorption of arsenate on ferrihydrite and hematite in the presence of oxalate[J]. Journal of Hazardous Materials, 262(22) : 701–708. |
| [${referVo.labelOrder}] | Zhang Z N, Yin N Y, Du H L, et al. 2016. The fate of arsenic adsorbed on iron oxides in the presence of arsenite-oxidizing bacteria[J]. Chemosphere, 151 : 108–115. DOI:10.1016/j.chemosphere.2016.02.065 |
 2017, Vol. 37
2017, Vol. 37


