农业生态系统是氧化亚氮 (N2O) 的重要排放源, 其中, 高氮 (N) 投入的菜地生态系统占农业生态系统N2O总排放量的20%(Zheng et al., 2004).菜地生态系统是特殊的旱地生态系统, 种植面积占我国耕地总面积的12.4%(FAO, 2015), 其施肥量大、灌溉频繁及复种指数高等特点导致土壤微生物, 特别是N转化功能微生物组成和数量发生变化 (Jetten, 2014), 易造成土壤N2O大量排放 (Wang et al., 2011)、硝酸盐 (NO3--N) 累积和土壤酸化等一系列环境问题 (Qu et al., 2015).因此, 研究和掌握菜地土壤N循环 (硝化和反硝化作用) 相关微生物的丰度和功能,对改善菜地土壤N循环, 缓解土壤N2O排放有积极的参考意义.
硝化作用和反硝化作用是土壤N2O产生的主要途径.硝化作用是指氨在微生物作用下氧化为硝酸盐的过程, 主要包括2种途径:① 由氨态氮 (NH3) 通过亚硝酸盐 (NO2-) 转化成NO3-, 其中, 由NH3氧化成NO2-是硝化作用的限速步骤, 由氨氧化细菌 (Ammonia-oxidizing bacteria, AOB) 和氨氧化古菌 (Ammonia-oxidizing archaea, AOA) 的氨单加氧酶 (amoA) 催化完成 (Arp et al., 2003;贾仲君等, 2010);② 由“完全硝化菌”将NH3直接氧化为NO3-, 该化能自养生物是硝化螺菌属 (Nitrospira), 可编码氨氧化和亚硝酸盐氧化2个过程的功能基因 (Daims et al., 2015).反硝化作用是指反硝化微生物在厌氧条件下将NO3-中的N通过一系列中间产物 (NO2-、NO、N2O) 还原为氮气 (N2) 的生物化学过程.它是闭合氮循环的重要步骤, 也是农田氮肥损失的重要途径, 其中, 参与的酶包括硝酸盐还原酶、亚硝酸盐还原酶、一氧化氮还原酶和氧化亚氮还原酶.由亚硝酸盐还原为NO的过程是反硝化作用区别于其他硝酸盐代谢的标志性反应, 也是反硝化作用中最重要的限速步骤, 亚硝酸盐还原酶是执行该步骤的限速酶, 对应的亚硝酸盐还原基因nirK和nirS也成为反硝化细菌功能基因中的研究热点 (Braker et al., 2011;曾希柏等, 2014).氧化亚氮还原酶控制着反硝化作用的最后一步, nosZ基因作为编码此酶的唯一基因也被广泛用作功能标志基因来研究反硝化微生物 (Thomson et al., 2012).
近年来, 生物炭作为固碳减排的有效措施已成为研究热点, 有机无机肥料配合施用也是设施蔬菜地较为常见的增产减排施肥方式.以往研究主要探讨了施用生物炭和有机肥对菜地土壤N2O排放或N相关功能基因的影响, 如Taghizadeh Toosi等 (2011)在田间原位试验发现, 施用生物炭可显著减少N2O累积排放量约50%;Jia等 (2012)通过盆栽试验表明, 施用有机肥对菜地土壤N2O排放无显著影响; Ducey等 (2013)研究表明, AOA和AOB丰度对生物炭添加并无响应;王晓辉等 (2013)发现, 生物炭可显著增加设施退化土壤nirK基因丰度, 对nirS和nosZ基因丰度没有显著影响.然而关于生物炭和有机肥对菜地土壤N2O排放及其相关功能基因丰度的综合分析研究甚少.为此, 本试验以南京集约化蔬菜土壤为研究对象, 采用室内培养和实时荧光定量PCR技术, 结合土壤理化性质和硝化、反硝化微生物功能基因丰度, 综合分析生物炭和有机肥对菜地土壤N2O排放的影响, 以期为改善菜地土壤性质、调控和减少菜地土壤N2O排放等提供理论依据.
2 材料与方法 (Material and methods) 2.1 试验处理试验地点位于南京 (32°01′N, 118°52′E) 集约化种植菜地 (有长达10 a的种植历史).该地区属于典型的长江中下游亚热带季风气候, 年均气温为15.4 ℃, 年均降水量为1107 mm.一年可以种植3~5茬蔬菜, 是南方集约化蔬菜生产的典型代表.试验地土壤属于黄棕壤, 质地为粉粘壤土 (粘粒30.1%, 粉粒64.7%, 砂粒5.2%).初始土壤pH=5.5, 容重为1.2 g·cm-3, 有机碳 (SOC) 为15.6 g·kg-1(以C计, 下同), 总氮 (TN) 为1.9 g·kg-1(以N计, 下同), 阳离子交换量 (CEC) 为31.2 cmol·kg-1.
设置5个田间处理:CK (对照)、N (尿素)、N+BC (尿素+生物炭)、N+M (尿素+有机肥)、N+BC+M (尿素+生物炭+有机肥).每个小区面积为3 m×2 m, 每个处理设置3次重复.田间管理 (包括蔬菜品种、施肥量及施用方法、耕作、灌溉、除虫和杂草控制) 与当地农民管理方式保持一致.各施N处理施N量一致, 总施N量为1250 kg·hm-2·a-1(以N计, 下同), 施用有机肥处理的施N量为有机肥N量+尿素N量, 其中, 有机肥和尿素比例为1:1, 同时各处理施入等量的磷肥 (钙镁磷肥, 含P2O5 14.0%) 和钾肥 (氯化钾, 含K2O 63.2%), 对照处理补充相应数量磷钾肥, 于每季蔬菜种植前施用.生物炭为河南三利新能源有限公司通过高温热分解小麦秸秆所得, pH=9.4, 总碳量为46.7 g·kg-1, TN为5.6 g·kg-1, CEC为24.1 coml·kg-1, 表面积为8.9 m2·g-1, 灰分为20.8%.生物炭于2012年4月一次性施入土壤中, 施用量为40 t·hm-2, 翻耕混匀, 生物炭施用后共种植13季蔬菜, 不同处理种植蔬菜种类和农业管理措施等保持一致.有机肥为南京市土壤肥料站的金达牌有机肥, 有机质含量为35%, 含N量为3.2%, 原材料为发酵微生物菌、发酵鸡粪、风化煤、饼粕等, 于2014年12月施用, 有机肥施用后共种植4季蔬菜.土壤样品于2015年12月蔬菜成熟季采集, 在每个小区内均匀分布采样, 用土钻获得0~20 cm土层鲜土, 取15 g用于土壤理化性质测定, 取2 g置于-80 ℃冰箱供微生物测定, 其余置于4 ℃冰箱供室内培养.
2.2 室内培养取出贮存于4 ℃冰箱的鲜土, 立即过2 mm筛, 每个处理设置3次重复, 分别称取相当于30 g烘干土的新鲜土样于250 mL培养瓶内, 置于 (28±1) ℃恒温培养箱中预培养24 h.预培养结束后, 用注射器均匀添加200 mg·kg-1 (NH4)2SO4溶液, 目的是刺激N相关微生物生长, 并调节含水量至65%土壤持水量 (WHC).然后于 (28±1) ℃下恒温培养6周, 培养期间每天补充水分以保持土壤含水量.N2O浓度测定于第1~2周每天测定1次, 第3~6周每周测定2次, 用20 mL三通阀注射性针筒在培养瓶密闭后0、5 h分别采集气体样品.采用气相色谱仪 (Agilent 7890A, 上海) 测定样品中的N2O浓度, 检测器为ECD.每个处理分别于第1、7、14、21、28、35和42 d破坏性取样以测定NH4+-N、NO3--N和amoA、nirS、nirK、nosZ基因丰度.
2.3 土壤理化性质和微生物丰度测定土壤pH值采用精密pH计 (PHS-3C) 测定, 土水比为1:5(质量体积比, g·mL-1), SOC含量测定采用重铬酸钾容量法, TN含量测定采用开氏法 (鲍士旦, 2000), NH4+-N含量测定采用2 mol·L-1 KCl浸提-靛酚蓝比色法, NO3--N含量测定采用2 mol·L-1 KCl浸提-紫外分光光度法.
土壤DNA利用FastDNA Spin Kit for Soil试剂盒 (MP Biomedicals), 根据其提供的操作指南提取土壤微生物总DNA.由于菜地土壤中腐殖酸含量较高, 而腐殖酸的存在会影响样品的下游分子分析, 因此,本研究采用5.5 mol·L-1异硫氰酸胍 (Guanidine Thiocyanate) 反复清洗DNA, 除去腐殖酸, 并将DNA溶解于100 μL无菌水后于-20 ℃保存待用.
土壤氨氧化细菌 (amoA)、氨氧化古菌 (amoA)、亚硝酸盐还原菌 (nirK、nirS) 和氧化亚氮还原菌 (nosZ) 定量PCR扩增引物和反应条件如表 1所示.定量PCR标线采用含有古菌和细菌的amoA、nirK、nirS和nosZ基因的克隆进行制备.首先采用特定引物分别扩增目的基因, 构建克隆文库后, 将含有目标基因的克隆在LB营养液中过夜培养, 提取质粒纯化并测定质粒浓度, 根据摩尔常数计算目标基因的拷贝数, 并将质粒连续稀释8~10个数量级, 从而获得各目的基因的标准曲线 (郭赟等, 2012).实时荧光定量PCR于CFX96 Real-Time PCR System (Bio-Rad公司) 上完成.定量PCR扩增反应体系为20 μL, 包括:SYBR Green (TaKaRa, 日本)10 μL, Rox DYEII 0.2 μL, DNA模板1 μL, 上下游引物 (10 μmol·L-1) 各0.4 μL, 灭菌水8.0 μL.每次试验均设置严格的阴性对照, 采用灭菌双蒸水代替DNA作为反应模板.
| 表 1 荧光实时定量PCR扩增引物和反应条件 Table 1 Amplification primer and reaction condition of quantitative PCR |
采用Microsoft Excel 2003和SigmaPlot 12.5软件进行数据计算和图表制作, 采用JMP 9.0软件对土壤理化性质 (pH、SOC、TN、NH4+-N、NO3--N) 及各功能基因丰度进行方差分析, 采用Tukey法对土壤理化性质和N2O累积排放量进行多重比较 (α=0.05), 采用SigmaPlot 12.5软件对N2O排放量与NH4+-N、NO3--N浓度进行相关性分析.
3 结果 (Results) 3.1 田间施用生物炭和有机肥对土壤理化性质和功能基因丰度的影响由表 2可知, 与CK处理相比, 施肥各处理的土壤pH值显著降低, SOC和TN含量显著提高 (p < 0.05).与N处理, N+BC处理的pH和SOC含量均显著提高 (p < 0.05), 分别提高11.1%和15.7%, TN含量没有显著差异.N+M处理的SOC含量与N处理相比显著增加9.4%, 但pH值和TN含量没有显著差异 (p>0.05).与N处理相比, N+BC+M处理显著增加了土壤pH值和SOC含量, 增幅分别为4.7%和17.9%.
| 表 2 田间施用生物炭和有机肥对土壤理化性质和功能基因丰度的影响 Table 2 Effects of biochar and organic manure fertilizer addition on physiochemical properties and genes abundance in vegetable field |
由表 2可知, 与CK处理相比, 各施肥处理均显著降低了具有硝化作用的AOB、AOA丰度, 显著增加了反硝化作用关键基因nirK、nirS和nosZ的丰度 (p < 0.05).与N处理相比, N+BC处理显著增加了AOB、AOA、nirK、nirS和nosZ基因丰度 (p < 0.05), 增幅分别为105.8%、57.3%、22.0%、176.2%和204.9%.与N处理相比, N+M处理显著增加了nirK和nirS基因丰度, 增幅分别为58.8%和7.1%, 对AOB、AOA和nosZ基因丰度没有显著影响.N+BC+M处理较N处理显著增加了AOB、nirK、nirS和nosZ基因丰度, 增幅分别为30.7%、68.7%、6.5%和84.5%(p < 0.05).另外, 各处理AOB丰度较AOA丰度高约2个数量级, nirS基因丰度较nirK基因丰度高约2个数量级.
3.2 室内培养N2O排放动态及其累积排放量由图 1可知, 加入 (NH4)2SO4溶液后, CK处理培养期间未出现明显的N2O排放峰, 施肥各处理排放规律一致, 培养初期 (1~5 d) N2O排放速率 (以N计) 显著提高, 分别高达1829.3(N)、1550.0(N+BC)、1831.1(N+M) 和1726.3(N+BC+M) ng·kg-1·h-1.随着培养时间的延长, N2O排放速率迅速降低 (5~14 d), 14~42 d施肥各处理N2O排放速率基本稳定.
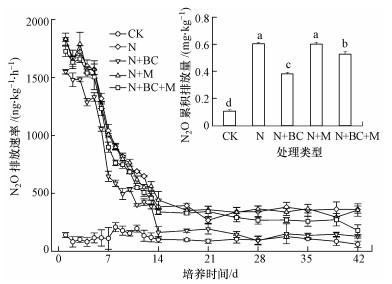 |
| 图 1 室内培养期间N2O排放速率和N2O累积排放量 (图中不同字母表示处理间差异显著 (p < 0.05)) Fig. 1 N2O emission rate and cumulative N2O emissions during the 42 d incubation period. |
由图 1中N2O累积排放量 (以N计) 可以看出, 各施肥处理N2O累积排放量均显著高于CK处理, 分别提高了454.2%(N)、250.9%(N+BC)、450.8%(N+M) 和384.5%(N+BC+M).与N处理相比, N+BC和N+BC+M处理均显著降低了N2O累积排放量, 分别降低了58.1%和14.4%(p < 0.05).N+M处理的N2O累积排放量与N处理差异不显著 (p>0.05).
3.3 培养期间NH4+-N和NO3--N的动态变化由图 2a可以看出, 各处理土壤NH4+-N含量变化趋势基本一致, 加入 (NH4)2SO4溶液后第1 d NH4+-N含量显著增加, 1~21 d呈现降低趋势, 21~42 d基本稳定.培养期间, 各施肥处理的NH4+-N含量均显著高于CK处理 (p < 0.05), 与N处理相比, N+BC处理的NH4+-N含量显著降低 (p < 0.05), N+M处理的NH4+-N含量没有显著差异 (p>0.05), N+BC+M处理NH4+-N含量显著降低 (第28 d除外).
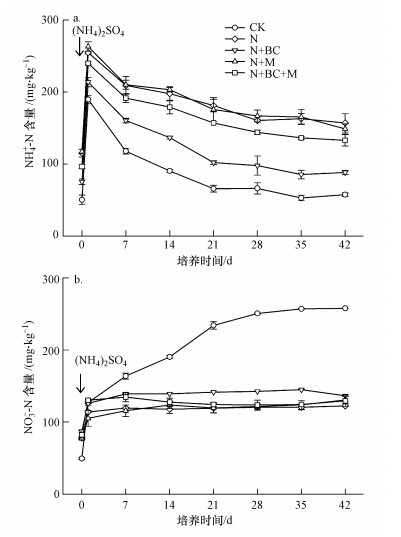 |
| 图 2 室内培养期间各处理NH4+-N (a) 和NO3--N (b) 变化趋势 (箭头表示加入 (NH4)2SO4溶液) Fig. 2 Dynamics in NH4+-N (a) and NO3--N (b) concentrations of five treatments during the whole incubation period with (NH4)2SO4 addition |
由图 2b可以看出, 添加 (NH4)2SO4溶液后, CK处理的NO3--N含量显著增加, 由127.0 mg·kg-1增加到257.9 mg·kg-1.N、N+BC、N+M、N+BC+M处理的NO3--N含量未呈现增加趋势, 基本保持在105.2~145.1 mg·kg-1范围内, 且各处理间差异不显著 (p>0.05).由表 3可知, 不同处理间NH4+-N、NO3--N与N2O排放速率之间相关性并不相同.除CK处理外, 其余施氮各处理的N2O排放速率与NH4+-N含量均呈显著正相关.CK、N、N+BC和N+M处理的N2O排放速率与NO3--N含量呈显著正相关, N+BC+M处理的N2O排放速率与NH4+-N、NO3--N之间的相关性不显著.
| 表 3 不同处理间N2O排放速率与无机氮含量之间的相关性 Table 3 Correlation between N2O emission rates and soil contents of NH4+-N and NO3--N |
由图 3a和3b可知, 添加 (NH4)2SO4溶液后, CK处理的AOB和AOA丰度变化显著, 呈现先升高后降低的趋势, AOB和AOA丰度峰值分别出现在第1、14 d, 高达1.3×108、3.5×106 copies·g-1(以干重计).N+BC处理的AOB和AOA丰度变化规律与CK处理基本一致, AOB和AOA丰度峰值分别出现在第1、14 d, 高达8.0×107、1.8×106 copies·g-1, 丰度显著低于CK处理, 但高于N、N+M和N+BC+M处理 (p < 0.05).N、N+M和N+BC+M处理的AOB丰度在第1 d略有增加, 之后逐渐降低至稳定, AOA丰度变化不显著 (p>0.05), 各处理间AOB和AOA丰度差异不显著.
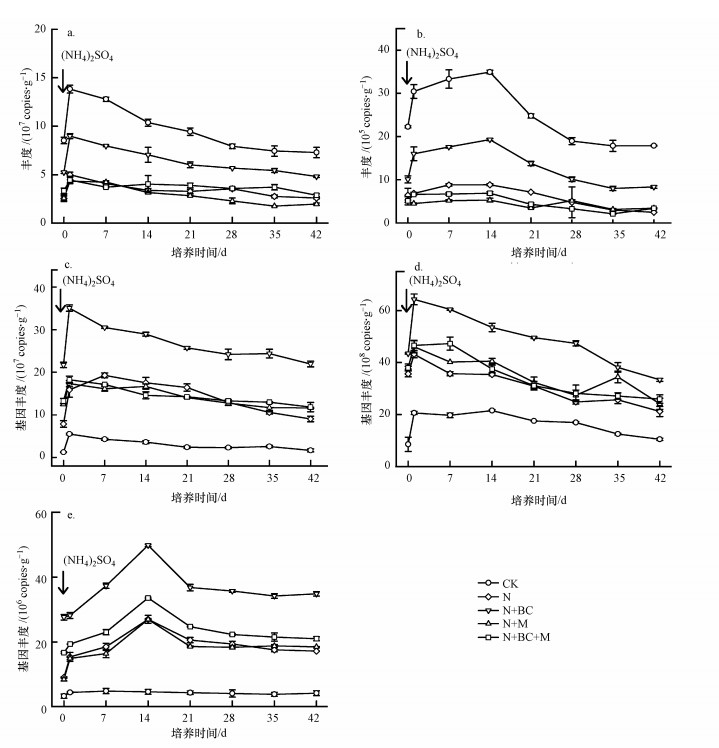 |
| 图 3 室内培养不同处理AOB (a)、AOA (b)、nirK (c)、nirS (d) 和nosZ (e) 基因丰度变化趋势 (箭头表示加入 (NH4)2SO4溶液) Fig. 3 Dynamics in gene copies of AOB (a), AOA (b), nirK (c), nirS (d) and nosZ (e) in five treatments during the whole incubation period |
如图 3c和3d所示, 加入 (NH4)2SO4溶液后, 各处理的亚硝酸盐还原酶nirK和nirS基因丰度的变化规律基本一致, 表现为第1 d出现峰值, 之后逐渐降低.由图 3c可知, nirK基因丰度在施肥的N、N+BC、N+M和N+BC+M处理中变化范围为1.2×108~3.5×108 copies·g-1, 显著高于CK处理 (1.7×107~5.5×107 copies·g-1).与N处理相比, N+BC处理的nirK基因丰度显著增加, 增幅为87.3%~142.7%;N+M和N+BC+M处理的nirK基因丰度没有显著差异 (p>0.05).由图 3d可知, nirS基因丰度在CK处理中的变化范围为1.1×109~2.1×109 copies·g-1.与CK处理相比, 各施肥处理的nirS基因丰度均显著增加 (p < 0.05), 变化范围分别为2.1×109~4.3×109(N)、3.3×109~6.4×109(N+BC)、2.4×109~4.6×109(N+M)、2.6×109~4.7×109(N+BC+M) copies·g-1.与N处理相比, N+BC处理显著增加nirS基因拷贝数, 增幅为57.4%~90.6%.nirS基因丰度在N、N+M和N+BC+M处理间差异不显著 (p>0.05).
由图 3e可以看出, 加入 (NH4)2SO4溶液后, CK处理的nosZ基因丰度变化范围为4.1×106~4.9×106 copies·g-1.各施肥处理的nosZ基因丰度均呈现先上升后降低的趋势, 峰值均出现在第14 d, 变化范围分别为1.5×107~2.7×107(N)、2.8×107~5.0×107(N+BC)、6.5×106~1.5×107(N+M) 和1.9×107~3.7×107(N+BC+M) copies·g-1.与N处理相比, N+M处理的nosZ基因丰度没有显著差异 (p>0.05), N+BC和N+BC+M处理均显著增加nosZ基因丰度, 增幅分别为82.8%~102.6%和15.1%~25.6%.
4 讨论 (Discussion) 4.1 施用生物炭和有机肥对相关功能基因丰度的影响在常规施N基础上添加生物炭显著提高了土壤AOB、AOA的amoA硝化基因和nirS、nirK、nosZ型反硝化基因丰度 (表 2、图 3, p < 0.05).首先, 生物炭的孔隙结构较大的内表面积为土壤微生物提供了有益环境, 可促进土壤微生物生长繁殖 (Steinbeiss et al., 2009);其次, 土壤pH是影响N循环相关微生物丰度的重要环境因子, 研究表明, 土壤pH值与amoA、nirK基因丰度之间存在显著相关性 (王晓辉等, 2013).本文中, 施用生物炭可有效缓解土壤酸化 (表 2), 调节土壤中氮素形态与含量的变化, 影响amoA、nirK、nirS和nosZ丰度;再次, 土壤SOC是影响硝化和反硝化菌丰度变化的主要环境因子, 土壤SOC含量与氨氧化古菌amoA基因 (方宇等, 2015) 和nosZ型反硝化基因 (Dambreavill et al., 2006) 丰度有着显著的相关性.菜地土壤施N量大, 在N含量较高的情况下, 施用生物炭为异养反硝化菌种群的生长提供代谢同化的底物 (Dambreville et al., 2006), 充足的碳施入提高了功能微生物活性, 增加了菜地土壤N相关功能基因丰度.
在常规施N基础上, 添加有机肥显著提高了nirK和nirS型反硝化基因丰度 (p < 0.05), 对amoA和nosZ丰度均没有显著影响 (表 2, p>0.05).该结果与前人的研究结果并不完全一致 (Hallin et al., 2009;王亚男等, 2015):长期施用有机肥会显著提高AOB及nirK型 (王亚男等, 2015)、nirS型 (尹昌等, 2010) 和nosZ型 (Hallin et al., 2009) 反硝化基因丰度.由本文结果可知, nirK和nirS型反硝化微生物丰度更易受到有机肥的影响, 可能原因是:① 有机肥会显著增加SOC含量 (表 2, p < 0.05), 为反硝化细菌的生长提供充足碳源 (Dambreville et al., 2006);② 有机肥能通过促进好氧微生物生长, 降低土壤中氧气 (O2) 分压, 为反硝化菌提供良好的厌氧环境 (Smith et al., 1997);③ 有机肥能提高土壤的缓冲性能, 减少干湿交替等环境胁迫对反硝化微生物的抑制作用 (Sharma et al., 2006).另外, 施用有机肥对amoA和nosZ型功能基因丰度影响并不显著, 这可能是由于amoA和nosZ基因丰度主要受pH值影响 (Enwall et al., 2007), 而本试验中施用有机肥对土壤pH影响不显著 (表 2, p>0.05).前人研究表明, 在酸性土壤施肥试验中, AOB、AOA丰度 (He et al., 2007;王亚男等, 2015)、nosZ基因丰度 (Liu et al., 2010) 和土壤pH相关性显著.因此, 有关有机肥施用对菜地土壤硝化、反硝化微生物的影响仍需进一步综合研究.
4.2 施用生物炭和有机肥对菜地土壤N2O排放的影响本文结果显示, 施用N肥会显著促进土壤N2O排放, 在常规施N基础上添加生物炭会显著降低菜地土壤N2O排放 (图 1), 该结果与Cayuela等 (2014)统计分析结果相一致, 其分析发现施用生物炭平均降低54%的农业生态系统N2O排放.首先, 常规施N基础上添加生物炭能提高土壤pH值 (表 2), 有效缓解菜地土壤酸化, 有研究表明, 生物炭的“石灰效应”可以通过影响土壤理化性质和微生物数量 (Cayuela et al., 2014) 进而影响土壤N2O排放.其次, 生物炭的分解性对土壤N2O排放也会产生影响, N+BC和N+M处理的SOC和TN含量均没有显著差异 (表 2), 但N+M处理的N2O累积排放量显著高于N+BC处理, 该结果表明, 生物炭稳定性高、难分解等特点降低了N+BC处理碳的有效性, 抑制土壤N2O排放 (Wang et al., 2015).再次, 土壤净N2O排放是由N2O的产生和还原作用共同决定的 (Baggs et al., 2010;Heuvel et al., 2011).由图 3可知, 施用生物炭会增加amoA (AOB和AOA) 基因丰度, 刺激nirS、nirK和nosZ型反硝化微生物生长, 且土壤N2O排放量与NH4+和NO3-含量呈现显著的相关性 (表 3).由上述结果可知, 施用生物炭通过改变微生物丰度影响酸性菜地土壤N2O排放途径有:① 通过增加amoA基因丰度, 加速硝化作用, 间接促进硝化作用中N2O的产生;② 通过刺激nirK和nirS型反硝化微生物生长, 促进NO2-还原为NO, 间接刺激反硝化作用中N2O产生;③ 施用生物炭促进单施氮肥土壤反硝化作用, 但增加的nosZ基因丰度能促进N2O还原为N2释放到大气中, 直接减少土壤N2O排放, 且有研究表明, nosZ基因表达水平是决定N2O转化为N2还是作为温室气体释放到大气中的关键因素 (Thomson et al., 2012).因此, 施用生物炭降低土壤N2O排放的微生物机理主要是通过增加nosZ基因丰度促进完全反硝化过程, 使得N2O转化为N2排放到大气中, 该结果与Zwieten等 (2010)和Harter等 (2014)在石灰性土壤中的研究结果相一致.
在常规施N基础上添加有机肥对菜地土壤N2O排放影响不显著 (图 1), 目前关于施用有机肥影响土壤N2O排放的报道较多, 但结论不一.Cai等 (2013)通过长期定位试验研究表明, 有机肥可提高氮肥利用率、降低土壤N2O排放.本文结果与孟磊等 (2008)长期定位试验研究结果一致, 其结果发现在单施无机氮肥基础上施用有机肥对华北典型潮土N2O排放没有显著影响.首先, 有机肥中氮素形态为有机态, 时效缓长的特点导致前期氮素供应能力不及单施化肥, N2O排放量低于单施氮肥, 但后期有机质的不断矿化能减缓土壤有效氮素的消耗, 为微生物硝化和反硝化作用提供了充足氮素, 促进土壤N2O产生.其次, 本研究发现, 在氮肥和生物炭配施基础上施用有机肥可显著降低土壤N2O累积排放量.有研究表明, 在等N条件下, 施用有机肥和化肥处理间N2O排放差异不显著, 此时N2O排放主要受外源碳供应水平的制约 (Chadwick et al., 2000).本实验中N+BC+M处理的SOC含量显著高于N+M处理, 有效缓解N+M处理中碳源短缺问题, 一定程度上降低土壤N2O累积排放量 (图 1).另外, N+M处理的N2O排放速率仅与NH4+含量相关性显著 (表 3), 而N+BC+M处理的N2O排放速率与NH4+和NO3-均显著相关, 表明在氮肥和生物炭基础上添加有机肥可促进土壤反硝化作用产生N2O, 但也会显著增加nosZ基因丰度, 促进N2O还原为N2, 进而表现为降低菜地土壤N2O排放.
5 结论 (Conclusions)1) 施用生物炭可显著提高土壤pH和SOC, 增加amoA、nirS和nirK基因丰度从而间接促进N2O排放, 同时增加nosZ基因丰度直接促进N2O还原, 综合效应表现为降低菜地土壤N2O排放.
2) 施用有机肥会显著增加nirK和nirS基因丰度, 对N2O减排效果并不显著.联合施用生物炭和有机肥能够增加AOB和nirK、nirS及nosZ型反硝化微生物丰度, 减少菜地土壤N2O排放, 以生物炭的减排效应为主.
| [${referVo.labelOrder}] | Arp D J, Stein L Y. 2003. Metabolism of inorganic N compounds by ammonia-oxidizing bacteria[J]. Critical Reviews in Biochemistry & Molecular Biology, 38(6) : 471–95. |
| [${referVo.labelOrder}] | Baggs E M, Smales C L, Bateman E J. 2010. Changing pH shifts the microbial sourceas well as the magnitude of N2O emission from soil[J]. Biology & Fertility of Soils, 46(8) : 793–805. |
| [${referVo.labelOrder}] | 鲍士旦. 2000. 土壤农化分析[M]. 北京: 中国农业出版社: 355–356. |
| [${referVo.labelOrder}] | Braker G, Conrad R. 2011. Diversity, structure and size of N2O-producing microbial communities in soils-what matters for their functioning?[J]. Advances in Applied Microbiology, 75 : 33–70. DOI:10.1016/B978-0-12-387046-9.00002-5 |
| [${referVo.labelOrder}] | Cai Y, Ding W, Luo J. 2013. Nitrous oxide emissions from Chinese maize-wheat rotation systems:A 3-year field measurement[J]. Atmospheric Environment, 65(65) : 112–122. |
| [${referVo.labelOrder}] | Cayuela M L, Zwieten L V, Singh B P, et al. 2014. Biochar's role in mitigating soil nitrous oxide emissions:A review and meta-analysis[J]. Agriculture Ecosystems & Environment, 191 : 5–16. |
| [${referVo.labelOrder}] | Chadwick D R, Pain B F, Brookman S K. 2000. Nitrous oxide and methane emissions following application of animal manures to grassland[J]. Journal of Environmental Quality, 29(29) : 277–287. |
| [${referVo.labelOrder}] | Daims H, Lebedeva E V, Pjevac P, et al. 2015. Complete nitrification by Nitrospira bacteria[J]. Nature, 528(7583) : 504–509. |
| [${referVo.labelOrder}] | Dambreville C, Hallet S, Nguyen C, et al. 2006. Structure and activity of the denitrifying community in a maize-cropped field fertilized with composted pig manure or ammonium nitrate[J]. Fems Microbiology Ecology, 56(1) : 119–131. DOI:10.1111/fem.2006.56.issue-1 |
| [${referVo.labelOrder}] | Ducey T F, Ippolito J A, Cantrell K B, et al. 2013. Addition of activated switchgrass biochar to an aridic subsoil increases microbial nitrogen cycling gene abundances[J]. Applied Soil Ecology, 65(2) : 65–72. |
| [${referVo.labelOrder}] | Enwall K, Nybery K, Bertilsson S. 2007. Long-term impact of fertilization on activity and composition of bacterial communities and metabolic guilds in agricultural soil[J]. Soil Biology Biochemistry, 39 : 106–115. DOI:10.1016/j.soilbio.2006.06.015 |
| [${referVo.labelOrder}] | 方宇, 景晓明, 王飞, 等. 2015. 长期施肥对氨氧化古菌丰度及群落结构的影响[J]. 植物营养与肥料学报, 2015, 21(6) : 1607–1614. DOI:10.11674/zwyf.2015.0628 |
| [${referVo.labelOrder}] | Food and Agriculture Organization (FAO).2015.FAOSTAT (Food and Agriculture Organization Statistical Data) Statistical Yearbook Vol.4[OL].2015-08-12.http://faostat.fao.org. |
| [${referVo.labelOrder}] | Francis C A, Roberts K J, Beman J M, et al. 2005. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences, 102(41) : 14683–14688. DOI:10.1073/pnas.0506625102 |
| [${referVo.labelOrder}] | Guo G X, Deng H, Qiao M, et al. 2011. Effect of pyrene on denitrification activity and abundance and composition of denitrifying community in an agricultural soil[J]. Environmental Pollution, 159(7) : 1886–1895. DOI:10.1016/j.envpol.2011.03.035 |
| [${referVo.labelOrder}] | 郭赟, 吴宇澄, 林先贵, 等. 2012. 3次连续重复提取DNA能较好反映土壤微生物丰度[J]. 微生物学报, 2012, 52(7) : 894–901. |
| [${referVo.labelOrder}] | Harter J, Krause H M, Schuettler S, et al. 2014. Linking N2O emissions from biochar-amended soil to the structure and function of the N-cycling microbial community[J]. Isme Journal Multidisciplinary Journal of Microbial Ecology, 8(3) : 660–674. |
| [${referVo.labelOrder}] | Hallin S, Lindgren P E. 1999. PCR Detection of genes encoding nitrite reductase in denitrifying bacteria PCR detection of genes encoding nitrite reductase in denitrifying bacteria[J]. Applied & Environmental Microbiology, 65(4) : 1652–1657. |
| [${referVo.labelOrder}] | Hallin S, Jones C M, Schloter M, et al. 2009. Relationship between ncycling communities and ecosystem functioning in a 50-year-old fertilization experiment[J]. The ISME Journal, 3(5) : 597–605. DOI:10.1038/ismej.2008.128 |
| [${referVo.labelOrder}] | He J Z, Shen J P, Zhang L M, et al. 2007. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices[J]. Environmental Microbiology, 9(9) : 2364–2374. DOI:10.1111/emi.2007.9.issue-9 |
| [${referVo.labelOrder}] | Heuvel R N V D, Bakker S E, Jetten M S M, et al. 2011. Decreased N2O reduction by low soil pH causes high N2O emissions in a riparian ecosystem[J]. Geobiology, 9(3) : 294–300. DOI:10.1111/gbi.2011.9.issue-3 |
| [${referVo.labelOrder}] | Jetten M S M. 2014. The microbial nitrogen cycle[J]. Frontiers in Microbiology, 5(11) : 2903–2909. |
| [${referVo.labelOrder}] | Jia J X, Li B, Chen Z Z, et al. 2012. Effects of biochar application on vegetable production and emissions of N2O and CH4[J]. Soil Science and Plant Nutrition, 58(4) : 1–7. |
| [${referVo.labelOrder}] | 贾仲君, 翁佳华, 林先贵, 等. 2010. 氨氧化古菌的生态学研究进展[J]. 微生物学报, 2010, 50(4) : 431–437. |
| [${referVo.labelOrder}] | Kloos K, Mergel A C, Bothe H. 2001. Denitrification within the genus Azospirillum and other associativebacteria[J]. Functional Plant Biology, 28(9) : 991–998. DOI:10.1071/PP01071 |
| [${referVo.labelOrder}] | Liu B, Tore M P, Åsa F, et al. 2010. Denitrification gene pools, transcription and kinetics of NO, N2O and N2 production as affected by soil pH[J]. Fems Microbiology Ecology, 72(3) : 407–417. DOI:10.1111/fem.2010.72.issue-3 |
| [${referVo.labelOrder}] | 孟磊, 蔡祖聪, 丁维新. 2008. 长期施肥对华北典型潮土N分配和N2O排放的影响[J]. 生态学报, 2008, 28(12) : 6197–6203. DOI:10.3321/j.issn:1000-0933.2008.12.050 |
| [${referVo.labelOrder}] | Qu Z, Wang J, Almøy T, et al. 2014. Excessive use of nitrogen in Chinese agriculture results in high N2O/(N2O+N2) product ratio of denitrification, primarily due to acidification of the soils[J]. Global Change Biology, 20(5) : 1685–1698. DOI:10.1111/gcb.2014.20.issue-5 |
| [${referVo.labelOrder}] | Rotthauwe J H, Witzel K P, Liesack W. 1997. The ammonia monooxygenase structural gene amoA as a functional marker:Molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied & Environmental Microbiology, 63(12) : 4704–4712. |
| [${referVo.labelOrder}] | Sharma S, Szele Z, Schilling R, et al. 2006. Influence of freeze-thaw stress on the structure and function of microbial communities and denitrifying populations in soil[J]. Applied and Environmental Microbiology, 72(3) : 2148–2154. DOI:10.1128/AEM.72.3.2148-2154.2006 |
| [${referVo.labelOrder}] | Smith K. 1997. The potential for feedback effects induced by global warming on emissions of nitrous oxide by soils[J]. Global Change Biology, 3(4) : 327–338. DOI:10.1046/j.1365-2486.1997.00100.x |
| [${referVo.labelOrder}] | Steinbeiss S, Gleixner G, Antonietti M. 2009. Effect of biochar amendment on soil carbon balance and soil microbial activity[J]. Soil Biology & Biochemistry, 41(6) : 1301–1310. |
| [${referVo.labelOrder}] | Taghizadeh Toosi A, Condron T J, Sherlock L M, et al. 2011. Biochar incorporation into pasture soil suppresses in situ nitrous oxide emissions from ruminant urine patches[J]. Journal of Environmental Quality, 40(2) : 468–476. DOI:10.2134/jeq2010.0419 |
| [${referVo.labelOrder}] | Thomson A J, Giannopoulos G, Pretty J, et al. 2012. Biological sources and sinks of nitrous oxide and strategies to mitigate emissions[J]. Philosophical Transactions of the royal Society of London, 367(1593) : 1157–1168. DOI:10.1098/rstb.2011.0415 |
| [${referVo.labelOrder}] | Wang C, Lu H, Dong D, et al. 2013. Insight into the effects of biochar on manure composting:evidence supporting the relationship between N2O emission and denitrifying community[J]. Environmental Science & Technology, 47(13) : 7341–7349. |
| [${referVo.labelOrder}] | Wang J Y, Xiong Z Q, Yan X Y, et al. 2011. Fertilizer-induced emission factors and background emissions of N2O from vegetable fields in China[J]. Atmospheric Environment, 45(38) : 6923–6929. DOI:10.1016/j.atmosenv.2011.09.045 |
| [${referVo.labelOrder}] | Wang J Y, Xiong Z Q, Kuzyakov Y. 2015. Biochar stability in soil:meta-analysis of decomposition and priming effects[J]. Global Change Biology Bioenergy, 8(3) : 512–523. |
| [${referVo.labelOrder}] | 王晓辉, 郭光霞, 郑瑞伦, 等. 2013. 生物炭对设施退化土壤氮相关功能微生物群落丰度的影响[J]. 土壤学报, 2013, 50(3) : 624–631. |
| [${referVo.labelOrder}] | 王亚男, 曾希柏, 王玉忠, 等. 2015. 施肥模式对设施菜地根际土壤微生物群落结构和丰度的影响[J]. 生态学杂志, 2015, 34(3) : 826–834. |
| [${referVo.labelOrder}] | 尹昌, 范分良, 李兆君, 等. 2012. 长期施用有机和无机肥对黑土nirS型反硝化菌种群结构和丰度的影响[J]. 环境科学学报, 2012, 33(11) : 3967–3975. |
| [${referVo.labelOrder}] | Zheng X, Han S, Huang Y, et al. 2004. Re-quantifying the emission factors based on field measurements and estimating the direct N2O emission from Chinese croplands[J]. Global Biogeochemical Cycles, 18(2) : 60–70. |
| [${referVo.labelOrder}] | Zwieten L V, Kimber S, Morris S, et al. 2010. Influence of biochars on flux of N2O and CO2 from Ferrosol[J]. Australian Journal of Soil Research, 48(6) : 555–568. |
 2017, Vol. 37
2017, Vol. 37


