2. 福建省污染控制与资源循环重点实验室 (福建师范大学), 福州 350007;
3. 英国兰卡斯特大学环境中心, 兰卡斯特LA1 2YW
2. Fujian Key Laboratory of Pollution Control and Resource Recycling (Fujian Normal University), Fuzhou 350007;
3. Lancaster Environment Center, Lancaster University, Lancaster LA1 2YW, United Kingdom
水体富营养化和藻类水华仍然是全球共同面临的重大水环境问题之一 (Brookes et al., 2011).世界范围内,大多数富营养化水体属于磷限制型,即磷元素是调控富营养化水体的限制性因子 (Schindler et al., 2008).在天然水体中, 大部分磷存在于沉积物中,沉积物中的磷是湖泊水体中磷的重要源和汇,与湖泊富营养化密切相关 (Huang et al., 2005; Marguerite et al., 2009).例如,在湖泊水库中,沉积物中的磷在整个水域中占据了很大的比例,特别是浅水湖泊,可构成整个湖泊磷负荷的60%~80% (Bai et al., 2009).
沉积物-水界面是由沉积物和水体两相组成的特殊环境边界,是天然水域沉积物和上覆水进行物质频繁交换的一个相对特殊的界面,对上覆水营养盐的释放和贮存都有重要的作用 (Penn et al., 1995).沉积物-水界面是微藻复苏增殖的重要场所,在环境因子适宜和营养盐充足的情况下,藻类可快速复苏增殖并上升至表层水,进而导致水华暴发.Xie等 (2003)在东湖设置野外围隔实验,以探究沉积物和水体之间的磷交换是否会对微囊藻水华产生影响,结果表明,沉积物大量释放的磷经水界面进入水体可以诱导水体中微囊藻水华的发生.Wang等 (2016)对太湖梅梁湾沉积物-水界面磷释放研究发现,沉积物-水界面磷的释放对湖泊藻类水华的形成有一定促进作用.在自然界中,沉积物和水体中的磷主要以无机磷和有机磷2种形态存在,一般研究认为,无机磷被认为是可以被大多数藻类直接利用 (Cotner et al., 1992),而近些年研究也表明,部分有机磷也能在无机磷缺乏的情况下被藻类利用.如有研究者使用不同有机磷研究东海原甲藻生长的影响发现,藻类可以通过分泌磷酸酶对有机磷进行分解加以利用,并且产生的磷酸酶活性与不同有机磷种类有关 (Huang et al., 2005);Koch等 (2009)对佛罗里达湾含有有机磷的水域研究发现,水华暴发仍存在一定的风险;Cao等 (2005)对武汉东湖多种藻类生长调查发现,藻类或者细菌可以通过分泌胞外碱性磷酸酶对有机磷进行利用.同时研究也发现,藻类对不同形态磷的利用存在差异性.Bill等 (2015)对K.Brevis(短凯伦藻) 和K.Mikimotoi(米氏凯伦藻) 进行了多种无机磷和有机磷培养研究发现,2种藻的生长状况在不同形态磷下差异较大;Bai等 (2014)利用4种有机磷对蓝藻中的Cylindrospermopsis raciborskii(纳氏拟筒孢藻) 分别培养发现,该藻在培养期内增长情况和磷酸酶活性等生理活动在不同形态有机磷中差异较为明显;Wang等 (2011)将5种常见水华暴发种在9种有机磷中进行培养,不同藻对最适磷源的响应有差别.以上研究均揭示藻类对不同磷的利用具有选择性,即不同磷形态对不同藻促进作用不同.自然界沉积物中存在的不同形态磷,其释放后是否改变水体浮游植物群落结构,进而促进水体中优势藻种暴发水华,有必要对其进行研究.
本研究通过实验室模拟,首先用纯的有机磷 (单磷酸腺苷, AMP) 和无机磷 (NaH2PO4·2H2O) 对采集于九龙江的样品进行培养实验,而后采用鲜沉积物、野外原水及SMT方法提取野外采集的沉积物中总磷来探究不同培养下浮游植物群落结构及丰度变化,比较特定磷源和磷供给方式对藻类丰度及群落结构影响,识别不同形态磷对浮游植物影响差异,为富营养化水体水华预警和调控提供理论依据.
2 材料与方法 (Materials and methods) 2.1 不同形态磷来源沉积物和水样于2015年10月18日采集于九龙江北溪西陂水库,考虑到九龙江西陂库区是河道型库区,本湖泊区 (X1~X7) 为湖泊型库区,X3点位 (25°07′19.99″N,117°31′37.60″E) 位于库区中间,离大坝300 m,更具有代表性,实验采用X3点位采集的样品进行研究.使用彼得森采泥器 (Peterson grab sampler) 采取表层沉积物样品,将表层沉积物置于洁净的聚乙烯盆中混匀,迅速装入标有采样时间、点位记号的自封袋中,排尽袋中空气,进行密封避光保存.采集1 L水样,按水样体积的1.5%添加鲁格氏碘液进行固定,用于分析水体浮游植物群落结构与丰度情况.所有样品均装入放有冰块的保温箱中,带回实验室后,尽快处理.
野外采集的原始水体藻类丰度为7.2×104 cells·L-1,以硅藻、绿藻、蓝藻为主,分别占藻类丰度的49.16%、32.40%、17.32%.鲜沉积物各形态磷含量见表 1.实验所用培养液为f/2去硅培养液 (Guillard et al., 1962).沉积物总磷的分离和获取根据欧洲发展框架委员会推荐的SMT法 (Ruban et al., 1999; 2001), 分离步骤为:取1.25 g湿沉积物放置于坩埚内,在450 ℃马弗炉中灰化3 h,取出后冷却至室温,提取的为总磷,即SMT-TP.
| 表 1 九龙江北溪西陂水库X3点位不同形态磷含量 Table 1 Phosphorus forms of sampling points X3 of Xipi reservoir in Jiulong River |
实验设置纯磷样:无机磷 (NaH2PO4·2H2O)、有机磷 (单磷酸腺苷,AMP);沉积物样:沉积物总磷 (SMT-TP)、野外原水 (OW)、新鲜沉积物 (Sediment)、无添加磷对照组 (NP) 样品.在沉积物实验中,为确保磷充分过量,添加沉积物磷时根据每克湿沉积物磷形态含量, 以f/2培养液P含量的2倍 (约0.4 mg P) 进行添加.实验样品放置于250 mL锥形瓶中培养20 d,每个样品体积为200 mL并在生化培养箱中进行,每个培养组设置2组平行.培养条件为:光照:黑暗为12 h:12 h,光照度2400 lx,温度20 ℃,各实验组培养基设置及样品添加量见表 2.
| 表 2 不同处理条件设置 Table 2 The experimental conditions of different treatments |
总磷 (TP)、活性磷 (SRP) 测定:于实验开始第0、5、10、15、20 d取1 mL上层培养液,采用磷钼蓝分光光度法 (国家环境保护总局, 2002) 测定.
浮游植物群落结构与丰度测定:取5 mL上层培养液,离心浓缩至1 mL,按样品体积的1.5%添加鲁格试剂固定,完成预处理.后期取已完成预处理的样品0.1 mL置于0.1 mL (20 mm×20 mm) 的计数框内,在生物显微镜下,以10×40倍进行观察计数,按照章宗涉等 (1991)的图谱对各种藻类进行判定.采用视野法,计算上层培养液的藻类丰度,最后将其换算成细胞丰度,计算公式为:
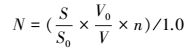
|
式中,N为细胞丰度 (cells·L-1);S为计数框面积 (mm2);S0为计数视野面积 (mm2);V0为浓缩后体积 (mL);V为计数体积 (mL);n为计数所得平均每个视野藻类数目 (cells).
3 结果 (Results) 3.1 纯磷样品对沉积物-水界面浮游植物影响 3.1.1 纯磷样品SRP与TP变化无机磷和有机磷作为磷源培养时,培养液中SRP、TP浓度随着培养时间的变化见图 1.由图 1可知, 无机磷作为磷源时, 培养液中SRP、TP浓度随培养时间的增加呈现缓慢减少的趋势,表明藻类的生长增殖可直接利用培养液中的磷源.有机磷作为磷源培养藻类时,培养液TP浓度也随着培养时间增加呈现缓慢减少的趋势,然而培养液中SRP浓度却呈现先下降而后上升,于第10 d达到最高值,随之呈现缓慢下降趋势.
 |
| 图 1 无机磷和有机磷培养组中SRP (a) 和TP (b) 浓度变化趋势 Fig. 1 The change trend of SRP (a) and TP (b) in the culture medium |
有学者对有机磷营养盐与藻类生长的关系进行了研究,发现在无机磷缺失的条件下,有些藻类能够利用有机磷来维持自身的生长 (Llebot et al., 2010; Yamamoto et al., 2002).图 1产生磷利用差异的原因可能是由于无机正磷酸盐可被浮游植物直接吸收利用,并且是浮游植物最先吸收的部分 (Cotner et al., 1992),因此,以无机磷作为磷源时,藻类通过大量增殖消耗培养液中的磷,导致水体中SRP和TP浓度持续下降.有机磷作为磷源时,大量藻类难以直接利用,藻类开始利用自身储存的磷源继续保持生长,进而水体中的SRP呈现下降的趋势,而在培养后期培养液中SRP浓度大大增加,这是由于浮游植物在磷胁迫条件下将有机磷转化为可利用的无机磷 (Zhang et al., 2002; Huang et al., 2005; 杨维东等,2008; Wang et al., 2011).在自然界一些磷营养盐不高或无机磷缺失的水体中,水体中的一些藻类或细菌能够通过分泌胞外磷酸酶分解吸附的有机磷,将其转化为可直接利用的无机磷以促进自身生长.这些能有效利用某些有机磷的藻类相比于无机磷较丰富的水域,由于缺乏其他藻种的竞争,更容易大量繁殖而成为优势藻种 (Canellas et al., 2000; Moutin et al., 2005; Koch et al., 2009).
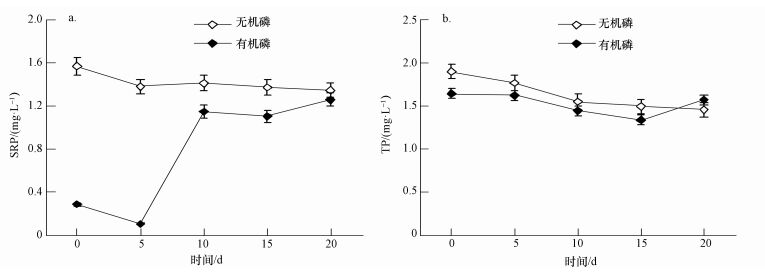
3.1.2 藻类群落结构和丰度变化原始水体藻类丰度为7.20×104 cells·L-1,以硅藻、绿藻、蓝藻为主,分别占藻类丰度的49.16%、32.40%、17.32%.以无机磷作为磷源的培养组,随着培养时间的增加,藻类丰度持续上升,在培养20 d后达到7.21×106 cells·L-1,群落结构转化为以蓝藻、绿藻为主,分别占藻类丰度的76.67%、23.34%(图 2a).而以有机磷作为磷源的培养组,其藻类丰度变化趋势和无机磷培养组相似 (图 2b),丰度逐渐增高,在培养20 d后其丰度达到3.43×106 cells·L-1,但浮游植物群落结构转化为以绿藻为主,绿藻中的栅藻 (Scenedesmus)、月牙藻 (Selenastrum bibraianum) 等逐渐成为培养液中的优势种,绿藻所占藻类丰度比例高达92.51%.
 |
| 图 2 两培养组藻类丰度及群落结构变化 (a.NaH2PO4·2H2O, b.AMP) Fig. 2 The change of algae abundance and Phytoplankton Community in two culture media (a.NaH2PO4·2H2O, b.AMP) |
实验室用纯的无机磷和有机磷作为单一磷源时,藻类的丰度情况类似,均能很好地促进藻类增殖生长,但二者对浮游植物群落结构演替存在差异性.无机磷为磷源时,群落结构以蓝藻和绿藻为主;而以有机磷作为磷源培养时,浮游植物群群落结构则以绿藻为优势种,说明无机磷能更好地促进蓝藻和绿藻生长,有机磷则能有效地促进绿藻的增殖和生长.
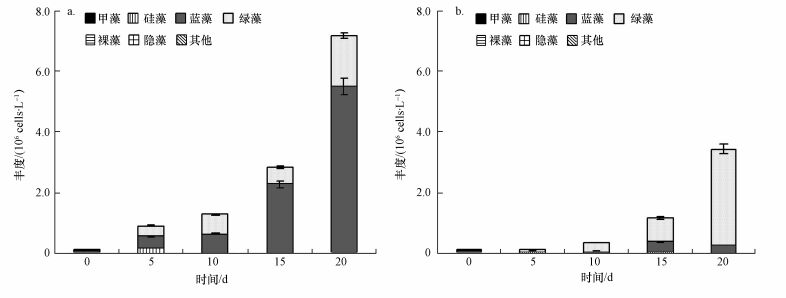
3.2 沉积物磷对沉积物-水界面浮游植物影响 3.2.1 SRP与TP变化沉积物磷培养实验中,各培养组SRP整体变化趋势一致,表现为前5 d下降,在第5~10 d SRP浓度保持在相对低值,随后至第15 d SRP浓度保持上升,最后基本保持稳定 (图 3a).各培养组上清液TP变化趋势因组而异 (图 3b),其中,NP、OW、Sediment 3组培养液中TP浓度先增加,于第5 d到达最高值,随后下降,而后又上升.而SMT-TP组培养液TP从培养初期到第10 d不断下降,在第10~15 d时,培养液中TP浓度又随之上升,最后又下降.
 |
| 图 3 各培养组SRP (a) 和TP (b) 浓度变化趋势 Fig. 3 The change of SRP (a) and TP (b) in the culture medium |
NP、OW、Sediment作为磷源培养组,NP培养组TP和SRP在培养前期均下降,但SRP下降更明显,其原因可能是无磷添加组中藻类本身吸收和自带了一些磷源可以暂时满足生长中磷需求;OW培养组则由于原位水中本身含有磷,能够促进藻类的增殖,而鲜沉积物组上清液TP从实验开始到第5 d逐渐升高,SRP下降,主要是因为培养条件下,加快了沉积物中微生物新陈代谢等活动,促进了沉积物中磷向上清液的转化和释放,培养液中藻类吸收水体中较容易利用的SRP大量繁殖,导致培养液中SRP浓度降低.SMT-TP组SRP、TP呈现出先下降后上升最后保持不变的状态.其原因是磷源经过SMT实验处理,破坏了沉积物中磷的原始形态,破坏了沉积物中磷的原始形态和微生物生化作用环境.
3.2.2 浮游植物群落结构及丰度变化培养初期硅藻、绿藻、蓝藻所占比例分别为49.16%、32.40%、17.32%,NP培养组藻类丰度在实验期内呈现增长趋势,藻类丰度从初期的7.2×104 cells·L-1增加到最后的5.00×105 cells·L-1,群落结构演替为以蓝藻 (63.3%)、绿藻 (36.4%) 为主 (图 4a).SMT-TP组随着培养时间的增加,沉积物磷慢慢释放到水体中,藻类丰度基本上保持在1.57×105 cells·L-1,藻类群落结构从硅藻、绿藻、蓝藻演替以为蓝藻 (63.1%)、绿藻 (36.4%) 为主 (图 4b).原水培养介质中,OW培养组中的藻类丰度先随着培养时间的增长而增加,直至第10 d后,藻类丰度减少,群落结构由初期硅藻占据优势,随着培养时间逐渐演替为蓝藻 (61.2%)、绿藻 (37.3%) 占优势,硅藻 (13.8%) 比例降低 (图 4c);Sediment培养组中,藻类丰度随着培养时间的进行呈现先增大而后下降的趋势,在培养的第5 d,培养液中SRP浓度达到最低值,TP浓度则达到最高值,也就是说沉积物磷大量释放到水体,因此,藻类丰度在培养第10 d达到最大值,为1.42×106 cells·L-1(图 4d).浮游植物群落结构最终转变为以蓝藻 (71.8%) 为主,绿藻细胞密度较低,但藻种种类较多,包括栅藻 (Scemdesmus)、月牙藻 (Selenastrum bibraianum)、小球藻 (Chlorella)、多芒藻 (Golenkinia) 等常见藻.
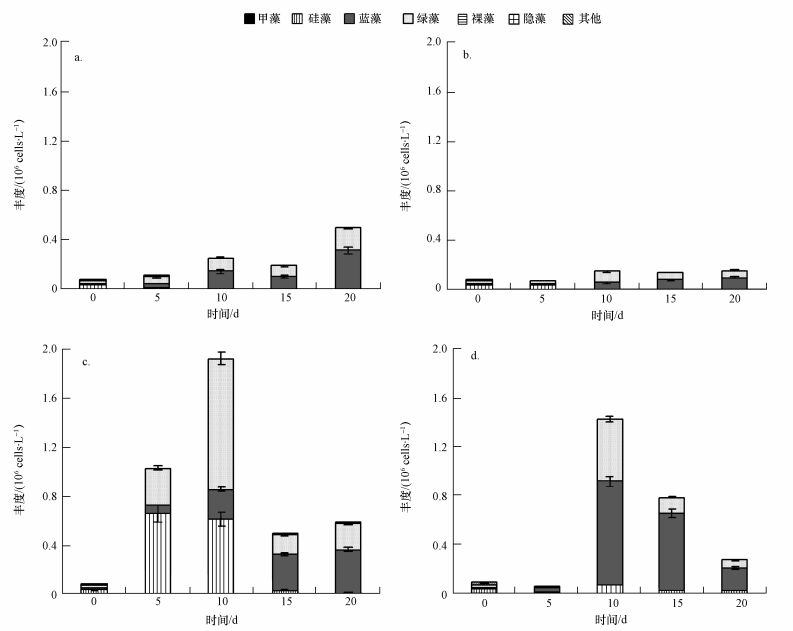 |
| 图 4 各培养组培养液中浮游植物情况 (a.NP, b.SMT-TP, c.OW, d.Sediment) Fig. 4 The growth of phytoplankton in each culture medium (a.NP, b.SMT-TP, c.OW, d.Sediment) |
OW培养组和Sediment培养组藻类丰度先随着培养时间的增长而增加,后开始慢慢减少,其原因有可能是OW和Sediment中本身含有一定浓度的磷以供藻类增殖生长,但藻类大量增殖后导致水体中营养盐胁迫,限制了藻类的继续大量生长.SMT-TP组相比于其他组藻类丰度较低, 其原因是除了磷在SMT实验处理后形态改变使磷难以有效被微藻吸收,更重要的是,Sediment或OW中不仅保存着部分原来的生存环境和部分藻种源,同时含大量原始微生物,在培养的过程中,沉积物中的微生物在合适的条件下通过分解活动促使沉积物中磷的释放 (Bill et al., 2015),进而为藻类提供必要的磷源.
4 讨论 (Discussion)不同形态磷对浮游植物生长的利用效果随着藻种类的不同而有着明显的区别,即磷形态的不同影响藻类的增殖生长,进而影响水体系统浮游植物群落结构的变化 (Bai et al., 2014; 赵艳芳等, 2009).在自然界水体中,蓝藻和绿藻均容易演变成浮游植物群落结构中的优势种,而水华的爆发不仅与藻类的丰度有关,还与其群落结构有关.本研究中纯有机磷和无机磷实验表明,无机磷条件下更容易促进蓝藻增殖,而在沉积物实验SMT-TP组中群落结构演替也同样表现出这种特性,这与沉积物无机磷比例高的湖泊更容易爆发蓝藻水华保持一致 (黎睿等, 2015).部分报道指出,蓝藻可在无机磷缺乏的情况下部分地吸收有机磷 (卢玮等,2015),而实验中绿藻能够在以AMP为有机磷下快速增殖生长,并且在群落结构中演替为优势种,蓝藻则未表现出这种特质,说明绿藻在无机磷缺失的情况下比硅藻和蓝藻利用有机磷的能力更强.研究表明,绿藻能够在无机磷缺失的情况下通过分泌孢外碱性磷酸酶或者与水体细菌等微生物协同进行利用有机磷以满足自身生长的磷需求 (Cao et al., 2005; Bill et al., 2015),绿藻的这种特性暗示着在有机质含量高的水域更容易形成以绿藻为优势种的群落结构.
已有研究表明,N:P比值会影响浮游植物丰度和群落结构变化 (孙凌等, 2006; Jaanus et al., 2003;Piehler et al., 2002),硅藻在N:P比较高的环境下容易成为优势种 (Billen et al., 1985; Escaravage et al., 1996);Hodgkiss等 (1997)指出,淡水中硅含量较低时,蓝藻在低氮磷比下占优势,绿藻在高氮磷比下占优势;也有研究认为,在氮磷浓度均充足的情况下,N:P比值不会对2种藻的生长产生影响 (许海等,2011).本文中无机磷组和SMT-TP组在N:P为20:1及10:1的情况下群落结构均演变为以蓝藻占优势,同时无机磷比重较大的Sediment组也表现同样结果,而有机磷组N:P比值与无机磷组同为20:1时群落结构演替为绿藻为优势种 (表 3),说明不同形态磷对浮游植物群落结构的影响相比其他因素可能更为重要.
| 表 3 不同磷形态下浮游植物群落结构和SRP/TP Table 3 Phytoplankton community structure under different phosphorus forms |
在沉积物实验中,尽管SMT-TP组和Sediment组总磷添加量比OW组和NP组多,但实验结束时藻类的丰度并不比后两组高,其原因是SRP/TP值比后两者低 (表 3).本研究中,Sediment培养组藻类丰度较高,群落结构中硅藻比例减少但仍然存在,OW培养介质中也存在一定数量的硅藻 (表 3).同时,Sediment培养组实验初始时镜检到的藻种在该培养组后期中大部分仍可镜检到,如蓝藻门的微囊藻 (Microcystis),绿藻门的栅藻 (Scemdesmus)、月牙藻 (Selenastrum bibraianum)、小球藻 (Chlorella)、多芒藻 (Golenkinia),以及硅藻门的直链藻属 (Melosira)、针杆藻属 (Synedra) 及小环藻属 (Cycloella),而无机磷组和AMP组各形态磷培养下几乎难以看到硅藻存在,且藻种单一,NP组和SMT-TP组培养介质中硅藻也趋于消失,说明天然沉积物对于水中藻类群落具有一定的调控作用.
5 结论 (Conclusions)1) 以纯无机磷和有机磷分别作为磷源对采自九龙江北溪西陂库区沉积物-水界面样品进行增殖培养,两培养组藻类生长较快,无机磷培养组中浮游植物群落结构由初始时硅藻、绿藻、蓝藻为主演替为以蓝藻、绿藻为主;有机磷作为磷源培养时浮游植物群落结构则演替为以绿藻为主.沉积物实验SMT-TP组中群落结构同样演替为以蓝藻、绿藻为主,说明无机磷能有效促进蓝藻、绿藻生长,绿藻则在无机磷缺失的情况下比硅藻和蓝藻利用有机磷的能力更强.
2) 无机磷组和SMT-TP组在N:P为20:1及10:1的情况下群落结构均演变为以蓝藻占优势,同时,无机磷比重较大的Sediment组也呈现同样的结果,而有机磷组与无机磷组N:P比同为20:1时群落结构演替为绿藻为优势种,说明不同形态磷对浮游植物群落结构的影响相比其他因素可能更为重要.
3) 在鲜沉积物培养条件下藻类丰度较高,种类较多,硅藻仍然存在,原水培养介质中也存在硅藻,而无机磷和有机磷形态及SMT-TP组中硅藻均逐渐消失,反映了天然沉积物对于水中藻类群落具有一定的调控作用.
| [${referVo.labelOrder}] | Bai F, Liu R, Yang Y J, et al. 2014. Dissolved organic phosphorus use by the invasive freshwater diazotroph cyanobacterium, Cylindrospermopsis raciborskii[J]. Harmful Algae, 39 : 112–120. DOI:10.1016/j.hal.2014.06.015 |
| [${referVo.labelOrder}] | Bai X, Ding S, Fan C, et al. 2009. Organic phosphorus species in surface sediments of a large, shallow, eutrophic lake, Lake Taihu, China[J]. Environmental Pollution, 157(8) : 2507–2513. |
| [${referVo.labelOrder}] | Bill R, Corcoran A A. 2015. Use of dissolved inorganic and organic phosphorus by axenic and nonaxenic clones of Karenia brevis and Karenia mikimotoi[J]. Harmful Algae, 48 : 30–36. DOI:10.1016/j.hal.2015.06.005 |
| [${referVo.labelOrder}] | Billen G, Somville M, Becker E D, et al. 1985. A nitrogen budget of the Scheldt hydrographical basin[J]. Netherlands Journal of Sea Research, 19(3/4) : 223–230. |
| [${referVo.labelOrder}] | Brookes J D, Carey C C. 2011. Resilience to blooms[J]. Science, 334(6052) : 46–47. DOI:10.1126/science.1207349 |
| [${referVo.labelOrder}] | Cao X Y, Strojsova A, Znachor P. 2005. Detection of extracellular phosphatases in natural spring phytoplankton of a shallow eutrophic lake (Donghu, China)[J]. European Journal of Phycology, 40(3) : 251–258. DOI:10.1080/09670260500192760 |
| [${referVo.labelOrder}] | Cañellas M, Agustí S, Duarte C M. 2000. Latitudinal variability in phosphate uptake in the central Atlantic[J]. Marine Ecology Progress Series, 194(1) : 283–294. |
| [${referVo.labelOrder}] | Cotner J B, Wetzel R G. 1992. Uptake of dissolved inorganic and organic phosphorus compounds by phytoplankton and bacterioplankton[J]. Limnology and Oceanography, 37(2) : 232–243. DOI:10.4319/lo.1992.37.2.0232 |
| [${referVo.labelOrder}] | Escaravage V, Prins T C, Smaal A C, et al. 1996. The response of phytoplankton communities to phosphorus input reduction in mesocosm experiments[J]. Journal of Experimental Marine Biology & Ecology, 198(1) : 55–79. |
| [${referVo.labelOrder}] | Guillard R R, Ryther J H. 1962. Studies of marine planktonic diatoms[J]. I.Cyclotella nana Hustedt, and Detonula confervacea(cleve) Gran[J].Canadian Journal of Microbiology, 8(2) : 229–239. |
| [${referVo.labelOrder}] | 国家环境保护总局. 2002. 水和废水监测分析方法[M]. 北京: 中国环境科学出版社. |
| [${referVo.labelOrder}] | Huang B Q, Ou L J, Hong H S, et al. 2005. Bioavailability of dissolved organic phosphorus compounds to typical harmful dinoflagellate Prorocentrum donghaiense Lu[J]. Marine Pollution Bulletin, 51 : 838–844. DOI:10.1016/j.marpolbul.2005.02.035 |
| [${referVo.labelOrder}] | Hodgkiss I J, Ho K C. 1997. Are changes in N:P ratios in coastal waters the key to increased red tide blooms?[J]. Hydrobiologia, 352(1/3) : 141–147. DOI:10.1023/A:1003046516964 |
| [${referVo.labelOrder}] | Jaanus A, Pellikka K. 2003. Does excessive phosphorus necessarily cause increasing biomass of diazotrophic cyanobacteria?[J]. Proceedings of the Estonian Academy of Sciences, Biology, Ecolog, 52(3) : 205–217. |
| [${referVo.labelOrder}] | Koch M S, Kletou D C, Tursi R. 2009. Alkaline phosphatase activity of water column fractions and seagrass in a tropical carbonate estuary, Florida Bay, Estuarine[J]. Coastal and Shelf Science, 83 : 403–413. DOI:10.1016/j.ecss.2009.04.007 |
| [${referVo.labelOrder}] | Llebot C, Spitz Y H, Solé J, et al. 2010. The role of inorganic nutrients and dissolved organic phosphorus in the phytoplankton dynamics of a Mediterranean bay:A modeling study[J]. Journal of Marine Systems, 83(3) : 192–209. |
| [${referVo.labelOrder}] | 黎睿, 王圣瑞, 肖尚斌, 等. 2015. 长江中下游与云南高原湖泊沉积物磷形态及内源磷负荷[J]. 中国环境科学, 2015, 35(6) : 1831–1839. |
| [${referVo.labelOrder}] | 卢玮, 庄惠如, 翁笑艳, 等. 2015. 山仔水库两种水华蓝藻磷营养动力学特征[J]. 福建师范大学学报 (自然科学版), 2015, 31(5) : 70–75. |
| [${referVo.labelOrder}] | Moutin T, Broeck V D B, Beker B, et al. 2005. Phosphate availability controls Trichodesmium spp[J]. biomass in the SW Pacific Ocean[J].Marine Ecology Progress Series, 297(1) : 15–21. |
| [${referVo.labelOrder}] | Penn M R, Auer T, Van Orman E, et al. 1995. Phosphorus diagenesis in lake sediments:investigations using fractionation techniques[J]. Marine and Freshwater Research, 46(1) : 89–99. |
| [${referVo.labelOrder}] | Pettersson K, Herlitz E, Istvánovics V. 1993. The role of Gloeotrichia echinulata in the transfer of phosphorus from sediments to water in Lake Erken[J]. Hydrobiologia, 253(1) : 123–129. |
| [${referVo.labelOrder}] | Pettersson K. 1998. Mechanisms for internal loading of phosphorus in lakes[J]. Hydrobiologia, 373 : 21–25. |
| [${referVo.labelOrder}] | Piehler M F, Dyble J, Moisander P H, et al. 2002. Effects of modified nutrient concentrations and ratios on the structure and function of the native phytoplankton community in the Neuse River Estuary, North Carolina, USA[J]. Aquatic Ecology, 36(3) : 371–385. DOI:10.1023/A:1016529015349 |
| [${referVo.labelOrder}] | Ruban V, Brigault S, Demare D, et al. 1999. An investigation of the origin and mobility of phosphorus in freshwater sediments from Bort-Les-Orgues Reservoir, France[J]. Journal of Environmental Monitoring, 1(4) : 403–407. DOI:10.1039/a902269d |
| [${referVo.labelOrder}] | Ruban V, López Sánchez J F, Pardo P, et al. 2001. Harmonized protocol and certified reference material for the determination of extractable contents of phosphorus in freshwater sediments-A synthesis of recent works[J]. Fresenius' Journal of Analytical Chemistry, 370(2/3) : 224–228. |
| [${referVo.labelOrder}] | Schindler D W, Hecky R E, Findlay D L, et al. 2008. Eutrophication of lakes cannot be controlled by reducing nitrogen input:results of a 37-year whole-ecosystem experiment[J]. Proceedings of the National Academy of Sciences of the United States of America, 105(32) : 11254–11258. DOI:10.1073/pnas.0805108105 |
| [${referVo.labelOrder}] | Spears B M, Carvalho L, Perkins R, et al. 2012. Long term variation and regulation of internal phosphorus loading in Loch Leven[J]. Hydrobiologia, 681 : 23–33. DOI:10.1007/s10750-011-0921-z |
| [${referVo.labelOrder}] | Wang J, Jiang X, Zheng B, et al. 2016. Effect of algal bloom on phosphorus exchange at the sediment-water interface in Meiliang Bay of Taihu Lake, China[J]. Environmental Earth Sciences, 75(1) : 1–9. DOI:10.1007/s12665-015-4873-x |
| [${referVo.labelOrder}] | Wang Z H, Liang Y, Kang W. 2011. Utilization of dissolved organic phosphorus by different groups of phytoplankton taxa[J]. Harmful Algae, 12 : 113–118. DOI:10.1016/j.hal.2011.09.005 |
| [${referVo.labelOrder}] | Xie L Q, Xie P, Tang H J. 2003. Enhancement of dissolved phosphorus release from sediment to lake water by Microcystis blooms-an enclosure experiment in a hyper-eutrophic, subtropical Chinese lake[J]. Environmental Pollution, 122(3) : 391–399. DOI:10.1016/S0269-7491(02)00305-6 |
| [${referVo.labelOrder}] | 许海, 朱广伟, 秦伯强, 等. 2011. 氮磷比对水华蓝藻优势形成的影响[J]. 中国环境科学, 2011, 31(10) : 1676–1683. |
| [${referVo.labelOrder}] | Yamamoto T, Hashimoto T, Tsuji K, et al. 2002. Spatial and temporal variations of biophilic elements in Hiroshima Bay, Japan, during 1991-2000, with special reference to the deviation of phytoplanktonic C:N:P ratio from the redfield ratio[J]. Bulletin on Coastal Oceanography, 39 : 163–169. |
| [${referVo.labelOrder}] | 杨维东, 钟娜, 刘洁生, 等. 2008. 不同磷源及浓度对利玛原甲藻生长和产毒的影响研究[J]. 环境科学, 2008, 29(10) : 2760–2765. DOI:10.3321/j.issn:0250-3301.2008.10.012 |
| [${referVo.labelOrder}] | Yuan H Z, Shen J, Liu E F, et al. 2011. Assessment of nutrients and heavy metals enrichment in surface sediments from Taihu Lake, a eutrophic shallow lake in China[J]. Environmental Geochemistry & Health, 33(1) : 67–81. |
| [${referVo.labelOrder}] | 章宗涉, 黄祥飞. 1991. 淡水浮游生物研究方法[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | Zhang M, Shi X L, Jiang L J, et al. 2002. Effects of two exogenous phosphorus and shake on the growth of Microcystis aeruginosa[J]. Journal of Application and Environmental Ecology, 8(5) : 507–510. |
| [${referVo.labelOrder}] | 赵艳芳, 俞志明, 宋秀贤, 等. 2009. 不同磷源形态对中肋骨条藻和东海原甲藻生长及磷酸酶活性的影响[J]. 环境科学, 2009, 30(3) : 693–699. |
 2017, Vol. 37
2017, Vol. 37


