2. 慈溪市留学人员创业服务中心, 慈溪 315302;
3. 浙江省水体污染控制与环境安全技术重点实验室, 杭州 310029
2. Innovation Service Center of Cixi, Cixi 315302;
3. Key Laboratory of Water Pollution Control and Environmental Safety Technology, Hangzhou 310029
壬基酚 (Nonylphenol,NP) 是常用的工业抗氧化剂,润滑油的添加剂,也是合成最广泛使用的非离子表面活性剂壬基酚聚氧乙烯醚 (Nonylphenol ethoxylates,NPEOs) 的原料 (Eganhouse et al., 2009).NP是主要由对位壬基酚 (p-Nonylphenol,p-NP) 组成的具有100多种同分异构体的混合物,其分子式为C9H19C6H4OH,正辛醇-水分配系数 (lgKow) 为4.48,是典型的疏水性有机污染物 (Hydrophobic Organic Contaminant,HOCs),也是最具代表性的内分泌干扰物 (Endocrine Disrupting Chemicals,EDCs),具有雌激素效应 (Lu et al., 2014).NP具有广泛的生物毒性,能影响土壤微生物 (Gejlsbierg et al., 2001)、水生生物 (安敏等,2006)、陆生动植物 (Gejlsbierg et al., 2001) 的正常生长,甚至影响人的大脑发育和神经系,最终影响人类生命活动 (应锋,2014).因此,我国在2011年将NP加入有毒物质限制名单,严格禁止NP的进出口 (熊杰等,2014).联合国环境保护署 (UNEP) 和欧盟水框架指令 (WFD) 也将NP划定为优先污染物.
已有研究表明,环境中的NP约10%分布在土壤中,25%存在于水相中,还有大于60%分布于沉积物中 (Soares et al., 2008).据统计,世界范围内水环境中上覆水NP浓度范围为ND~4100 ng· L-1(Chen et al., 2010;Duong et al., 2010;Vethaak et al., 2005),沉积物NP含量范围为ND~32000 ng· g-1(Kawahata et al., 2004;Stewart et al., 2014).NP结构稳定,在自然沉积物环境中降解缓慢,半衰期长达46.2~69.3 d,而经驯化后的微生物对NP的降解能力则显著增强 (Chang et al., 2004).目前研究者从土壤、沉积物和污水处理厂的活性污泥中分离得到多种NP降解菌,主要有假单胞菌属 (Pseudomonas)(Soares et al., 2008)、鞘氨醇单胞菌属 (Sphingomonas)(Gabriel et al., 2008)、鞘脂菌属 (Sphingobium amiense)(Ushiba et al., 2003) 等,证实了微生物降解途径在NP污染环境修复中的重要作用.
但鉴于NP是100多种同分异构体的混合物,一些研究认为不同NP异构体的降解特性可能与其结构特征有关.Gabriel等 (2008)研究了Sphingobium xenophagum Bayram对NP异构体的降解情况,发现NP128和NP119的降解率高达99.7%,而NP193a的降解率仅为30.5%.而Isobe等 (2001)却发现污水处理厂一次和二次排水中NP异构体的降解情况没有明显差异.矛盾的研究结果说明NP异构体的降解特性仍有待进一步研究.本文从钱塘江杭州段沉积物中分离得到一株NP高效降解菌,并对其进行菌种鉴定和降解特性的初步研究,进一步探究该菌对10种NP异构体的降解特性,以期明晰NP的生物降解效能,为NP同分异构体的微生物修复提供一定的理论依据.
2 材料与方法 (Materials and methods) 2.1 试剂与材料NP (纯度>99%) 为多种NP异构体的混合物,购自中国上海Aladdin公司,以乙腈为溶剂配制储备液;乙腈、甲醇、二氯甲烷 (色谱纯) 购自美国Sigma-Aldrich公司.沉积物样品采自钱塘江九溪水厂北,用抓斗采样器,采取0~10 cm的表层沉积物,去除碎石、败叶等杂物.经测定,沉积物pH为6.76,有机质和黑碳含量分别为0.964%和0.37%,腐殖质含量为0.57%,其他理化性质见前期研究 (程广焕,2015).
牛肉膏蛋白胨培养液 (1 L):5.0 g NaCl,10.0 g胰蛋白胨,5.0 g牛肉浸膏,用1 mol· L-1 NaOH调pH为7.0~7.2.牛肉膏蛋白胨培养基:在牛肉膏蛋白胨培养液中加入2%~4%的琼脂粉,121 ℃下灭菌30 min,冷却至40~50 ℃后按无菌操作要求,在酒精灯火焰上倒平板,冷却凝固后待用.MSM (无机盐培养基,1 L):4.0 g K2HPO4, 4.0 g NaH2PO4, 2.0 g (NH4)2SO4, 0.41 g MgSO4·7H2O, 0.01 g无水CaCl2, 0.01 g MnSO4·H2O, 0.01 g FeSO4·7H2O, 以1 mol· L-1 NaOH调pH为7.0~7.2.实验所用培养基、器材经121 ℃、30 min高温高压灭菌,在无菌个人操作台中进行操作.
2.2 NP降解菌的分离和纯化取沉积物湿样25.0 g于NP浓度为10 mg· L-1的MSM (100 mL) 中,在温度为30 ℃、转速为150 r· min-1的条件下恒温振荡培养7 d.同等条件下按10%接入量进行梯度压力式驯化,NP浓度分别为20、30、40、50和100 mg· L-1,培养时间为7 d.反复接种培养、分离、纯化,直至得到纯的单菌落.考察各单菌落对NP的降解能力,最终得到一株能够高效降解NP的纯菌.将纯菌接种到喷洒有NP的无机盐培养基上,于4 ℃冰箱内保存.
2.3 NP降解菌的鉴定委托中国科学院微生物研究所对该株菌进行鉴定,检测指标有细胞形态、生理生化特征、16S rRNA基因序列.采用Blast软件将16S rRNA测序结果与GenBank中已知菌株的16S rRNA序列进行同源性比较,选取同源性95%以上的序列,利用MEGA 5.0软件和Neighbor-Joining法计算序列的系统进化距离,构建系统发育树.
2.4 菌悬液的制备、NP的降解条件优化在斜面上挑取一环纯菌于牛肉膏蛋白胨培养液中富集培养24 h,以4000 r· min-1的转速离心15 min,去除上清液,加入灭菌过的MSM重悬浮后同样条件离心,反复4次,最后用MSM调菌液OD600为1.0制备菌悬液,4 ℃下储存备用.
采用正交试验考察温度、pH、菌量和NP浓度对NP降解的影响,以得到纯菌对NP的最适降解条件.4个条件分别设置5个梯度范围,即温度 (20、25、30、35和40 ℃)、pH (5、6、7、8和9)、菌量 (5%、10%、20%、50%和100%)、NP浓度 (1、5、10、50和100 mg· L-1),5个梯度分别用1、2、3、4、5表示.
实验在50 mL玻璃离心管中进行,以灭菌的MSM为培养液,根据正交试验调节pH、菌量和NP浓度,使最终体系为10 mL,放置在要求温度的恒温振荡培养箱 (150 r· min-1) 中培养7 d,分别测定0和7 d时体系中NP浓度,计算NP降解率.同步设置灭菌对照.每个处理设置3个平行.
NP萃取方法为:在玻璃离心管中加20 mL甲醇,超声30 min,吸取10 mL萃取液至氮吹管,氮吹浓缩至1 mL,转移至1.5 mL离心管,在12000 r· min-1、20 ℃下离心10 min,上清液转移至液相进样小瓶中,高效液相色谱 (HPLC) 测定, 该方法回收率为95.0%~105.0%.
2.5 纯菌对NP同分异构体的降解实验按2.4节所得NP最适降解条件进行实验设置,150 r·min-1恒温振荡培养箱中培养16 d.每个处理设置设3个平行.将用甲醇萃取的NP同分异构体氮吹至干,加1 mL二氯甲烷溶解后转移至1.5 mL离心管,12000 r·min-1下离心10 min,转移至气相进样小瓶后用气相色谱-质谱联用仪 (GC-MS) 测定,该方法回收率为90.0%~110.0%.
2.6 NP的定量测定NP浓度采用HPLC-荧光检测器 (Agilent 1100) 测定 (Lou et al., 2014),色谱柱为C18反相柱 (ODS,5 μm,2.1 mm×250 mm),流动相为乙腈和水 (90:10,V/V),流速为1.0 mL·mim-1,进样量为20 μL,采用荧光检测器,发射波长和激发波长分别为233 nm和302 nm.该方法中NP混合物在6~7 min出一个峰,能够定量NP整体浓度.
NP同分异构体采用GC-MS (Agilent 7890N-5759C) 测定,毛细管柱为DB-5(30 m×0.32 mm ID,0.25 μm液膜厚),离子源温度、进样口温度分别为230、280 ℃.电离能量70 eV,四级杆温度150 ℃.升温程序:初始温度为50 ℃,20 ℃·min-1上升至180 ℃,2 ℃·min-1上升至200 ℃,保持2 min,20 ℃·min-1上升至280 ℃,保持2 min.全扫描模式,扫描范围 (m/z)33~650.载气为氦气,恒流1.0 mL·min-1,无分流进样1 μL.以m/z =121、135、149、163、177和191为特征碎片区分不同的NP同分异构体.该方法中NP出峰时间在18~21 min之间,有13个峰,其中,NP110、NP111和NP193存在镜像异构 (以a和b表示),共检测到10种NP同分异构体.
3 结果与讨论 (Results and discussion) 3.1 菌的鉴定 3.1.1 菌的培养特征经驯化、分离、纯化,得到了一株能以NP作为唯一碳源生长的纯菌,命名为N-1,其菌落形态如图 1所示.可以看出,N-1在培养基上呈黄色,菌落成圆形,表面偏平,边缘齐整,湿润,光滑, 半透明且易挑起.
 |
| 图 1 N-1的菌落形态 Fig. 1 Colony morphology of strain N-1 |
N-1的16S rRNA基因序列含1454个碱基,选择相似性最高的菌株进行比对,建立系统发育树 (图 2).由图 2可知,N-1与菌株Pseudoxanthomonas sp.L2在进化树上处于同一分支,具有相近的进化距离,说明N-1与Pseudoxanthomonas sp.发育关系最紧密,因此,将N-1归为假黄单胞菌 (Pseudoxanthomonas sp.),命名为Pseudoxanthomonas sp.N-1.
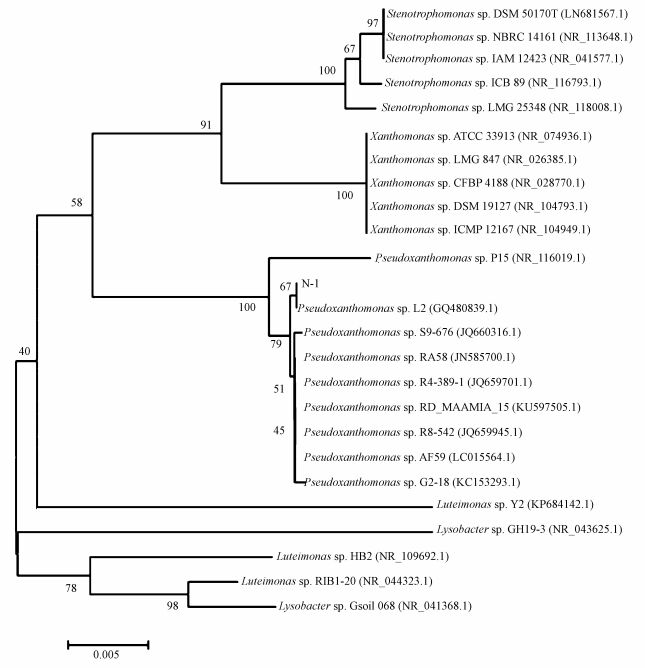 |
| 图 2 N-1基于16S rRNA基因同源性的系统发育树 Fig. 2 Phylogenetic tree of strains N-1 based on the 16S rRNA gene homology |
生理生化鉴定结果发现,N-1为革兰氏阴性菌,杆状,接触酶、氧化酶实验结果为阳性,水解淀粉实验结果为阴性.能利用葡萄糖、乳糖、果糖、蔗糖、松二糖、麦芽糖、丙酸、乙酸等碳源.耐盐性较差,不能耐受质量分数为8%的NaCl;不耐酸性,不能耐受pH 5.0以上酸度.
3.2 N-1降解NP的最适条件采用正交试验探究温度、pH、菌量和NP浓度对NP降解的影响,得到的正交试验结果见表 1.总的来说,N-1对NP的降解能力较强,4个因素都在不同程度上影响了N-1对NP的降解.4个因素对NP降解影响的大小顺序为R温度 > RNP浓度 > RpH> R菌量.温度水平上,k3> k2> k4> k1> k5,30 ℃是N-1降解NP的最适温度;pH水平上,k3> k4> k5> k2> k1,中性偏碱性条件适于N-1降解NP;菌量水平上,NP降解率随着加菌量增加而升高,但菌量超过10%后NP降解没有显著差异 (p>0.05);NP浓度水平上,k2>k3> k4> k1> k5,5~10 mg·L-1浓度下N-1能较好降解NP.因此,采用温度为30 ℃,pH为7.0,菌量10%,NP浓度10 mg·L-1作为NP降解的最适条件.
| 表 1 NP降解的正交试验结果 Table 1 Results of orthogonal test of NP degradation |
对标样NP进行GC-MS测定,共检测到13个峰 (图 3).Eganhouse等 (2009)对7种NP进行研究发现,NP中包含0.04%~0.3%的C3~C7酚类,0.01%~2.2%的辛基酚 (OP),2.5%~8.9%的2-NP,85.6%~93.9%的4-NP和2.2%~4.6%的癸基酚 (DP),其中,4-NP主要由具有4-α-quaternary结构的同分异构体组成,本文检测到的10种NP都属于4-NP.
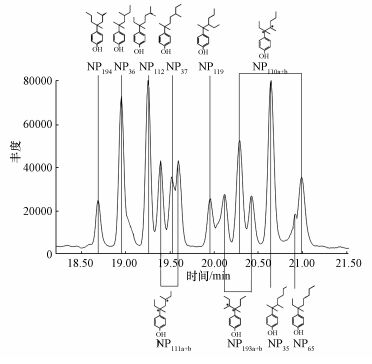 |
| 图 3 标样NP的GC-MS谱图 Fig. 3 GC-MS chromatogram of standard NP |
采用N-1对NP进行为期16 d的降解,分别在0、2、4、8、12和16 d时进行取样,得到10种NP异构体的降解率变化情况 (图 4).随着降解时间延长,10种NP异构体都逐渐发生降解,但降解各有快慢,说明不同的NP异构体具有不同的降解性能,即NP异构体具有结构选择降解 (Gabriel et al., 2008; Lu et al., 2015).经过16 d的降解,NP异构体降解率大小顺序为NP37=NP119(100%)> NP35(94.6%)>NP36(93.4%)>NP112(91.8%)>NP65(91.3%)>NP110b(91.0%)>NP110a(90.2%)>NP111a(88.5%)>NP111b (86.5%)>NP193b(76.0%)>NP194(74.0%)>NP193a(69.7%)(p<0.01),其中,降解最快的是NP37和NP119,16 d后被完全降解,而NP193a+b和NP194降解率最低,降解性能最差,可能是残留NP混合物的主要成分,其他NP异构体降解率都较高,N-1对这些NP异构体具有良好的去除效果.总的来说,NP经过16 d的降解,平均降解率可达88.0%,证实了N-1对NP具有良好的降解能力.Gabriel等 (2008)研究了Sphingobium xenophagum Bayram对NP异构体的降解情况,发现降解率为30.5%~99.7%,降解率大小顺序为NP119(99.7%)>NP36(98.8%)>NP112(98.2%)>NP35(97.6%)>NP37(96.6%)>NP111a(94.0%)>NP111b(90.4%)>NP65 (81.0%)>NP110a(77.5%)>NP110b(76.3%)>NP194(61.8%)>NP193a(31.3%)>NP193b(30.5%).由此可见,Pseudoxanthomonas sp.N-1对NP具有更强的降解能力,Pseudoxanthomonas sp.N-1与Sphingobium xenophagum Bayram对易降解NP的降解效果都较好,但N-1对较难降解NP的降解率显著较高,比如NP110a+b、NP193a+b和NP194的降解率分别为90.6%、72.9%和74.0%,显著高于Gabriel等 (2008)研究中的76.9%、30.9%和61.8%.
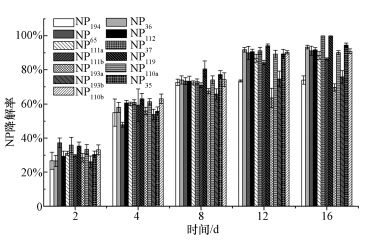 |
| 图 4 N-1对10种NP异构体的降解 Fig. 4 Biodegradation rates of 10 NP isomers by N-1 |
为了进一步探究NP同分异构体降解的结构-降解特性,本文选择C链 (苯环上烷基最长C链) 长度、α-取代基和β-取代基作为结构指标,8~16 d平均降解率作为降解指标,综合考察结构特性对NP异构体降解的影响.每种NP异构体对应的结构特征如表 2所示.
| 表 2 10种NP同分异构体的结构特征 Table 2 Structures of 10 NP isomers |
图 5总结了NP异构体降解率与其结构之间的关系,NP的降解率随着C链长度的增长而增加 (R2=0.860),随着α-取代基 (R2=0.813)、β-取代基 (R2=0.712) 逐渐复杂而降低.比如,6-C NP异构体的平均降解率为84.9%,而5-C时,降为81.2%,4-C时持续降低至71.0%.因此,C链长度能作为衡量NP异构体降解性能的结构指标之一.对于α-取代基,NP异构体的降解率大小顺序为NP36、NP37、NP119、NP35 > NP65、NP112、NP111a+b、NP110a+b > NP194、NP193a+b,对应3类α-取代基降解率排序为:α-二甲基> α-甲基-α-乙基> α-甲基-α-丙基,说明取代基越复杂,NP异构体降解能力越差,这可能是微生物更易攻击结构较简单的取代基结构所致.β-取代基也具有类似的结果,5类β-取代基降解能力的排序为:无取代基> β-甲基≈ β-二甲基> β-乙基> β-甲基-β-乙基,同样说明了结构越简单的NP异构体降解性能越好.
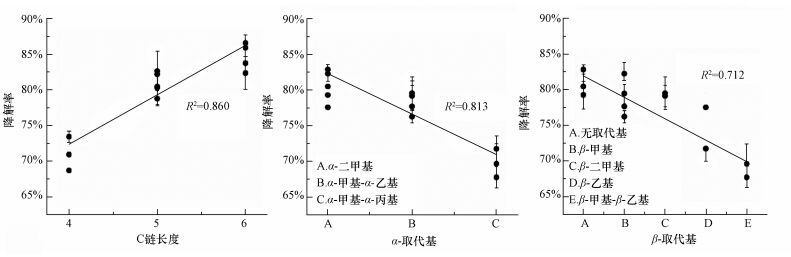 |
| 图 5 NP烷基链最长C链、α-取代基和β-取代基与NP异构体降解率的关系 Fig. 5 Quantitative relationship between isomer structure and biodegradation rate |
目前对于NP完全矿化的路径尚无明确结论,主要有3种推测,原位羟基化、邻位硝化和烷基链氧化,由于对位位阻效应的抑制作用,原位羟基化可能是NP最主要的降解途径.Corvini等 (2006)采用Sphingomonas sp.TTNP3对NP进行降解探究其降解机理,发现该菌对NP的降解以原位羟基化为基础,生成中间产物对二苯酚,继而通过水合作用、NIH机制和羟基化反应对对二苯酚进行下一步降解,得到产物壬醇、苯二酚、烷基苯二酚和烷氧酚.本文检测到的NP异构体主要由具有4-α-quaternary结构的同分异构体组成,为对位结构,因此,NP苯环对烷基链存在位阻效应,位阻大的异构体表现出高残留率低降解性,如NP193a+b和NP194,说明NP的对位结构可能在其降解过程中发挥着非常重要的作用 (Lu et al., 2015).
4 结论 (Conclusions)1) 从钱塘江沉积物中筛选分离纯化得到一株能以NP作为唯一碳源生长的纯菌N-1,经16S rRNA和生理生化鉴定,确定N-1为假黄单胞菌 (Pseudoxanthomonas sp.),命名为Pseudoxanthomonas sp.N-1.
2) 通过正交试验探究温度、pH、菌量和NP浓度对NP降解的影响,得到N-1降解NP的最适条件为温度30 ℃,pH=7.0,菌量10%,NP浓度5~10 mg·L-1.在最适降解条件下,16 d后NP的降解率高达88.0%.
3) NP同分异构体的降解具有结构-降解特性,即不同结构NP异构体的降解能力不一样,本文检出的10种NP异构体降解率在69.7%~100%之间.以C链长度、α-取代基和β-取代基为结构指标分析发现,NP异构体降解率随着C链长度增加而增大,随着取代基结构越复杂而减小.这说明在NP的污染修复研究中,还应考虑同分异构现象导致的难降解成分残留现象.
| [${referVo.labelOrder}] | 安敏, 彭自然, 氨世杰, 等. 2006. 4-壬基酚对三种水生生物的毒性影响[J]. 水生生物学报, 2006, 30(4) : 489–492. |
| [${referVo.labelOrder}] | Chang B V, Yu C H, Yuan S Y. 2004. Degradation of nonylphenol by an aerarobic microorganisms from river sediment[J]. Chemosphere, 55(4) : 493–500. DOI:10.1016/j.chemosphere.2004.01.004 |
| [${referVo.labelOrder}] | Chen T C, Yeh Y L. 2010. Ecological risk, mass loading, and occurrence of nonylphenol (NP), NP mono-, and diethoxylate in Kaoping River and its tributaries, Taiwan[J]. Water, Air, and Soil Pollution, 208(1/4) : 209–220. |
| [${referVo.labelOrder}] | Corvini P F, Hollender J, Ji R, et al. 2006. The degradation of alpha-quaternary nonylphenol isomers by Sphingomonas sp.strain TTNP3 involves a type Ⅱ ipso-substitution mechanism[J]. Applied Microbiology and Biotechnology, 70(1) : 114–122. DOI:10.1007/s00253-005-0080-0 |
| [${referVo.labelOrder}] | 程广焕. 2015. 黑碳对沉积物中壬基酚吸附/解吸和微生物降解的影响研究[D]. 杭州: 浙江大学. 42-43 |
| [${referVo.labelOrder}] | Duong C N, Ra J S, Cho J, et al. 2010. Estrogenic chemicals and estrogenicity in river waters of South Korea and seven Asian countries[J]. Chemosphere, 78(3) : 286–293. DOI:10.1016/j.chemosphere.2009.10.048 |
| [${referVo.labelOrder}] | Eganhouse R P, Pontolillo J, Gaines R B, et al. 2009. Isomer-specific determination of 4-nonylphenols using comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J]. Environmental Science & Technology, 43(24) : 9306–9313. |
| [${referVo.labelOrder}] | Gabriel F L, Routledge E J, Heidlberger A, et al. 2008. Isomer-specific degradation and endocrine disrupting activity of nonylphenols[J]. Environmental Science & Technology, 42 : 6399–6408. |
| [${referVo.labelOrder}] | Gejlsbierg B, Klinge C, Samsoe Petersen L, et al. 2001. Toxicity of linear alkylbenzene sulfonates and nonylphenol in sludge-amended soil[J]. Environmental Toxicology and Chemistry, 20(12) : 2709–2716. DOI:10.1002/etc.v20:12 |
| [${referVo.labelOrder}] | Isobe T, Nishiyama H, Nakashima A, et al. 2001. Distribution and behavior of nonylphenol, octylphenol, and nonylphenol monoethoxylate in Tokyo metropolitan area:their association with aquatic particles and sedimentary distributions[J]. Environmental Science & Technology, 35(6) : 1041–1049. |
| [${referVo.labelOrder}] | Kawahata H, Ohta H, Inoue M, et al. 2004. Endocrine disrupter nonylphenol and bisphenol A contamination in Okinawa and Ishigaki Islands, Japan-within coral reefs and adjacent river mouths[J]. Chemosphere, 55(11) : 1519–1527. DOI:10.1016/j.chemosphere.2004.01.032 |
| [${referVo.labelOrder}] | Lou L P, Cheng G H, Deng J Y, et al. 2014. Mechanism of and relation between the sorption and desorption of nonylphenol on black carbon-inclusive sediment[J]. Environmental Pollution, 190 : 101–108. DOI:10.1016/j.envpol.2014.03.027 |
| [${referVo.labelOrder}] | Lu Z J, Gan J. 2014. Analysis, toxicity, occurrence and biodegradation of nonylphenol isomers:A review[J]. Environment International, 73 : 334–345. DOI:10.1016/j.envint.2014.08.017 |
| [${referVo.labelOrder}] | Lu Z, Reif R, Gan J. 2015. Isomer-specific biodegradation of nonylphenol in an activated sludge bioreactor and structure-biodegradability relationship[J]. Water Research, 68 : 282–290. DOI:10.1016/j.watres.2014.09.050 |
| [${referVo.labelOrder}] | Soares A, Guieysse B, Jefferson B, et al. 2008. Nonylphenol in the environment:a critical review on occurrence, fate, toxicity and treatment in wastewaters[J]. Environmental International, 34(7) : 1033–1049. DOI:10.1016/j.envint.2008.01.004 |
| [${referVo.labelOrder}] | Stewart M, Olsen G, Hickey C W, et al. 2014. A survey of emerging contaminants in the estuarine receiving environment around Auckland, New Zealand[J]. Science of the Total Environment, 468 : 202–210. |
| [${referVo.labelOrder}] | Ushiba Y, Takahara Y, Ohta H. 2003. Sphingobium amiense sp.nov., a novel nonylphenol-degrading bacterium isolated from a river sediment[J]. International Journal of Systematic and Evolutionary Microbiology,, 53(6) : 2045–2048. DOI:10.1099/ijs.0.02581-0 |
| [${referVo.labelOrder}] | 熊杰, 钱蜀, 谢永洪, 等. 2014. 丰水期沱江水系环境内分泌干扰物分布特征[J]. 中国环境监测, 2014, 32(2) : 53–57. |
| [${referVo.labelOrder}] | 应锋. 2014. 壬基酚经口摄入后在雄性大鼠体内分布及其对大鼠睾丸间质细胞影响的研究[D]. 南京: 南京大学. 85-87 |
 2017, Vol. 37
2017, Vol. 37


