镉是一种蓄积性很强且致癌的环境污染物 (Nawrot et al., 2010).由于水体重金属污染加重,镉对水生生物的影响越来越受到人们的高度关注 (姜会超等,2014).研究表明,镉能够在雄性生殖系统中积累并产生毒性作用 (Wang et al., 2011;贾秀英等,2011),可以使精巢的功能出现障碍,导致精子数量和活力下降,精子畸形率上升 (李煌元等,2007;Dietrich et al., 2010;郭树榜等,2010),影响动物的生殖能力.副性腺是雄性生殖系统的重要组成部分 (王海东等,2007; Freitas et al., 2010; Chen et al., 2012),研究显示,副性腺蛋白可以有效地消化精荚和精荚壁,使精荚结构疏松而易破裂,提高精子的存活率 (孙菊香,2007;曲迪,2007)和顶体反应率.副性腺内容物可以为精子的运动提供能量和营养,使精子保持活力,对顺利完成受精过程具有重要的作用 (毛倩,2009).
河南华溪蟹 (Sinopotamon henanense) 广泛分布于我国淡水水域,营底栖生活,对重金属敏感,是环境污染的理想指示生物.本课题组前期的研究表明,镉能够引起河南华溪蟹鳃 (Wang et al., 2012)、肝胰腺 (Liu et al., 2013)、消化系统 (吴昊,2014)和生殖系统 (Wang et al., 2011; Yang et al., 2013; Ma et al., 2013)等生理生化和形态结构的变化,导致功能受损.急性镉胁迫对副性腺的形态结构和生理生化方面也产生了明显的毒性作用 (侯宇华,2015),但慢性镉胁迫对副性腺的影响更接近自然状态 (吴昊等,2015).
鉴于此,本文研究慢性镉 (Cd2+) 胁迫对河南华溪蟹副性腺的影响,以及镉的富集、组织细胞结构、抗氧化酶 (超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GPx) 活性)、脂质过氧化水平 (MDA含量)、蛋白质羰基化 (PCO含量)和DNA-蛋白质交联 (DPC) 的变化情况.旨在为研究重金属胁迫对动物生殖和养殖带来的不利因素提供科学依据.
2 材料与方法 (Materials and methods) 2.1 实验材料河南华溪蟹 (以下简称“华溪蟹”) 于2015年4月购自太原市五龙口海鲜市场,在实验室水族缸 (45 cm×35 cm×30 cm) 暂养2周以上备用.
2.2 主要试剂氯化镉 (CdCl2·2.5H2O,分析纯) 购自于天津市博迪化工有限公司,实验前用蒸馏水配成20000 mg· L-1的母液;苏木素、伊红购自Amersco公司;硝酸、高氯酸 (优级纯) 购自北京化工厂,标准镉溶液 (1000 mg· L-1) 由环境保护部标准样品研究所提供;超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GSH-Px)、丙二醛 (MDA) 含量和蛋白含量测定的试剂盒 (南京建成生物工程研究所);Tris、蛋白酶K和荧光染料Hoechest33258(Sigma公司);盐酸胍和EDTA (分析纯,北京化工厂); 2, 4-二硝基苯肼 (DNPH)(分析纯,天津Kermal化学试剂开发中心).
2.3 实验方法 2.3.1 实验设计根据镉对华溪蟹96 h的LC50的1/320和1/160,分别设置0.725和1.45 mg· L-1 2个镉浓度处理组和1个对照组,每组设3个平行.随机选取体重 (20.7±1.5) g的健康成熟雄蟹置于处理缸 (45 cm×30 cm×20 cm),每缸放15只.缸内分别加72.5和145 μL的镉母液及2 L曝气48 h以上的自来水 (pH=6.8, 溶氧量8.0~8.3 mg· L-1).分别处理7、14和28 d,染毒期间2 d换一次水、喂一次食.
2.3.2 样品制备常规石蜡切片样品制备:华溪蟹在处理组暴露7、14和28 d后,每缸随机选2~3只蟹体,取副性腺后一部分放入10%的中性甲醛溶液中固定24 h,经脱水、透明、浸蜡、包埋、切片、脱蜡复水、脱水和中性树胶封片等步骤, 具体步骤参见文献 (侯宇华,2015) 方法;副性腺另一部分称重后,液氮速冻,置-80 ℃冰箱保存.
镉含量测定方法:采用火焰原子吸收法 (马文丽等,2008),浓硝酸和高氯酸硝化完全,定容后用火焰原子吸收仪测定副性腺组织镉的含量.
生理生化指标的测定:按组织质量体积比1 g/4 mL加入磷酸缓冲液 (PBS,pH=7.4),电动匀浆器制备20%的组织匀浆液,4 ℃、2500 r·min-1离心10 min,取上清备用.SOD、CAT、GPx 3种酶活性、MDA含量和蛋白含量按试剂盒说明书进行测定;PCO和DPC的测定方法参见文献 (Li et al., 2011).
2.3.3 数据处理实验数据用SPSS 16.0单因素方差分析 (One-Way ANOVA) 进行统计分析,结果用平均值±标准差 (Mean±SD) 表示,*p < 0.05表示存在显著性差异, **p < 0.01表示存在极显著性差异.
3 结果 (Results) 3.1 镉在河南华溪蟹副性腺中的积累由图 1可以看出,镉在河南华溪蟹副性腺组织中的积累显著或极显著高于对照组.同一时间不同浓度或同一浓度不同时间下,随着时间的延长和镉浓度的增加,华溪蟹副性腺组织镉的积累逐渐增高.与对照组相比,染毒7 d、1.45 mg· L-1浓度组镉积累显著升高;染毒14、28 d,0.725和1.45 mg· L-1浓度组镉积累极显著升高.
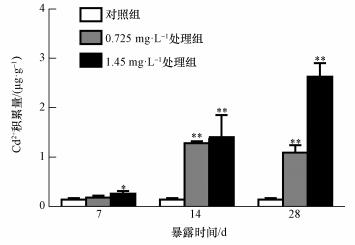 |
| 图 1 镉在河南华溪蟹副性腺组织中的积累 (n=6) Fig. 1 Bioaccumulation of cadmium in male accessory gland of S. henanense |
观察图 2可以发现,河南华溪蟹副性腺组织的细胞核被染成蓝紫色,细胞质和内容物被染成粉红色.由对照组可知,正常华溪蟹副性腺组织呈管状结构,管内壁靠近基膜处有排列紧密的上皮细胞,细胞核的形状比较规则,基膜完整.随着镉浓度的增加和处理时间的延长,华溪蟹副性腺组织细胞结构发生不同程度的改变,主要表现在为上皮细胞与基膜的分离甚至破裂导致细胞核丢失.镉处理7 d,0.725和1.45 mg· L-1浓度组中,在副性腺上皮细胞中有少量细胞核丢失 (图a1、a2中红色箭头).但随着染毒时间的延长,副性腺组织结构的损伤不断严重.镉染毒28 d,0.725和1.45 mg· L-1浓度组中,基膜结构发生严重变化,上皮细胞和基膜之间出现较大空腔,上皮细胞细胞核变形,严重缺失 (图c1、c2中红色箭头).
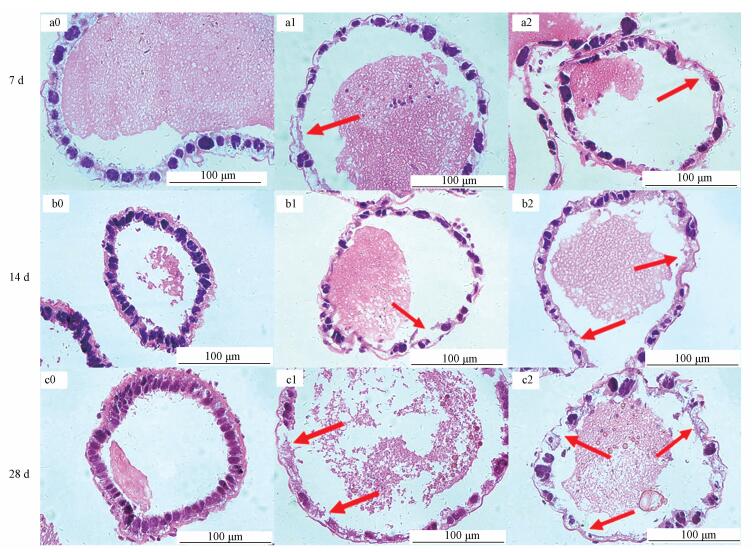 |
| 图 2 镉对河南华溪蟹副性腺显微结构的影响 (a0, b0, c0.对照组;a1, b1, c1. Cd2+ 0.725 mg· L-1;a2, b2, c2. Cd2+ 1.45 mg· L-1) Fig. 2 Effects of cadmium on the microstructure in male accessory gland of S. henanense |
图 3a显示,与对照组相比,河南华溪蟹副性腺SOD活性 (以prot计) 随着镉浓度的增加基本呈现上升趋势;同一浓度不同时间下呈先升后降的趋势.染毒14 d、1.45 mg· L-1浓度组SOD活性较对照组有显著性差异.
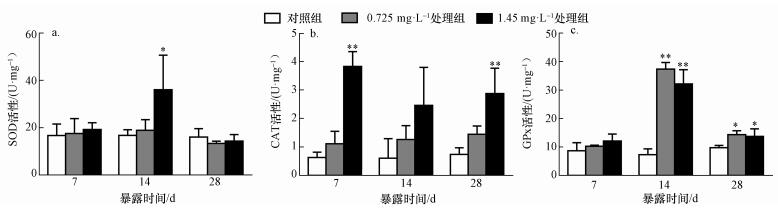 |
| 图 3 镉对河南华溪蟹副性腺抗氧化酶活性的影响 (n=6) Fig. 3 Effect of Cd2+ on antioxidant enzymes activities in male accessory gland of S. henanense |
由图 3b可见,与对照组相比,河南华溪蟹副性腺CAT的活性 (以prot计) 随着镉染毒浓度的增加逐渐升高,并且在7和28 d的1.45 mg· L-1浓度组中,CAT活性的增高呈极显著性差异.
3.3.3 镉对GPx活性的影响如图 3c所示,与对照组相比,河南华溪蟹副性腺GPx活性 (以prot计) 在同一时间不同浓度下呈增加趋势,染毒14和28 d,GPx活性出现极显著升高,特别是14 d.同一浓度不同时间下,GPx活性表现为先升高后的趋势.
3.4 镉对河南华溪蟹副性腺MDA含量的影响与对照组相比,在同一时间内,随着镉浓度的增加,河南华溪蟹副性腺MDA含量 (以prot计) 表现出逐渐升高的趋势,且都高于对照组;随着时间的延长,尤其在28 d,副性腺MDA含量出现下降的情况;镉浓度0.725和1.45 mg· L-1下处理28 d,副性腺MDA含量呈显著性或极显著性差异 (图 4).
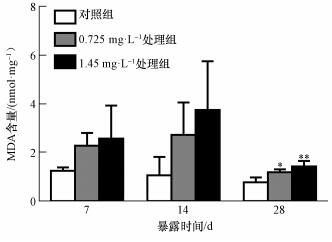 |
| 图 4 镉对河南华溪蟹副性腺MDA含量的影响 (n=6) Fig. 4 Effect of Cd2+ on MDA content in male accessory gland of S. henanense |
河南华溪蟹经镉处理后,副性腺PCO含量 (以prot计) 在同一时间随着镉浓度的增加逐渐增高.与对照组相比,镉浓度0.725和1.45 mg· L-1下处理7 d后出现极显著性增加,并在镉浓度1.45 mg· L-1下处理28 d时达到最大值,较对照组呈极显著性差异 (图 5).
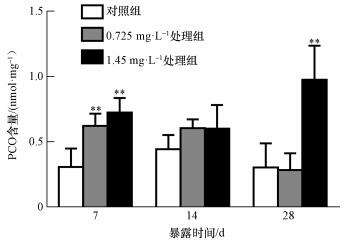 |
| 图 5 镉对河南华溪蟹副性腺PCO含量的影响 (n=6) Fig. 5 Effect of Cd2+ on PCO content in male accessory gland of S. henanense |
随着镉浓度的增加和处理时间的延长,河南华溪蟹副性腺DPC基本呈现逐渐升高的趋势.镉浓度0.725和1.45 mg· L-1下处理28 d,DPC较对照组出现极显著差异,且在镉浓度为1.45 mg· L-1时达到最大值 (图 6).
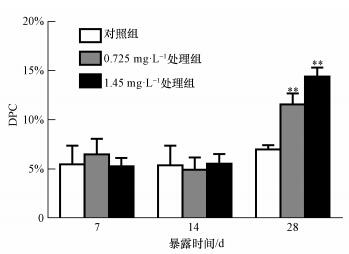 |
| 图 6 镉对河南华溪蟹副性腺DPC的影响 (n=6) Fig. 6 Effect of Cd2+ on DPC in male accessory gland of S. henanense |
动物生殖系统的副性腺能有效地消化精囊壁释放出精子,并与精囊蛋白相互作用以增加精子顶体酶的活性 (Hou et al., 2010; Wang et al., 2013).此外,还参与包括保护、精子运动、精子获能和顶体反应等关键反应.同时,精子与卵子的相互作用需要副性腺的参与 (Moura et al., 2007).河南华溪蟹副性腺位于贮精囊和射精管的交界处,为乳白色的管状结构,管壁组织结构较简单,由结缔组织层、基膜和上皮细胞层组成.与急性镉胁迫的研究结果类似 (侯宇华等,2015),河南华溪蟹在慢性镉胁迫下副性腺中镉的积累具有明显的时间和浓度效应,尤其在28 d,染毒组镉的积累远远大于对照组.水生动物可以通过排泄、排遗、分泌、解毒等生理过程消除体内的镉 (张翠等,2007),当镉的积累速度超过机体自身代谢和解毒能力时,就会对生物有机体造成损伤,诱导机体产生活性氧 (ROS),而ROS再通过与酶、核酸、脂类等生物大分子发生氧化应激反应,诱导细胞凋亡甚至导致坏死 (Cuypers et al., 2010).镉在副性腺组织中的积累达到一定量时,会干扰参与合成抗氧化酶的必需金属元素,破坏抗氧化系统,造成抗氧化酶 (SOD、CAT和GPx) 活性的变化.同时,副性腺中的脂质、蛋白质和DNA等生物大分子的氧化损伤程度不断加剧,导致MDA、PCO含量及DNA-蛋白质交联率上升.随着镉在副性腺组织中积累的增加,副性腺管壁结构出现了上皮细胞和基膜之间的空腔,细胞核变形、与细胞质分离等病理特征,影响了副性腺分泌蛋白的功能,进而会对正常生殖功能产生影响.
4.2 镉胁迫使河南华溪蟹副性腺组织抗氧化酶的活性发生改变镉可以诱导机体产生活性氧物质,如超氧自由基 (O2·-)、过氧化氢 (H2O2)、羟基自由基 (·OH)等.这些物质可以和体内的核酸、蛋白质、糖类和脂质等生物大分子发生反应,导致生物有机体出现氧化损伤 (Ferreira et al., 2004; Kern et al., 2002; Lassen et al., 2008).SOD、CAT及GPx作为机体主要的抗氧化物酶,通过清除活性氧物质达到保护机体的目的.其中,SOD通过清除O2·-,将其转化为H2O2(Lawniczak et al., 2013),CAT和GPx通过清除H2O2并将其转化成H2O和O2来减少自由基对组织的损伤,从而起到解毒的作用.本研究结果表明,SOD和GPx活性变化基本呈现先升后降的趋势,表现出“促进-抑制”的效应机制,说明短时间镉暴露时,生物体内的SOD和GPx活性被诱导;而经过长时间镉胁迫,SOD和GPx活性都受到了抑制而降低.这与急性镉处理的研究结果基本相似 (侯宇华等,2015), 而CAT活性与急性条件的结果不太相同.相比于7 d,CAT活性在14和28 d的1.45 mg· L-1浓度组有所下降.但同一时间,随着浓度的增加CAT的活性仍然呈升高的趋势.可能因为镉浓度为1.45 mg· L-1时在28 d没有达到抑制CAT活性的程度,有利于MDA的清除.镉对副性腺抗氧化系统的破坏降低了细胞对氧自由基的清除能力,间接导致副性腺组织损伤 (Roméo et al., 2000).
4.3 镉对河南华溪蟹副性腺MDA、PCO含量和DPC的影响镉在生物体内大量积累,机体会产生过多的自由基,当抗氧化系统不足以清除体内自由基时,就造成机体氧化损伤,产生脂质过氧化反应.MDA是脂质过氧化反应的产物,MDA含量可以反映机体氧化损伤程度 (Rio et al., 2005; Parrilla Taylor et al., 2013).镉能够破坏核酸和蛋白质等生物大分子对生物体产生毒性作用.PCO含量和DPC也可以作为反映机体氧化损伤程度的指示物 (Liu et al., 2014;Zhu et al., 2013).在本研究中,MDA、PCO含量和DPC均出现显著升高.其中,PCO含量和DPC随着镉浓度的增加和染毒时间的延长呈升高趋势,这与急性条件下PCO含量和DPC的变化趋势一致 (侯宇华等,2015).而在28 d,MDA含量相比于14 d出现了降低的情形,可能与在28 d CAT活性仍没有被抑制有关.综上所述,低浓度长时间的慢性镉胁迫会对河南华溪蟹副性腺产生严重的氧化损伤,进而导致正常生殖功能受阻.
5 结论 (Conclusions)1) 镉在河南华溪蟹副性腺组织中积累导致组织细胞产生病理性的改变,特别是副性腺管壁上皮细胞层的损伤.同时,对副性腺组织的抗氧化系统产生了氧化损伤,进而对河南华溪蟹正常的生殖功能产生影响.
2) 镉对水生动物生殖系统的毒性作用,可以通过副性腺抗氧化酶的活性、MDA、PCO含量和DPC的变化情况来反映,可以作为有效评估重金属污染状况和毒性效应的指标之一.
| [${referVo.labelOrder}] | Chen H, Liao S B, Cheung M P L, et al. 2012. Effects of sperm DNA damage on the levels of RAD51 and p53 proteins in zygotes and 2-cell embryos sired by golden hamsters without the major accessory sex glands[J]. Free Radical Biology & Medicine, 53(4) : 885–892. |
| [${referVo.labelOrder}] | Cuypers A, Plusquin M, Remans T, et al. 2010. Cadmium stress:an oxidative challenge[J]. Biometals An International Journal on the Role of Metal Ions in Biology Biochemistry & Medicine, 23(5) : 927–940. |
| [${referVo.labelOrder}] | Dietrich G J, Dietrich M, Kowalski R K, et al. 2010. Exposure of rainbow trout milt to mercury and cadmium alters sperm motility parameters and reproductive success[J]. Aquatic Toxicology, 97(97) : 277–284. |
| [${referVo.labelOrder}] | Ferreira L F, Reid M B. 2004. Muscle-derived ROS and thiol regulation in muscle fatigue[J]. Bipolar Disorders, 6(6) : 460–469. DOI:10.1111/bdi.2004.6.issue-6 |
| [${referVo.labelOrder}] | Freitas S P C, Gonçalves T C M, Serrão J E, et al. 2010. Male reproductive system structure and accessory glands ultrastructure of two species of Triatoma (Hemiptera, Reduviidae, Triatominae)[J]. Micron, 41(5) : 518–525. DOI:10.1016/j.micron.2010.01.008 |
| [${referVo.labelOrder}] | 郭树榜, 刘丽清, 路陶生, 等. 2010. 镉对雄性大鼠生殖毒作用的实验研究[J]. 河南预防医学杂志, 2010, 21(4) : 241–243. |
| [${referVo.labelOrder}] | 侯宇华.2015.镉对河南华溪蟹副性腺的毒性作用研究[D].太原:山西大学.12-17 |
| [${referVo.labelOrder}] | Hou X L, Mao Q, He L, et al. 2010. Accessory sex gland proteins affect spermatophore digestionrate and spermatozoa acrosin activity in Eriocheir sinensis[J]. Journal of Crustacean Biology, 30(3) : 435–440. DOI:10.1651/09-3177.1 |
| [${referVo.labelOrder}] | 侯宇华, 李娜, 李丹, 等. 2015. 镉对河南华溪蟹副性腺抗氧化酶活性及脂质、蛋白质和DNA的影响[J]. 水生生物学报, 2015, 39(3) : 621–626. DOI:10.7541/2015.82 |
| [${referVo.labelOrder}] | 贾秀英, 施蔡雷, 张杭君. 2011. 镉暴露致黑斑蛙精巢氧化损伤与DNA损伤[J]. 环境科学学报, 2011, 31(7) : 1537–1541. |
| [${referVo.labelOrder}] | 姜会超, 刘爱英, 宋秀凯, 等. 2014. 重金属胁迫对刺参胚胎发育的影响[J]. 水生生物学报, 2014, 38(2) : 393–400. DOI:10.7541/2014.56 |
| [${referVo.labelOrder}] | Kern P A, Fishman R B, Wei S, et al. 2002. The effect of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin (TCDD) on oxidative enzymes in adipocytes and liver[J]. Toxicology, 171(2/3) : 117–125. |
| [${referVo.labelOrder}] | Lassen N, Black W J, Estey T, et al. 2008. The role of corneal crystallins in the cellular defense mechanisms against oxidative stress[J]. Seminars in Cell & Developmental Biology, 19(2) : 100–112. |
| [${referVo.labelOrder}] | Lawniczak M, Romestaing C, Roussel D, et al. 2013. Preventive antioxidant responses to extreme oxygen level fluctuation in a subterranean crustacean[J]. Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology, 165(2) : 299–303. |
| [${referVo.labelOrder}] | 李煌元, 闫平, 夏品苍, 等. 2007. 镉对大鼠睾丸生精功能与性激素含量影响[J]. 中国公共卫生, 2007, 23(11) : 1371–1373. DOI:10.11847/zgggws2007-23-11-49 |
| [${referVo.labelOrder}] | Li R, Zhou Y, Ji J, et al. 2011. Oxidative damages by cadmium and the protective effects of low-molecular-weight chitosan in the freshwater crab[J]. Aquaculture Research, 42(4) : 506–515. DOI:10.1111/are.2011.42.issue-4 |
| [${referVo.labelOrder}] | Liu D, Yang J, Li Y, et al. 2013. Cd-induced apoptosis through the mitochondrial pathway in the hepatopancreas of the freshwater crab Sinopotamon henanense[J]. PloS One, 8(7) : e68770–e68770. DOI:10.1371/journal.pone.0068770 |
| [${referVo.labelOrder}] | Liu C, Li M, Cao Y, et al. 2014. Effects of avermectin on immune function and oxidative stress in the pigeon spleen[J]. Chemico-biological Interactions, 210(1) : 43–50. |
| [${referVo.labelOrder}] | 马文丽, 王兰, 何永吉, 等. 2008. 镉诱导华溪蟹不同组织金属硫蛋白表达及镉蓄积的研究[J]. 环境科学学报, 2008, 28(6) : 1192–1197. |
| [${referVo.labelOrder}] | Ma D, Hou Y, Du L, et al. 2013. Oxidative damages and ultrastructural changes in the sperm of freshwater crab Sinopotamon henanense exposed to cadmium[J]. Ecotoxicology & Environmental Safety, 98(12) : 244–249. |
| [${referVo.labelOrder}] | 毛倩.2009.中华绒螯蟹副性腺蛋白功能的初步研究[D].上海:华东师范大学.12-14 |
| [${referVo.labelOrder}] | Moura A A, Chapman D A, Koc H, et al. 2007. A comprehensive proteomic analysis of the accessory sex gland fluid from mature Holstein bulls[J]. Animal Reproduction Science, 98(3/4) : 169–188. |
| [${referVo.labelOrder}] | Nawrot T S, Staessen J A, Roels H A, et al. 2010. Cadmium exposure in the population:from health risks to strategies of prevention[J]. Biometals An International Journal on the Role of Metal Ions in Biology Biochemistry & Medicine, 23(5) : 769–782. |
| [${referVo.labelOrder}] | Parrilla Taylor D P, Zenteno Savín T, Magallón Barajas F J. 2013. Antioxidant enzyme activity in pacific whiteleg shrimp (Litopenaeus vannamei) in response to infection with white spot syndrome virus[J]. Aquaculture, s380-383(1) : 41–46. |
| [${referVo.labelOrder}] | 曲迪. 2007. 中华绒螯蟹 (Eriocheir sinensis) 精荚破裂以及精子顶体酶活力研究[M]. 上海: 华东师范大学: 23–25. |
| [${referVo.labelOrder}] | Rio D D, Stewart A J, Pellegrini N. 2005. A review of recent studies on malondialdehyde as toxic molecule and biological marker of oxidative stress[J]. Nutrition Metabolism & Cardiovascular Diseases, 15(4) : 316–328. |
| [${referVo.labelOrder}] | Roméo M, Bennani N, Gnassia-Barelli M, et al. 2000. Cadmium and copper display different responses towards oxidative stress in the kidney of the sea bass Dicentrarchus labrax[J]. Dicentrarchus Labrax, 48(2/3) : 185–194. |
| [${referVo.labelOrder}] | 孙菊香. 2007. 中华绒螯蟹 (Eriocheir sinensis) 副性腺的结构和功能研究[M]. 上海: 华东师范大学: 31–37. |
| [${referVo.labelOrder}] | 王海东, 薛霖莉, 董常生. 2007. 羊驼副性腺结构的组织化学研究[J]. 中国兽医科学, 2007, 37(11) : 987–989. |
| [${referVo.labelOrder}] | Wang J, Fang D A, Wang Y, et al. 2013. Cathepsin A protein from the accessory sex gland of the Chinese mitten crab (Eriocheir sinensis) plays a key role in spermatophore digestion[J]. Journal of Insect Physiology, 59(9) : 953–960. DOI:10.1016/j.jinsphys.2013.07.003 |
| [${referVo.labelOrder}] | Wang J, Qian W, Li J, et al. 2012. Cadmium induces hydrogen peroxide production and initiates hydrogen peroxide-dependent apoptosis in the gill of freshwater crab, Sinopotamon henanense[J]. Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology, 156(3/4) : 195–201. |
| [${referVo.labelOrder}] | Wang L, Xu T, Lei W W, et al. 2011. Cadmium-induced oxidative stress and apoptotic changes in the testis of freshwater crab, Sinopotamon henanense[J]. PloS One, 6(11) : e27853. DOI:10.1371/journal.pone.0027853 |
| [${referVo.labelOrder}] | 吴昊.2014.镉对河南华溪蟹消化系统的损伤作用和毒性机制的研究[D].太原:山西大学.25-70 |
| [${referVo.labelOrder}] | 吴昊, 轩瑞晶, 李颖君, 等. 2015. 急性与亚慢性镉胁迫对河南华溪蟹消化系统亚细胞结构的影响[J]. 环境科学学报, 2015, 35(11) : 3695–3703. |
| [${referVo.labelOrder}] | Yang J, Liu D, Jing W, et al. 2013. Effects of cadmium on lipid storage and metabolism in the freshwater crab Sinopotamon henanense[J]. PloS One, 8(10) : 1002–1004. |
| [${referVo.labelOrder}] | 张翠, 翟毓秀, 宁劲松, 等. 2007. 镉在水生动物体内的研究概况[J]. 水产科学, 2007, 26(8) : 465–470. |
| [${referVo.labelOrder}] | Zhu W J, Li M, Liu C, et al. 2013. Avermectin induced liver injury in pigeon:mechanisms of apoptosis and oxidative stress[J]. Ecotoxicology & Environmental Safety, 98(12) : 74–81. |
 2017, Vol. 37
2017, Vol. 37


