随着水体污染状况的加剧,水体富营养化和水华已成为一种普遍现象,并导致水体的环境功能丧失.大量研究结果表明,蓝藻,特别是铜绿微囊藻是水华暴发过程中的优势藻种,并且其引起的水华通常伴随着严重的藻毒素问题.水华,特别是产毒铜绿微囊藻引起的水华,已引起全球范围内的健康问题和公众关注 (Carmichael, 2001; Christoffersen et al., 2000; Paerl, 2001; Fleming et al., 2002).人们通常认为水体富营养化和水华暴发主要是由水体氮磷含量超标引起的,因此,在氮、磷对藻类生长及产毒素方面做了大量研究 (Moisander et al., 2009; Xu, 2010; Baek et al., 2015).然而,随着对藻华现象及暴发过程的深入分析,微量元素在藻华暴发过程中的作用也逐渐为人们所重视,并展开了相关研究 (Brand, 1983; Lukac et al., 1993).Cu作为一种藻类必须的微量营养元素,在藻细胞内各种生化过程中的作用已为研究者们所重视.微量元素的作用机理研究表明,Cu作为藻类呼吸和光合作用中多种酶的辅助因子,能在很大程度上提高酶的表达量,促进藻类的光合作用和细胞的生长繁殖 (Brand, 1983; Lukac et al., 1993);此外,Cu对原核藻类蓝藻固氮酶和硝酸还原酶活性有着重要的作用,而过量的铜会抑制藻细胞内碳水化合物的合成 (Kashyap et al., 1982).虽然Cu在藻细胞光合作用、碳水化合物合成及氮素利用方面的作用已被大量研究成果揭示,其对藻细胞增殖的影响也已得到一定研究.但这些研究中并未涉及Cu在藻毒素合成这一藻细胞重要生化过程中的作用,Cu胁迫下藻细胞增殖及藻毒素合成之间的相关研究也鲜有报道.鉴于藻毒素暴发现象日益严重及其不亚于藻华的危害性,开展这方面的研究是很有必要的.
本文以产毒铜绿微囊藻为研究对象,以不同浓度Cu2+培养液为实验环境,通过藻密度、藻毒素浓度等指标来研究Cu2+胁迫条件下藻类生长及藻毒素合成状况,进而分析两者之间的相互关系,以期在控制水体中氮磷含量的条件下,进一步通过控制城市水体中微量元素的含量来控制水华及随之产生的藻毒素问题.
2 材料与方法 (Materials and methods) 2.1 实验材料实验用藻种为铜绿微囊藻 (M. aeruginosa),购于中科院武汉生物研究所,编号为FACHB-12.
2.2 培养基中营养条件的设定实验中营养条件除氮、磷、铜之外,其它均依照BG-11的营养条件来设定.实验用培养基氮磷浓度的设置分别以NaNO3和K2HPO4为原料,依据GB18918-2002中一级A排放标准来设定 (TN=15 mg·L-1,TP=0.5 mg·L-1);铜元素用CuSO4·5H2O配置,设5个梯度,分别为0.01、0.1、1、10、100 μg·L-1.
2.3 预培养及接种将正常培养至对数期的藻种去除营养物质 (25 ℃、4500 r·min-1离心10 min,倒掉上清液, 用15 mg·L-1的NaHCO3洗涤3次后保留离心得到的藻细胞) 后,接种至预处理培养基 (不含氮、磷、铜) 中培养7 d.预培养结束后,按前述方法再次去除营养物质后接入配置不同铜浓度梯度的培养基中.接种体积比为1:20,初始培养时培养液总体积为500 mL,培养瓶总容积为1000 mL.接种好的培养瓶置于全温光照培养箱 (GZP-450(S),精宏,中国) 培养.控制培养条件为:温度 (25±1) ℃,光照3000 lx,光暗时间比为12 h:12 h,培养周期为16 d.为确保实验准确,每个样品设3个平行样,实验过程中每天调整培养瓶位置3次.
2.4 指标测定 2.4.1 藻密度藻密度的测定采用细胞计数分析仪 (Cellometer Auto T4,达科为, 中国),每次测定取样量为1 mL.实验过程中,从接种至第6 d每隔1 d测定一次藻密度,第7 d开始每天测定藻密度.
2.4.2 藻毒素的测定标准藻毒素样品购置于Sigma (纯度98%),以GB/T 20466-2006中藻毒素的测定方法为标准,采用液相色谱装置测定 (LC-2000,日立,日本) 藻毒素含量,分离柱尺寸为250 mm×4.6 mm (SB-C18,安捷伦,USA).从培养第4 d开始每隔1 d测定一次藻细胞藻毒素产量,从第6 d开始每天进行测定.每次取样量控制在10~25 mL (前期取样量多,后期逐渐减少),样品的制备参考Long等(2010) 的制备方法.
2.4.3 硝氮的测定培养液中剩余的硝氮含量依据HJ/T-2007中所述方法测定,每次取样量为5 mL,用0.45 μm滤头过滤后取滤液测定,从培养第4 d开始,每2 d测定一次.
2.4.4 指标计算比增长率μ采用公式 (1) 计算,其中,Xt表示第t天的藻密度 (106cells·mL-1),Xt-1表示第t-1天的藻密度 (106cells·mL-1),t表示时间间隔 (d).当连续2 d的μ值小于5%时,藻细胞增殖停止,实验结束 (Li et al., 2015).
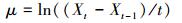
|
(1) |
文中所有实验数据均采用Excel 2007处理,图像均用Origin8.0绘制,数据统计学分析采用SPSS18.0,p值表明各组数据之间存在显著性差异,p值越小表示各组数据之间的显著性差异越大.
3 结果 (Results) 3.1 不同Cu胁迫条件下藻细胞增殖图 1所示为不同Cu2+浓度 (CCu) 胁迫条件下藻细胞密度随培养时间的变化曲线.在培养前期 (0~6 d),各实验组之间并无显著性差异,从第6 d开始,Cu的胁迫效应才开始影响到藻类的增长.当CCu取0.01 μg·L-1时,对应的藻细胞密度显著小于CCu取0.1和100 μg·L-1时的藻细胞密度 (p < 0.001),而CCu取0.1 μg·L-1和100 μg·L-1时二者的藻密度并无显著性差异 (p > 0.05).当CCu取1.0和10 μg·L-1时,对应的藻细胞密度显著大于CCu取0.1和100 μg·L-1时的藻细胞密度 (p < 0.001),但CCu取1.0和10 μg·L-1时二者间并无显著性差异 (p > 0.05).当CCu取10 μg·L-1时,对应藻细胞密度取得所有实验组中的最大值,达到15.2×106 cells·mL-1.当CCu取0.01、0.1、1、100 μg·L-1时,对应的最大藻细胞密度值分别为5.2×106、6.62×106、15.0×106、6.33×106 cells·mL-1,相对CCu为10 μg·L-1时的最大值分别下降了65.8%、56.4%、1.3%、58.4%.
 |
| 图 1 不同Cu2+浓度胁迫下的铜绿微囊藻细胞密度 Fig. 1 Cell density of M. aeruginosa under different CCu |
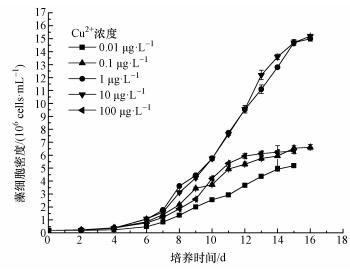
图 2所示为培养液中剩余硝氮浓度随培养时间的变化曲线.在整个培养周期内,硝氮浓度随着培养时间的增长而减小,且在培养后期 (8~16 d) 曲线的变化速率明显大于中前期 (4~8 d),即培养后期氮的吸收速率明显大于培养中前期.当CCu取10 μg·L-1时,藻细胞对氮的吸收明显高于CCu为0.01 μg·L-1时;当CCu取0.1 μg·L-1时,氮的吸收速率最小.实验结束时,CCu在0.01~100 μg·L-1范围内培养液中残留的氮浓度依次为6.55、6.37、3.06、3.29、6.35 mg·L-1.
 |
| 图 2 不同Cu2+浓度下溶液中残留的硝氮 Fig. 2 Residual nitrate in culture solutions under different CCu |
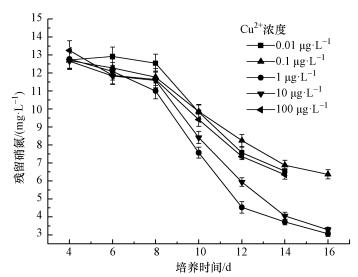
根据样品检测结果,实验用铜绿微囊藻在生长过程中共产生3种藻毒素异构体,分别为MC-RR、MC-YR、MC-LR.在本实验的氮磷条件下,各组在实验过程中合成的MC-RR量非常少,几乎检测不到,MC-YR在各组中虽基本能检测到,占藻毒素总量的比例也均在3%~10%范围内.在本实验氮磷条件下,MC-LR为主导性藻毒素,因此,实验结果中总藻毒素的变化本质上就是藻毒素MC-LR的变化.
如图 3所示,藻毒素总浓度在培养过程中表现为先增长后基本保持稳定且略有下降的趋势, 藻毒素含量从小到大对应的CCu依次为100、0.01、0.1、10、1 μg·L-1.除CCu为1 μg·L-1和10 μg·L-1处理组之间显著性差异较弱外 (p < 0.05),相邻2个浓度之间的藻毒素含量均有极显著性差异 (p < 0.001).当CCu取1 μg·L-1时,总藻毒素浓度取得所有实验组的最大值,为62.4 μg·L-1.当CCu取0.01、0.1、10、100 μg·L-1时,在培养期间藻毒素最大值依次为10.86、16.03、53.65、4.25 μg·L-1,分别是最大藻毒素浓度的17.4%、25.4%、86.0%、6.8%.
 |
| 图 3 不同Cu2+浓度下藻毒素总浓度 Fig. 3 Total concentration of microcystin under different CCu |
Cu对藻类生化过程的影响方式有2种:一种是作为必须元素直接参与藻细胞内某些生化过程;另一种是通过影响影响藻细胞内某些酶的活性来影响藻类对氮磷等元素的利用 (Kashyap et al., 1982;Allen et al., 2007;Wang et al., 2010).氮元素是藻类生长的必须元素,也是藻毒素的重要组成元素.图 4所示为单藻细胞对硝氮的吸收量.由图 4可知,在4~8 d,单藻细胞吸收的硝氮量随着培养时间增加急剧降低,到第8 d后基本趋于稳定.这是由于在4~8 d藻细胞处于快速增长期,且需要大量氮元素来合成新的细胞物质,因此,造成单个细胞吸收硝氮量减小.
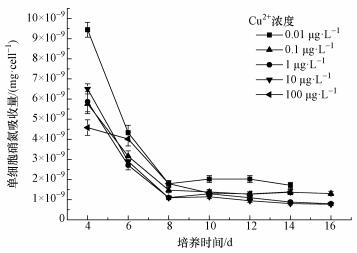 |
| 图 4 不同Cu2+浓度下单细胞硝氮吸收量 Fig. 4 Absorption of cellular nitrate under different CCu |
当CCu取0.01 μg·L-1时,在整个培养周期内,单藻细胞吸收的氮的量显著高于其它CCu条件下藻细胞对氮元素的吸收 (p < 0.01),也就是说,维持藻体内正常生化过程所需硝氮量远高于其它CCu条件下,藻细胞对环境中氮元素的要求更加苛刻.当CCu取0.1和100 μg·L-1时,在培养周期内单藻细胞对硝氮的吸收量显著低于CCu取0.01 μg·L-1时 (p < 0.01),高于CCu取1和10 μg·L-1时 (p < 0.05).当CCu取1和10 μg·L-1时,单藻细胞吸收的硝氮量处于一个很低水平,说明此条件下藻类对氮元素的利用效率处于很高水平,这可能也是在此CCu条件下藻密度能够达到高水平的原因.Cu胁迫下造成硝氮吸收差异的主要原因是不同CCu造成藻细胞内硝酸盐还原酶活性差异 (Kashyap et al., 1982).当CCu取0.01 μg·L-1时,由于铜元素缺乏导致细胞体内硝酸盐还原酶活性降低,硝氮利用效率降低,所以维持细胞生命活动需要吸收更多的硝氮.当Cu2+严重过量时 (CCu取100 μg·L-1),单细胞吸收的硝氮量较高应是由于在此CCu条件下藻细胞密度相对较低,单藻细胞可利用的硝氮量相对较高,因此, 单细胞所吸收的氮量相对较高 (Tsukada et al., 2006; Chen et al., 2016).
4.2 Cu胁迫对单细胞产毒素含量的影响单细胞产毒素含量是衡量藻细胞藻毒素合成的一个重要指标,它能更加直观地表征在一定环境条件下藻细胞个体的藻毒素合成能力.图 5所示为不同CCu条件下单个藻细胞藻毒素合成量的变化曲线.Cu对单藻细胞产毒素的影响结果可分为4种情况.当CCu取0.01 μg·L-1时,CCu处于很低的水平,藻细胞的增殖受到严重限制 (图 1),在快速增长前期 (4~7 d),单细胞产毒素量从1.45×10-6 μg·cell-1增至2.93×10-6 μg·cell-1,而后快速降至1.39×10-6 μg·cell-1(7~10 d),最后基本保持不变.在整个培养周期内,单细胞的藻毒素产量处于1.39×10-6~2.93×10-6 μg·cell-1范围内.当CCu取0.1 μg·L-1时,Cu对藻细胞增殖的限制作用有所缓解 (图 1),单细胞藻毒素产量也明显增大.在培养前期结束时 (4 d),单细胞藻毒素产量已到达2.68×10-6 μg·cell-1,在快速增长前期 (4~8 d),又快速增加至6.27×10-6 μg·cell-1.从8~16 d,随着培养时间的增加,单细胞藻毒素产量缓慢降至1.31×10-6 μg·cell-1.当CCu取1和10 μg·L-1时,单细胞产毒素变化趋势与CCu取0.1 μg·L-1时相似,且始终处于所有实验组的最高水平,只是在实验后期 (9~16 d) 下降的趋势略微平缓,CCu取1 μg·L-1时单藻细胞产毒素量略高于CCu取10 μg·L-1时单藻细胞产毒素量.
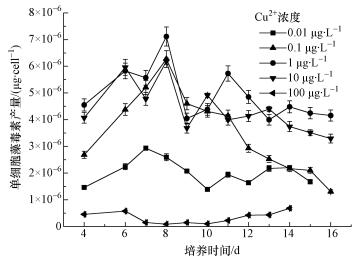 |
| 图 5 不同Cu2+浓度下单细胞藻毒素产量 Fig. 5 Cellular microcystin yield under different CCu |
当CCu取100 μg·L-1时,藻细胞产毒素受到严重抑制,单细细胞产毒素量始终处于很低水平 (0.10×10-6~0.68 ×10-6 μg·cell-1).与其它实验组相比,其特殊之处在于在培养后期,单细胞产毒素水平随着培养时间的持续而增大.结合图 1、4可知,单细胞产毒素量在细胞快速增殖期快速增加,而在生长后期逐渐减小,这与Dai等(2009) 的研究结果相同.不同CCu条件下单细胞产毒素量存在显著性差异,这说明在一定条件下Cu影响总藻毒素产量不仅通过影响藻类增殖一种方式,而且参与了藻毒素合成的某些过程来直接影响单细胞的藻毒素产量.
4.3 Cu胁迫下藻类生长与藻毒素合成之间的关系Long等(2001) 在研究铜绿微囊藻单细胞产藻毒素量与细胞增殖之间的关系时发现,在氮元素限制条件下,藻细胞比增长率 (μ) 与单藻细胞的产毒素量 (q) 存在一定的线性关系:当藻细胞比增长率为零时,单细胞产毒素量处于最低水平;当比增长率取得最大值时,单藻细胞产毒素量取得最大值.Jhnichen等(2011) 在Long等(2001) 研究的基础上分别研究了磷、铁限制下单细胞产毒素水平与细胞比增长率之间的关系,其结果也表明藻细胞比增长率与单藻细胞的产毒素量之间存在简单线性关系.本研究中参考Long等(2001) 的研究方法,将不同CCu胁迫下单细胞藻毒素产量与细胞比增长率进行简单线性拟合,结果如图 6所示.当CCu处于0.01~100 μg·L-1范围内时,单细胞藻毒素产量与细胞比增长率呈现线性关系,且拟合线的斜率随着CCu的增加先增大后减小,在CCu取0.1 μg·L-1时取得最大值.当CCu取100 μg·L-1时,单细胞藻毒素产量与细胞比增长率之间已经变化为负相关关系.结合图 1、5可知,单细胞产毒素量在实验末期迅速减小,引起这一现象的原因以目前的研究机理还难以解释.
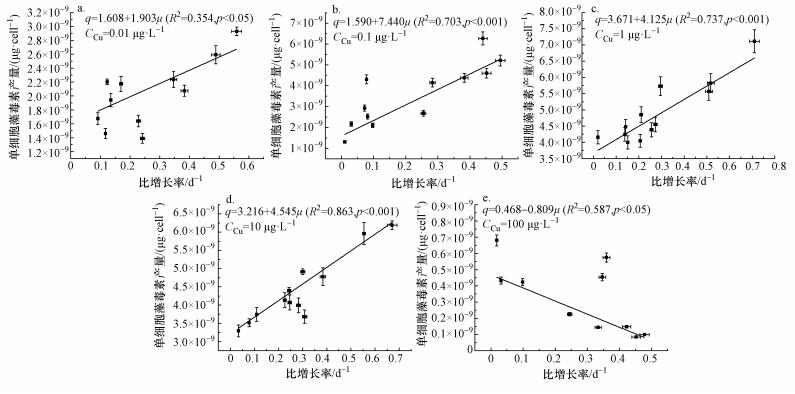 |
| 图 6 不同Cu2+浓度下单细胞藻毒素产量与比增长率线性拟合 Fig. 6 Linear fitting between cellular microcystin and specific growth rate |
1) Cu对藻类生长及藻毒素合成具有显著影响. CCu取1和10 μg·L-1时,Cu对铜绿微囊藻生长的促进效果最好;CCu取1 μg·L-1时,Cu对藻毒素合成的促进效果最好.
2) Cu通过2种方式影响藻毒素产量:一种是直接参与藻毒素合成的某些过程来影响单细胞的藻毒素产量;另一种是通过间接影响藻细胞增殖引起藻密度变化而实现的.
3) 在不同CCu胁迫条件下,藻细胞比增长率μ与单细胞藻毒素产量q之间均符合q=aμ+b的线性关系.
4) 在本文所研究的氮磷条件下,将CCu控制在1 μg·L-1下可有效控制藻类的生长,低于0.1 μg·L-1时控制效果更加显著.
| [${referVo.labelOrder}] | Allen M D, Kropat J, Tottey S, et al. 2007. Manganese deficiency in Chlamydomonas results in loss of photosystem Ⅱ and MnSOD function, sensitivity to peroxides, and secondary phosphorus and iron deficiency[J]. Plant Physiology, 143(1) : 263–277. |
| [${referVo.labelOrder}] | Baek S H, Kim D, Son M, et al. 2015. Seasonal distribution of phytoplankton assemblages and nutrient-enriched bioassays as indicators of nutrient limitation of phytoplankton growth in Gwangyang Bay, Korea[J]. Estuarine, Coastal and Shelf Science, 163 : 265–278. DOI:10.1016/j.ecss.2014.12.035 |
| [${referVo.labelOrder}] | Brand L E. 1983. Limitation of marine phytoplankton reproductive rates by zinc, manganese, and iron[J]. Limnology and Oceanography, 28(6) : 1182–1198. DOI:10.4319/lo.1983.28.6.1182 |
| [${referVo.labelOrder}] | Carmichael W W. 2001. Health effects of toxin-producing cyanobacteria:"the cyanoHABs"[J]. Human and Ecological Risk Assessment:An International Journal, 7(5) : 1393–1407. DOI:10.1080/20018091095087 |
| [${referVo.labelOrder}] | Chen R, Lei Z, Ji J Y, et al. 2017. On the effect of Fe (Ⅲ) on proliferation of Microcystis aeruginosa at high nitrate and low chlorophyll condition[J]. Journal of Environmental Sciences, 52 : 105–110. DOI:10.1016/j.jes.2016.03.006 |
| [${referVo.labelOrder}] | Christoffersen K, Kaas H. 1999. Toxic cyanobacteria in water[J]. A guide to their public health consequences monitoring and management[J].Limnology and Oceanography, 45(5) : 255–258. |
| [${referVo.labelOrder}] | Dai R, Liu H, Qu J H. 2009. The effects of different nitrogen compounds on the growth and microcystin production of Microcystis aeruginosa[J]. Journal of Water Supply:Research and Technology-AQUA, 58(4) : 277–284. DOI:10.2166/aqua.2009.032 |
| [${referVo.labelOrder}] | Fleming L E, Rivero C, Burns J, et al. 2002. Blue green algal (cyanobacterial) toxins, surface drinking water, and liver cancer in Florida[J]. Harmful Algae, 1 : 157–168. DOI:10.1016/S1568-9883(02)00026-4 |
| [${referVo.labelOrder}] | Jähnichen S, Long B M, Petzoldt T. 2011. Microcystin production by Microcystis aeruginosa:Direct regulation by multiple environmental factors[J]. Harmful Algae, 12 : 95–104. DOI:10.1016/j.hal.2011.09.002 |
| [${referVo.labelOrder}] | Kashyap A K, Gupta S L. 1982. Effect of lethal copper concentrations on nitrate uptake, reduction and nitrite release in anacystis nidulans[J]. Zeitschrift für Pflanzenphysiologie, 107(4) : 289–294. DOI:10.1016/S0044-328X(82)80194-3 |
| [${referVo.labelOrder}] | Li J, Wang Z, Cao X, et al. 2015. Effect of orthophosphate and bioavailability of dissolved organic phosphorous compounds to typically harmful cyanobacterium Microcystis aeruginosa[J]. Marine Pollution Bulletin, 92(1/2) : 52–58. |
| [${referVo.labelOrder}] | Long B M, Jones G J, Orr P T. 2001. Cellular microcystin content in N-limited Microcystis aeruginosa can be predicted from growth rate[J]. Applied and Environmental Microbiology, 67(1) : 278–283. DOI:10.1128/AEM.67.1.278-283.2001 |
| [${referVo.labelOrder}] | Long B M. 2010. Evidence that sulfur metabolism plays a role in microcystin production by Microcystis aeruginosa[J]. Harmful Algae, 9(1) : 74–81. DOI:10.1016/j.hal.2009.08.003 |
| [${referVo.labelOrder}] | Lukac M, Aegerter R. 1993. Influence of trace metals on growth and toxin production of Microcystis aeruginosa[J]. Toxicon, 31(3) : 293–395. DOI:10.1016/0041-0101(93)90147-B |
| [${referVo.labelOrder}] | Paerl H W, Fulton Ⅲ R S, Moisander P H, et al. 2001. Harmful freshwater algal blooms, with an emphasis on cyanobacteria[J]. The Scientific World, 1 : 76–113. DOI:10.1100/tsw.2001.138 |
| [${referVo.labelOrder}] | Moisander P H, Ochiai M, Andrew L. 2009. Nutrient limitation of Microcystis aeruginosa in northern California Klamath River reservoirs[J]. Harmful Algae, 8(6) : 889–897. DOI:10.1016/j.hal.2009.04.005 |
| [${referVo.labelOrder}] | Tsukada H, Tsujimura S, Nakahara H. 2006. Effect of nutrient availability on the C, N, and P elemental ratios in the cyanobacterium Microcystis aeruginosa[J]. Limnology, 7(3) : 185–192. DOI:10.1007/s10201-006-0188-7 |
| [${referVo.labelOrder}] | Wang C Kong H N, Wang X Z, et al. 2010. Effects of iron on growth and intracellular chemical contents of Microcystis aeruginosa[J]. Biomedical and Environmental Sciences, 23(1) : 48–52. DOI:10.1016/S0895-3988(10)60031-1 |
| [${referVo.labelOrder}] | Xu H, Paerl H W, Qin B Q, et al. 2010. Nitrogen and phosphorus inputs control phytoplankton growth eutrophic Lake Taihu, China[J]. Limnology and Oceanography, 55(1) : 420–432. DOI:10.4319/lo.2010.55.1.0420 |
 2017, Vol. 37
2017, Vol. 37


