2. 中国科学院饮用水科学与技术重点实验室, 中国科学院生态环境研究中心, 北京 100085;
3. 中国科学院大学, 北京 100049
2. Key Laboratory of Drinking Water Science and Technology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085;
3. University of Chinese Academy of Sciences, Beijing 100049
氨氧化过程是硝化作用的第一步反应并且是限速步骤, 在整个氮循环中发挥着重要的作用 (Troelstra et al., 1990; Kowalchuk et al., 2001).2005年前, 学者们认为氨氧化细菌 (Ammonia-oxidizing bacteria, AOB) 是唯一驱动氨氧化过程的微生物 (Head et al., 1993).但从氨氧化古菌 (Ammonia-oxidizing archaea, AOA) 的发现到纯培养出氨氧化古菌, 改变了人们对氨氧化过程的认识 (Könneke et al., 2005).不同环境中的诸多因素, 包括CO2浓度和温度 (Horz et al., 2004)、土壤pH (Nicol et al., 2008)、盐度 (Zhang et al., 2015)、氧气 (Liu et al., 2011)、氨氮 (Okano et al., 2004) 等都会影响氨氧化细菌 (AOB) 和氨氧化古菌 (AOA) 的生态分布及群落结构.目前而言, 在大多数生态环境中, AOA在数量上比AOB更多, 并且在极端的环境中存在, 但对于这2个氨氧化微生物在不同环境中谁主导氨氧化过程, 还存在着争议 (Schleper et al., 2010).
南水北调是优化配置中国水资源的一项宏伟工程, 此工程的一条重要线路是将南水北调的水流入到北京市重要地表水饮用水源地——密云水库.调水将引起密云水库水位上涨, 这将直接影响密云水库消落带区域.消落带是水生生态系统和陆地生态系统交界带, 其特殊的边界效应为氮循环反应创造了条件, 从而形成了氮循环的“热区”(McClain et al., 2003).国内对消落带的研究起步较晚, 研究主要集中在消落带生态重建、开发利用、植被恢复等方面 (艾丽皎等, 2013), 而对消落带氨氧化微生物丰度和多样性认识尚浅.因此, 本文将对南水北调来水后密云水库水位上涨对消落带中氨氧化古菌 (AOA) 和氨氧化细菌 (AOB) 生物多样性和丰度分布的影响做深入研究, 以功能基因amoA为分子标记, 对AOA和AOB进行定性和定量分析, 通过研究AOA和AOB的生物多样性和丰度分布, 为消落带区域氨氧化机制提供深层的了解和理论依据.
2 材料和方法 (Materials and methods) 2.1 采样点设置及样品采集密云水库位于北京市密云县城北13 km处, 是京津唐地区第一大水库, 华北地区第二大水库, 担负着向北京市供应工农业生产和生活用水的任务.根据密云水库植被和土地利用情况布置5个采样地区, 具体如表 1所示, 每个采样地区的采样点分布如图 1所示.采集样品时间分别为南水北调水来之前和之后, 依次为2015年9月和2015年11月.
| 表 1 密云水库消落带采样点分布 Table 1 Distribution of sampling sites in water-fluctuating zone at Miyun reservior |
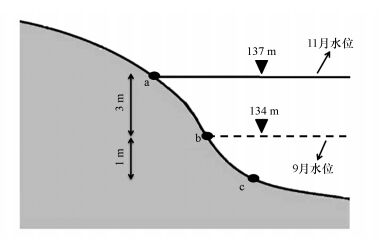 |
| 图 1 密云水库消落带土壤/沉积物采样点示意图 Fig. 1 Schematic of soil and sediment sampling sites in water-fluctuating zone at Miyun reservior |
2015年9月, 分别在采样点a、b、c (分别对应消落带岸上土壤、水陆界面土壤、沉积物) 采表层0~10 cm土壤和沉积物3个平行样品, 标记为BF (Before flooded).2015年11月, 分别在采样点a、b、c采0~10 cm表层土壤及沉积物3个平行样品, 标记为AF (After flooded).将采集的样品贮存于无菌塑料袋中密封, 4 ℃保存至实验室, 一部分样品放于-80 ℃冷冻柜中保存待DNA提取, 用于微生物指标分析.另一部分样品保存于-20 ℃冰柜中用于理化指标分析.
2.2 样品理化指标测定按照《土壤农化分析》(第3版) 的测定方法, 对样品NH4+、NO3-的含量进行测定.用2 mol·L-1KCl溶液浸提样品, 浸提液过滤后用SAN++连续流动分析仪 (Skalar, Netherlands) 测定.用SPSS 13.0、Excel 2010统计分析软件进行数据处理.
2.3 DNA提取和普通PCR扩增称取0.25 g真空干燥土壤样品, 用Power Soil DNA提取盒 (MO BIO Laboratories, Inc.), 按照DNA提取盒内说明书提取DNA.25 μL PCR扩增反应体系包括:DNA模板1 μL, 正反向引物各1 μL, 2×Taq Master Mix (天根生化科技公司, 北京)12.5 μL, ddH2O 9.5 μL.用C1000TM Thermal Cycler仪器 (Bio-Rad, USA) 做普通PCR扩增, 扩增采用的AOA引物序列为:amoA-F:STAATGGTCTGGCTTAGACG, amoA-R:GCGGCCATCCATCTGTATGT;AOB引物序列为:amoA-F: GGGGTTTCTACTGGTGGT, amoA-R:CCCCTCKGSAAAGCCTTCTTC.反应程序如下, AOA:95 ℃预变性30 s;95 ℃变性5 s, 55 ℃退火30 s, 72 ℃延伸45 s, 共40循环;AOB:95 ℃预变性30 s;95 ℃变性5 s, 53 ℃退火1 min, 72 ℃延伸60 s, 共40循环 (Chen et al., 2008).
2.4 PCR产物测序及系统发育树的建立将PCR产物用1.5%的琼脂糖凝胶检测, 有明亮条带的样品送至擎科新业生物技术有限公司 (北京) 做克隆及测序, 将返回来的测序结果提交到NCBI找相似性序列.用DOTUR软件按98%的相似性划出独立操作单元OTU (Operational Taxonomic Unit), 以已知的AOA和AOB的种属作为参比序列, 用Mega 7.0软件以邻位相连法 (Neighbor-Joining) 构建系统发育树.
2.5 AOA和AOB定量PCR实验定量PCR实验采用实时荧光定量PCR实验方法, 引物参见普通PCR扩增实验所用引物.扩增体系为10 μL, 包括:DNA Green Master (Loche, Germany)5 μL, 正反向引物各0.3 μL, ddH2O 3.4 μL, DNA模板1 μL.用罗氏Light Cycler 96仪器 (Loche, Germany) 扩增做定量PCR实验, 定量PCR反应程序如下, AOA:95 ℃预变性10 min;95 ℃变性10 s, 53 ℃退火30 s, 72 ℃延伸60 s, 共40个循环; AOB:95 ℃预变性10 min;95 ℃变性10 s,
55 ℃退火30 s, 72 ℃延伸60 s, 共40个循环 (Wang et al., 2011).先做标准线实验, 将阴性对照和已知拷贝数的质粒稀释的6个标准样品进行定量扩增.AOA和AOB的扩增效率分别为90%和94%, R2分别为0.9919和0.9969.
3 结果 (Results) 3.1 密云水库消落带中NH4+和NO3-的分布从图 2可以看出, 密云水库的水位上涨之后, 各个采样点的NO3-含量有小幅度的升高.NH4+含量在不同的采用点变化不一样, 水位上涨之后, 在5个采样地区的a、b采样点的NH4+含量增加, 而c采样点的NH4+含量略有下降.虽然来水引起的水位变化对NO3-和NH4+有影响, 但从NH4+含量结果可看出, 密云水库消落带地区属于低氨氮环境.
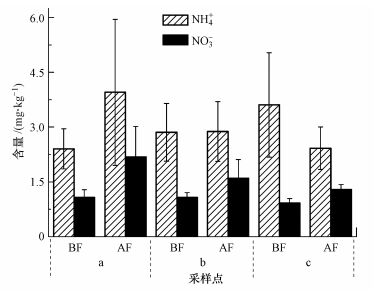 |
| 图 2 消落带岸上土壤、水陆界面土壤、沉积物中NH4+和NO3-的含量 Fig. 2 Concentration of NH4+ and NO3- in soil of landward and land-water interface, sediment in water-fluctuating zone |
通过定量PCR分析得出, 密云水库水位上涨之前, AOA和AOB的amoA功能基因拷贝数范围分别为1.00×107~3.91×107 copies·g-1和5.49×106~9.77×106 copies·g-1.水位上涨之后, AOA和AOB的amoA功能基因拷贝数范围分别为5.80×106~1.56×107 copies·g-1和2.14×106~4.40×106 copies·g-1.密云水库的水位上涨之后, 在5个采样地区的a、b采样点中AOA的amoA功能基因拷贝数均有所降低, 而c采样点中AOA的amoA功能基因拷贝数有所增长.而AOB的amoA功能基因拷贝数在5个采样点的a、b、c采样点中都降低.对比AOA和AOB拷贝数后可以发现, 在各个采样点无论是水位上涨之前还是之后, AOA的amoA功能基因的拷贝数始终比AOB高.2015年9月, 每个采样点样品中AOA的平均丰度比AOB的平均丰度大1.02~7.13倍, 其中, 在水界面土壤中的差异最大.2015年11月水位上涨之后, 每个采样点样品中AOA的平均丰度比AOB的平均丰度大1.96~4.01倍, 同样, 11月份水下3 m沉积物差异最大.
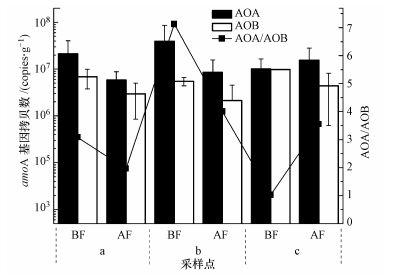 |
| 图 3 消落带岸上土壤、水陆界面土壤、沉积物中AOA和AOB amoA功能基因丰度 Fig. 3 Abundance of AOA and AOB amoA genes in in soil of landward and land-water interface, and sediment in water-fluctuating zone |
对密云水库的岸边带土壤/沉积物样品的理化指标与AOA、AOB丰度进行相关性分析, 结果如表 2所示.皮尔逊相关性分析显示, 水位上涨之前样品中AOB的丰度与土壤NH4+含量呈显著正相关 (p < 0.01).而所有样品中AOA丰度与NH4+及NO3-含量没有呈现正相关性.
| 表 2 消落带中NH4+、NO3-含量和AOA、AOB丰度相关性分析结果 Table 2 Result of partial correlation between concentration of NH4+、NO3- and abundance of AOA、AOB |
选取密云水库库东岸北地区消落带样品为代表, 进行AOA和AOB的多样性分析.通过DNA提取、定性扩增、克隆及测序后, 获得81条AOA、76条AOB amoA功能基因序列.从水位上涨之后样品中获得76条AOA、87条AOB amoA功能基因序列.OTU结果如表 3所示, 可知2015年11月水位上涨之后消落带岸上土壤样品中AOA和AOB的OTU数量有所增长, 而9月的水陆界面土壤和沉积物样品中AOA和AOB的OTU数量有所下降.
| 表 3 密云水库消落带中AOA、AOB amoA功能基因序列和OTU分布 Table 3 The amoA gene sequence and OTUs of AOA and AOB in water-fluctuating zone at Miyun reservior |
基于amoA功能基因的氨氧化古菌系统发育树如图 4a所示, AOA amoA功能基因序列可分为3个簇 (cluster).水位上涨之后水陆交界面土壤和沉积物样品中全部76条AOA amoA功能基因序列集中分布在cluster1中, 水位上涨之前部分消落带样品中26条AOA amoA功能基因序列分布在cluster1中, 其它57条AOA amoA功能基因序列分别分布在cluster2和cluster3中.cluster1包含来自于水位上涨之前消落带及水位上涨之后水陆交界面土壤、水下4 m沉积物样品中共56条amoA功能基因序列, 归属于已知种属Nitrososphaera, 并跟来自熔洞熔岩湖沉积物、杂草地等环境样品的同源性较高.在cluster1中其他来自于水位上涨之前和之后消落带样品中的amoA功能基因序列与湖泊沉积物、松林土等环境的序列同源性较高.cluster2包含来自于水位上涨之前水陆交界面土壤、沉积物样品共11条amoA功能基因序列, 归属于已知种属Nitrosoarchaeum, 并跟来自非农田土壤、水陆交错带沉积物等环境样品的同源性较高.cluster3包含来自于水位上涨之前消落带样品共46条amoA功能基因序列, 归属于已知种属Nitrosopumilus.水位上涨之前各个采样点样品中AOA amoA功能基因序列在3个cluster中都有分布且分别归属于Nitrososphaera、Nitrosoarchaeum、Nitrosopumilus等种属.而水位上涨之后各个采样点样品中AOA amoA功能基因序列只属于Nitrososphaera种属.从而可以看出, 南水北调的水进入密云水库引起的水位变化对氨氧化古菌的群落结构有一定的影响.
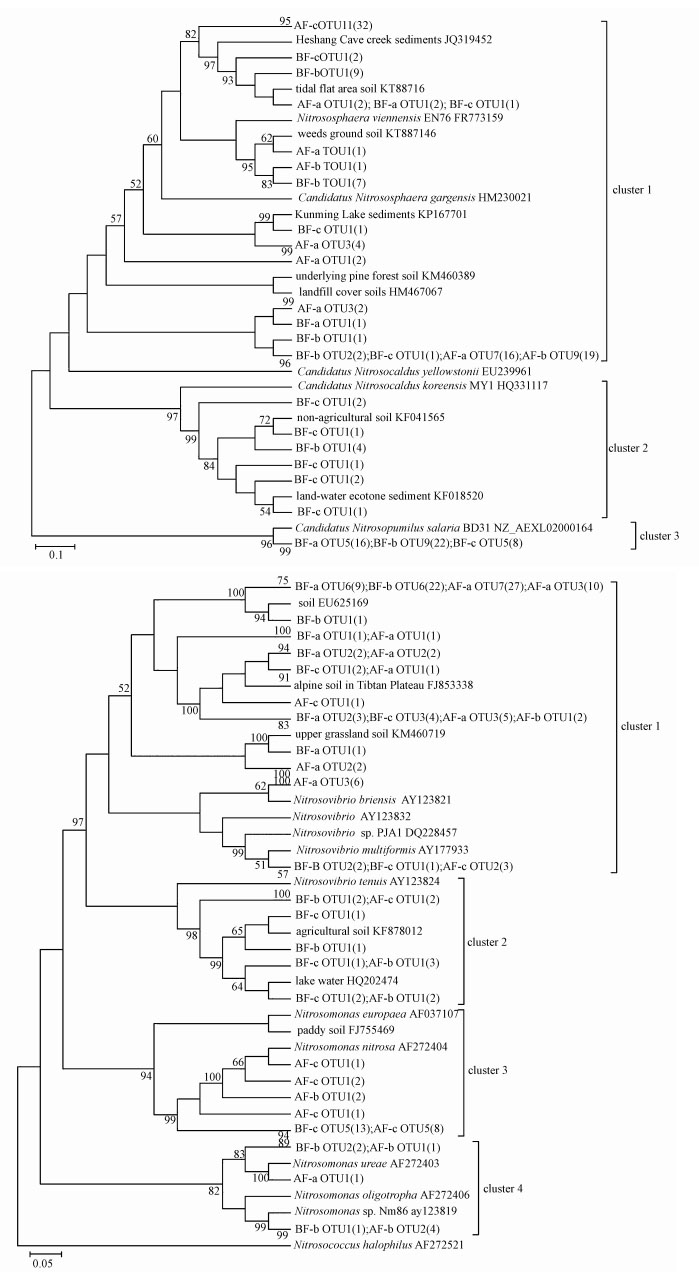 |
| 图 4 基于amoA功能基因序列构建的氨氧化古菌 (AOA)(a) 和氨氧化细菌 (AOB)(b) 系统发育树 (以BF-a、AF-a、BF-b、AF-b、BF-c、AF-c命名的古菌序列分别代表从a~c采样点获得的序列, 其中, BF代表淹没前, AF代表淹没后;圆括号里的数字为每个基因所对应的OTU数;序列名称后的字母加数字代表提交序号, 分支节点上的数字表示每1000次bootstrap分析所支持的次数, 小于50%的未显示;图a中线段表示10%序列差异的分支长度, 图b中线段表示5%序列差异的分支长度) Fig. 4 Phylogenetic tree of ammonia-oxidizing archaea (AOA)(a) and ammonia-oxidizing bacteria (AOB)(b) amoA gene sequences (The obtained bacterial sequences beginning with BF-a and AF-a, BF-b and AF-b, BF-c and AF-c were referred to the sequences retrieved from the sampling sites a~c, respectively. BF means before flooded, AF means after flooded. The number of clones of each OTU is shown in parenthesis. Accessions numbers are shown at the end. Numbers at the nodes indicate the levels of bootstrap support based on neighbor-joining analysis of 1000 resampled datasets. Bootstrap values < 50% are not shown. The bar represents 10% sequence divergence in figure a, the bar represents 5% sequence divergence in figure b) |
基于amoA功能基因的氨氧化细菌系统发育树如图 4b所示, AOB amoA功能基因序列可分为4个簇 (cluster).水位上涨之前消落带样品中共48条AOB amoA功能基因序列分布在cluster1中, 其他amoA功能基因序列分别分布在cluster2、cluster3和cluster4中.水位上涨之后水陆交界面土壤、沉积物样品中的共59条AOB amoA功能基因序列分布在cluster1中, 其他amoA功能基因序列分别分布在cluster2、cluster3和cluster4中.cluster1包含来自于水位上涨之前水陆交界面土壤、沉积物及水位上涨之后水陆交界面土壤、水下4 m沉积物样品中共12条amoA功能基因序列, 归属于Nitrosopira(亚硝化螺菌属).其他来自于消落带水位上涨之前和上涨之后样品中amoA功能基因序列与青藏高原土壤、草原土壤等环境样品的同源性较高.cluster2包含来自于水位上涨之前水陆交界面土壤、沉积物样品和水位上涨之后沉积物样品中共14条amoA功能基因序列, 属于Nitrosovibrio(亚硝化弧菌属), 并跟来自农田土壤、湖泊等环境样品的同源性较高.cluster3和cluster4中的amoA功能基因序列都属于Nitrosomonas(亚硝化单胞菌属), 包含来自于水位上涨之前水陆交界面土壤、沉积物和水位上涨之后水陆交界面土壤、水下沉积物样品共36条amoA功能基因序列.各个采样点样品中AOB amoA功能基因序列无论在水位上涨之前还是之后, 都分布在4个cluster中, 主要属于β-变形菌纲氨氧化细菌菌群:Nitrosopira和Nitrosomonas.由此可发现, 水位的变化对氨氧化细菌群落结构并没有造成影响.
4 讨论 (Discussion) 4.1 水位变化对密云水库消落带中氨氧化微生物分布的影响本研究利用生物分子学方法研究密云水库消落带土壤和沉积物中氨氧化细菌和氨氧化古菌发现, AOA和AOB的amoA功能基因广泛地存在于水库岸边带环境中.2015年11月, 水位上涨约3 m后, 9月份的水陆交界面土壤变成被淹没的状态, 而岸上土壤变为水陆交界面状态.已有研究发现, 氨氧化古菌 (AOA) 对低氨氮更有亲和力, 而氨氧化细菌 (AOB) 更喜好高氨氮环境 (Verhamme et al., 2011).2015年9月消落带土壤中AOB与氨氮含量呈现显著正相关性, 与已有研究结果相符.其他学者在布吉河 (孙海美等, 2012)、中国东海 (He et al., 2015) 及林地、草原土壤、水稻土等不同土地利用条件 (Zhao et al., 2015) 下发现, AOB丰度与氨氮呈显著正相关.土壤AOA基质半饱和常数和基质抑制浓度远低于AOB, 当AOA可以正常生长时, 氨氮不足以支持AOB进行正常的生长代谢 (Prosser et al., 2012).密云水库消落带属于低氨氮环境, AOA更适合生长.水位上涨之后, a、b采样点AOA丰度有所降低, 但在c采样点其丰度高于水位上涨前, 这可能是因为AOA与土壤中的矿化微生物结合, 利用有机质持续矿化所释放的低浓度氨氮进行自养生长, 还有一种可能是因为AOA进行混合营养型生长, 将土壤中的有机质作为获取能量的氮源 (He et al., 2012).在淹水水稻田模拟培养中, 随着被水淹没时间延长AOA丰度总体趋势在降低, 但中间出现波动, 40 d时, AOA丰度有所增长 (宋亚珩等, 2014),与本文结果相似.本研究中, 无论是水位上涨之前还是之后, 各个采样点AOA的丰度比AOB高.对Nitrosopumilu maritimus进行基因组研究发现, 其含有3HP / 4HB代谢途径 (羟基丙酸/羟基丁酸途径) 的完整基因, 具备自养生长的遗传基础, 使AOA在氨氧化过程和固碳过程中减少了能量的消耗, 在不利生态环境中普遍存在且丰度较高 (Walker et al., 2010).在三峡消落带, AOA的数量始终比AOB的数量高, 同样水位上涨之后AOA和AOB各自的丰度有所降低, AOA与AOB比值在增加, 表明AOA更适合生长在低氧/好氧交替的消落带 (Liu et al., 2015), 与本文AOA和AOB丰度特征结果基本一致.并且已有研究认为, 潮湿热带土壤中的AOA对缺氧环境有更好的忍耐力, 说明AOA对低氧逆境有更好的适应能力 (Pett-Ridge et al., 2013).虽然在低氨氮浓度消落带区域环境中AOA在数量上占优势地位, 但AOA丰度与氨氧化速率之间的关系需谨慎分析 (Pratscher et al., 2011).研究结果显示, 土壤环境中AOA对N2O的生成发挥了重要作用 (Jung et al., 2014), 采用同位素示踪技术和氨氧化活性实验可进一步探讨AOA和AOB对消落带氮循环的作用.
4.2 水位变化对密云水库消落带中氨氧化微生物多样性及群落结构的影响从AOA的系统发育树可以看出, 水位上涨之前库东岸北地区a、b、c采样点的AOA共36个OTU归属于Nitrososphaera、Nitrosoarchaeum、Nitrosopumilus.水位上涨之后库东岸北地区a、b、c采样点的AOA共36个OTU都归属于Nitrososphaera, 且土壤簇 (Group 1.1b) 占大多数.在溶解氧含量低的淹水条件下, 有可能土壤簇 (Group 1.1b) AOA在氨氧化过程中发挥着更大的作用 (Zhao et al., 2015).从AOB的系统发育树看出, 水位上涨之前a、b采样点样品中95%的OTU和87%的OTU、水位上涨之后a、b采样点样品中95%的OTU和55%的OTU属于Nitrosopira, c采样点的大部分OTU属于Nitrosomonas.Nitrosomonas europaea能够在缺氧环境中进行反硝化生长 (Bock et al., 1995), 从本文结果可看出, 沉积物的大多数OTU属于Nitrosomonas,与之符合.本文研究表明, 水位的上涨对AOA的种群结构有一定影响, 对AOB的种群结构影响较小.但水位上涨之后, b、c采样点样品中AOA和AOB的OTU数量都在减少.研究人员对白洋淀湿地岸边带氨氧化微生物的分布研究表明, 在水下沉积物中的氨氧化微生物OTU数低于水陆边界和岸上土壤, 多样性低 (叶磊等, 2011).2015年11月b、c采样点已变为被水淹没的状态, 与已有研究结果相符.还有可能是因为在低基质浓度条件下, 对基质亲和力较低的氨氧微生物逐渐被淘汰, 其多样性随之减少 (Zheng et al., 2014).郭佳等 (2016)对三峡库区消落带的研究表明, 周期性淹水-落干对AOB的种群结构影响比较小, 对AOA的种群结构有影响, 并且大部分采样区域AOA和AOB的OTU数量在变小, 与本文研究结果基本相似.Nitrosopira和Nitrosomonas主要存在于土壤和淡水环境中, 并且主导着在土壤和沉积物中氨氧化过程的AOB (Wan et al., 2014).从本研究可以看出, 在密云水库消落带水陆交界面土壤中, Nitrosopira在氨氧化过程中发挥主要的作用, 而在水下更深的沉积物中, Nitrosomonas在氨氧化过程中发挥主要的作用.
5 结论 (Conclusions)1) 在密云水库消落带区域, 水位的变化对AOA和AOB的丰度有一定影响, 水位上涨之后AOA和AOB的丰度有所低.对比AOA和AOB的丰度发现, 无论是水位上涨之前还是之后, AOA的丰度均高于AOB.并且来水前消落带土壤中AOB的丰度与NH4+含量呈显著正相关关系, AOB在低氨氮环境中可能被抑制.因此, AOA在低氨氮的消落带环境中比AOB在数量上占优势.
2) 水位的变化对消落带土壤中AOA的种群结构有影响, 而对AOB的种群结构影响较小.在a采样点, AOA和AOB各自的OTU数在水位上涨之后均有所增加, 而在b、c采样点沉积物中OTU数减少.水位上涨之后, AOA的OTU大多数归属于土壤簇 (Group 1.1b) Nitrososphaera.水位上涨可能加强了土壤簇Nitrososphaera在氨氧化过程中发挥的作用.对于AOB, 水陆交界面土壤和水下沉积物中Nitrosopira和Nitrosomonas分别在氨氧化过程中发挥作用.
| [${referVo.labelOrder}] | 艾丽皎, 吴志能, 张银龙. 2013. 水体消落带国内外研究综述[J]. 生态科学, 2013, 32(2) : 259–264. |
| [${referVo.labelOrder}] | Bock E, Schmidt I, Stüven R, et al. 1995. Nitrogen loss caused by denitrifying Nitrosomonas cells using ammonium or hydrogen as electron donors and nitrite as electron acceptor[J]. Archives of Microbiology, 163(1) : 16–20. DOI:10.1007/BF00262198 |
| [${referVo.labelOrder}] | Chen X P, Zhu Y G, Xia Y, et al. 2008. Ammonia-oxidizing archaea:important players in paddy rhizosphere soil?[J]. Environmental Microbiology, 10(8) : 1978–1987. DOI:10.1111/emi.2008.10.issue-8 |
| [${referVo.labelOrder}] | 郭佳, 蒋先军, 周雪, 等. 2016. 三峡库区消落带周期性淹水-落干对硝化微生物生态过程的影响[J]. 微生物学报, 2016, 56(6) : 983–999. |
| [${referVo.labelOrder}] | He H, Zhen Y, Mi T, et al. 2015. Seasonal and spatial distribution of ammonia-oxidizing microorganism communities in surface sediments from the East China Sea[J]. Acta Oceanologica Sinica, 34(8) : 83–92. DOI:10.1007/s13131-015-0710-z |
| [${referVo.labelOrder}] | He J Z, Hu H W, Zhang L M. 2012. Current insights into the autotrophic thaumarchaeal ammonia oxidation in acidic soils[J]. Soil Biology and Biochemistry, 55 : 146–154. DOI:10.1016/j.soilbio.2012.06.006 |
| [${referVo.labelOrder}] | Head I M, Hiorns W D, Embley T M, et al. 1993. The phylogeny of autotrophic ammonia-oxidizing bacteria as determined by analysis of 16S ribosomal RNA gene sequences[J]. Microbiology, 139(6) : 1147–1153. |
| [${referVo.labelOrder}] | Horz H P, Barbrook A, Field C B, et al. 2004. Ammonia-oxidizing bacteria respond to multifactorial global change[J]. Proceedings of the National Academy of Sciences of the United States of America, 101(42) : 15136–15141. DOI:10.1073/pnas.0406616101 |
| [${referVo.labelOrder}] | Jung M Y, Well R, Min D, et al. 2014. Isotopic signatures of N2O produced by ammonia-oxidizing archaea from soils[J]. The ISME Journal, 8(5) : 1115–1125. DOI:10.1038/ismej.2013.205 |
| [${referVo.labelOrder}] | Könneke M, Bernhard A E, José R, et al. 2005. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature, 437(7058) : 543–546. DOI:10.1038/nature03911 |
| [${referVo.labelOrder}] | Kowalchuk G A, Stephen J R. 2001. Ammonia-oxidizing bacteria:a model for molecular microbial ecology[J]. Annual Reviews in Microbiology, 55(1) : 485–529. DOI:10.1146/annurev.micro.55.1.485 |
| [${referVo.labelOrder}] | Liu S, Hu B, He Z, et al. 2015. Ammonia-oxidizing archaea have better adaptability in oxygenated/hypoxic alternant conditions compared to ammonia-oxidizing bacteria[J]. Applied Microbiology and Biotechnology, 99(20) : 8587–8596. DOI:10.1007/s00253-015-6750-7 |
| [${referVo.labelOrder}] | Liu Z, Huang S, Sun G, et al. 2011. Diversity and abundance of ammonia-oxidizing archaea in the Dongjiang River, China[J]. Microbiological Research, 166(5) : 337–345. DOI:10.1016/j.micres.2010.08.002 |
| [${referVo.labelOrder}] | McClain M E, Boyer E W, Dent C L, et al. 2003. Biogeochemical hot spots and hot moments at the interface of terrestrial and aquatic ecosystems[J]. Ecosystems, 6(4) : 301–312. DOI:10.1007/s10021-003-0161-9 |
| [${referVo.labelOrder}] | Nicol G W, Leininger S, Schleper C, et al. 2008. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J]. Environmental Microbiology, 10(11) : 2966–2978. DOI:10.1111/emi.2008.10.issue-11 |
| [${referVo.labelOrder}] | Okano Y, Hristova K R, Leutenegger C M, et al. 2004. Application of real-time PCR to study effects of ammonium on population size of ammonia-oxidizing bacteria in soil[J]. Applied and Environmental Microbiology, 70(2) : 1008–1016. DOI:10.1128/AEM.70.2.1008-1016.2004 |
| [${referVo.labelOrder}] | Pett-Ridge J, Petersen D G, Nuccio E, et al. 2013. Influence of oxic/anoxic fluctuations on ammonia oxidizers and nitrification potential in a wet tropical soil[J]. FEMS Microbiology Ecology, 85(1) : 179–194. DOI:10.1111/femsec.2013.85.issue-1 |
| [${referVo.labelOrder}] | Pratscher J, Dumont M G, Conrad R. 2011. Ammonia oxidation coupled to CO2 fixation by archaea and bacteria in an agricultural soil[J]. Proceedings of the National Academy of Sciences, 108(10) : 4170–4175. DOI:10.1073/pnas.1010981108 |
| [${referVo.labelOrder}] | Prosser J I, Nicol G W. 2012. Archaeal and bacterial ammonia-oxidisers in soil:the quest for niche specialisation and differentiation[J]. Trends in Microbiology, 20(11) : 523–531. DOI:10.1016/j.tim.2012.08.001 |
| [${referVo.labelOrder}] | 宋亚珩, 王媛媛, 李占明, 等. 2014. 淹水水稻土中氨氧化古菌丰度和群落结构演替特征[J]. 农业环境科学学报, 2014, 33(5) : 999–1006. DOI:10.11654/jaes.2014.05.025 |
| [${referVo.labelOrder}] | 孙海美, 白姣姣, 孙卫玲, 等. 2012. 布吉河丰水期总细菌和氨氧化细菌的定性和定量研究[J]. 环境科学, 2012, 33(8) : 2691–2700. |
| [${referVo.labelOrder}] | Schleper C, Nicol G W. 2010. Ammonia-oxidising archaea-physiology, ecology and evolution[J]. Advances in Microbial Physiology, 57 : 1–41. DOI:10.1016/B978-0-12-381045-8.00001-1 |
| [${referVo.labelOrder}] | Troelstra S R, Wagenaar R, De Boer W. 1990. Nitrification in Dutch heathland soils[J]. Plant and Soil, 127(2) : 179–192. DOI:10.1007/BF00014424 |
| [${referVo.labelOrder}] | Verhamme D T, Prosser J I, Nicol G W. 2011. Ammonia concentration determines differential growth of ammonia-oxidising archaea and bacteria in soil microcosms[J]. The ISME Journal, 5(6) : 1067–1071. DOI:10.1038/ismej.2010.191 |
| [${referVo.labelOrder}] | Walker C B, De La Torre J R, Klotz M G, et al. 2010. Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea[J]. Proceedings of the National Academy of Sciences, 107(19) : 8818–8823. DOI:10.1073/pnas.0913533107 |
| [${referVo.labelOrder}] | Wang S, Wang Y, Feng X, et al. 2011. Quantitative analyses of ammonia-oxidizing Archaea and bacteria in the sediments of four nitrogen-rich wetlands in China[J]. Applied Microbiology and Biotechnology, 90(2) : 779–787. DOI:10.1007/s00253-011-3090-0 |
| [${referVo.labelOrder}] | Wang X, Wang C, Bao L, et al. 2014. Abundance and community structure of ammonia-oxidizing microorganisms in reservoir sediment and adjacent soils[J]. Applied Microbiology and Biotechnology, 98(4) : 1883–1892. DOI:10.1007/s00253-013-5174-5 |
| [${referVo.labelOrder}] | 叶磊, 祝贵兵, 王雨, 等. 2011. 白洋淀湖滨湿地岸边带氨氧化古菌与氨氧化细菌的分布特性[J]. 生态学报, 2011, 31(8) : 2209–2215. |
| [${referVo.labelOrder}] | Zhang Y, Chen L, Dai T, et al. 2015. The influence of salinity on the abundance, transcriptional activity, and diversity of AOA and AOB in an estuarine sediment:a microcosm study[J]. Applied Microbiology and Biotechnology, 99(22) : 9825–9833. DOI:10.1007/s00253-015-6804-x |
| [${referVo.labelOrder}] | Zhao D, Luo J, Wang J, et al. 2015. The influence of land use on the abundance and diversity of ammonia oxidizers[J]. Current Microbiology, 70(2) : 282–289. DOI:10.1007/s00284-014-0714-5 |
| [${referVo.labelOrder}] | Zhao J, Wang B, Jia Z. 2015. Phylogenetically distinct phylotypes modulate nitrification in a paddy soil[J]. Applied and Environmental Microbiology, 81(9) : 3218–3227. DOI:10.1128/AEM.00426-15 |
| [${referVo.labelOrder}] | Zheng Y, Hou L, Newell S, et al. 2014. Community dynamics and activity of ammonia-oxidizing prokaryotes in intertidal sediments of the Yangtze Estuary[J]. Applied and Environmental Microbiology, 80(1) : 408–419. DOI:10.1128/AEM.03035-13 |
 2017, Vol. 37
2017, Vol. 37


