2. 重庆融极环保有限公司, 重庆 400000
2. Chongqing Rongji Environmental Technology Co., Ltd, Chongqing 400000
聚甲醛生产废水含有甲醛、三聚甲醛 (TOX)、二氧五环、甲缩醛和酚类等有害物质, 具有盐分高、COD高等特征, 很难生物处理至达标排放, 对环境和人体有极大的危害.目前针对聚甲醛废水常见的处理方法有石灰法、高级氧化法 (如Fenton氧化法、湿式氧化法、臭氧催化氧化法)、复合工艺法等 (徐潇雨等, 2013).但由于以上方法会产生大量化学污泥、条件要求苛刻、运行成本较高、工艺管理困难, 因此应用受限;普通生物法也由于甲醛、TOX等有毒物质的抑制作用, 许多微生物活性丧失, 无法实现有效生物降解.
通过对聚甲醛污水反应器底泥分离筛选, 本课题组先后获得甲醛降解菌Candida maltosa和Pseudomonsa putida(李媛等, 2015) 和三聚甲醛 (TOX) 降解菌Bacillus methylotrophicus(陆瑜丰等, 2016) 等, 调查了其在不同环境因子下对TOX的降解规律, 并发现B. methylotrophicus与甲醛降解菌的生物强化组的结果优于其它组合, 可共同消除抑制微生物群落的主要毒性物质.在此基础上, 本次实施了聚甲醛废水生物强化的中试模拟研究, 除调查污染物去除规律和稳定强化系统外, 还利用PCR-TGGE技术分析中试系统中微生物的群落结构和种群动态, 以对强化系统高稳态、高抗冲击负荷能力的解读, 为工业难降解污水的生物强化处理提供有益的思路.
2 材料与方法 (Materials and methods) 2.1 菌株麦芽糖假丝酵母 (C. maltosa)、恶臭假单胞菌 (P. putida) 和甲基营养型芽孢杆菌 (B. methylotrophicus), 为重庆大学城市建设与环境工程学院微生物分子生态学实验室保存菌株.以分离纯化的菌株B. methylotrophicus及实验室分离出的甲醛降解菌按2:1(体积) 组合成的复合菌剂作为外投菌剂.
2.2 活性污泥与水样活性污泥取自某煤化工企业聚甲醛污水厂曝气池;以该污水厂厌氧段出水作为中试模拟进水 (同时亦为该污水厂好氧段进水), 水质数据见表 1.
| 表 1 系统进水水质 Table 1 Quality of the influent wastewater |
扩培培养基 (LB):蛋白胨10 g、氯化钠10 g、酵母浸出粉5 g、蒸馏水1000 mL、pH 7.0, 1×105 Pa灭菌20 min.
2.4 指标测定COD测定:HACH消解法 (吉芳英等, 2003);甲醛测定:乙酰丙酮分光光度法;TOX测定:参照侯丽等 (2013)顶空色谱毛细柱法方法测定.
2.5 聚甲醛废水中试系统反应器及运行参数中试模拟装置以污水厂工艺为参照, 采用钢筋混凝土罐作为连续流反应器, 共设一级好氧 (R1)、二级好氧 (R2)、三级好氧 (R3) 和二沉池 (R4) 等4级, Q1~Q3为风机, J1~J3为搅拌器, F1~F12为阀门 (图 1), 各反应器有效容积分别为2.4、0.8、2.4和0.6 m3, 设计水力停留时间 (HRT) 分别为48、16、48 h和8 h.各反应器配置有相应污水泵、变频搅拌器及空压机以保证系统正常连续运行;流量通过出水阀和电磁流量计控制, 污泥回流比控制为50%~80%;系统剩余污泥通过二沉池底部排泥阀定期排放.当系统运行稳定后于一级好氧反应器R1中按容积比例的1%投加菌液;首次加入菌剂时反应器R1需停止进、出水, 维持DO值2~3 mg·L-1闷曝24 h, 而后中试反应系统在其他运行条件不变下再次实现连续运行.
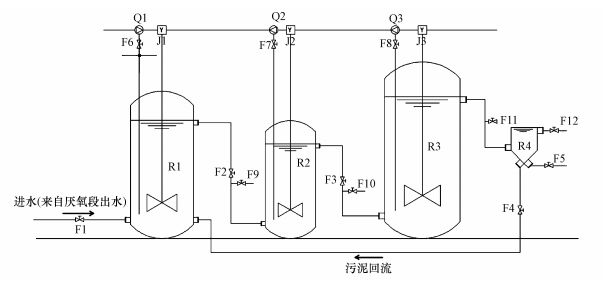 |
| 图 1 中试模拟装置简图 Fig. 1 The sketch of pilot-scale reactors |
系统运行后每天定时取样, 测定各反应器进出水甲醛、TOX和COD浓度.样本基因组DNA提取所需活性污泥取自R1反应器第5、15、30、40和55 d, 样品采集后于-20 ℃保存备用.
2.7 活性污泥镜检及扫描电镜 2.7.1 活性污泥的显微镜观察取反应器R1未经强化的原始活性污泥以及投加菌剂强化运行后第5、30和40 d的活性污泥于光学显微镜下观察, 并利用Motic Images Advanced 3.2软件进行记录拍照, 分析各阶段活性污泥絮体状态以及微生物生长状况.
2.7.2 活性污泥的扫描电镜观察取运行至40 d时中试系统 (生物强化) 与同期污水厂 (未强化) 的活性污泥样品, 首先用戊二醛、酒精等逐级脱水固定, 然后低温干燥, 最后喷金进行扫描电镜分析其表面及微生物种群形态.
2.8 活性污泥总DNA的提取与纯化提取方法参照OMEGA DNA提取试剂盒说明书进行.取3 μL提取的DNA与1 μL 6 × loading buffer混合后, 用1%琼脂糖凝胶电泳检验其DNA浓度及大小, 并判断是否需要进行纯化.若提取的DNA纯度不够, 用TaKaRa DNA凝胶回收试剂盒进行纯化;若纯度够, 亮度不够, 尽量不纯化, 否则会因试剂盒对大片段DNA回收率低, 影响后续PCR.
2.9 污泥总基因组DNA的PCR扩增对已纯化的DNA, 选择引物R518(5′AT TACCGCGGCTGCT GG3′) 和F341-GC5′CGCCCG CCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGG CCTACGGGAGGCAGCAG3′) 进行16S rDNA V3区的扩增.PCR反应体系为:总反应体积50 μL, 其中10×Taq buffer 5 μL, d NTP mix 4 μL, 上下游引物 (10 μmol·L-1) 各2 μL, DNA模板4 μL, Taq酶0.5 μL, 灭菌超纯水32.5 μL.反应条件为:95 ℃预反应5 min;95 ℃变性1 min, 58 ℃退火45 s, 72 ℃延伸1 min, 反应循环35次; 72 ℃延伸5 min.用1%琼脂糖凝胶电泳检验PCR产物, 若一次扩增产物亮度不够, 用一次扩增产物作为模板进行二次扩增, 反应体系不变, 则将反应条件中的循环次数减为26次.
2.10 污泥样品中群落结构的PCR-TGGE分析TGGE所需凝胶的配制参照王云仙等 (2010)实验步骤.主要分3步:第1步电压300 V, 温度范围为20~ 20 ℃, 时间10 min;第2步电压0 V, 温度范围为42~60 ℃, 时间10 min;第3步电压155 V, 温度范围为42~60 ℃, 时间18 h.电泳结束后采用银染法染色, 染色显影后用UVP凝胶成像系统于白光下拍照保存, 并用软件Quantity One进行分析.
2.11 微生物群落多样性分析以Shannon-wiener指数来作为群落结构量度指标, 展示系统整体微生物群落中近似的多样性程度.Shannon-wiener指数: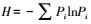
甲醛是聚甲醛污水的主要有毒物质之一, 但部分微生物可以利用甲醛作为碳源和能源, 从而可对其进行降解.本次选择性生物强化菌剂中的甲醛降解菌为麦芽糖假丝酵母 (C. maltosa)、恶臭假单胞菌 (P. putida), 系前期分离及测试菌株.中试系统采用污水厂同期进水, 对中试系统一级好氧反应器 (R1) 出口、二沉池 (R4) 出水和同期污水厂出水的甲醛浓度进行了测定, 结果见图 2.
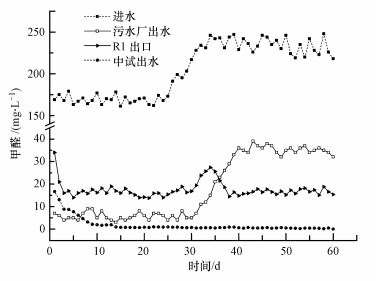 |
| 图 2 系统反应器甲醛进出水浓度 Fig. 2 Formaldehyde concentration of influent and effluent in reactors |
由图 2可知, 在运行的0~25 d、进水甲醛浓度控制在150~200 mg·L-1之间时, 中试系统在短期适应后, 反应器R1与中试系统出水甲醛浓度均逐渐降低, R1出水甲醛稳定在16~20 mg·L-1, 甲醛去除率在89.8%以上;而中试最终出水甲醛浓度均低于4 mg·L-1, 系统甲醛总去除率高达97.8%.运行至26~35 d时, 进水甲醛被调控升高, R1出口甲醛浓度出现轻微波动后逐步恢复至前期降解水平, 而中试系统最终出水几乎不受影响.而对比同期聚甲醛污水厂出水状况, 虽然0~25 d初始阶段时污水厂有较高的甲醛降解率 (95.6%), 但当甲醛冲击负荷出现以后, 出水甲醛浓度大幅攀升, 可能污水厂原生污泥中部分微生物活性受到极大抑制.对照实验表明, 中试系统可耐受住高浓度甲醛的冲击, 其抗冲击负荷能力远高于污水厂污泥系统.其主要原因应该是该强化菌剂的甲醛耐受浓度可达1060 mg·L-1, 在720 mg·L-1以下可实现甲醛的有效降解从而稳定中试系统 (李媛等, 2015).
针对甲醛的微生物降解, 国内外近年来关于此方面的研究也开始逐渐增多, 研究中涉及的甲醛降解微生物有细菌、酵母菌及少部分真菌.这些已经报道的菌株对甲醛的降解能力高低不一, Halomonas sp. MA-C在甲醛浓度100 mg·L-1以下时能很好生长, 而当甲醛浓度提升至125~150 mg·L-1时, 即使在碳源丰富的培养基中仍不能生长 (Azachi et al., 1995);Rhodococcus erythropolis UPV-1在近20 h内去除了20 mg·L-1的甲醛 (Hidalgo et al., 2002);Pseudomonas pseudoalcaligenes OSS能在24 h内完全降解3700 mg·L-1的甲醛 (Mirdamadi et al., 2005).即使同一菌属的菌, 不同菌株之间的甲醛降解率也相差较大, Pseudomonas putida A2能够在24 h内将240 mg·L-1的甲醛降解至40 mg·L-1(Adroer et al., 1990);Pseudomonas putida A1最高能耐受1200 mg·L-1的甲醛, 完全降解400 mg·L-1的甲醛耗时56 h (谢文娟等, 2011);Pseudomonas putida能在含有丰富碳源的条件下46 h内降解5000 mg·L-1的甲醛, 属于甲醛耐受及降解率较高的菌株 (徐云等, 2010), 寻找高浓度甲醛高效降解菌仍然是甲醛生物降解的目标.
3.2 废水中TOX的生物降解特征TOX为聚甲醛废水中浓度仅次于甲醛的有毒污染物, 且较甲醛更难生化降解.为考察复合菌剂对TOX降解能力, 中试系统采用污水厂同期进水, 对中试系统一级好氧反应器 (R1) 出口、二沉池 (R4) 出水和同期污水厂出水的TOX浓度进行了测定, 结果如图 3所示.
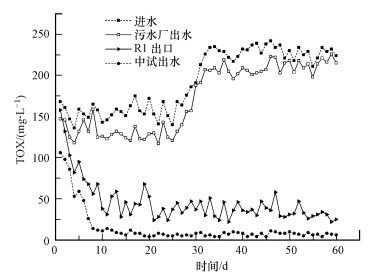 |
| 图 3 系统反应器TOX进出水浓度 Fig. 3 TOX concentration of influent and effluent in reactors |
由图 3可知, 污水厂出水TOX浓度及变化趋势与进水基本一致, TOX降解率不到10%;而当后期受到TOX浓度冲击时, 更是几乎不降解, 可见污水厂好氧段已失去对TOX的降解能力.而中试系统加入含有甲基营养型芽孢杆菌 (B. methylotrophicus) 的复合菌剂后, R1出口和中试出水的TOX浓度均逐步降低, 经0~10 d适应期后出水即趋于稳定.在10~30 d内, R1出口TOX浓度平均为40 mg·L-1, 对TOX降解率为73.5%;最终中试出水低于10 mg·L-1, 去除率高达94.2%以上.即使在26 d后TOX浓度逐渐上升至250 mg·L-1左右, 中试出水TOX浓度仍稳定在10 mg·L-1以下, 中试系统展示出较强的耐受TOX和抗冲击负荷的能力.
3.3 废水中COD生物降解特征系统稳定运行并加入复合菌剂后, 测定污水厂进水、中试R1出口、中试系统出水和同期污水厂出水的COD值, 结果见图 4.
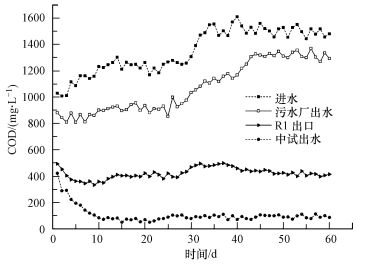 |
| 图 4 系统反应器进出水COD Fig. 4 COD concentration of influent and effluent in reactors |
由图 4可知, 系统进水COD变化主要分为2个阶段:0~30 d, COD为1000~1250 mg·L-1;30~60 d, COD为1500~1600 mg·L-1.在同等进水条件下, 污水厂好氧段COD降解率不到20.0%;当中期受到负荷冲击时, 其出水COD甚至达1300 mg·L-1, 污水厂整个好氧段已处于崩溃状态.而对于中试系统, 经短暂适应期后, R1出口COD趋于稳定, 保持在350~450 mg·L-1之间, 去除率达65.8%以上;而中试系统在运行至10 d时出水COD便降至120 mg·L-1以下, COD去除率高达92.6%, 满足污水综合排放标准GB8978-1996二级标准, 整个中试系统也展现出优良的抗冲击负荷能力.
中试系统甲醛、TOX和COD去除率如表 2所示.结合图 2、3和4可知, 相比于甲醛, TOX对于普通活性污泥更难降解且对微生物毒性更强, 是引起聚甲醛废水污染物和COD去除率低的主要因素.经强化后中试系统获得同步有效降甲醛和TOX的能力, 从而解除甲醛、特别是TOX对其它COD降解微生物的代谢和生长的抑制, 通过协同作用增强活性污泥去除COD的能力.
| 表 2 主要污染物去除率 Table 2 The degradation of pollutants |
对系统运行不同时期活性污泥进行光学显微镜观察, 分析不同阶段活性污泥形态及生物相变化, 结果如图 5所示.
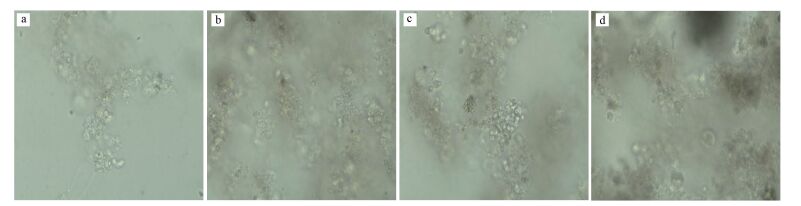 |
| 图 5 各阶段活性污泥镜检图 (10 × 40光学显微镜)(a.未强化, b.强化5 d, c.强化30 d, d.强化40 d) Fig. 5 The phase-contrast microscopic image of actived sludge in different periods (10×40 optical microscope) (a. unenhenced, b. enhenced 5 d, c. enhenced 30 d, d. enhenced 40 d) |
由图 5总体可看出, 未强化前污泥絮体松散, 污泥颗粒较小, 且未观察到任何原生及后生动物, 说明该活性污泥活性差, 这也从另一方面解释了污水厂好氧段COD去除率低的原因.在投加复合菌剂运行至第5 d以后, 污泥絮体明显较为紧实, 且颗粒变大;至第30 d时, 活性污泥相对于第5 d时则较为松散, 观察到有球状菌团出现, 而期间进水TOX骤升至250 mg·L-1, COD升至1600 mg·L-1左右, 受到负荷冲击, 这也许是微生物抵抗外界不利因素侵害的一种反应;当运行至第40 d时, 活性污泥絮体更为密实, 且颗粒度最大, 并有轮虫出现, 表明此时系统在经历负荷冲击后运行稳定, 活性污泥生长状态良好.
3.4.2 污泥扫描电镜分析分别选取同期污水厂一级氧化池和反应器R1运行至第40 d的活性污泥, 作扫描电镜对比观察, 结果如图 6所示.
 |
| 图 6 强化前后污泥扫描电镜图 (放大倍数3000x)(a.同期聚甲醛污水厂活性污泥, b.中试系统第40 d活性污泥) Fig. 6 The scanning electronic microscopic graphs of sludge during different operation periods (Image magnification 3000x) |
同期聚甲醛污水厂活性污泥 (图 6a) 疏松多孔, 且有大量丝状菌附着繁殖, 期间甲醛和TOX浓度均在250 mg·L-1以上, 系统受严重负荷冲击, 表明此时污泥已中毒失活, 生长状况较差;而同期强化中试系统活性污泥 (图 6b) 密实少孔, 且有杆状和球状菌存在, 可看出强化后中试系统较原污水厂对甲醛及TOX毒性有更强的耐受和降解能力.
3.5 活性污泥微生物群落结构及多样性分析 3.5.1 微生物群落结构变化分析对各个阶段活性污泥样品进行DNA提取, 并将所得污泥总DNA进行PCR扩增实验, 活性污泥6个样品PCR均未出现非特异性扩增, 片段大小在250~500 bp之间, 满足后续温度梯度凝胶电泳 (TGGE) 实验要求.系统运行各阶段PCR-TGGE图谱及泳道识别见图 7.
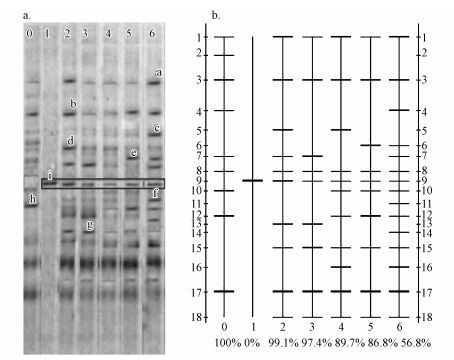 |
| 图 7 一级氧化反应器R1不同运行时段污泥TGGE图谱及泳道识别图 (a.污泥TGGE图谱; b. TGGE图谱泳道识别图; 0.未强化, 1. B. methylotrophicus, 2.第5 d, 3.第15 d, 4.第30 d, 5.第40 d, 6.第55 d) Fig. 7 The TGGE fingerprint and compare lane images of R1 reactors at different periods (0. unenhenced, 1. B. methylotrophicus, 2. 5th d, 3. 15th d, 4. 30th d, 5. 40th d, 6. 55th d) |
由图 7a可看出, 未强化前系统微生物群落结构较单一, 但随着强化菌群的加入及进水水质变化, 图谱部分条带出现亮度逐渐变暗或增加, 以及出现新条带的现象, 表明该系统活性污泥微生物种群结构发生了明显演替.以0号样品 (未强化) 作为参照, 6号与0号样品相似性指数最低, 仅为56.8%(图 7b), 表明强化后稳定运行的中试系统与原污泥系统的微生物群落结构已有较大差异.而相邻泳道6号 (55 d)、5号 (40 d) 之间相似性相差也较大, 研究认为这是系统对冲击负荷实现了有效适应, 实现了优势菌株的快速增长.
图 7a中i谱带为原活性污泥中不具有的B. methylotrophicus, 该菌加入中试系统后一直存在, 这揭示了中试系统TOX低的原因.随着运行进程, TGGE图谱的i谱带出现了亮度先下降、后逐渐增加和在第30 d时最暗的现象, 这应该同该系统受到负荷冲击有关, 是菌株对系统环境变化的适应所致.运行至后期代表B. methylotrophicus的条带i亮度恢复, 几乎与强化初期持平, 说明此时B. methylotrophicus已成功附着于活性污泥中, 并实现了有效增殖.而原污水厂活性污泥中没有该谱带和B. methylotrophicus, 反映在水质指标上就是TOX较高, 水质毒性未解除, 导致其生物种群数量也不及中试系统稳定态多, 从而COD降解率也较低.总体来看, 菌株B. methylotrophicus在系统中拥有抵抗负荷冲击和去除TOX所需的优势地位, 解除了TOX对其他微生物的抑制, 实现聚甲醛废水的高效处理.
3.5.2 活性污泥微生物多样性分析中试系统污泥群落的Shannon-wiener指数变化情况如图 8所示.
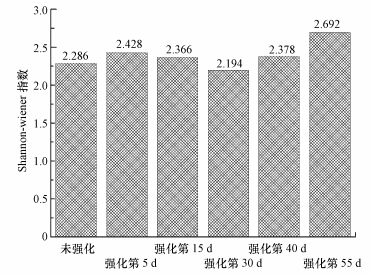 |
| 图 8 活性污泥各阶段Shannon-wiener指数变化 Fig. 8 The variation of Shannon-wiener Index of activated sludge in different periods |
由图 8可知, 在整个运行期间, 系统污泥微生物多样性经历了由高到低、再由低到高的过程.未强化前污泥Shannon-wiener指数低 (2.286), 说明其微生物多样性相对较低.加入菌剂初期 (第5 d), Shannon-wiener指数上升至2.428, 大幅增强了系统微生物种类和多样性.当运行至第30 d, 期间由于负荷冲击使Shannon-wiener指数一度降至2.194, 表明系统微生物生长受到严重抑制致使其多样性降低;结合图 7b(泳道4) 可知, 负荷冲击虽使活性污泥微生物多样性有所降低, 但仍未影响到关键优势菌株如B. methylotrophicus对目标污染物TOX的降解能力.系统稳定运行期55 d时, Shannon-wiener指数大幅提高至2.692, 微生物多样性获得进一步增加, 表明此时中试系统已完全适应进水高负荷的冲击, TOX毒性被降低, 微生物种群数量增加, 其中B. methylotrophicus则是维持该系统微生物多样性回复上升和稳定的关键因子和优势菌株.
4 结论 (Conclusions)1) 复合菌剂被应用于中试系统进行了聚甲醛降解的生物强化研究, 当采用生产污水作为进水时, 中试系统最终出水甲醛、TOX和COD浓度分别低于4、10和120 mg·L-1, 其降解率在97.8%、94.2%和92.6%以上, 出水水质达到预期目标.
2) PCR-TGGE图谱分析表明, 添加强化复合菌剂的中试系统, 聚甲醛降解菌B. methylotrophicus可以在活性污泥中实现有效增殖, 在经受住冲击负荷后成为了系统的优势菌株, 支撑着中试系统对TOX的有效降解.
3) 复合菌剂的加入不仅大幅降低了TOX、甲醛等物质的毒性, 更由于毒性物质对活性污泥中微生物抑制的去除, 提高了中试系统的微生物活力和微生物多样性, 不仅增强了系统的抗冲击负荷能力, 也最终形成了一个稳定的聚甲醛污水处理系统.
| [${referVo.labelOrder}] | Azachi M, Henis Y, Oren A, et al. 1995. Transformation of formaldehyde by a Halomonas sp[J]. Canadian Journal of Microbiology, 41(6) : 548–553. DOI:10.1139/m95-073 |
| [${referVo.labelOrder}] | Adroer N, Casas C, de Mas C, et al. 1990. Mechanism of formaldehyde biodegradation by Pseudomonas putida[J]. Applied Microbiology and Biotechnology, 33(2) : 217–220. DOI:10.1007/BF00176528 |
| [${referVo.labelOrder}] | Hidalgo A L M P. 2002. Formaldehyde removal in synthetic and industrial wastewater by Rhodococcus erythropolis UPV-1[J]. Applied Microbiology and Biotechnology, 58(2) : 260–264. DOI:10.1007/s00253-001-0876-5 |
| [${referVo.labelOrder}] | 侯丽, 辛德旺, 海芳. 2013. 聚甲醛工业废水中甲缩醛、三乙胺、甲醇、三聚甲醛、苯、二氧五环等微量组分含量的测定[J]. 中国石油和化工标准与质量, 2013(16) : 19. DOI:10.3969/j.issn.1673-4076.2013.16.021 |
| [${referVo.labelOrder}] | 吉芳英, 杨琴, 罗固源. 2003. 实验室自配HACH-COD替代试剂研究[J]. 给水排水, 2003, 29(1) : 17–20. |
| [${referVo.labelOrder}] | 李媛. 2015. 甲醛降解菌的筛选及其生物强化研究[D]. 重庆: 重庆大学 |
| [${referVo.labelOrder}] | 陆榆丰. 2016. 三聚甲醛降解菌的筛选鉴定及其对聚甲醛废水的生物强化研究[J]. 重庆:重庆大学, 2016 . |
| [${referVo.labelOrder}] | Mirdamadi S, Rajabi A, Khalilzadeh P, et al. 2005. Isolation of bacteria able to metabolize high concentrations of formaldehyde[J]. World Journal of Microbiology and Biotechnology, 21(6/7) : 1299–1301. |
| [${referVo.labelOrder}] | 王云仙. 2010. 热泵水源水体中藻类和细菌群落的变化[D]. 重庆: 重庆大学 |
| [${referVo.labelOrder}] | 谢文娟, 王洁, 孙珮石, 等. 2011. 高效降解甲醛菌株的分离鉴定及其特性[J]. 微生物学通报, 2011, 38(11) : 1626–1631. |
| [${referVo.labelOrder}] | 徐云, 金晶, 郑重, 等. 2010. 高活性高耐受甲醛降解菌株的分离鉴定及降解条件研究[J]. 环境科学, 2010, 31(10) : 2481–2486. |
| [${referVo.labelOrder}] | 徐潇雨, 郑俊, 魏金亮. 2013. 煤制聚甲醛废水处理工艺研究[J]. 给水排水, 2013, 39(S1) : 324–326. |
 2017, Vol. 37
2017, Vol. 37


