2. 环境保护部南京环境科学研究所, 南京 210042;
3. 江苏省环境科学研究院, 南京 210000
2. Nanjing Institute of Environmental Science, Ministry of Environmental Protection, Nanjing 210042;
3. Jiangsu Provincial Academy of Environmental Science, Nanjing 210000
湖泊中的底泥细菌作为湖泊系统的分解者,通过物质循环和能量流动,影响和调节水体环境,在实现水质净化、改善湖泊生态环境中发挥了重要作用 (任丽娟等,2013),而水体环境质量和功能的变化也反过来影响着湖泊底泥细菌群落结构和分布.湖泊底泥环境通常是营养盐充足、微生物种类繁多、生物活性高,在整个湖泊污染物质降解中起着十分关键的作用,也是湖泊物质循环的主要中枢 (屈建航等,2007).底泥细菌群落结构特征及多样性的研究对了解水体富营养化程度及水体生态系统功能的演变具有重要的意义,因此受到大家广泛的关注.
滆湖地处太湖流域,总面积约164 km2,为苏南第二大湖泊,地跨无锡宜兴和常州武进两地,据多年监测,滆湖平均水深为1.47 m,水位3.3 m,蓄水量约1.575 × 10 m3.近年来,滆湖周围地区农业生产及人工养殖的迅速发展,致使湖体水污染和富营养化程度加剧,目前有关滆湖重金属含量 (熊春晖等,2016)、水文特征 (张毅敏等,2013)、浮游动植物 (熊春晖等,2016) 及水生植物恢复 (杨飞等,2015) 等方面的研究较多,但对湖泊沉积物中细菌群落组成及结构报道相对较少.本研究以滆湖为研究对象,在进行水质分析的基础上,采用16S rRNA高通量生物测序技术,对滆湖不同区域表层底泥中微生物群落组分及多样性进行分析,旨在揭示滆湖底泥微生物群落分布特征及与水体富营养化的响应关系,为进一步探讨滆湖水体水质演变规律提供参考.
2 材料与方法 (Materials and methods) 2.1 样品采集与处理2015年11月中旬,在滆湖由南到北选取4个不同生态类型湖区采样点,分别为:南部草型湖区殷村港 (G1),位于滆湖南部区域,曾有大量挺水和沉水植物,后因夏季降雨量过大水位上升,造成了大量水生植物死亡,该区域表层底泥较软,颜色呈黄褐色;中部渔业养殖湖区繁保区 (G2),位于滆湖中部渔业养殖区周围,该区域有大量围网养殖,底层沉积物为较软的淤泥,颜色发黑且伴有腥臭味;北部入湖湖区塘门沟 (G3),位于北部孟津和与滆湖交汇处,分布大量荷花、茭草等水生植物,该区域入湖河流携带大量污染物,经此处流入滆湖内,沉积物呈青灰色;湖北区 (G4),位于滆湖高速公路向北1 km处,该处为滆湖南北水相交换的主要流经点,因湖底进行过清淤,底部以黄褐色泥沙为主.采样点位置如图 1所示,所有采样点均用全球定位系统GPS定位.用有机玻璃采水器对离水面0.5 m处水样进行采集,用采泥器同步采集湖泊表层底泥样品,每个点位分别采集3个平行底泥样品,装在干净的聚乙烯薄膜自封袋,待测.
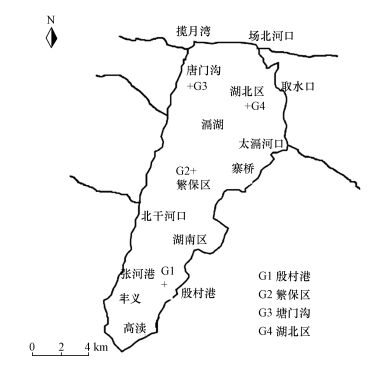 |
| 图 1 滆湖不同湖区的采样点示意图 Fig. 1 Different Sampling sites in Lake Gehu |
水样测定指标有:化学需氧量 (COD)、总磷 (TP)、总氮 (TN)、叶绿色a (Chla).COD采用高锰酸盐酸性法测定;TP采用钼锑抗分光光度法测定;TN采用过硫酸钾氧化-紫外分光光度法测定;Chla采用热乙醇分光光度法测定 (国家环境保护局,2002),计算富营养化指数以及评价富营养化程度 (李祚泳等,2010).
2.3 菌群落结构测定及序列分析方法使用土壤DNA提取试剂盒 (PowerSoilTMDNA Isolation Kit,MOBIO,USA) 对底泥微生物基因组DNA进行提取,将每个样品提取3个重复有效的基因组DNA并进行混合来降低在DNA提取过程中实验操作产生的误差.微生物细菌16S rRNA片段采用454GS Junior测序仪 (上海微基生物科技有限公司),测序引物选用16S V4-V5区引物515F-926R.相比传统的生物检测技术,新一代16S rRNA高通量技术能够较为全面和准确的反映细菌群落结构,并能够体现细菌种群中丰度较低但对生态系统具有重要功能的菌群.
序列使用Mohtur V1.33.3 (Schloss et al., 2009) 软件包进行检查分析,筛选有效序列并将相似性≥97%的序列归为同一分类操作单元 (OTU),计算多样性指数, 并绘制稀释性曲线 (Rarefaction curves)、韦恩图 (Venn)、群落结构柱状图等.
3 结果与讨论 (Results and discussion) 3.1 理化指标分析如表 1所示,全湖4个区域因地理位置及功能不同,水质状况存在差异.G1殷村港点位水质状况最好,其中TP、TN含量分别为0.102和1.72 mg·L-1,均低于其他3个区域,属于轻度富营养化水体;G2繁保区点位TP、TN含量分别为0.198和2.54 mg·L-1,TN含量高于其他3个区域,其富营养化指数最高为61.55,属于中度富营养化水体;G3塘门沟点位Chla含量为15.73 mg·m-3,均高于其他3个湖区,富营养化指数为60.67,属于中度富营养化水体;G4湖北区点位作为滆湖南北水相主要的交汇点,富营养化指数为59.63,属于轻度富营养化水体.湖北区与繁保区TN含量较高,分别达到2.47和2.54 mg·L-1.
| 表 1 各点位理化指标状况 Table 1 The physico-chemical properties of each point |
在本次实验中各点位微生物的序列统计见表 2.对滆湖4个湖区底泥细菌样品中获得的序列进行处理,得到有效序列总计154413条,优化序列总计111252条,其中G3塘门沟点位拥有优化序列最少,为23982条,G4湖北区点位拥有优化序列最多,为31906条.将这些序列以97%的相似性作为一个单元来划分,进行OTU (Operational Taxonomic Unit) 聚类分析,共得到6157个运算的分类单位 (OTUs).对序列进行随机抽样,统计抽样的重复样本数和OTU数来分别计算香农指数 (Shannon) 和辛普森 (Simpson) 指数,以进行多样性分析.
| 表 2 各点位序列统计 Table 2 The sequence statistics of each point |
Venn图用于统计样品之间所共有以及独有的OTU数目,可以直观的比较样品中OTU数目组成相似性及重叠情况 (Schloss et al., 2011).如图 2所示,本次实验4种样品所共有的OTU总数为1038,其中G1、G2、G3和G4特有的OTU数目分别为28、15、16和27.G1殷村港和G4湖北区特有的OTU数目较多,预示有较多特有的细菌种类.
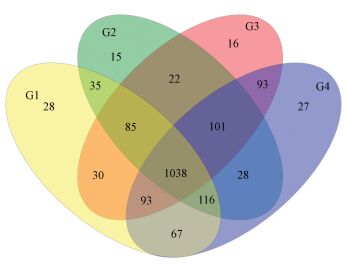 |
| 图 2 OTU分布韦恩图 Fig. 2 Venn diagram showing the distribution of OTUs |
对序列进行随机抽样,统计抽样样本的序列数和OTU数目绘制稀释性曲线,当曲线趋于平稳时,表明更大的测序量不会引起OTU数目的增加 (Amato et al., 2013),即各个样品得到的测序数据能够反映各个样品内的物种分类信息全面的整体状况,也就是说测序数量“足够”.所以,通过构建稀释性曲线得到的结果可看出样品的测序的合理性及深度情况.
据图 3结果可知,各个区域的底泥样品的稀释曲线均逐渐进入一个平坦的趋势,当随机抽取测序条数大于20000时,在图中可直观看出在相似性≥97%的运算条件下,能构建的OTUs数量G4湖北区>G3塘门沟>G1殷村港>G2繁保区.
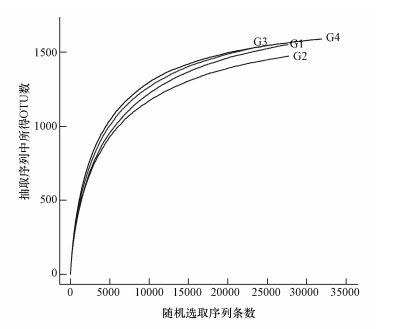 |
| 图 3 稀释性曲线 Fig. 3 Rarefaction curves of OTUs |
Shannon指数 (Møller et al., 2012) 及Simpson指数 (Wang et al., 2012) 用于反映样品中微生物群落的多样性,受样品群落中物种丰富度和物种均匀度的影响,Shannon指数越大,说明样品中物种越丰富,Simpson指数越小,说明样品中物种丰富度越高.如图 4所示,当随机抽取的测序条数大于5000时Shannon指数和Simpson指数走势趋于平坦且稳定,表明其测序得到的数据及物种覆盖面足够,基本能够反映出样品中微生物的基因信息,且通过Shannon指数和Simpson指数均可直观看出底泥细菌多样性:G4湖北区>G3塘门沟>G1殷村港>G2繁保区.
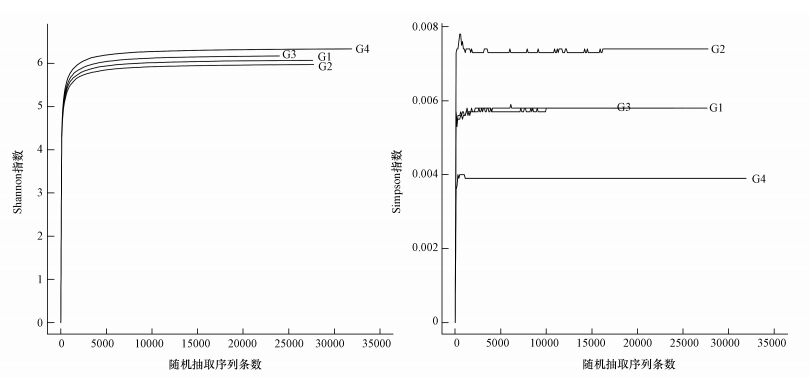 |
| 图 4 多样性指数曲线 Fig. 4 Diversity curves of samples |
根据分类学分析结果可知样品在各分类程度上的比对情况.在结果中,包含了2个信息:样品中含有何种菌群;某菌群在此样品中所占的比例.因此,可以使用这种方法能够直观的观察出不同样品物种组成及分类状况 (Fouts et al., 2012).
如图 5a、5b所示,在门和纲水平上均采用多样品相似度树与组成成分柱状图组合的方法分析底泥中细菌组成成分,左边是样品间基于群落组成的Bray-Curtis层次聚类分析 (Oberauner et al., 2013),右边是样品的群落结构柱状图.经物种注释绝大部分基因信息均能找到相对应的菌种.结果显示:滆湖底泥细菌隶属26个门38个纲.在门水平上G1殷村港与G4湖北区在底泥细菌组成及丰度相似性较高,主要优势菌群 (>10%) 有变形菌门 (Proteobacteria, 44.89%)、绿弯菌门 (Chloroflexi, 16.44%) 和拟杆菌门 (Bacteroidetes, 10.13%),还含有丰度相对较低的酸杆菌门 (Acidobacteria, 6.56%)、硝化螺旋菌门 (Nitrospirae, 4.14%)、绿菌门 (Chlorobi, 3.33%)、浮霉菌门 (Planctomycetes, 3%)、螺旋体门 (Spirochaetae, 1.4%)、蓝藻门 (Cyanobacteria, 1.3%)、放线菌门 (Actinobacteria, 1.2%) 和厚壁菌门 (Firmicutes, 0.82%) 等.
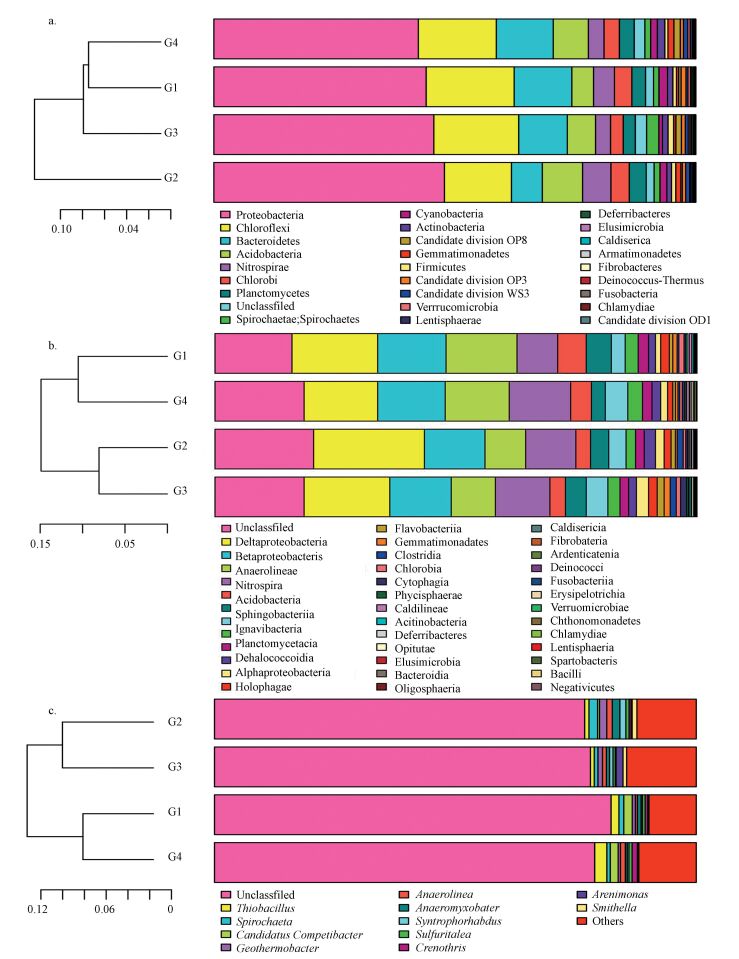 |
| 图 5 门水平 (a)、纲水平 (b) 和属水平 (c) 样品聚类树与柱状图组合分析图 Fig. 5 Bacterial community barplot with cluster tree at the phylum (a), class (b) and genus (c) level |
在纲水平上G1殷村港与G4湖北区、G2繁保区与G3塘门沟在底泥细菌组成及丰度相似性较高,以δ-变形菌纲 (Deltaproteobacteria, 18.21%)、β-变形菌 (Betaproteobacteria, 13.36%)、γ-变形菌 (Gammaproteobacteria, 11.44%)、厌氧绳菌纲 (Anaerolineae10.76%)、硝化螺旋菌纲 (Nitrospira, 4.14%) 和酸杆菌纲 (Acidobacteria, 4.04%) 为主,还含有少量丰度的鞘脂杆菌纲 (Sphingobacteria, 3.87%)、浮霉菌纲 (Planctomycetacia, 1.90%) 以及α-变形菌纲 (Alphaproteobacteria, 1.68%) 等.
为了更全面的了解底泥细菌的组成,在属水平进一步进行了细菌群落结构的分析,如图 5c所示.经过OTUs分类滆湖底泥细菌隶属141个属,主要有氧化亚铁硫杆菌属 (Thiobacillus, 1.45%)、螺旋体属 (Spirochaeta, 1.02%)、Geothermobacter(0.87%)、厌氧粘菌属 (Anaeromyxobacter, 0.82%)、厌氧绳菌属 (Anaerolinea, 0.83%) 为主,并含有少量丰度的Polynucleobacter (0.045%) 和地杆菌属 (Geobacter, 0.021%) 等.
3.5 统计学分析通过SPSS20.0软件对滆湖不同湖区底泥中微生物指数 (表 2)、富营养化指数 (表 1) 和对湖泊富营养化具有指示作用菌群的丰度进行相关性分析.结果见表 3,OTUs数与香农指数 (r=0.966,p < 0.05) 呈显著正相关, 与辛普森指数 (r=-0.965,p < 0.05) 呈负显著相关,香浓指数与辛普森指数呈负显著相关,说明细菌门的多样性受到相对丰度的影响.相关性分析结果也表明Betaproteobacteria、Bacteroidetes和Actinobacteria与富营养化指数呈负显著相关,而Alphaproteobacteria和Firmicutes与富营养化指数呈正显著相关.
| 表 3 底泥生物因子与理化因子相关性分析 Table 3 Biological factor of sediment as a function of physicochemical factor |
本研究以滆湖为背景,在水质分析的基础上研究底泥细菌群落结构及多样性.滆湖是典型的浅水淡水湖泊,所选取的4个区域G1殷村港、G2繁保区、G3塘门沟和G4湖北区分别属于草型湖区、鱼类保护区、入湖湖区和清淤湖区.G1殷村港是滆湖通向太湖的入湖口, G4湖北区是滆湖南北水相交换的主要区域,两处周围原先生长有大量茭草、菱角等水生植物, 然后消亡,两个湖区水体环境相似.G2繁保区属滆湖中部,水相交换较少,G3塘门沟虽然是滆湖北部主要的入湖口之一,但由于地理位置的特殊性,塘门沟处水相交换相对稳定.G2繁保区与G3塘门沟在各自区域内均生长有大量鱼类,生物密度较高,水体环境相似.根据结论3.4节,由图 5中左侧聚类树可知,G1殷村港与G4湖北区底泥细菌组成及丰度相似性较高而聚类,G2繁保区和G3塘门沟底泥细菌组成及丰度相似性较高而聚类,且门、纲、属结果一致.
根据表 2、Venn图 (图 2)、稀释性曲线 (图 3)、香农指数曲线和辛普森指数曲线 (图 4) 发现:每个样品的细菌群落中含有大量独特的基因群,相对丰度高的细菌门有更多的OTU数目,其生物多样性也更高.说明底泥中的优势菌群的基因型也更加多样化,不同环境也造成了微生物种群不同的竞争力 (Srinivasan et al., 2012;Li et al., 2006),但底泥细菌门OTUs数与相对丰度的线性相关性及高丰度的细菌种类是否也在底泥环境的演变中发挥着更重要的作用还需要进一步研究.
虽然不同湖泊在功能及物理化学特性上有所不同,但底泥中细菌菌群种类大体相似.本次研究发现在滆湖选取的4个区域中,底泥细菌组成成分基本相似,在丰度上存在差异,底泥细菌经过OTUs分类结果显示:在门 (图 5a) 水平上主要 (>10%) 优势种群以Proteobacteria、Chloroflexi、Bacteroidetes和Acidobacteria为主,这一结果与学者对德国Stechlin湖泊及芬兰的Joutikas湖泊等淡水湖中底泥细菌群落的研究报道相似 (Newton et al., 2014;Tian et al., 2014).其中Proteobacteria所占比例更是平均达到42%以上,这与Tamaki等对富营养化浅水湖泊Kasumingaura Laker底泥细菌的研究结果一致 (Tamaki et al., 2005),Proteobacteria为Kasumingaura湖底泥细菌的最优势种群,主要为δ-、β-、γ-,还含少量丰度的α-,与此次研究得到的结论相符合.根据门聚类结果, G1与G4、G2与G3在细菌组成及丰度上分别聚类,研究发现主要组成菌群中G1殷村港与G4塘门沟含有Proteobacteria丰度相对较少,分别为44.07%和42.43%,而G2繁保区与G3塘门沟的Proteobacteria丰度相对较高,分别为47.85%和45.65%;Bacteroidetes在G1殷村港和G4湖北区相对丰度较大,分别为11.98%和11.81%,在G2繁保区和G3塘门沟相对丰度较小,分别为6.41%和10.07%;Chloroflexi在G1、G3、G4中相对丰度较高,在G2中相对丰度较低,分别为18.25%、17.62%、16.19%和13.911%.据文献报道 (毛丹丹,2012) 底泥中Planctomycetes常见于污水中,对湖泊系统中的氮循环具有重要的作用,而繁保区G2与湖北区G4中TN含量较高,分别达到2.54、2.47 mg·L-1,其Planctomycetes所占比例也分别达到3.5%和3.1%,均高于G1和G3,表明Planctomycetes的丰度对氮含量具有指示作用,丰度越大,氮含量也越大,而Planctomycetes与氮含量之间是否具有线性关系还需要大量数据进行论证.
在纲 (图 5b) 水平上优势菌群以Deltaproteobacteria、Betaproteobacteria、Gammaproteobacteria和Anaerolineae为主.Deltaproteobacteria在所有菌群中丰度最高,在4个区域中相对丰度分别为G1殷村港17.72%、G2繁保区22.19%、G4湖北区18.12%和G3塘门沟15.33;G1和G4具有的Betaproteobacteria相对丰度差异较小,分别为14.07%和13.96%,而G2与G3的Betaproteobacteria丰度也较为接近,分别为12.87%和13.16%;Gammaproteobacteria在G1和G4丰度较高,分别为14.84%和13.21%,而在G2和G3中丰度较低,分别为8.45%和9.21%.因此, 根据纲水平聚类结果,G1殷村港和G4湖北区的细菌主要组成成分更为接近,G2繁保区与G3塘门沟的细菌主要组成成分更为接近.
据文献 (Liu et al., 2009),底泥中Firmicutes、Alphaproteobacteria、Betaproteobacteria、Actinobacteria和Bacteroidetes菌群的丰度与富营养化程度存在响应关系,会随水体的富营养化程度有数量的变化.根据相关性 (表 3) 分析发现,含量相对较低的Alphaproteobacteria和Firmicutes这两种菌群的丰度与富营养化指数呈正显著相关,而Betaproteobacteria、Bacteroidetes和含量较少相对较低的Actinobacteria这3种菌群丰度与富营养化指数呈负显著相关,这一结果与张晓军 (2011)对乌梁素海以及Percent等 (2008)对美国Adirondack湖泊底泥微生物群落结构的研究结果一致.
Thiobacillus是属 (图 5c) 水平上的优势菌群主要菌群,在G1殷村港和G4繁保区丰度相对较高,分别达1.63%和2.52%,在G2和G3中丰度相对较低,分别为0.88%和0.81%.这类菌群能够产生三价铁离子,并在特定的环境中能够加速亚铁离子的氧化.Anaeromyxobacter和Geobacter均是隶属变形菌纲的细菌群,也是一种非常重要的异化三价铁离子的还原菌,大多分布在厌氧沉积环境中,并参与重金属的氧化还原,在重金属含量较高的沉积物中大量存在.Thiobacillus、Anaeromyxobacter和Geobacter的存在表明滆湖表层沉积物已经受到了一定程度的重金属污染,本次研究与熊春晖等 (2016)2014年1月对滆湖表层沉积物重金属分布研究结果相似.在属水平上还发现少量的Polynucleobacter菌群存在于滆湖底泥中,根据寇文伯等 (2015)对鄱阳湖的研究,这类菌群只存在于水体的浮游细菌中,在底泥中未见.与鄱阳湖相比,滆湖平均水深只有1.47 m,底泥中会存在一些处于水体下层的浮游动物,所以滆湖底泥中含有少量Polynucleobacter菌群也是可能的.细菌群落丰度变化对水体得富营养化的过程存在指示作用,若采用传统的微生物检测方法,一些与水体富营养化具有指示作用的菌群信息因丰度较低可能会被掩盖,本次研究体现了应用16S rRNA高通量测序技术的优势.
4 结论 (Conclusions)1) 滆湖4个不同区域水质均呈富营养化状态,富营养化指数结果显示:G1殷村港<G4湖北区<G3塘门沟<G2繁保区,殷村港、湖北区为轻度富营养化,繁保区、塘门沟为中度富营养化.
2) 在门和纲水平上滆湖底泥微生物群落结构与其他淡水湖泊相似,主要优势菌群有Proteobacteria、Chloroflexi、Bacteroidetes、Deltaproteobacteria、Betaproteobacteria和Gammaproteobacteria.
3) 滆湖底泥细菌中Firmicutes和Alphaproteobacteria丰度与富营养化指数呈正显著相关,Betaproteobacteria、Bacteroidete和Actinobacterias丰度与富营养化指数呈负显著相关,即富营养化程度越高,Firmicutes和Alphaproteobacteria丰度也越大,Betaproteobacteria、Bacteroidete和Actinobacterias丰度则越小.
| [${referVo.labelOrder}] | Amato K R, Yeoman C J, Kent A, et al. 2013. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes[J]. The ISME Journal, 7 : 1344–1353. DOI:10.1038/ismej.2013.16 |
| [${referVo.labelOrder}] | Fouts D E, Szpakowski S, Purushe J, et al. 2012. Next generation sequencing to define prokaryotic and fungal diversity in the bovine rumen[J]. PLoS One, 7(11) : e48289. DOI:10.1371/journal.pone.0048289 |
| [${referVo.labelOrder}] | 国家环境保护局. 2002. 水和废水分析监测方法 (第4版)[M]. 北京: 中国环境科学出版社. |
| [${referVo.labelOrder}] | 寇文伯, 黄正云, 张杰, 等. 2015. 鄱阳湖湖泊细菌群落组成及结构-以松门山为例[J]. 生态学报, 2015, 35(23) : 7608–7614. |
| [${referVo.labelOrder}] | Li S, Xiao X, Yin X, et al. 2006. Bacterial community along a historic lake sediment core of Ardley Island, west Antarctica[J]. Extremophiles, 10(5) : 461–467. DOI:10.1007/s00792-006-0523-2 |
| [${referVo.labelOrder}] | Liu Y Q, Yao T D, Zhu L P, et al. 2009. Bacterial diversity of freshwater alpine lake Puma Yum co on the Tibetan Plateau[J]. Geomicrobiology Journal, 26 : 131–145. DOI:10.1080/01490450802660201 |
| [${referVo.labelOrder}] | 李祚泳, 汪嘉杨, 郭淳. 2010. 富营养化评价的对数模型幂函数普适指数公式[J]. 环境科学学报, 2010, 30(3) : 664–672. |
| [${referVo.labelOrder}] | 毛丹丹. 2012. 生活污水活性污泥中菌群结构分析及功能菌的分离与培养[D]. 杭州: 浙江工业大学 |
| [${referVo.labelOrder}] | Møller A K, Søborg D A, Al Soud W A, et al. 2013. Bacterial community structure in high-arctic snow and freshwater as revealed by pyrosequencing of 16S rRNA Genes and cultivation[J]. Polar Research, 32(1) : 1–11. |
| [${referVo.labelOrder}] | Newton R J, Jones S E, Eiler A, et al. 2011. A guide to the natural history of freshwater lake bacteria[J]. Microbiology and Molecular Biologyreviews:MMBR, 75(1) : 14–49. DOI:10.1128/MMBR.00028-10 |
| [${referVo.labelOrder}] | Oberauner L, Zachow C, Lackner S, et al. 2013. The ignored diversity:complex bacterial communities in intensive care units revealed by 16S pyrosequencing[J]. Scientific Reports, 3 : 1413. DOI:10.1038/srep01413 |
| [${referVo.labelOrder}] | Percent S F, Frischer M E, Vescio P A, et al. 2008. Bacterial community structure of acid-impacted lakes:what controls diversity[J]. Applied Environmental Microbiology, 74 : 1856–1868. DOI:10.1128/AEM.01719-07 |
| [${referVo.labelOrder}] | 屈建航, 李宝珍, 袁红莉. 2007. 沉积物中微生物资源的研究方法及其进展[J]. 生态学报, 2007, 27(6) : 2636–2641. |
| [${referVo.labelOrder}] | 任丽娟, 何聃, 邢鹏, 等. 2013. 湖泊水体细菌多样性及其生态功能研究进展[J]. 生物多样性, 2013, 21(4) : 421–432. |
| [${referVo.labelOrder}] | Schloss P D, Gevers D, Westcott S L. 2011. Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA-based studies[J]. PLoS ONE, 6(12) : e27310. DOI:10.1371/journal.pone.0027310 |
| [${referVo.labelOrder}] | Schloss P D, Westcoll S L, Ryabin T, et al. 2009. Introducting mother:open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 75(23) : 7537–7541. DOI:10.1128/AEM.01541-09 |
| [${referVo.labelOrder}] | Srinivasan S, Hoffman N G, Morgan M T, et al. 2012. Bacterial communities in women with bacterial vaginosis:high resolution phylogenetic analyses reveal relationships of microbiota to clinical criteria[J]. PLoS One, 7(6) : e37818. DOI:10.1371/journal.pone.0037818 |
| [${referVo.labelOrder}] | Tamaki H, Sekiguchi Y, Hanada S, et al. 2005. Comparative analysis of bacterial diversity in freshwater sediment of a shallow eutrophic lake by molecular and improved cultivation-based techniques[J]. Applied and Environmental Microbiology, 71(4) : 2162–2169. DOI:10.1128/AEM.71.4.2162-2169.2005 |
| [${referVo.labelOrder}] | Tian J, Lu J, Zhang Y, et al. 2014. Microbial community structures and dynamics in the O3/BAC drinking water treatment process[J]. International Journal of Environmental Research and Public Health, 11(6) : 6281–6290. DOI:10.3390/ijerph110606281 |
| [${referVo.labelOrder}] | Wang Y, Sheng H F, He Y, et al. 2012. Comparison of the levels of bacterial diversity in freshwater, intertidal wetland, and marine sediments by using millions of illumina tags[J]. Applied and Environmental Microbiology, 78(23) : 8264. DOI:10.1128/AEM.01821-12 |
| [${referVo.labelOrder}] | 熊春晖, 张瑞雷, 季高华, 等. 2016. 江苏滆湖大型底栖动物群落结构及其与环境因子的关系[J]. 应用生态学报, 2016, 27(3) : 927–936. |
| [${referVo.labelOrder}] | 熊春晖, 张瑞雷, 吴晓东, 等. 2016. 滆湖表层沉积物营养盐和重金属分布及污染评价[J]. 环境科学, 2016, 37(3) : 925–934. |
| [${referVo.labelOrder}] | 杨飞, 林超, 张毅敏, 等. 2015. 水体浊度对马来眼子菜和菹草生长的影响[J]. 环境工程学报, 2015, 9(2) : 506–512. DOI:10.12030/j.cjee.20150202 |
| [${referVo.labelOrder}] | 张晓军. 2011. 乌梁素海富营养化不同程度湖区水体和沉积物微生物群落多样性及进化分析[D]. 呼和浩特: 内蒙古农业大学 |
| [${referVo.labelOrder}] | 张毅敏, 段金程, 晁建颖, 等. 2013. 河口前置库系统在滆湖富营养化控制中的应用研究[J]. 生态与农村环境学报, 2013, 29(3) : 273–277. |
 2017, Vol. 37
2017, Vol. 37


