2. 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室, 南京 210008;
3. 中国科学院大学中丹学院, 北京 100049;
4. 上海海洋大学水产与生命学院, 上海 201306
2. State Key Laboratory of Lake Science and Environment, Nanjing Institute of Geography & Limnology, Chinese Academy of Sciences, Nanjing 210008;
3. Sino-Danish College, University of Chinese Academy of Sciences, Beijing 100049;
4. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306
寡毛类如霍甫水丝蚓(Limnodrilus hoffmeisteri)是富营养水体底栖动物典型优势种.研究表明, 水丝蚓能够通过摄食、匍行、筑穴、钻孔等形式对沉积物颗粒产生搬运和混合, 促进沉积物中营养盐向上覆水的释放, 从而直接或间接的提高水体的营养盐水平(Peterson, 1985).同时, 这些营养盐被浮游植物利用后会促进浮游植物的生长, 不利于生态系统由“浊水态”到“清水态”转换(Zhang et al., 2014).
在富营养湖泊的生态修复中, 通过底泥疏浚(Moss et al., 1986;王宁等, 2004), 絮凝沉降(秦伯强等, 2007)或食物网调控(Jeppesen et al., 2012)等工程手段, 通常能够在一段时间内提高水体的透明度, 当光照达到一定条件, 底栖的初级生产者如底栖藻, 就会快速生长(姚扬等, 2004).研究发现, 底栖藻对水体中的营养盐具有较强的滞留作用(Dalsgaard, 2003;Reddy et al., 2011).底栖藻一方面通过对水体中营养盐的吸收、吸附和储存作用, 能够增加营养盐从水体向沉积物的流动, 另一方面, 由于其直接附着于沉积物表层, 从而能减弱沉积物中营养盐向水体的释放和转化(Dodds, 2003).那么在富营养化水体中, 当底栖藻快速生长时, 水丝蚓对富营养水体水质的不良影响能否得到抑制?为此, 本文设计两因素室外受控实验, 以底栖藻和霍甫水丝蚓为研究对象, 揭示富营养水体中, 底栖藻在“水丝蚓-营养盐释放”过程中的作用.研究结果能够为富营养湖泊的生态修复提供参考依据.
2 材料与方法(Materials and methods)实验在封底有机玻璃柱(内径14 cm, 深度50 cm)中进行.每柱加入10 cm湖泊表层沉积物, 并注入35 cm湖水, 所用沉积物和湖水均采自太湖梅梁湾, 分别经80目和500目筛网过滤.实验所用水丝蚓于实验前一周采自太湖梅梁湾, 暂养在2 L烧杯中.实验正式开始前2 d, 于太湖站围隔内剪取水面下30~40 cm处的网片(孔径为5 mm×5 mm), 带回实验室将网片剪成直径14 cm的圆饼用以模拟底栖藻(底栖藻的叶绿素浓度为2.31 μg·cm-2, 主要是由月牙藻(Selenastrum spp.)、桥弯藻(Gymbella spp.)、裸藻(Euglena spp.)及颤藻(Oscillatoria spp.)组成, 其生物量分别占总生物量的71.56%、7.05%、8.13%、1.18%).剪好的圆饼置于装有网片采集点湖水的白色塑料箱(长×宽×高为120 cm×70 cm×60 cm)中暂养直至实验开始.暂养期间每日用湖水更换箱内水体.
实验设双因素共4种处理, 分别命名为对照组、底栖藻组、水丝蚓组和混合组(底栖藻和水丝蚓), 每个处理设4个重复, 共有机玻璃柱16个.为保持各处理组水温一致, 不同处理的有机玻璃柱分别置于4个注水的白色圆柱塑料桶(内径80 cm, 深度70 cm)内.2014年7月18日按上述方法往有机玻璃柱中加入沉积物后, 挑选附着藻长势基本一致的圆形网片平铺于底栖藻组及混合组的沉积物表层, 同时在对照组和水丝蚓组的沉积物表层铺上与所采集网片孔径和面积相同的网片, 随后缓慢注入过滤后湖水.待注水完毕, 往水丝蚓组和混合组中加入体长和活性相似的水丝蚓150条·柱-1.稳定一夜后于2014年7月19日正式开始实验.水丝蚓的密度设置参照2007—2008年太湖野外调查结果(蔡永久等, 2010).
实验期间每次采样后补加同体积纯净水, 每两天用软质毛刷轻刷管壁以抑制附着生物的生长.实验期间平均水温为28.0 ℃, 若水温超过35 ℃, 加盖遮阳网降温, 遮盖时间一般为11:00—16:30.
实验持续21 d, 分别于0、3、6、9、12、15、18、21 d采样测定水体总氮(TN)、总磷(TP)、总溶解氮(TDN)、总溶解磷(TDP)和叶绿素 a(Chl-a)浓度, 方法依据《湖泊富营养化调查》, 每次采集水样前均用溶氧仪(YSI 550A)测定水体温度和溶解氧(DO)浓度.最后一次采样, 加采沉积物表层的网片, 带回实验室进行藻类鉴定及叶绿素浓度的测定同时采集浮游动物样品.TN、TP、TDN、TDP、Chl-a和DO采用两因素方差分析(repeated-measures two-way ANOVA)进行比较, 如果二者存在交互作用, 再分组进行简单效应分析.底栖藻叶绿素a含量和浮游动物生物量采用两因素方差分析(two-way ANOVA)进行比较, 数据统计分析采用SPSS19.0.
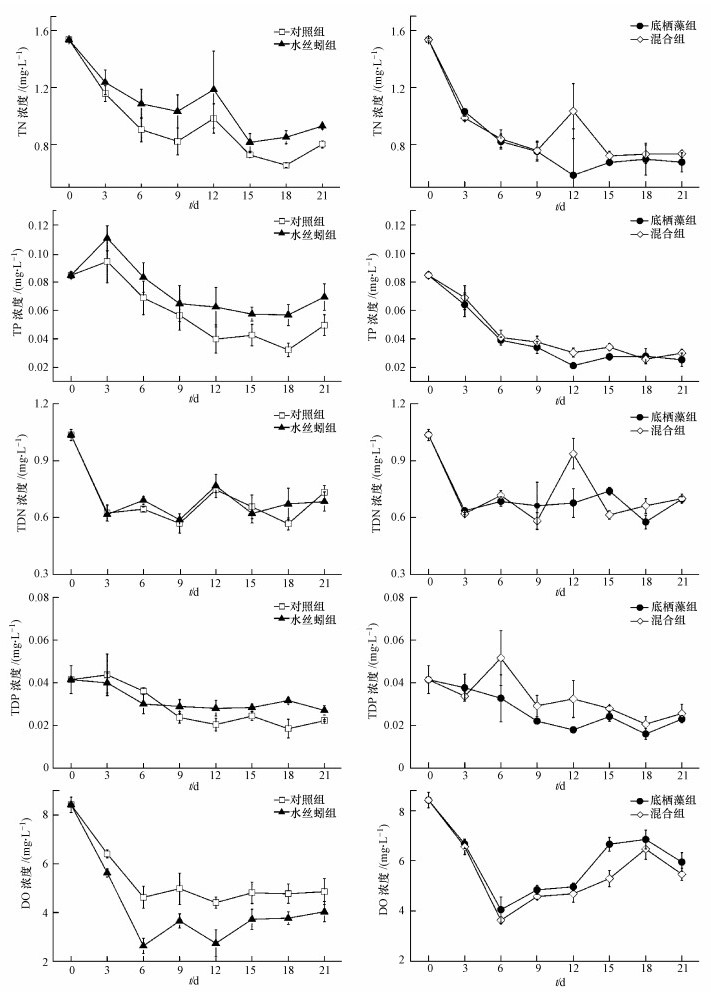
3 结果(Results) 3.1 水体理化指标水丝蚓和底栖藻对水体TN浓度均具有显著影响(表 1), 但二者无交互作用(表 1).水丝蚓显著提高了水体TN浓度, 实验结束时, 添加水丝蚓的处理组(水丝蚓组和混合组)TN浓度要显著高于相应的对照组(对照组和底栖藻组)(图 1);底栖藻添加显著降低了水体TN浓度.实验结束时, 底栖藻组(0.68 mg·L-1)和混合组(0.73 mg·L-1)TN浓度均分别低于对照组(0.80 mg·L-1)和水丝蚓组(0.93 mg·L-1)(图 1).
| 表 1 水体水质指标重复测量方差分析结果 Table 1 Results of repeated-measures two-way ANOVA results for Water quality index |
 |
| 图 1 水体中TN、TP、TDN、TDP及DO的浓度变化(平均值±标准差) Fig. 1 The changes of TN, TP, TDN, TDP and DO concentration in water column(Mean±SD) |
水丝蚓和底栖藻对水体TP浓度具有显著影响(表 1), 且二者间存在着显著的交互作用(表 1).在无底栖藻的情况下, 水丝蚓提高了水体TP浓度, 表现为实验期间水丝蚓组TP浓度明显高于对照组(图 1);而在有底栖藻存在的情况下, 水丝蚓对水体TP浓度影响不大, 如图 1所示, 混合组和底栖藻组TP浓度在实验期间差异不显著.
水丝蚓对水体TDN浓度影响不显著(表 1), 而底栖藻对水体TDN浓度具有显著影响(表 1), 实验结束时, 底栖藻组和混合组TDN浓度分别低于对照组和水丝蚓组浓度的4.93%、2.35%(图 1).水丝蚓和底栖藻对水体TDN浓度无交互作用(表 1).
水丝蚓显著提高了水体TDP浓度(图 1, 表 1), 实验结束时, 水丝蚓组TDP浓度高于对照组浓度的21.95%(图 1);底栖藻对水体TDP浓度无显著影响(表 1), 二者间无交互作用(表 1).
水丝蚓和底栖藻均对水体DO浓度具有显著影响(表 1), 且二者间有显著交互作用(表 1).在无底栖藻的情况下, 水丝蚓活动显著降低了水体DO的浓度, 实验期间, 水丝蚓组DO浓度要明显低于对照组(图 1);而在底栖藻存在的情况下, 水丝蚓对水体DO浓度的影响不显著(图 1).
3.2 水体叶绿素a浓度底栖藻、水丝蚓对水体Chl-a浓度具有显著影响(表 1), 二者间有交互作用(表 1).如图 2所示, 在无底栖藻的处理中, 水丝蚓显著提高了水体Chl-a浓度, 实验结束时, 水丝蚓组Chl-a浓度是对照组浓度的1.29倍;而在有底栖藻的处理中, 水丝蚓对水体Chl-a浓度的影响不显著.
 |
| 图 2 水体中Chl-a的浓度变化(平均值±标准差) Fig. 2 The changes of Chl-a concentration in water column.(Mean±SD) |
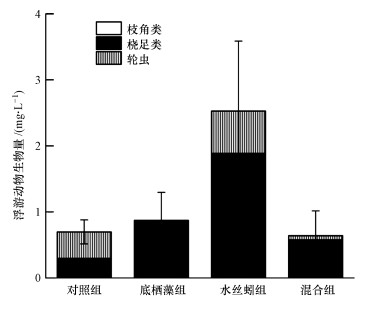
水丝蚓对浮游动物生物量具有显著影响(p < 0.05).水丝蚓能显著增加浮游动物生物量, 实验结束时, 水丝蚓组浮游动物生物量是对照组的3.62倍.水丝蚓组、底栖藻组及混合组中桡足类的生物量分别为对照组的5.76、2.06、1.06倍.除水丝蚓组中轮虫生物量比对照组增加了59.20%, 底栖藻组和混合组同比对照分别降低了96.15%、84.28%.此外, 实验结束时在水丝蚓组中并未观察到枝角类, 混合组和底栖藻组中枝角类生物量同比对照组分别降低了89.47%、83.55%(图 3).
 |
| 图 3 实验结束时的浮游动物生物量(平均值±标准差) Fig. 3 The biomass of zooplankton at the end of experiment(Mean±SD) |
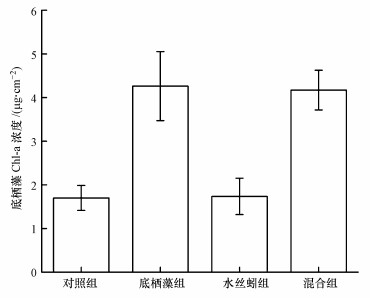
实验结束时, 底栖藻组和混合组叶绿素含量显著显著高于对照组和水丝蚓组(p < 0.05), 底栖藻组与混合组叶绿素浓度差异不显著(p>0.05)(图 4).实验结束时, 对照组、底栖藻组及混合组中底栖藻的优势种类均为月牙藻(Selenastrum spp.), 而在水丝蚓组中的优势藻类为双菱藻(Surirella spp.), 月牙藻(Selenastrum spp.)和单角盘星藻(Pediastrum simplex spp.).
 |
| 图 4 底栖藻Chl-a浓度(平均值±标准差) Fig. 4 The Chl-a of benthic algae(Mean±SD) |
本研究表明无底栖藻处理中, 水丝蚓显著提高了水体营养盐(TN、TP及TDP)浓度, 该研究结果与Zhang (2014)、吴方同等(2011a;2011b)的研究结果一致.水丝蚓对水体营养盐影响的潜在机理主要有以下3点:① 水丝蚓的栖居方式是将身体的前端埋于底泥中, 后端露于水中且不停摆动进行呼吸, 产生的垂向通道有助于上覆水和间隙水相互交换, 促进沉积物中的氮、磷向水中释放(Hedman et al., 2011;白秀玲等, 2012).② 水丝蚓的呼吸作用能降低水体DO浓度, 进而改变沉积物-水界面的理化性质, 这可能有利于沉积物营养盐的静态释放.研究表明, 厌氧条件下, 沉积物更易向水体释放氮、磷(袁文权等, 2004;Gomez et al., 1999).此外, 本研究还显示水丝蚓的存在对桡足类和轮虫生物量有显著的促进作用, 浮游动物的呼吸作用也可能会进一步降低水体DO浓度, 从而可能加剧沉积物表层缺氧甚至形成厌氧环境, 进一步促进沉积物氮磷向水体的释放.③ 水丝蚓排泄将有机物转化为无机物, 也促进了氮、磷向水体释放(Devine et al., 2002;Ji et al., 2015).在无底栖藻的情况下, 本研究还发现添加水丝蚓的处理(水丝蚓组)Chl-a浓度明显高于不添加水丝蚓的处理(对照组)(图 2), 这可能是由于添加水丝蚓增加了水体中的营养盐, 较高的营养盐促进了浮游植物的生长, 从而导致水体中较高的Chl-a浓度.类似的, Zhang等(2014)通过12周的微宇宙实验, 研究了水丝蚓与双壳类对底栖-浮游耦合的影响, 结果同样表明水丝蚓通过提高上覆水营养盐浓度促进了浮游植物的生长.
尽管在无底栖藻的情况下, 水丝蚓能够显著提高水体营养盐;然而, 本研究发现当底栖藻存在时, 水丝蚓对水体营养盐, 特别是TP的影响不显著, 表明了底栖藻的存在在一定程度上抑制了水体营养盐对水丝蚓添加的响应.其潜在机理可能有以下3个方面:① 底栖藻通过光合作用增加了水体DO浓度(图 1), 从而抵消掉了水丝蚓活动对水体溶解氧的负面影响.同时, 底栖藻能增加表层沉积物溶解氧浓度, 使沉积物中的好氧层厚度显著增加(Zhang et al., 2013), 从而促进Fe2+向Fe3+转化, 使磷酸盐与Fe3+形成难溶性化合物而被固定于沉积物中(Carlton et al., 1988;Dodds, 2003).② 底栖藻的存在可能为水丝蚓提供了额外食物来源, 继而减弱水丝蚓为获取食物所导致的掘穴活动(Lewandowski et al., 2005), 最终降低水丝蚓扰动沉积物引起的营养盐释放.③ 底栖藻与沉水植物机理类似(Genkai Kato et al., 2012), 不仅能够抑制沉积物营养盐向上覆水释放(Adey et al., 1993), 同时能够吸收水体营养盐(Dodds, 2003), 因此, 水丝蚓新陈代谢所释放的营养盐也可能会直接被底栖藻类吸收.综上所述, 在底栖藻存在的情况下, 水丝蚓活动并没有对水体营养盐(特别是TP)和溶解氧产生显著的影响, 这也可能是混合组和底栖藻组水体Chl-a浓度差异不显著的主要原因.此外, 有底栖藻处理组(混合组和底栖藻组)中水体Chl-a浓度显著低于无水丝蚓添加的处理组(对照组和水丝蚓组), 这可能是浮游藻类和底栖藻类二者对营养盐的竞争所致(Hansson, 1990).在无外源营养盐输入的情况下, 水体营养盐浓度主要来自于沉积物中有机质的矿化过程, 由于底栖藻类直接附着于沉积物表层使其能优先于浮游藻类利用沉积物中营养盐促进自身生长(Carlton et al., 1988), 同时也能从水体中吸收营养盐, 从而使浮游藻类对于营养盐的竞争处于劣势.此外, 底栖藻生物量的增加(图 4)会进一步加强底栖藻对营养盐的吸收和截留作用(Dalsgaard, 2003), 从而使水体叶绿素显著降低.
5 结论(Conclusions)本研究表明, 在富营养水体中, 水丝蚓能显著提高水体营养盐水平, 并促进浮游植物生长;底栖藻的生长能显著抑制水丝蚓对水体营养盐和叶绿素a浓度的促进作用, 同时提高水体DO浓度, 因此, 在富营养水体的生态修复工程中, 通过工程手段提高水体透明度, 恢复底栖藻群落, 有利于水体从“浊水态”到“清水态”的转换.
| [${referVo.labelOrder}] | Adey W, Luckett C, Jensen K. 1993. Phosphorus removal from natural waters using controlled algal production[J]. Restoration Ecology, 1(1): 29–39. DOI:10.1111/rec.1993.1.issue-1 |
| [${referVo.labelOrder}] | 白秀玲, 周云凯, 张雷. 2012. 水丝蚓对太湖沉积物有机磷组成及垂向分布的影响[J]. 生态学报, 2012, 32(17): 5581–5588. |
| [${referVo.labelOrder}] | 蔡永久, 龚志军, 秦伯强. 2010. 太湖大型底栖动物群落结构及多样性[J]. 生物多样性, 2010, 18(1): 50–59. |
| [${referVo.labelOrder}] | Carlton R G, Wetzel R G. 1988. Phosphorus flux from lake sediments:effects of epipelic algal oxygen production[J]. Limnol and Oceanography, 33: 562–570. DOI:10.4319/lo.1988.33.4.0562 |
| [${referVo.labelOrder}] | Dalsgaard T. 2003. Benthic primary production and nutrient cycling in sediments with benthic microalgae and transient accumulation of macroalgae[J]. Limnology & Oceanography, 48(6): 2138–2150. |
| [${referVo.labelOrder}] | Dodds W K. 2003. The role of periphyton in phosphorus retention in shallow freshwater aquatic systems[J]. Journal of Phycology, 39(5): 840–849. DOI:10.1046/j.1529-8817.2003.02081.x |
| [${referVo.labelOrder}] | Devine J A, Vanni M J. 2002. Spatial and seasonal variation in nutrient excretion by benthic invertebrates in a eutrophic reservoir[J]. Freshwater Biology, 47(6): 1107–1121. DOI:10.1046/j.1365-2427.2002.00843.x |
| [${referVo.labelOrder}] | Gomez E, Durillon C, Rofes G, et al. 1999. Phosphate adsorption and release from sediments of brackish lagoons:pH, O2 and loading influence[J]. Water Research, 33(10): 2437–2447. DOI:10.1016/S0043-1354(98)00468-0 |
| [${referVo.labelOrder}] | Genkai Kato M, Vadeboncoeur Y, Liboriussen L, et al. 2012. Benthic-planktonic coupling, regime shifts, and whole-lake primary production in shallow lakes[J]. Ecology, 93(3): 619–631. DOI:10.1890/10-2126.1 |
| [${referVo.labelOrder}] | Hedman J E, Gunnarsson J S, Samuelsson G, et al. 2011. Particle reworking and solute transport by the sediment-living polychaetes Marenzelleria neglecta and Hediste diversicolor[J]. Journal of Experimental Marine Biology and Ecology, 407(2): 294–301. DOI:10.1016/j.jembe.2011.06.026 |
| [${referVo.labelOrder}] | Hansson L A. 1990. Quantifying the impact of periphytic algae on nutrient availability for phytoplankton[J]. Freshwater Biology, 24(24): 265–273. |
| [${referVo.labelOrder}] | Jeppesen E, Søndergaard M, Lauridsen T L, et al. 2012. Chapter 6Biomanipulation as a restoration tool to combat eutrophication:Recent advances and future challenges[J]. Advances in Ecological Research, 47: 411–488. DOI:10.1016/B978-0-12-398315-2.00006-5 |
| [${referVo.labelOrder}] | Ji L, Song C L, Cao X Y, et al. 2015. Spatial variation in nutrient excretion by macrozoobenthos in a Chinese large shallow lake (Lake Taihu)[J]. Journal of Freshwater Ecology, 30(1): 169–180. DOI:10.1080/02705060.2014.997816 |
| [${referVo.labelOrder}] | Lewandowski J, Hupfer M. 2005. Effect of macrozoobenthos on two-dimensional small-scale heterogeneity of pore water phosphorus concentrations in lake sediments:A laboratory study[J]. Limnology & Oceanography, 50(4): 1106–1118. |
| [${referVo.labelOrder}] | Moss B, Balls H, Irvine K, et al. 1986. Restoration of two lowland lakes by isolation from nutrient-rich water sources with and without removal of sediment[J]. Journal of Applied Ecology, 23(2): 391–414. DOI:10.2307/2404025 |
| [${referVo.labelOrder}] | Peterson C H. 1985. Tidal flat ecology; an experimental approach to species interactions[M]. Springer-Verlag: : 1229–1229. |
| [${referVo.labelOrder}] | 秦伯强, 王小冬, 汤祥明, 等. 2007. 太湖富营养化与蓝藻水华引起的饮用水危机--原因与对策[J]. 地球科学进展, 2007, 22(9): 896–906. |
| [${referVo.labelOrder}] | Reddy K R, Newman S, Osborne T Z, et al. 2011. Phosphorous cycling in the greater Everglades ecosystem:legacy phosphorous implications for management and restoration[J]. Critical Reviews in Environmental Science and Technology, 41(S1): 149–186. |
| [${referVo.labelOrder}] | 王宁, 张刚, 王瑗. 2004. 湖泊内源污染的环保疏浚及其效果--以长春南湖清淤工程为例[J]. 环境科学研究, 2004, 17(2): 34–37. |
| [${referVo.labelOrder}] | 吴方同, 陈锦秀, 闫艳红, 等. 2011a. 水丝蚓生物扰动对东洞庭湖沉积物氮释放的影响[J]. 湖泊科学, 2011a, 23(5): 731–737. |
| [${referVo.labelOrder}] | 吴方同, 闫艳红, 孙士权, 等. 2011b. 水丝蚓生物扰动对沉积物磷释放的影响[J]. 环境工程学报, 2011b, 5(5): 1071–1076. |
| [${referVo.labelOrder}] | 姚扬, 金相灿, 姜霞, 等. 2004. 光照对湖泊沉积物磷释放及磷形态变化的影响研究[J]. 环境科学研究, 2004, 17(s1): 30–33. |
| [${referVo.labelOrder}] | 袁文权, 张锡辉, 张丽萍. 2004. 不同供氧方式对水库底泥氮磷释放的影响[J]. 湖泊科学, 2004, 16(1): 28–34. |
| [${referVo.labelOrder}] | Zhang X F, LIU Z W, Jeppesen E, et al. 2014. Effects of deposit-feeding tubificid worms and filter-feeding bivalves on benthic-pelagic coupling:Implications for the restoration of eutrophic shallow lakes[J]. Water Research, 50(3): 135–146. |
| [${referVo.labelOrder}] | Zhang X F, LIU Z W, Gulati R D, et al. 2013. The effect of benthic algae on phosphorus exchange between sediment and overlying water in shallow lakes:A microcosm study using 32P as a tracer[J]. Hydrobiologia, 710(1): 109–116. DOI:10.1007/s10750-012-1134-9 |
 2017, Vol. 37
2017, Vol. 37



