2. 中国科学院生态环境研究中心, 北京 100085
2. Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085
1998年, Dieluweit等研究发现微生物可介导合成金纳米颗粒(Dieluweit et al., 1998), 自此引发了后续的大量研究.目前, 可介导合成金纳米颗粒的微生物主要有细菌(Husseiny et al., 2007)、真菌(Mishra et al., 2010)、放线菌(Ahmad et al., 2003a)、酵母菌(Pimprikar et al., 2009), 病毒(Slocik et al., 2005).相对于传统纳米颗粒的化学合成, 微生物介导的合成方法由于其对环境无污染, 成本低廉, 合成条件温和等优点, 越来越受到重视, 成为新的环境微生物研究热点(De et al., 2008; Thirumurugan et al., 2016).
金纳米材料的潜在应用主要由其粒径和形貌决定(Aizpurua et al., 2003; 张敬畅等, 2001), 而环境因素如温度和pH影响微生物合成金纳米颗粒的形貌和大小(Bastus et al., 2011; He et al., 2007; Binupriya et al., 2010).温度和pH影响微生物生命活动(沈娥等, 2015), 生物活性物质如蛋白质, 糖等对稳定纳米金有重要的作用(石杰等, 2012), 进而影响微生物介导的金纳米颗粒的生成过程.比如, Cai等研究发现pH可以控制Magnetospirillum gryphiswaldense MSR-1合成的金纳米颗粒的粒径, pH为1.5时, 粒径为5~10 nm, pH为2时, 粒径为10~20 nm, pH为4时, 粒径大于30 nm(Cai et al., 2011), 而调节反应温度, 金纳米颗粒的粒径、形貌和光学特性也随之发生改变(Rai et al., 2006).2003年, Ahmad等首次发现红球菌可以在胞内介导金纳米颗粒的合成(Ahmad et al., 2003b), 但是温度和pH对红球菌介导合成的金纳米颗粒的影响还未知.
本研究在锑污染土壤中筛选得到一株红球菌, 发现其可介导合成金纳米颗粒, 并进一步探究了不同温度和pH对金纳米颗粒合成的影响.同时研究了此生物合成的金纳米材料对亚甲基蓝的吸附去除效果, 希望以亚甲基蓝这种传统吸附材料难以有效去除的染料分子做为典型污染物(Bello et al., 2013), 探索生物合成纳米材料的环境应用潜力.
2 材料与方法(Materials and methods) 2.1 试剂实验所用的主要药品为氯金酸、氯化钠、氯化钾、磷酸氢二钠、磷酸二氢钾, 均由国药集团化学试剂(北京)有限公司生产, 纯度为分析纯.用去离子水将氯金酸配成100 mmol·L-1的贮备液, 4 ℃保存备用.
2.2 样品的采集土样来自于湖南省冷水江市(27.7°24′33″N, 111.4°51′47″E), 用土壤采集器收集0~20 cm的土壤, 然后放入灭菌的自封袋中, 4 ℃保存备用.
2.3 培养基及磷酸钠盐缓冲液菌株生长培养基为LB培养基(1 L液体培养基中含有10 g蛋白胨, 5 g酵母, 10 g氯化钠, pH 7.5), 菌株筛选培养基SLB和金还原培养基ALB分别是在1 L的LB培养基中加入1.27 g焦锑酸钾和0.41 g氯金酸制成, pH为7.5.固体生长培养基为液体LB培养基中加入1.5%的琼脂制备而成.
1 L的磷酸钠盐缓冲液(PBS)含有磷酸氢二钾0.24 g, 磷酸二氢钠1.44 g, 氯化钠8 g, 氯化钾0.2 g, pH为7.5.
2.4 实验方法 2.4.1 Rhodococcus sp.LSJ-6的分离与纯化将1 g土样加入到100 mL无菌水中, 160 r·min-1摇30 min, 吸取1 mL加入到99 mL水中混匀, 按照同样方法逐级稀释到10-1~10-8倍, 取100 μL涂布到含1 mmol·L-1焦锑酸钾的LB培养基中, 36 h后选取平板上菌落进行划线纯化(Fan et al., 2008), 纯化后的单菌落在30%的甘油中-80 ℃保存.
2.4.2 菌株鉴定将菌株划线接种于固体LB培养基中, 30 ℃, 避光培养36 h后, 观察菌落形貌.用扫描电镜(SEM, Hitachi, 日本)表征, 观察菌株形状.提取菌株基因组并以其为模板进行16S rRNA扩增, 所用引物是27F (5′-AGAGTTTGATCCTGGCTC-AG-3′)和1492R (5′-GGTTACCTTGTTACGACTT-3′), 将扩增的产物送到北京擎科生物工程公司测序.测序结果在NCBI比对, 并使用MEGA 5.03软件构建系统发育树.
2.4.3 最适温度和pH将1%的菌株接种到500 mL LB培养基中, 分别在pH为4、5、6、7、8、9、10和5、10、20、30、40、50 ℃的条件下生长, 160 r·min-1培养36 h后测OD600.
2.4.4 金纳米颗粒的合成以及表征将Rhodococcus sp.LSJ-6接种于LB培养基中, 160 r·min-1培养36 h后, 6000 r·min-1, 10 min离心收集菌体.用无菌水洗涤菌体3次后, 60 ℃烘干后制成10 g干菌/L的悬浮液.取2 mL悬浮液加入到98 mL含有1 mmol·L-1氯金酸的PBS buffer中, 160 r·min-1, 28 ℃培养12 h.将该培养液8000 r·min-1离心5 min.取上清液用UV-vis紫外分光光度计(岛津, 日本)在800~200 nm范围内扫描.将沉淀经过脱水, 固定, 风干后, 进行扫描电子显微镜(SEM, Hitachi, 日本).同时, 将上清液滴加到碳支持膜上, 自然风干后, 用透射电子显微镜(TEM, FEI, 美国)和能谱分析(EDX)表征合成的颗粒.使用Nano Measurer 1.2对电镜图进行粒径分析.另外, 在UV-vis实验中将氯金酸溶液和菌液做为空白对照.
为研究pH的影响, 将PBS缓冲液分别调至pH为5、7、9, 温度30 ℃.为研究温度的影响, 将上述反应体系分别置于20、30、40 ℃的条件下, 用同上的方法合成金纳米颗粒并进行表征.
2.4.5 亚甲基蓝的吸附去除将0.05 mmol·L-1的亚甲基蓝分别加入到2.4.4节中不同温度和pH条件下合成的金纳米颗粒体系中, 取2 mL悬浮液加入到98 mL的PBS buffer中作为空白对照.160 r·min-1的摇床中吸附去除8 h后, 10000 r·min-1离心15 min, 用UV-vis在664 nm处测亚甲基蓝反应前后的吸收度, 亚甲基蓝的吸附率X由式(1) 得到
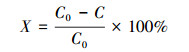
|
(1) |
式中, C0为溶液中亚甲基蓝的初始浓度(mmol·L-1), C为吸附平衡后溶液中剩余的亚甲基蓝的浓度(mmol·L-1).
3 结果与分析(Results and analysis) 3.1 Rhodococcus sp.LSJ-6的分离在含1 mmol·L-1焦锑酸钾锑的固体LB培养基中分离得1株锑抗性菌株, 其菌落为浅黄色, 圆形, 光滑, 不透明, 表面光滑(图 1a).扫描电镜结果显示该菌株为杆状, 革兰氏阳性菌, 大小约为(0.5~1.0)μm ×(1.0~3.5) μm(图 1b).
 |
| 图 1 Rhodococcus sp. LSJ-6的菌落(a)及扫描电镜图(b), 标尺=5 μm Fig. 1 The bacterial colony (a) and SEM image (b) of Rhodococcus strain LSJ-6, the ruler is 5 μm |
用邻接法进行分子系统发育分析, 从系统发育树(图 2)可知, 菌株LSJ-6与Rhodococcus属菌株聚在同一分支上, 表明菌株LSJ-6属于红球菌属, 命名为Rhodococcus sp.LSJ-6.其16S rRNA基因序列号为KX344509.
 |
| 图 2 基于Rhodococcus sp.LSJ-6的16S rRNA序列构建的系统发育树 Fig. 2 The phylogenetic tree based on 16S rDNA sequence of Rhodococcus sp.LSJ-6 |
为了研究不同的pH和温度对红球菌生长的影响, 分别在20、25、30、35、40、45 ℃和pH为5、6、7、8、9、10条件下, 160 r·min-1培养36 h后, 测其OD600.温度和pH对微生物的生长和酶活性产生重要影响(沈娥等, 2015), 从图 3a可知, 随着温度的增加, Rhodococcus sp. LSJ-6生长量急速增加, 在30 ℃达到最大, 随后迅速下降, 其最适生长温度为30 ℃(图 3a).其OD600值随着pH的升高而增加, 在pH为7时最大, 其OD600值大约是1.6, 随后有缓慢下降的趋势, 其最适pH为接近7的中性环境(图 3b).
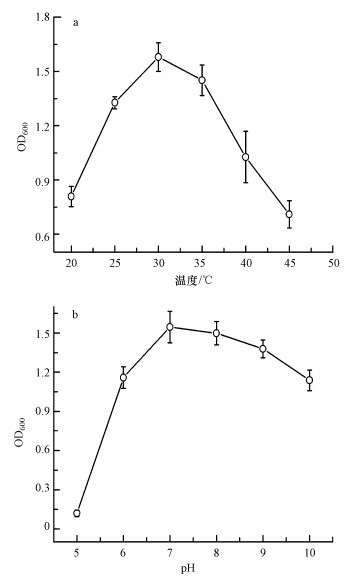 |
| 图 3 Rhodococcus sp. LSJ-6在不同的温度和pH下的生长情况 Fig. 3 The growth of Rhodococcus sp. LSJ-6 in different temperature and pH |
由于金纳米尺寸或间距变化导致其吸收波长发生变化, 从而使溶液颜色呈现酒红色, 紫色等不同颜色, 甚至聚沉(Mayer et al., 2011).金纳米颗粒的特征吸收波长一般在530 nm左右(Nath et al., 2002; Brust et al., 1998).如图 4中的3可知, Rhodococcus sp.LSJ-6介导生成的纳米颗粒在540 nm出现吸收峰, 溶液呈酒红色.因此, 初步分析红球菌合成了金纳米颗粒(Ahmad et al., 2003b; Kasthuri et al., 2009).
 |
| 图 4 氯金酸(a)、菌株悬浮液(b)和金纳米颗粒(c)溶液的UV光谱图 Fig. 4 UV-Vis spectra of HAuCl4, strain suspension liquid and AuNPs solution |
为了研究温度对Rhodococcus sp. LSJ-6介导的金纳米颗粒的影响, 用2.4.4节所述方法分别在20、30、40 ℃条件合成金纳米颗粒.从图 5a-1、图 5b-1、图 5c-1的SEM结果知, 在Rhodococcus sp. LSJ-6周围存在许多金纳米颗粒.利用TEM对其大小, 形貌进行表征, 20 ℃条件下诱导合成的金纳米颗粒形状不规则, 有三角形, 六边形, 球形等, 而且聚合在一起(图 5a-2), 粒径为17~30 nm(图 5a-4);30 ℃条件下诱导合成的金纳米分散性好, 但形貌和大小不均一, 有四边形, 五边形, 椭球形, 类球形以及三角形的形貌(图 5b-2), 粒径为20~35 nm(图 5b-4);40 ℃时, 颗粒形状以六边形为主(图 5c-2), 粒径为12~28 nm(图 5c-4).从图 5a-3, 5b-3, 5c-3的EDX分析可知, 此纳米颗粒的主要成分是金.插图的HRTEM显示, 金纳米颗粒的晶格宽度为0.220~0.223 nm, 表明此生物合成的金纳米颗粒的暴露晶面为(111)(Boeeuzzi et al., 1998).因此, 温度可以控制金纳米颗粒的形状(Zhou et al., 2006), 而对粒径的影响相对较小.目前, 已报道的金纳米材料有纳米线, 纳米棒, 纳米片等, 由于其独特的形状, 在生物传感, 超导材料等领域有广阔的应用价值.例如, 金纳米线在太阳能转化, 合成纤维与微电池的制造等应用中有明显的优势.
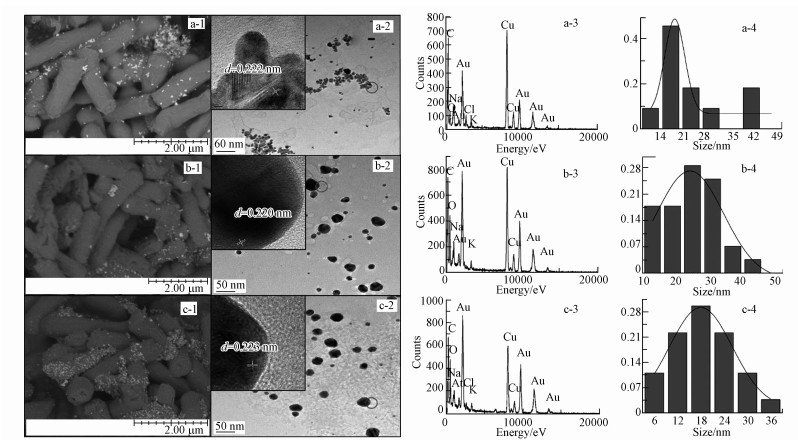 |
| 图 5 不同温度下Rhodococcus sp. LSJ-6合成的金纳米颗粒的表征图 ((1) 扫描电镜图(标尺=2 μm), (2) 透射电镜图(标尺=50 nm), (3) 能量谱图, (4) 粒径分布, 插图为高倍透射电镜图.a, b和c分别代表反应条件20、30、40 ℃) Fig. 5 The images of synthetic AuNPs of Rhodococcus sp. LSJ-6 in the different temperature ((1) SEM (the ruler is 2 μm), (2) TEM (the ruler is 50 nm), (3) EDX, (4) histogram of size distribution, the inset presents HRTEM. a, b and c represent the experiment condition of 20 ℃、30 ℃、40 ℃, respectively) |
为了研究pH对Rhodococcus sp. LSJ-6介导的金纳米颗粒的影响, 用2.4.4节所述方法分别在pH为5、7、9的条件下合成金纳米颗粒.SEM显示在菌周围存在纳米颗粒(图 6a-1, 图 6b-1, 6c-1).通过TEM进一步对其大小, 形貌进行研究, 在pH为5时, 金纳米颗粒出现团聚现象, 以球形颗粒居多, 有少数三角形颗粒, 颗粒数目较多(图 6a-2), 粒径约为10~18 nm(图 6a-4);当pH为7时, 球形颗粒较多, 分散性好(图 6b-2), 粒径约为7~12 nm(图 6b-4);当pH为9时, 颗粒形状为球形, 分散度更好, 颗粒数目较少(图 6c-2), 粒径主要小于4 nm(图 6c-4).从插图和图 6a-3、6b-3、6c-3可知, 金纳米颗粒的晶格宽度为0.221~0.226 nm, 表明此生物合成的金纳米颗粒的暴露晶面为(111)(Boeeuzzi et al., 1998), 存在金纳米颗粒.通过以上分析, 可以发现发现随着pH值的增加, 颗粒的粒径减小.而且, pH主要影响金纳米颗粒的粒径大小, 对形状影响较小(Liu et al., 2005).随着金纳米颗粒粒径的减小, 其表面原子数目增加, 使金催化剂的活性增强, 使其在CO的催化氧化, 乙炔的氢氯化反应, 催化燃烧等领域有重要的作用.
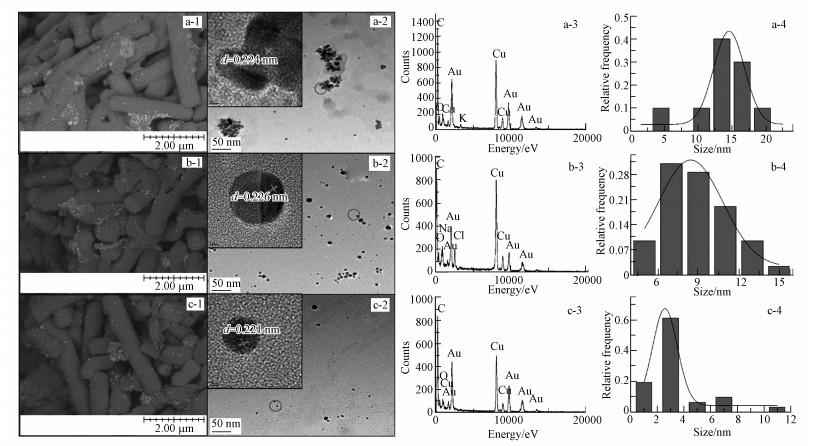 |
| 图 6 不同pH下Rhodococcus sp. LSJ-6合成的金纳米颗粒的表征图 ((1) 扫描电镜图(标尺=2 μm), (2) 透射电镜图(标尺=50 nm), (3) 能量谱图, (4) 粒径分布, 插图为高倍透射电镜图.a, b和c分别代表反应条件pH 5, pH 7, pH 9) Fig. 6 The images of synthetic AuNPs of Rhodococcus sp. LSJ-6 in the different pH ((1) SEM (the ruler is 2 μm), (2) TEM (the ruler is 50 nm), (3) EDX, (4) histogram of size distribution, the inset presents HRTEM. a, b and represent the experiment condition of pH 5, pH 7, pH 9, respectively) |
Ahmad等研究发现红球菌可以在胞内介导合成粒径为5~15 nm的球形金纳米颗粒, XRD显示金纳米颗粒的晶面主要为(111), 推测在生物膜内出现的金纳米颗粒有定向生长的趋势(Ahmad et al., 2003b ).而本研究通过改变反应条件, 合成了不同形状和大小的金纳米颗粒, 对于进一步研究红球菌合成金纳米颗粒的机理奠定了基础.
3.4.3 亚甲基蓝的吸附去除为了研究不同条件下合成的金纳米颗粒对亚甲基蓝的吸附去除作用, 应用UV-vis在800~200 nm的范围内对方法2.4.5节得到的溶液进行扫描, 进而得出其去除率(图 7).在空白组呈现了不同温度下红球菌对亚甲基蓝的吸附, 可知去除率为20%左右(图 7a).在实验组, 20 ℃合成的金纳米颗粒对亚甲基蓝的吸附去除达到68%, 30 ℃到40 ℃合成的金纳米颗粒对亚甲基蓝的吸附量增加, 其去除率分别为80%和85%.从pH 5到pH 9, 金纳米颗粒对亚甲基蓝的吸附去除率逐渐增加.其中, pH 9时96%的亚甲基蓝被吸附, 而在pH 7和pH 5时吸附率分别为91%和60%, 其空白组的吸附率变化不大(图 7a).我们推测在不同温度的条件下, 颗粒形状变化大, 粒径变化较小, 40℃时, 六边形相对较多, 对污染物的吸附达到85%.相对而言, 在pH影响下合成的纳米金主要是球形且粒径小, 对亚甲基蓝的吸附能力明显较高, 最高达到96%.主要由于随着纳米材料粒径的减小, 或者表面面积的增大, 其吸附能力将会增强(Shen et al., 2009).
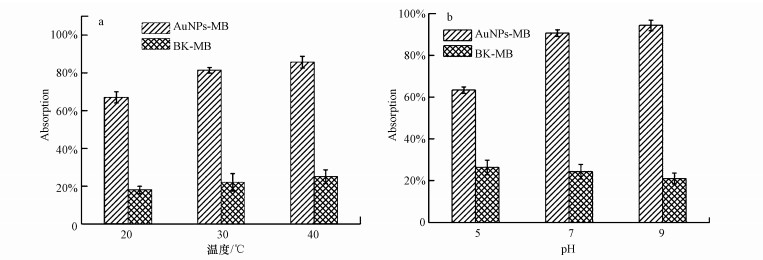 |
| 图 7 在不同的温度和pH下Rhodococcus sp. LSJ-6介导合成的金纳米颗粒对亚甲基蓝的吸附去除 Fig. 7 Absorption of methylene blue with synthetic AuNPs by Rhodococcus sp. LSJ-6 under different temperature and pH condition |
1) 本文研究了Rhodococcus sp.LSJ-6在不同温度和pH下介导合成的金纳米颗粒.研究发现, 温度主要影响颗粒的形状, 温度越高, 其形状越规则, 分散度好.pH对颗粒的粒径有重要的作用, 在pH为9时, 可以合成粒径小于4 nm的金纳米颗粒.由此, 可以改变温度和pH来合成不同形貌和大小的金纳米颗粒.
2) 亚甲基蓝的吸附去除研究结果表明, 在pH为9条件下吸附去除率高达96%, 这主要是因为此时合成的金纳米颗粒最小, 为生物合成金纳米颗粒的环境应用奠定了基础.
| [${referVo.labelOrder}] | Dieluweit S, Pum D, Sleytr U B. 1998. Formation of a gold superlattice on an S-layer with square lattice symmetry[J]. Supramolecular Science, 5(1/2): 15–19. |
| [${referVo.labelOrder}] | Husseiny M I, El Aziz M A, Badr Y, et al. 2007. Biosynthesis of gold nanoparticles using Pseudomonas aeruginosa[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 67(3/4): 1003–1006. |
| [${referVo.labelOrder}] | Mishra A N, Bhadauria S, Gaur M S, et al. 2010. Extracellular microbial synthesis of gold nanoparticles using fungus Hormoconis resinae[J]. Jom:the Journal of the Minerals, Metals & Materials Society, 62(11): 45–48. |
| [${referVo.labelOrder}] | Ahmad A, Senapati S, Khan M I, et al. 2003. Extracellular Biosynthesis of Monodisperse Gold Nanoparticles by a Novel Extremophilic Actinomycete, Thermomonospora sp[J]. Langmuir, 19(8): 3550–3553. DOI:10.1021/la026772l |
| [${referVo.labelOrder}] | Pimprikar P S, Joshi S S, Kumar A R, et al. 2009. Influence of biomass and gold salt concentration on nanoparticle synthesis by the tropical marine yeast Yarrowia lipolytica, NCIM 3589[J]. Colloids and Surfaces B:Biointerfaces, 74(1): 309–316. DOI:10.1016/j.colsurfb.2009.07.040 |
| [${referVo.labelOrder}] | Slocik J M, Naik R R, Stone M O, et al. 2005. Viral templates for gold nanoparticle synthesis[J]. Journal of Materials Chemistry, 15(7): 749–753. DOI:10.1039/b413074j |
| [${referVo.labelOrder}] | De M, Ghosh P S, Rotello V M. 2008. Applications of Nanoparticles in Biology[J]. Advanced Materials, 20(22): 4225–4241. DOI:10.1002/adma.v20:22 |
| [${referVo.labelOrder}] | Thirumurugan A, Aswitha P, Kiruthika C, et al. 2016. Green synthesis of platinum nanoparticles using Azadirachta indica-an eco-friendly approach[J]. Materials Letters, 170: 175–178. DOI:10.1016/j.matlet.2016.02.026 |
| [${referVo.labelOrder}] | Aizpurua J, Hanarp P, Sutherland D S, et al. 2003. Optical properties of gold nanorings[J]. Physical Review Letters, 90(5): 057401. DOI:10.1103/PhysRevLett.90.057401 |
| [${referVo.labelOrder}] | 张敬畅, 刘慷, 曹维良. 2001. 纳米粒子的特性、应用及制备方法[J]. 石油化工高等学校学报, 2001, 14(2): 21–26. |
| [${referVo.labelOrder}] | Bastus N G, Comenge J, Puntes V. 2011. Kinetically controlled seeded growth synthesis of citrate-stabilized gold nanoparticles of up to 200 nm:size focusing versus ostwald ripening[J]. Langmuir, 27(17): 11098–11105. DOI:10.1021/la201938u |
| [${referVo.labelOrder}] | He S, Guo Z, Zhang Y, et al. 2007. Biosynthesis of gold nanoparticles using the bacteria Rhodopseudomonas capsulata[J]. Materials Letters, 61(18): 3984–3987. DOI:10.1016/j.matlet.2007.01.018 |
| [${referVo.labelOrder}] | Binupriya A R, Sathishkumar M, Vijayaraghavan K, et al. 2010. Bioreduction of trivalent aurum to nano-crystalline gold particles by active and inactive cells and cell-free extract of Aspergillus oryzae var. viridis[J]. Journal of Hazardous Materials, 177(1/3): 539–545. |
| [${referVo.labelOrder}] | 沈娥, 刘紫嫣, 周豪, 等. 2015. Cupriavidus metallidurans SHE好氧还原Se (Ⅳ)合成硒纳米颗粒的特性研究[J]. 环境科学学报, 2015, 35(10): 3065–3070. |
| [${referVo.labelOrder}] | 石杰, 范淑敏, 吴静, 等. 2012. 生物法合成纳米金的研究进展[J]. 吉首大学学报(自然科学版), 2012, 33(3): 71–75. |
| [${referVo.labelOrder}] | Cai F, Li J, Sun J S, et al. 2011. Biosynthesis of gold nanoparticles by biosorption using Magnetospirillum gryphiswaldense MSR-1[J]. Chemical Engineering Journal, 175: 70–75. DOI:10.1016/j.cej.2011.09.041 |
| [${referVo.labelOrder}] | Rai A, Singh A, Ahmad A, et al. 2006. Role of halide ions and temperature on the morphology of biologically synthesized gold nanotriangles[J]. Langmuir, 22(2): 736–741. DOI:10.1021/la052055q |
| [${referVo.labelOrder}] | Ahmad A, Senapati S, Islam Khan M, et al. 2003. Intracellular synthesis of gold nanoparticles by a novel alkalotolerant actinomycete, Rhodococcus species[J]. Nanotechnology, 14(7): 824–828. DOI:10.1088/0957-4484/14/7/323 |
| [${referVo.labelOrder}] | Bello O S, Bello I A, Adegoke K A. 2013. Adsorption of dyes using different types of sand:a review[J]. South African Journal of Chemistry, 66(3): 117–129. |
| [${referVo.labelOrder}] | Fan H, Su C, Wang Y, et al. 2008. Sedimentary arsenite-oxidizing and arsenate-reducing bacteria associated with high arsenic groundwater from Shanyin, Northwestern China[J]. Journal of Applied Microbiology, 105(2): 529–539. DOI:10.1111/jam.2008.105.issue-2 |
| [${referVo.labelOrder}] | Mayer K M, Hafner J H. 2011. Localized surface plasmon resonance sensors[J]. Chemical Reviews, 111(6): 3828–3857. DOI:10.1021/cr100313v |
| [${referVo.labelOrder}] | Nath N, Chilkoti A. 2002. A colorimetric gold nanoparticle sensor to interrogate biomolecular interactions in real time on a surface[J]. Analytical Chemistry, 74(3): 504–509. DOI:10.1021/ac015657x |
| [${referVo.labelOrder}] | Brust M, Bethell D, Kiely C J, et al. 1998. Self-assembled gold nanoparticle thin films with nonmetallic optical and electronic properties[J]. Langmuir, 14(19): 5425–5429. DOI:10.1021/la980557g |
| [${referVo.labelOrder}] | Kasthuri J, Kathiravan K, Rajendiran N. 2009. Phyllanthin-assisted biosynthesis of silver and gold nanoparticles:a novel biological approach[J]. Journal of Nanoparticle Research, 11(5): 1075–1085. DOI:10.1007/s11051-008-9494-9 |
| [${referVo.labelOrder}] | Boeeuzzi F, Cerrato G, Pinna F, et al. 1998. FTIR, UV-Vis, and HRTEM study of Au/ZrO2 catalyst:Reduced reactivity in the CO-O2 reaction of electron-deficient gold sites present on the used samples[J]. Journal of Physical Chemistry B, 102(30): 5733–5736. DOI:10.1021/jp980890t |
| [${referVo.labelOrder}] | Zhou M, Chen S H, Zhao S Y. 2006. Synthesis of icosahedral gold nanocrystals:A thermal process strategy[J]. Journal of Physical Chemistry B, 110(10): 4510–4513. DOI:10.1021/jp060200i |
| [${referVo.labelOrder}] | Liu B, Xie J, Lee J Y, et al. 2005. Optimization of high-yield biological synthesis of single-crystalline gold nanoplates[J]. Journal of Physical Chemistry B, 109(32): 15256–15263. DOI:10.1021/jp051449n |
| [${referVo.labelOrder}] | Shen Y F, Tang J, Nie Z H, et al. 2009. Preparation and application of magnetic Fe3O4 nanoparticles for wastewater purification[J]. Separation and Purification Technology, 68(3): 312–319. DOI:10.1016/j.seppur.2009.05.020 |
 2017, Vol. 37
2017, Vol. 37


