2. 中国科学院陆地表层格局与模拟重点实验室, 北京 100101;
3. 中国科学院大学, 北京 100049
2. Key Laboratory of Land Surface Pattern and Simulation, Chinese Academy of Sciences, Beijing 100101;
3. University of Chinese Academy of Sciences, Beijing 100049
砷(As)是一种广泛存在于自然环境中的化学元素,砷化物对生物具有很强的毒性(Deschamps et al., 2005; Levy et al., 2005; 许效天等,2011).水体砷污染,尤其是淡水水体砷污染,对人类的健康构成了极大的威胁,因而受到广泛的关注(Yan et al., 2016).水体中砷的来源包括自然源和人为源,目前由于人类活动,包括农业中的除草剂、农药与杀虫剂施用,以及化石燃料的燃烧和金属冶炼等,造成大量砷进入水体(Huang et al., 2014),使人为源成为水体中砷的主要来源.
自然水体中砷浓度范围为0.5~5000 μg·L-1(Smedley et al., 2002),其在水体中的存在形态主要为无机五价和三价砷,在氧化性条件下,主要以无机五价砷形态存在,而在还原性条件下则主要以无机三价砷形态存在(Hasegawa et al., 2010).其中,无机As(Ⅴ)与P(Ⅴ)具有相似的性质,As(Ⅴ)和P(Ⅴ)均通过磷酸盐转运蛋白进入胞内,因而存在竞争性,即进入藻细胞内的As(Ⅴ)随着外部磷浓度的增加而减少(Wang et al., 2013; Wang et al., 2014; Wang et al., 2015).然而,磷作为水体富营养化的主要因子之一,对藻类生长起着至关重要的作用,目前微囊藻异常繁殖所导致的水华现象已遍布全球(Oberholster et al., 2006; Arzate Cárdenas et al., 2010; Zębek, 2014; Yan et al., 2016).在我国大部分富营养水体中,铜绿微囊藻均为优势种,中国三大湖泊(太湖、滇池和巢湖)均受到铜绿微囊藻的危害(吴丰昌等,2008).
目前,尽管国内外已有一些关于砷与铜绿微囊藻相互影响的研究报道,但都只关注指数增长期砷胁迫对其生长的影响(Huang et al., 2012; Wang et al., 2012; Huang et al., 2014),或随时间变化藻类胞外与胞内不同砷形态含量及与磷浓度的关系(Guo et al., 2011; Wang et al., 2013; Wang et al., 2014; Yan et al., 2014).基于此,本研究将探索不同生长期和磷浓度条件下As(Ⅴ)对铜绿微囊藻生长及胞内总砷的影响,以期为认识砷污染与湖泊富营养化之间的相互作用提供科学基础.
2 材料和方法(Materials and methods) 2.1 铜绿微囊藻的培养与藻细胞计数 2.1.1 铜绿微囊藻的来源与培养实验所用铜绿微囊藻(FACHB-1322) 购于中国科学院野生生物种质库——淡水藻种库.实验采用室内批量培养,在250 mL锥形瓶中添加150 mL培养液,用无菌培养容器封口膜密封,在121 ℃高温下灭菌30 min,冷却至常温,接入铜绿微囊藻,放置在温度25 ℃、光照强度2000 Lx、日昼时间比为12 h:12 h的智能型人工气候箱中进行培养.在一个光照周期内,摇动锥形瓶3~4次,每次摇晃后将气候箱中锥形瓶的位置重新随机调整.整个实验过程中尽量保证铜绿微囊藻处于无菌状态,铜绿微囊藻的转接均在洁净工作台(WT-1ND型,北京)上操作.
2.1.2 铜绿微囊藻培养基的选定室内培养铜绿微囊藻以M11培养基为基础,组分为(mg·L-1):MgSO4·7H2O 75、K2HPO4 10、NaNO3 100、CaCl2·2H2O 40、Na2CO3 20、Na2·EDTA·2H2O 1、柠檬酸铁(FeC6H5O7·5H2O) 6,pH=8(胡小贞等,2004;吕爱芃等,2012).由于柠檬酸铁对As(Ⅲ)具有氧化性(Levy et al., 2005; Pozdnyakov et al., 2016; Xu et al., 2016),会影响铜绿微囊藻对砷的吸收,因此,在进行As(Ⅴ)添加实验时,M11培养基中不添加柠檬酸铁.
2.1.3 铜绿微囊藻细胞计数在磷浓度分别为0、0.02、0.10和0.50 mg·L-1的无铁M11培养基中,定量接入经“饥饿”处理后的铜绿微囊藻,初始藻细胞密度为5×104 cells·mL-1,每组设3个平行.分别在接入藻的第0、2、3、5、7、9、11、13、15、17、19、21、23、25 d的接入时间点取样,在数码显微镜(DN-10,上海)下用25×16型血球计数板对样品计数,每个样品计数3次;同时,用紫外可见分光光度计(优尼柯UV-2101C型,上海),在波长为680 nm处,以超纯水作参比,测量样品吸光度值,每个样品重复测量3次.
2.2 As(Ⅴ)添加实验取经过“饥饿”处理且用15 mg·L-1碳酸氢钠溶液洗涤3次并离心的铜绿微囊藻,定量接种到分别代表实际淡水水体中营养、富营养和极富营养状态的磷浓度为0.02、0.10和0.50 mg·L-1的培养基中(刘建康,1999;黄漪平,2001;童昌华,2004).将铜绿微囊藻培养到各生长期的As(Ⅴ)添加时间点,按照0(空白对照)、400、600、800和1000 μg·L-1的浓度加入,并在0和2 d后取样测吸光度.
当铜绿微囊藻与As(Ⅴ)作用2 d后,用0.45 μm滤膜对藻液分离,用20 mL超纯水浸泡10 min,抽滤,并用20 mL 0.1 mol·L-1KH2PO4/K2HPO4缓冲液浸泡10 min,抽滤,以去除胞外吸附的砷(Levy et al., 2005; Wang et al., 2013).用10 mL 25%的HNO3溶液冲洗滤膜,将滤膜上的藻全部转移到100 mL烧杯中,在140 ℃条件下消解1 h,排酸后将剩余溶液全部转移到10 mL(或5 mL)试管中,定容到5 mL(铜绿微囊藻处于延缓期时定容到2.5 mL,延缓期时藻细胞密度小,砷含量低,因此,通过减小溶液体积使砷浓度高于检出限),最后用原子荧光光度计(AFS-8230,北京)测量铜绿微囊藻胞内砷含量.
2.3 相关计算与统计分析 2.3.1 平均生长速率的计算在不同生长期和磷浓度下,测量铜绿微囊藻与As(Ⅴ)作用0和2 d后的藻细胞密度,测吸光度A,通过吸光度与藻细胞密度的拟合公式估算出铜绿微囊藻的藻细胞密度,并采用公式(1) 计算出铜绿微囊藻与砷作用2 d的平均生长速率μ2d.通过分析不同条件下平均生长速率的大小关系,从而研究不同生长期和磷浓度下As(Ⅴ)对铜绿微囊藻生长的影响.
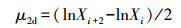
|
(1) |
式中,μ2d表示与砷作用2 d的平均生长速率(cells·mL-1·d-1),Xi和Xi+2分别表示第i和(i+2) d的藻细胞密度(cells·mL-1)(Huang et al., 2014; Franco et al., 2015).
2.3.2 胞内砷含量的计算由于不同条件下的铜绿微囊藻细胞密度不同,因此,需要换算成单个细胞胞内砷含量,公式如下:
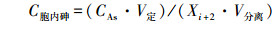
|
(2) |
式中,C胞内砷表示单个细胞胞内砷含量(μg·cell-1),CAs表示所测量的胞内砷含量值(μg·L-1),V定为最终定容体积(mL),Xi+2为与As(Ⅴ)作用2 d后的藻细胞密度(cells·mL-1),V分离表示被分离藻液的体积(mL)(Salvador et al., 2016).
2.3.3 统计分析统计分析用SPSS软件完成.采用单因素方差分析Duncan多重比较方法检验不同因素不同浓度处理之间的差异,并对处理梯度效应的趋势进行线性回归分析.
3 结果(Results) 3.1 铜绿微囊藻细胞计数法相关函数的构建根据血球计数板法和分光光度法测量数据,构建2种不同藻细胞密度测定方法的相关函数,获得吸光度和藻细胞密度的线性方程式,为后续正式实验中通过测量藻液吸光度来估算藻细胞密度提供依据(图 1).不同藻细胞密度的计算值与实测值分析结果表明,血球计数板法和分光光度计法在低藻细胞密度、高藻细胞密度和总藻细胞密度条件下都具有良好的线性关系,但计算值与实测值在不同的吸光度范围产生了较大的偏差(图 1).当0.002≤A≤0.006时,总藻细胞密度小于0 cells·mL-1;当0.002≤A≤0.032时,高藻细胞密度小于0 cells·mL-1.
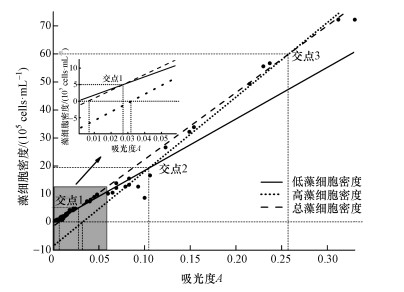 |
| 图 1 不同藻细胞密度的计算值与实测值 (低藻细胞密度公式是根据吸光度0<A≤0.065时2种测量方法建立,高藻细胞密度公式是根据吸光度A>0.065时建立,总藻细胞密度公式是根据不区分高藻细胞密度和低藻细胞密度时建立,散点图为真实测量值;低藻细胞密度和总藻细胞密度在A=0.027时相交于交点1,低藻细胞密度和高藻细胞密度在A=0.104时相交于交点2,高藻细胞密度和总藻细胞密度在A=0.259时相交于交点3) Fig. 1 The calculated and measured values of algae cell density |
由于不同吸光度范围时,实测值接近不同的拟合曲线,据此在不同吸光度范围内选择不同的回归方程.当0.002≤A≤0.027或0.06<A≤0.104时,y=184x+0.00174(R2=0.9696);当0.027<A≤0.06或A>0.259时, y=238.48x-1.4843(R2=0.9876);当0.104<A≤0.259时,y=265.69x-8.5224(R2=0.9874).
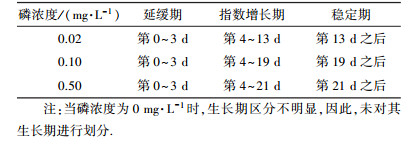
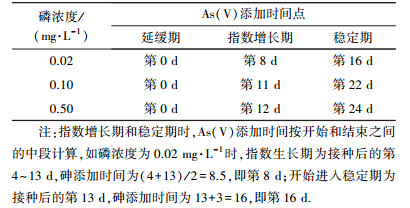
3.2 铜绿微囊藻生长期的划分根据血球计数板法和分光光度法测量数据,利用Origin 2016软件分别绘制藻类生长曲线(图 2).根据生长曲线,将不同磷浓度下铜绿微囊藻生长期进行了划分,包括延缓期、指数增长期和稳定期(表 1),并根据生长期的划分确定了As(Ⅴ)在不同生长期和磷浓度时的添加时间点(表 2).
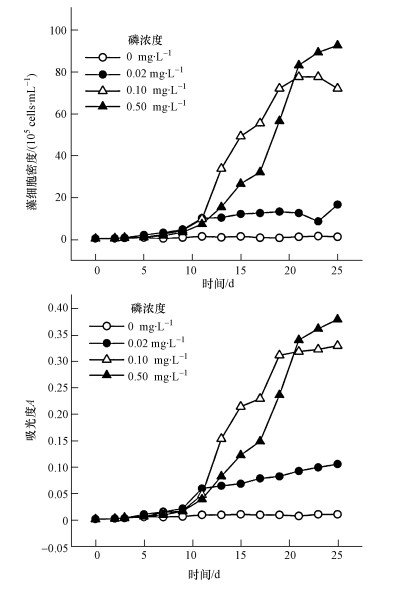 |
| 图 2 不同磷浓度下铜绿微囊藻的生长曲线 Fig. 2 The growth curve of M. aeruginosaat different phosphorus levels |
| 表 1 不同磷浓度下铜绿微囊藻生长期的划分 Table 1 The determination of the growth phases at different phosphorus levels |
| 表 2 不同磷浓度下铜绿微囊藻各生长期As(Ⅴ)添加时间点 Table 2 The schedule of As(Ⅴ) addition at the different phosphorus levels and growth phases |
在不同生长期下,铜绿微囊藻的平均生长速率随着磷或As(Ⅴ)浓度的梯度变化呈现不同的变化规律(图 3).当铜绿微囊藻处于延缓期时,与对照组(CK)相比,3个磷浓度下的砷处理均显著增加了平均生长速率(μ2d,下同),增加了21.49%~32.23%,但各个砷处理之间并无显著性差异(p>0.05).同一As(Ⅴ)处理时,各个磷浓度条件下的μ2d之间也无显著性差异(p>0.05).
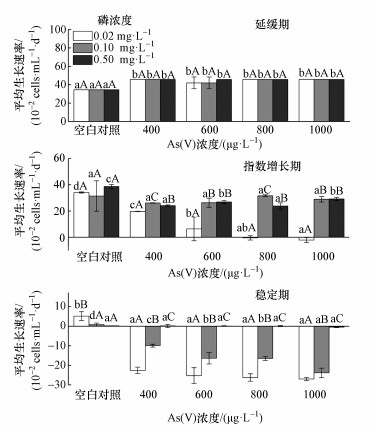 |
| 图 3 不同生长期、磷浓度和As(Ⅴ)处理条件下铜绿微囊藻平均生长速率 (不同小写字母表示同一生长期和磷浓度下不同砷浓度处理条件之间有显著性差异(p<0.05);不同大写字母表示同一生长期和砷浓度下不同磷浓度处理条件之间有显著性差异(p<0.05)) Fig. 3 The average growth rate at different growth phases, phosphorus and As(Ⅴ) levels |
当铜绿微囊藻处于指数增长期时,磷浓度为0.02 mg·L-1时,与CK相比,不同As(Ⅴ)浓度处理均显著抑制了铜绿微囊藻的生长,μ2d降低了42.35%~106.30%,且随砷浓度升高而呈线性模式下降(p<0.01, R2=0.961),即抑制程度随着砷浓度增加而增强,当砷处理浓度为800 μg·L-1时,铜绿微囊藻的生长开始出现负增长;磷浓度为0.1 mg·L-1时,与CK相比,不同砷处理浓度下μ2d均有不同程度的减少,降低了0.6%~16.91%,但其与砷处理浓度之间没有显著的线性回归关系(p>0.05);磷浓度为0.5 mg·L-1时,与CK相比,不同砷浓度处理下μ2d均有不同程度的减少,降低了24.60%~38.43%,但其与砷处理浓度之间没有显著的线性回归关系(p>0.05).同一As(Ⅴ)浓度处理下,磷浓度为0.1和0.5 mg·L-1时的μ2d显著高于磷浓度为0.02 mg·L-1时的μ2d,但分析显示μ2d与磷浓度之间并无显著的线性回归关系(p>0.05).
当铜绿微囊藻处于稳定期时,磷浓度为0.02 mg·L-1时,与CK相比,不同As(Ⅴ)浓度处理显著抑制了铜绿微囊藻的生长,μ2d降低了542%~628%,与砷处理浓度之间具有显著的线性回归关系(p<0.05,R2=0.765),且砷添加使铜绿微囊藻的生长均呈现负增长;磷浓度为0.1 mg·L-1时,与CK相比,不同As(Ⅴ)浓度处理显著抑制了铜绿微囊藻的生长,μ2d降低了1387%~3181%,其与砷处理浓度之间具有显著的线性回归关系(p<0.01,R2=0.965),且砷处理促使铜绿微囊藻的生长均呈现负增长;磷浓度为0.5 mg·L-1时,与CK相比,砷添加对铜绿微囊藻的生长也有抑制作用,μ2d降低了15.53%~378%,且随着砷处理浓度增加有逐渐下降的趋势,但其与砷处理浓度之间没有显著的线性回归关系(p>0.05).同一As(Ⅴ)浓度下,μ2d随着磷浓度的升高有增长的趋势,但与磷浓度之间无显著线性回归关系(p>0.05).
3.4 不同生长期、磷浓度和As(Ⅴ)浓度下的胞内砷含量在不同生长期时,铜绿微囊藻的胞内砷含量随着磷浓度或As(Ⅴ)浓度的梯度变化呈现出不同的规律(图 4).当铜绿微囊藻处于延缓期时,各磷浓度下,总体上胞内砷含量随砷处理浓度的增加而升高,其中,在磷浓度为0.1 mg·L-1和As(Ⅴ)浓度为800 mg·L-1处理时达到最大值(20.57×10-10 μg·cell-1),并且磷浓度为0.1 mg·L-1时,胞内砷含量与砷处理浓度之间有显著线性回归关系(p<0.05,R2=0.873).
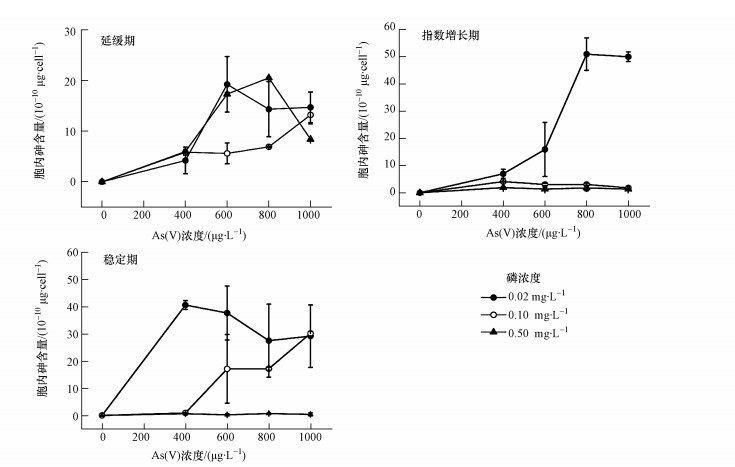 |
| 图 4 不同生长期、磷浓度和As(Ⅴ)浓度下的胞内砷含量 Fig. 4 The intracellular arsenic content under different growth phases, phosphorus and As(Ⅴ) levels |
当铜绿微囊藻处于指数增长期,磷浓度为0.02 mg·L-1时,胞内砷含量随砷处理浓度升高逐渐增加,且与砷处理浓度之间有显著的线性回归关系(p<0.05,R2=0.826),而磷浓度为0.1和0.5 mg·L-1时,不同砷浓度之间的胞内砷含量之间无显性差异.
当铜绿微囊藻处于稳定期,磷浓度为0.1 mg·L-1时,砷处理显著促进了藻细胞对砷的吸收,且胞内砷含量与砷浓度之间有显著的线性回归关系(p<0.05,R2=0.844);磷浓度为0.02和0.5 mg·L-1时,胞内砷含量不随砷处理浓度增长而发生变化(p>0.05),但磷浓度为0.02 mg·L-1时, 不同砷处理浓度下胞内砷含量均大于磷浓度为0.1和0.5 mg·L-1时胞内砷含量.
当铜绿微囊藻处于指数增长期和稳定期时,胞内总砷含量随着磷浓度的增加有减小的趋势,然而在延缓期时,并未出现这一规律.
4 讨论(Discussion) 4.1 不同生长期和磷浓度时As(Ⅴ)对铜绿微囊藻生长的影响当铜绿微囊藻处于延缓期时,与CK比较,As(Ⅴ)添加后平均生长速率(μ2d)有上升趋势(图 3),即促进铜绿微囊藻的生长.这是因为当铜绿微囊藻处于延缓期时,生长代谢缓慢,吸入的砷少,而少量的As(Ⅴ)能刺激藻的生长(王静, 2012).
在指数增长期和稳定期时,As(Ⅴ)添加均显著地抑制铜绿微囊藻的生长(图 3)(龚艳等,2009; Barral Fraga et al., 2015; Tuulaikhuu et al., 2015),导致这一现象的原因是:当处于指数增长期时,铜绿微囊藻生长代谢旺盛,吸入大量砷,而进入胞内的砷将对藻细胞的光合作用等产生抑制作用(Wang et al., 2012; 李斌等,2016),从而抑制藻类的生长;当处于稳定期时,铜绿微囊藻由于经过指数生长期的爆发性生长,环境中的代谢废物增加, 营养物质和生存空间减少,此时砷的添加使藻的生长环境变得更为恶劣,因此,导致藻细胞大量死亡.
在指数增长期和稳定期时,虽然As(Ⅴ)会显著抑制铜绿微囊藻的生长,但基本表现为随着磷浓度的增加抑制效应减小,即低磷浓度(0.02 mg·L-1)时,铜绿微囊藻受到抑制的程度随着As(Ⅴ)处理浓度增加而增加,而当磷浓度提高(0.1、0.5 mg·L-1)时,其平均生长速率随砷处理浓度升高的降低趋势大为减缓乃至不复存在,这是因为磷酸盐和As(Ⅴ)存在竞争性,且磷酸盐促进砷的外排,从而削减砷对藻细胞代谢的影响(Guo et al., 2011; Wang et al., 2014; Yan et al., 2014).
4.2 不同生长期和磷浓度时铜绿微囊藻对As(Ⅴ)的吸收特征当铜绿微囊藻处于延缓期,3个磷浓度,胞内砷随着As(Ⅴ)处理浓度增加均呈增加的趋势,而当处于指数增长期,只有磷浓度较低时(0.02 mg·L-1),胞内砷随着As(Ⅴ)处理浓度增加而增加(图 4).以上结果表明,铜绿微囊藻在大量繁殖前,培养基中的藻细胞较少,砷处理可显著促进藻细胞对砷的吸收,磷对铜绿微囊藻吸收砷的影响较小,而铜绿微囊藻大量繁殖之后,磷可显著拮抗藻对砷的吸收(Levy et al., 2005; 王振红等,2015).
当磷浓度为0.1和0.5 mg·L-1时,处于延缓期的铜绿微囊藻胞内砷含量均高于处于指数增长期胞内砷含量,延缓期时其均值分别为7.91×10-10 μg·cell-1和13.09×10-10 μg·cell-1,而指数增长期则分别为3.02×10-10 μg·cell-1和1.61×10-10 μg·cell-1.这可能是因为不同生长期藻的代谢特征不同所致,有研究指出,指数增长期时,藻可将吸入体内的砷酸盐As(Ⅴ)转化为亚砷酸盐As(Ⅲ),并大量排出体外(Wang et al., 2013; Wang et al., 2014; Yan et al., 2014),而延缓期时,藻细胞代谢缓慢(砷转化及外排缓慢),可能导致胞内砷的积累.
当铜绿微囊藻处于指数增长期和稳定期时,胞内总砷随着磷浓度的增加而减小,但延缓期时并没有随着磷浓度变化呈规律性变化.磷能减少As(Ⅴ)进入藻细胞中,因此,胞内总砷随着磷浓度的增加而减小(Wang et al., 2014),然而延缓期时胞内总砷没有因为磷浓度的梯度变化而呈现出规律性变化,可能是因为延缓期时培养基中磷含量对于少量的铜绿微囊藻而言均是富磷状态.
当处于稳定期时,磷浓度为0.1 mg·L-1时,胞内砷则随着As(Ⅴ)浓度的增加而增加,而磷浓度为0.02 mg·L-1时,胞内砷含量在As(Ⅴ)为400 μg·L-1时达到最大值,此后不再增加.导致这一现象的原因是生长期的差异性和磷与砷的竞争性,其中,生长期的差异性目前未发现相关报道,虽然关于藻类对磷与砷吸收的竞争性的报道已经有很多,但主要集中在指数增长期(龚艳等,2009; Wang et al., 2014; 王振红等,2015).
5 结论(Conclusions)1) 铜绿微囊藻的生长及胞内砷受到生长期、磷浓度和As(Ⅴ)浓度的共同影响.在不同生长期时,铜绿微囊藻的生长代谢不同,从而使铜绿微囊藻的生长和胞内砷受到生长期不同的影响而呈现出差异性.
2) 磷酸盐可抵消As(Ⅴ)对铜绿微囊藻生长的抑制作用,同时也通过拮抗作用抑制As(Ⅴ)进入藻细胞内,增加铜绿微囊藻对砷酸盐的耐性.
3) 当磷含量低时,As(Ⅴ)浓度的增加不利于铜绿微囊藻的生长,并且增加As(Ⅴ)进入胞内的机会,即铜绿微囊藻受到抑制程度随着As(Ⅴ)浓度的增加而增加,胞内总砷随着As(Ⅴ)浓度的增加而增加.
| [${referVo.labelOrder}] | Arzate Cárdenas M A, Olvera Ramírez R, Martínez Jerónimo F. 2010. Microcystis toxigenic strains in urban lakes:a case of study in Mexico City[J]. Ecotoxicology, 19(19): 1157–1165. |
| [${referVo.labelOrder}] | Barral Fraga L, Morin S, Rovira M D M, et al. 2015. Short-term arsenic exposure reduces diatom cell size in biofilm communities[J]. Environmental Science & Pollution Research, 23(5): 1–14. |
| [${referVo.labelOrder}] | Deschamps E, Ciminelli V S T, H ll W H. 2005. Removal of As(Ⅲ) and As(Ⅴ) from water using a natural Fe and Mn enriched sample[J]. Water Research, 39(20): 5212–5220. DOI:10.1016/j.watres.2005.10.007 |
| [${referVo.labelOrder}] | Franco M W, Ferreira F A G, Vasconcelos I F, et al. 2015. Arsenic biotransformation by cyanobacteria from mining areas:evidences from culture experiments[J]. Environmental Science & Pollution Research, 22(23): 1–9. |
| [${referVo.labelOrder}] | Guo P, Gong Y, Wang C, et al. 2011. Arsenic speciation and effect of arsenate inhibition in a Microcystis aeruginosa culture medium under different phosphorus regimes[J]. Environmental Toxicology & Chemistry, 30(8): 1754–1759. |
| [${referVo.labelOrder}] | 龚艳, 吴幸强, 肖邦定, 等. 2009. 铜绿微囊藻在不同供磷浓度下对砷胁迫的响应[J]. 水生生物学报, 2009, 33(5): 890–895. |
| [${referVo.labelOrder}] | 胡小贞, 马祖友, 易文利, 等. 2004. 4种不同培养基下铜绿微囊藻和四尾栅藻生长比较[J]. 环境科学研究, 2004, 17(S1): 55–57. |
| [${referVo.labelOrder}] | 黄漪平. 2001. 太湖水环境及其污染控制[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | Hasegawa H, Rahman M A, Kitahara K, et al. 2010. Seasonal changes of arsenic speciation in lake waters in relation to eutrophication[J]. Science of the Total Environment, 408(7): 1684–1690. DOI:10.1016/j.scitotenv.2009.11.062 |
| [${referVo.labelOrder}] | Huang W J, Lu Y M, Yu W L. 2012. Toxicity and bioaccumulation of monomethylmercury in freshwater Cyanobacteria:Oscillatoria tenuisa and Microcystis aeruginosa[J]. Environmental Forensics, 13(3): 255–261. DOI:10.1080/15275922.2012.676601 |
| [${referVo.labelOrder}] | Huang W J, Wu C C, Chang W C. 2014. Bioaccumulation and toxicity of arsenic in cyanobacteria cultures separated from a eutrophic reservoir[J]. Environmental Monitoring & Assessment, 186(2): 805–814. |
| [${referVo.labelOrder}] | 李斌, 陈亚男, 齐占会, 等. 2016. 无机砷As(Ⅴ)对牟氏角毛藻(Chaetoceros mulleri)生长、叶绿素a含量及抗氧化活力的影响[J]. 海洋与湖沼, 2016, 47(2): 455–459. |
| [${referVo.labelOrder}] | 刘建康. 1999. 高级水生生物学[M]. 北京: 科学出版社. |
| [${referVo.labelOrder}] | 吕爱芃, 马文林. 2012. 两种培养基下3种藻类的生长情况比较[J]. 安徽农业科学, 2012, 40(33): 16333–16335. DOI:10.3969/j.issn.0517-6611.2012.33.109 |
| [${referVo.labelOrder}] | Levy J L, Stauber J L, Adams M S, et al. 2005. Toxicity, biotransformation, and mode of action of arsenic in two freshwater microalgae (Chlorella sp.and Monoraphidium arcuatum)[J]. Environmental Toxicology & Chemistry, 24(10): 2630–2639. |
| [${referVo.labelOrder}] | Oberholster P J, Botha A M, Cloete T E. 2006. Toxic cyanobacterial blooms in a shallow, artificially mixed urban lake in Colorado, USA[J]. Lakes & Reservoirs Research & Management, 11(2): 111–123. |
| [${referVo.labelOrder}] | Pozdnyakov I P, Ding W, Xu J, et al. 2016. Photochemical transformation of an iron(Ⅲ)-arsenite complex in acidic aqueous solution[J]. Photochemical & Photobiological Sciences Official Journal of the European Photochemistry Association & the European Society for Photobiology, 15(3): 431–439. |
| [${referVo.labelOrder}] | Salvador D, Churro C, Valério E. 2016. Evaluating the influence of light intensity in mcyA gene expression and microcystin production in toxic strains of Planktothrix agardhii and Microcystis aeruginosa[J]. Journal of Microbiological Methods, 123: 4–12. DOI:10.1016/j.mimet.2016.02.002 |
| [${referVo.labelOrder}] | Smedley P L, Kinniburgh D G. 2002. A review of the source, behaviour and distribution of arsenic in natural waters[J]. Applied Geochemistry, 17(5): 517–568. DOI:10.1016/S0883-2927(02)00018-5 |
| [${referVo.labelOrder}] | Tuulaikhuu B A, Romaní A M, Guasch H. 2015. Arsenic toxicity effects on microbial communities and nutrient cycling in indoor experimental channels mimicking a fluvial system[J]. Aquatic Toxicology, 166: 72–82. DOI:10.1016/j.aquatox.2015.07.005 |
| [${referVo.labelOrder}] | 童昌华. 2004. 水体富营养化发生原因分析及植物修复机理的研究[D]. 杭州: 浙江大学 |
| [${referVo.labelOrder}] | Wang N X, Huang B, Shen X, et al. 2014. Effects of nitrogen and phosphorus on arsenite accumulation, oxidation, and toxicity in Chlamydomonas reinhardtii[J]. Aquatic Toxicology, 157(7): 167–174. |
| [${referVo.labelOrder}] | Wang N X, Li Y, Deng X H, et al. 2013. Toxicity and bioaccumulation kinetics of arsenate in two freshwater green algae under different phosphorus regimes[J]. Water Research, 47(7): 2497–2506. DOI:10.1016/j.watres.2013.02.034 |
| [${referVo.labelOrder}] | Wang S, Zhang D, Pan X. 2012. Effects of arsenic on growth and photosystem Ⅱ (PSⅡ) activity of Microcystis aeruginosa[J]. Ecotoxicology & Environmental Safety, 84(7): 104–111. |
| [${referVo.labelOrder}] | Wang Y, Wang S, Xu P, et al. 2015. Review of arsenic speciation, toxicity and metabolism in microalgae[J]. Reviews in Environmental Science & Biotechnology, 14(3): 427–451. |
| [${referVo.labelOrder}] | Wang Z, Luo Z, Yan C. 2013. Accumulation, transformation, and release of inorganic arsenic by the freshwater cyanobacterium Microcystis aeruginosa[J]. Environmental Science & Pollution Research, 20(10): 7286–7295. |
| [${referVo.labelOrder}] | 王静. 2012. 铜绿微囊藻中砷的代谢与生物效应[D]. 天津: 天津大学 http://cdmd.cnki.com.cn/Article/CDMD-10056-1013005402.htm |
| [${referVo.labelOrder}] | 王振红, 罗专溪, 车霏霏, 等. 2015. 不同磷浓度下铜绿微囊藻对砷酸盐的吸收和净化[J]. 中国环境科学, 2015, 35(2): 533–538. |
| [${referVo.labelOrder}] | 吴丰昌, 孟伟, 宋永会, 等. 2008. 中国湖泊水环境基准的研究进展[J]. 环境科学学报, 2008, 28(12): 2385–2393. DOI:10.3321/j.issn:0253-2468.2008.12.001 |
| [${referVo.labelOrder}] | 许效天, 霍林, 左叶颖, 等. 2011. 铝改性粉煤灰漂珠吸附水溶液中砷的性能研究[J]. 中国环境科学, 2011, 31(8): 1300–1305. |
| [${referVo.labelOrder}] | Wang Z, Luo Z, Yan C, et al. 2014. Arsenic uptake and depuration kinetics in Microcystis aeruginosa under different phosphorus regimes[J]. Journal of Hazardous Materials, 276(9): 393–399. |
| [${referVo.labelOrder}] | Xu J, Ding W, Wu F, et al. 2016. Rapid catalytic oxidation of arsenite to arsenate in an iron(Ⅲ)/sulfite system under visible light[J]. Applied Catalysis B Environmental, 186: 56–61. DOI:10.1016/j.apcatb.2015.12.033 |
| [${referVo.labelOrder}] | Yan C, Che F, Zeng L, et al. 2016. Spatial and seasonal changes of arsenic species in Lake Taihu in relation to eutrophication[J]. Sci Total Environ, 563-564: 496–505. DOI:10.1016/j.scitotenv.2016.04.132 |
| [${referVo.labelOrder}] | Yan C, Wang Z, Luo Z. 2014. Arsenic efflux from Microcystis aeruginosa under different phosphorus regimes[J]. Plos One, 9(12): e116099–e116099. DOI:10.1371/journal.pone.0116099 |
| [${referVo.labelOrder}] | Zębek E. 2014. Response of cyanobacteria to the fountain-based water aeration system in Jeziorak Mały urban lake[J]. Limnological Review, 14(1): 51–60. |
 2017, Vol. 37
2017, Vol. 37