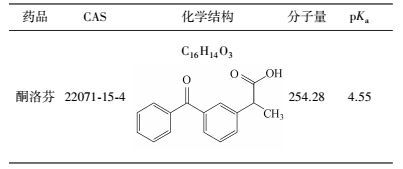
药品和个人护理用品(Pharmaceuticals and personal care products, PPCPs)作为一种“新兴污染物”日益受到关注(Padhye et al., 2014).酮洛芬(Ketoprofen, KET)是一种典型非甾体抗炎、解热、镇痛药, 被广泛应用于治疗类风湿关节炎、骨关节炎、关节僵硬脊柱炎以及非风湿性疾病或术后疼痛(Musa et al., 2007), 其性质如表 1所示.近年来, 国内外已有许多研究指出在污水处理厂出水、环境水体以及饮用水水源中频繁检测出酮洛芬.Santos等(2007)在西班牙的多个污水处理厂出水中检测到酮洛芬, 浓度高达2.5 μg·L-1.Kasprzyk-Hordern等(2008)在伊利河及塔夫河中均检出酮洛芬, 浓度为0.5~14 ng·L-1.Cao等(2010)在对漳渭南运河河流系统中内分泌干扰物及抗炎药的调查中发现, 酮洛芬的浓度最大值为31.35 ng·L-1, 其中岳城水库测得酮洛芬浓度为1.33~8.40 ng·L-1.Rabiet等(2006)调查了法国勒古河水中PPCPs的分布特征, 在作为饮用水水源的几个水库中检出酮洛芬.污水处理厂和自来水厂的传统工艺不能完全去除这一类污染物, 因此饮用水中可能含有低浓度酮洛芬, 长期饮用将带来健康风险(Rahman et al., 2009).因此, 亟需一种有效的方法去除水中的酮洛芬.
| 表 1 酮洛芬的性质 Table 1 Properties of ketoprofen |
臭氧(Ozone, O3)是一种环境友好的高级氧化剂, 其自身的氧化能力较强(E=2.07 V), 同时可以产生氧化能力更强的羟基自由基(Hydroxyl Radicals, ·OH, E=2.8 V), 对大部分难降解有机物都有良好的去除效果(De Witte et al., 2009; Broseus et al., 2009; Gago Ferrero et al., 2013), 目前被广泛应用于有机污染物去除领域中.近年来, 硫酸根自由基的高级氧化法由于其对有机物有效的去除率得到了广泛的应用(Oh et al., 2014; Liu et al., 2013; Govindan et al., 2014; Ghauch et al., 2012; Qin et al., 2016).比起羟基自由基易于与有机物发生抽氢反应及加成反应, 硫酸根自由基的不同在于它更倾向于电子转移(Govindan et al., 2014; Peyton, 1993).基于这两个体系的优越性, Cong等报道了臭氧联合过硫酸氢钾复合盐降解对氯苯甲酸, 两者的协同作用对pCBA起到很好的削减效果(Cong et al., 2015).目前, 仅有少量研究揭示了O3/PMS这一新型氧化体系的氧化机理(Yang et al., 2015), 关于其应用在新兴污染物降解的研究才刚起步, 亟需进一步研究和推广.
本文利用臭氧以及臭氧联合过硫酸氢钾复合盐降解水中的酮洛芬, 对比两个不同体系中酮洛芬的降解效果, 研究了溶液初始pH值对酮洛芬降解的影响, 并探究其降解机理, 为进一步的实际应用提供技术支持.
2 材料与方法(Materials and methods) 2.1 试剂酮洛芬(KET), 纯度≥98%, TCI公司;过硫酸氢钾复合盐(KHSO5·0.5KHSO4·0.5K2SO4, 307.38 MW), 分析纯, 阿拉丁公司;硫酸(H2SO4)、氢氧化钠(NaOH)均为分析纯, 广州化学试剂厂;冰乙酸(CH3COOH), 分析纯, 天津致远化学试剂;乙腈(CH3CN), 色谱纯, 美国ACS恩科化学;实验用水为超纯水(18 MΩ·cm-1).
2.2 仪器QJ-8002K臭氧发生器(铨聚科技);臭氧氧化反应器(自制玻璃材质, 高径比>5, 有效容积600 mL, 以锡箔纸密闭遮光);UT-500型臭氧浓度检测仪(美国独资爱迪尔测控技术有限公司);AL104型电子天平(梅特勒-托利多仪器有限公司);PHS--3C型pH计(上海雷磁科学仪器有限公司);LC-20A高效液相色谱仪(日本岛津公司);Smart2 Pure纯水/超纯水一体化系统(德国TKA);AS20500BDT-I型超声清洗器(天津奥特赛恩斯仪器有限公司).
2.3 酮洛芬降解实验氧化反应在自制的反应装置中进行(图 1), 配制500 mL酮洛芬浓度为20 μmol·L-1的反应液, 调节溶液初始pH值后, 加入12 μmol·L-1 PMS溶液, 打开臭氧发生器, 气体通过通气管下端的气体分散器分散后进入反应体系, 尾气中多余的臭氧通过KI吸收后排空.距离反应器底部5 cm处有取样口, 实验进行至0、2、4、8、12、16、24 min时取1.5 mL样品用高效液相色谱仪对酮洛芬剩余浓度其进行分析.每组实验设置3次平行实验以消除实验误差, 结果取平均值.
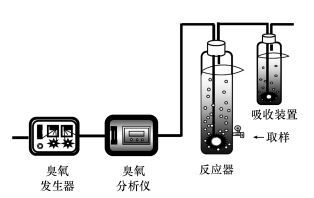 |
| 图 1 反应装置示意图 Fig. 1 Schematic diagram of reaction equipment |
利用臭氧浓度检测仪测进气与出气混合气体中臭氧浓度, 测得进气臭氧浓度为16 μmol·L-1, 出气臭氧浓度为12 μmol·L-1, 即臭氧利用率为25%, 混合气体流量为0.4 L·min-1, 反应体系消耗的臭氧量为1.6 μmol·min-1.
2.5 酮洛芬浓度测定方法用高效液相色谱仪(HPLC)对酮洛芬浓度进行测定, 色谱柱为ZORBAX Eclipse XDB-C18(4.6 mm×150 mm, 5 μm);色谱条件:乙腈:0.5%冰乙酸=45:55(V/V), 流动相流速为1.0 mL·min-1, 柱温40 ℃, 进样量为10 μL.检测器为光电二极管阵列检测器, 检测波长为260 nm.
3 结果与讨论(Results and discussions) 3.1 不同氧化剂对酮洛芬降解的影响在酮洛芬初始浓度为20 μmol·L-1, 溶液pH为7, 室温条件下考察了单独PMS, 单独O3以及O3/PMS 3个氧化体系对酮洛芬的降解情况.其中, 臭氧浓度为16 μmol·L-1, PMS浓度为12 μmol·L-1.结果如图 2所示, 酮洛芬的降解符合一级动力学.根据一级动力学方程(式(1))(Wang et al., 2015), 可计算出其降解的速率常数, 分别为0.000、0.029和0.046 min-1, 说明单独PMS对酮洛芬没有降解作用, O3以及O3/PMS均能降解酮洛芬.并且O3/PMS对酮洛芬的降解效果显著优于O3单独使用时的效果, 说明PMS可以促进臭氧降解酮洛芬, 根据式(2)(李富华, 2016), 可计算其促进率为58.6%.
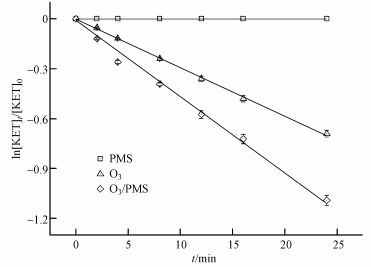 |
| 图 2 单独PMS、单独O3和O3/PMS体系中酮洛芬的降解 Fig. 2 Degradation kinetics of KET at PMS, O3 and O3/PMS systems |
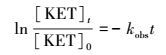
|
(1) |
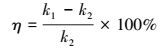
|
(2) |
式中, [KET]0和[KET]t分别代表 0时刻t时刻酮洛芬的浓度;k1代表O3/PMS时的降解速率常数;k2代表O3单独作用时的降解速率常数.
O3与PMS之间的不同比例会影响有机物的降解(Cong et al., 2015), 因此, 本文考察了0、8、10、12、16、24、32 μmol·L-17个不同浓度PMS联合O3对酮洛芬的降解情况, 从表 2可以看出, 浓度在0~12 μmol·L-1范围内, PMS浓度增大促进酮洛芬的降解, 当超过了这个范围, PMS浓度增大则抑制酮洛芬的降解.也即是说, 当酮洛芬:臭氧:PMS的浓度比为1:0.8:0.6时, 酮洛芬的去除效果达到最佳.本文还研究了PMS联合氧气对酮洛芬的降解效果, 结果如表 2所示, O2/PMS对酮洛芬并无去除作用.
| 表 2 不同实验条件下酮洛芬降解的动力学方程 Table 2 Pseudo-first-order kinetic model of ketoprofen degradation at different reaction processes |
研究表明, 臭氧溶于溶液中能分解产生羟基自由基(式3)(皮运正, 王建龙, 2005; Sein et al., 2008), O3/PMS体系中能同时产生硫酸根自由基和羟基自由基(Cong et al., 2015; Yang et al., 2015).PMS中的SO52-能与O3结合生成化合物-O3SOO-(式4), -O3SOO-分解生成SO5·-与O3·-(式5), SO5·-进一步分解产生SO4·-(式6), 而O3·-则与水结合生成·OH(式7).O3、·OH以及SO4·-对大部分难降解有机物都有良好的去除效果(De Witte et al., 2009; Broseus et al., 2009; Gago Ferrero et al., 2013; Cong et al., 2015)
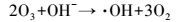
|
(3) |

|
(4) |
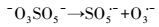
|
(5) |
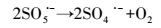
|
(6) |
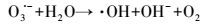
|
(7) |
为了考察O3/PMS体系中酮洛芬的降解机制, 本研究采用淬灭实验, 分别利用叔丁醇(Tert Butyl Alcohol, TBA)及乙醇(Ethanol, ET)为自由基抑制剂, 探究了体系中自由基的种类.叔丁醇被认为是一种有效的·OH抑制剂, 在·OH淬灭实验中的到广泛地应用(Sein et al., 2008; De Witte et al., 2009).乙醇与·OH的反应速率常数为107量级, 而与SO4·-为109量级(Liang and Su, 2009), 可被用作本文中·OH及SO4·-二者的淬灭剂.本实验在酮洛芬初始浓度为20 μmol·L-1, O3浓度为16 μmol·L-1, PMS浓度为12 μmol·L-1, 初始pH值为7, 室温条件下进行.TBA与ET浓度分别为0、20、40 mmol·L-1, 结果如图 3所示.实验表明在TBA和ET浓度均为20 mmol·L-1时, 几乎可以完全淬灭.O3/PMS/TBA体系中, 酮洛芬的降解速率明显受到抑制, 其降解速率常数为0.021 min-1.O3/PMS/ET体系中, 酮洛芬的降解速率几乎被完全抑制, 其降解速率常数为0.002 min-1.表明了体系中除了O3外, 还存在·OH和SO4·-, 它们对酮洛芬均能起降解作用.根据式(8)~(10) 可以估算出O3、·OH以及SO4·-在整个酮洛芬降解过程中的贡献率(陈平等, 2015), 求得O3、·OH、SO4·-对酮洛芬的贡献率分别为4.35%、54.35%、41.30%.另外, 本实验进一步探究了初始pH值为5和9时O3、·OH以及SO4·-的贡献率, 以对比酸性、中性以及碱性条件下3种自由基的相对贡献.初始pH值为5时, O3、·OH、SO4·-对酮洛芬的贡献率分别为6.52%、45.65%、47.83%.初始pH值为7时, O3、·OH、SO4·-对酮洛芬的贡献率分别为2.17%、58.69%、39.13%.随着初始pH值上升, O3及SO4·-的贡献率下降, ·OH的贡献率上升.
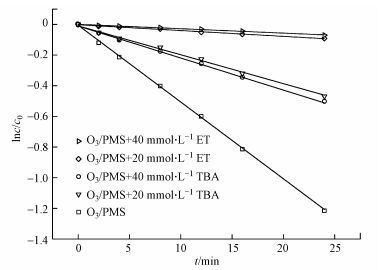 |
| 图 3 酮洛芬在O3/PMS、O3/PMS/TBA、O3/PMS/ET的降解动力学 Fig. 3 Degradation kinetics of KET in the O3/PMS, O3/PMS/TBA and O3/PMS/ET |

|
(8) |
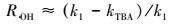
|
(9) |
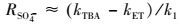
|
(10) |
式中, RO3、R·OH、RSO4·-分别代表O3、·OH、SO4·-对KET降解的贡献率, k1代表KET在O3/PMS体系中的降解速率常数, kTBA代表体系中存在叔丁醇的条件下KET的降解速率常数, kET代表体系中存在乙醇的条件下KET的降解速率常数.
3.3 初始pH值对O3/PMS降解酮洛芬的影响初始pH值是影响有机物降解的一个重要因素.本实验在酮洛芬初始浓度20 μmol·L-1, 臭氧浓度为16 μmol·L-1, PMS浓度为12 μmol·L-1, 室温条件下进行考察初始pH值对O3及O3/PMS两个体系中酮洛芬降解的影响.由表 3可知, 不同初始pH值条件下, 酮洛芬的降解均符合一级动力学, 当初始pH值为5、6、7、8、9和10时, O3体系中酮洛芬降解的速率常数为0.022、0.025、0.029、0.034、0.040、0.050 min-1, 而O3/PMS体系中则为0.025、0.036、0.046、0.077、0.099及0.136 min-1.初始pH值对两个体系中酮洛芬的降解均有较为明显的影响, 初始pH值增大有利于酮洛芬的降解, 这种影响在碱性条件下更加明显.表 3对比了同一pH下O3和O3/PMS体系降解酮洛芬的速率常数, 结果显示, 体系初始pH从5增大到10, PMS对体系降解酮洛芬的促进率由13.6%增大到171.9%.
| 表 3 初始pH值对O3和O3/PMS体系降解酮洛芬的影响 Table 3 Influence of initial pH values on KET degradation at O3 and O3/PMS systems |
前文已指出, O3分解产生·OH有赖于溶液中的OH-.溶液初始pH值增大, OH-的浓度随之增大, 促使溶液中·OH浓度增大从而促进有机物的降解.图 4列举了初始pH为5、7和9时, 加入PMS后溶液的pH值以及整个反应过程中溶液的pH值变化趋势.PMS在溶液中有两种离子形态, 分别为HSO5-与SO52-, 其解离常数为9.4(Qi et al., 2016), 解离平衡如图 5所示.当溶液pH值为酸性时, PMS以HSO5-的形式存在, 没有电离的H+, 对溶液pH值影响不大.当溶液初始pH值逐渐增加时, HSO5-开始电离产生SO52-以及H+, 导致溶液pH值下降, 初始pH值越大, HSO5-电离为SO52-的比例越大, 反应结束后pH值下降幅度也越大.初始pH=5时, PMS主要以HSO5-的形式存在, 电离产生的H+可以忽略, 反应过程中体系的pH值基本不变;初始pH=7时, PMS同样以HSO5-形式存在, 但其反应结束后的pH值则有明显下降, 这可能是因为反应过程中部分OH-会转变为·OH所致(式3);pH=9时, 由于HSO5-发生电离的比例提高, 释放H+增加, 同时体系OH-浓度较大, OH-按式(3) 转化为·OH的速度加快, 因此反应过程中体系的pH值下降更为明显.
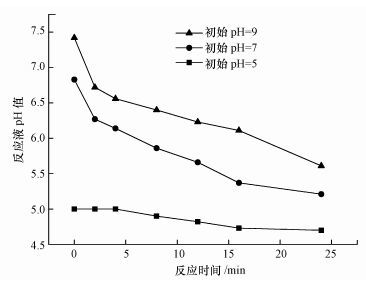 |
| 图 4 O3/PMS体系反应过程中溶液pH值的变化 Fig. 4 Changes of solution pH value during the reaction |
另一方面, PMS与O3反应后分解产生自由基, 该过程的有效成分是SO52-(式4).随着pH值增大, HSO5-的浓度减小, SO52-的浓度增大, 因此体系中SO4·-的浓度随之增大.这一结果与Guan等(2011)在研究UV/PMS体系中SO4·-浓度变化趋势一致.另一方面, 碱能诱导部分SO4·-转化为·OH (Qi et al., 2016; Furman et al., 2010), 已知·OH与酮洛芬反应的速率常数为8.4×109 L·mol-1·s-1(Real et al., 2009), 根据式(11) 可计算得溶液中的·OH浓度, 实验测得pH值为5、7、9时, ·OH的浓度分别为1.3×10-11、2.8×10-11、6.8×10-11 mmol·L-1.·OH的相对贡献率随着初始pH增大而增大, 也即是说, 增大初始pH值提高了体系中·OH的浓度, 从而提高了酮洛芬的降解率.
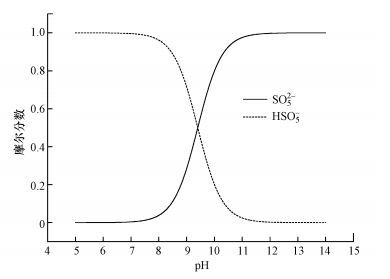 |
| 图 5 PMS的解离形态分布图 Fig. 5 Distribution of dissociation species of PMS |
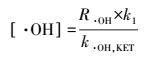
|
(11) |
1) 臭氧以及臭氧联合过硫酸氢钾复合盐两个体系对酮洛芬有良好的降解效果.也即使说, 臭氧与过硫酸氢钾复合盐具有协同作用.
2) 臭氧联合PMS体系中, 对酮洛芬降解起主要作用的是体系中所产生的·OH和SO4·-.
3) 溶液初始pH值影响两个体系对酮洛芬的降解, 随着pH值增大, 酮洛芬的降解率增大.
4) 在碱性条件下, PMS对臭氧降解酮洛芬的促进率增大.
| [${referVo.labelOrder}] | Broseus R, Vincent S, Aboulfadl K, et al. 2009. Ozone oxidation of pharmaceuticals, endocrine disruptors and pesticides during drinking water treatment[J]. Water Research, 43(18): 4707–4717. DOI:10.1016/j.watres.2009.07.031 |
| [${referVo.labelOrder}] | Cao J, Shi J, Han R, et al. 2010. Seasonal variations in the occurrence and distribution of estrogens and pharmaceuticals in the Zhangweinanyun River System[J]. Chinese Science Bulletin, 55(27/28): 3138–3144. |
| [${referVo.labelOrder}] | 陈平, 刘国光, 吕文英, 等. 2015. 水环境中不同形态氮对甲芬那酸光降解影响机制的研究[J]. 环境科学学报, 2015, 35(10): 3151–3156. |
| [${referVo.labelOrder}] | Cong J, Wen G, Huang T, et al. 2015. Study on enhanced ozonation degradation of para-chlorobenzoic acid by peroxymonosulfate in aqueous solution[J]. Chemical Engineering Journal, 264: 399–403. DOI:10.1016/j.cej.2014.11.086 |
| [${referVo.labelOrder}] | De Witte B, Dewulf J, Demeestere K, et al. 2009. Ozonation and advanced oxidation by the peroxone process of ciprofloxacin in water[J]. Journal of Hazardous Materials, 161(2/3): 701–708. |
| [${referVo.labelOrder}] | Furman O S, Teel A L, Watts R J. 2010. Mechanism of Base Activation of Persulfate[J]. Environmental Science and Technology, 44: 6423–6428. DOI:10.1021/es1013714 |
| [${referVo.labelOrder}] | Gago Ferrero P, Demeestere K, Diaz-Cruz S, et al. 2013. Ozonation and peroxone oxidation of benzophenone-3 in water:Effect of operational parameters and identification of intermediate products[J]. Science of The Total Environment, 443: 209–217. DOI:10.1016/j.scitotenv.2012.10.006 |
| [${referVo.labelOrder}] | Ghauch A, Tuqan A M, Kibbi N. 2012. Ibuprofen removal by heated persulfate in aqueous solution:A kinetics study[J]. Chemical Engineering Journal, 197: 483–492. DOI:10.1016/j.cej.2012.05.051 |
| [${referVo.labelOrder}] | Govindan K, Raja M, Noel M, et al. 2014. Degradation of pentachlorophenol by hydroxyl radicals and sulfate radicals using electrochemical activation of peroxomonosulfate, peroxodisulfate and hydrogen peroxide[J]. Journal of Hazardous Materials, 272: 42–51. DOI:10.1016/j.jhazmat.2014.02.036 |
| [${referVo.labelOrder}] | Guan Y H, Ma J, Li X C, et al. 2011. Influence of pH on the Formation of Sulfate and Hydroxyl Radicals in the UV/Peroxymonosulfate System[J]. Environmental Science & Technology, 45(21): 9308–9314. |
| [${referVo.labelOrder}] | Kasprzyk-Hordern B, Dinsdaleb R M, Guwy A J. 2008. The occurrence of pharmaceuticals, personal care products, endocrine disruptors and illicit drugs in surface water in South Wales, UK[J]. Water Research, 42: 3498–3518. DOI:10.1016/j.watres.2008.04.026 |
| [${referVo.labelOrder}] | 李富华. 2016. 布洛芬在水环境中的光解行为及机理研究[D]. 广州: 广东工业大学. 163 |
| [${referVo.labelOrder}] | Liang C, Su H. 2009. Identification of Sulfate and Hydroxyl Radicals in Thermally Activated Persulfate[J]. Industrial & Engineering Chemistry Research, 48(11): 5558–5562. |
| [${referVo.labelOrder}] | Liu X, Zhang T, Zhou Y, et al. 2013. Degradation of atenolol by UV/peroxymonosulfate:Kinetics, effect of operational parameters and mechanism[J]. Chemosphere, 93(11): 2717–2724. DOI:10.1016/j.chemosphere.2013.08.090 |
| [${referVo.labelOrder}] | Musa K A K, Matxain J M, Eriksson L A. 2007. Mechanism of Photoinduced Decomposition of Ketoprofen[J]. Journal of Medicinal Chemistry, 50(8): 1735–1743. DOI:10.1021/jm060697k |
| [${referVo.labelOrder}] | Oh J, Salcedo D E, Medriano C A, et al. 2014. Comparison of different disinfection processes in the effective removal of antibiotic-resistant bacteria and genes[J]. Journal of Environmental Sciences, 26(6): 1238–1242. DOI:10.1016/S1001-0742(13)60594-X |
| [${referVo.labelOrder}] | Padhye L P, Yao H, Kung'U F T, et al. 2014. Year-long evaluation on the occurrence and fate of pharmaceuticals, personal care products, and endocrine disrupting chemicals in an urban drinking water treatment plant[J]. Water Research, 51: 266–276. DOI:10.1016/j.watres.2013.10.070 |
| [${referVo.labelOrder}] | 皮运正, 王建龙. 2005. 臭氧氧化水中2, 4, 6-三氯酚的反应机理研究[J]. 环境科学学报, 2005, 25(12): 47–51. |
| [${referVo.labelOrder}] | Peyton G R. 1993. The free-radical chemistry of persulfate-based total organic carbon analyzers[J]. Marine Chemistry, 41(1/3): 91–103. |
| [${referVo.labelOrder}] | Qi C, Liu X, Ma J, et al. 2016. Activation of peroxymonosulfate by base:Implications for the degradation of organic pollutants[J]. Chemosphere, 151: 280–288. DOI:10.1016/j.chemosphere.2016.02.089 |
| [${referVo.labelOrder}] | Qin W, Fang G, Wang Y, et al. 2016. Efficient transformation of DDT by peroxymonosulfate activated with cobalt in aqueous systems:Kinetics, products, and reactive species identification[J]. Chemosphere, 148: 68–76. DOI:10.1016/j.chemosphere.2016.01.020 |
| [${referVo.labelOrder}] | Rabiet M, Togola A, Brissaud F, et al. 2006. Consequences of Treated Water Recycling as Regards Pharmaceuticals and Drugs in Surface and Ground Waters of a Medium-sized Mediterranean Catchment[J]. Environmental Science & Technology, 40(17): 5282–5288. |
| [${referVo.labelOrder}] | Rahman M F, Yanful E K, Jasim S Y. 2009. Endocrine Disrupting Compounds:Pharmaceuticals and Personal Care Products Strategic Research Initiative[J]. Journal of Water and Health, 7(2): 224–243. DOI:10.2166/wh.2009.021 |
| [${referVo.labelOrder}] | Real F J, Benitez F J, Acero J L, et al. 2009. Kinetics of the Chemical Oxidation of the Pharmaceuticals Primidone, Ketoprofen, and Diatrizoate in Ultrapure and Natural Waters[J]. Industrial & Engineering Chemistry Research, 48(7): 3380–3388. |
| [${referVo.labelOrder}] | Santos J L, Aparicio I, Alonso E. 2007. Occurrence and risk assessment of pharmaceutically active compounds in wastewater treatment plants[J]. A case study:Seville city (Spain)[J].Environment International, 33(4): 596–601. |
| [${referVo.labelOrder}] | Sein M M, Zedda M, Tuerk J, et al. 2008. Oxidation of Diclofenac with Ozone in Aqueous Solution[J]. Environmental Science & Technology, 42(17): 6656–6662. |
| [${referVo.labelOrder}] | Wang Y, Liu H, Liu G, et al. 2015. Oxidation of diclofenac with chlorine dioxide in aquatic environments:influences of different nitrogenous species[J]. Environmental Science and Pollution Research, 22(12): 9449–9456. DOI:10.1007/s11356-015-4118-2 |
| [${referVo.labelOrder}] | Yang Y, Jiang J, Lu X, et al. 2015. Production of Sulfate Radical and Hydroxyl Radical by Reaction of Ozone with Peroxymonosulfate:A Novel Advanced Oxidation Process[J]. Environmental Science & Technology, 49(12): 7330–7339. |
 2017, Vol. 37
2017, Vol. 37