2. 厦门大学海洋与地球学院, 近海海洋环境科学国家重点实验室, 厦门 361102;
3. 厦门市环境保护局海沧分局, 厦门 361026
2. State Key Laboratory of Marine Environmental Science, College of Ocean and Earth Sciences, Xiamen University, Xiamen 361102;
3. Haicang Branch of Xiamen Environmental Protection Bureau, Xiamen 361026
海陆界面是人口密集、经济活跃、对全球变化敏感的区域, 特别是处于新型城镇化的海湾流域, 面临农业集约化生产、人口快速增长、生态环境破坏、复合污染增加等多重压力.土地利用/覆被急剧变化和大量的营养盐流失进入水体, 引起水质恶化和生物多样性降低(Weijters et al., 2009).河流携带大量的营养盐入海可导致海湾富营化、有害藻华、低氧区形成等负面生态效应(Chen et al., 2012; Paerl, 2006).水体中氮主要包括有机氮、氨氮、亚硝酸盐和硝酸盐等形态, 其中, 氨氮从“十二五”规划起列入我国水污染减排的约束性指标, 要求实施氨氮污染总量控制和达标排放.过去几年, 各级政府投入巨资, 尝试通过水污染治理解决水质问题.然而, 全国范围内河流氨氮和海洋无机氮仍然普遍超标.2015年4月国务院公布《水污染防治行动计划》(简称《水十条》), 2016年6月国家环境保护部印发《关于强化水体达标方案编制实施工作的通知》, 要求各级政府针对未达标水体编制达标方案.水质超标是环境保护与社会经济发展不尽协调的结果, 水体达标是一个系统性工作, 单就点源达标排放和几个工程项目无法从根本上解决水质问题.科学编制水体达标方案, 需要在流域尺度上开展系统分析, 识别污染来源, 诊断水质未能达标的成因与机制, 才能科学高效地加以防治.其中, 污染溯源是水体达标的核心环节, 也是水体达标方案编制和科学施治的基础.
地表水氮的来源很多, 其中最受关注的是硝酸盐污染的溯源.Kohl等(1971)首次利用硝酸盐氮同位素评估了农用化肥对河流硝酸盐的影响.近年来, 稳定氮同位素方法已在河流污染溯源上得到广泛应用(肖化云等, 2004;邢萌等, 2010).由于不同硝酸盐来源的氮同位素比值有重叠现象, 近年来人们开始采用氮氧双同位素方法和端元混合模型, 以更准确地判断硝酸盐的来源并研究其生物地球化学过程(Anisfeld et al., 2007; Chang et al., 2002; Chen et al., 2009; Chen et al., 2012; Deutsch et al., 2006; Li et al., 2010; Mayer et al., 2002; Xue et al., 2014; Yue et al., 2013; Zhang et al., 2014; Zhi et al., 2016).但利用氮氧同位素定量各种硝酸盐来源比例的研究还不多(徐志伟等, 2014), 且无法直接指示氨氮超标的原因.国内外已有不少学者利用模型研究氮污染的产生与输出, 进而分析氮污染来源与贡献.利用HSPF、SWAT等机理模型和基于经验统计与过程相结合的SPARROW模型(吴在兴等, 2010), 可模拟分析流域氮的产生和输移, 但其缺点是模型结构相对复杂, 相关参数资料不易获取, 专业性较强, 难以在水质管理实践中推广使用.另外, 根据产排污系数和入河系数量化氮污染负荷的方法在操作上较为简便, 但系数的取值误差大, 且污染负荷以行政区为统计单元, 难以与断面水质建立输入响应关系.亦有学者为衔接子流域分区和行政区管理边界, 基于广义流域负荷模型(GWLF)、净氮负荷输入系统(NANI)和GIS空间分析技术, 尝试面向行政区的总氮污染源解析(李国光等, 2014).从水体达标的角度, 需要充分了解流域社会经济、水环境、水资源与水生态条件及其空间关系, 掌握水体中氮的浓度、形态分布和迁移转化规律, 进而分河段(控制单元)判别氮污染的主要来源, 为水质的精细管理和责任落地提供依据.
为满足海湾河流水体达标和海陆统筹的水环境保护重大需求, 溯源方法应兼具科学性与操作性.本文以厦门马銮湾流域主要河流——过芸溪为例, 基于综合溯源提出水体达标策略.全水系分河段调查研究氮的形态分布和迁移转化规律, 解析河流氮的生物地球化学过程, 采用硝酸盐氮氧双同位素端元混合模型评估其来源及贡献, 利用GIS技术分析土地利用与水质(各形态氮的浓度)的空间关系, 分河段判别氮污染的主要来源及机制, 进而讨论海湾河流水体达标应遵循的策略, 为我国水污染防治与管理提供科学依据与案例示范.
2 材料与方法(Materials and methods) 2.1 研究区概况过芸溪位于厦门市海沧区西北部, 呈“Y”字结构, 由3条支流(支流1、2、3) 组成并汇入马銮湾.干流(此处含支流1) 全长约15 km, 流域面积43.5 km2, 涉及8个行政村和6个自然村, 人口6.2万.流域内多低山丘陵, 地势呈西北向东南倾斜.属于亚热带海洋季风气候, 年均气温21 ℃, 年降雨量1350~1500 mm.过芸溪90%保证率最枯月平均流量约0.8 m3·s-1.近年来, 河流氨氮浓度时常超过地表水环境质量标准(GB3838-2002)Ⅳ类水质(水环境功能区划要求).
2.2 样品采集与实验分析沿过芸溪3条支流从下游到上游沿程设置19个站位(编号分别是A1~A9、B1~B7、C1~C3), 其中, 支流1和支流2为主要支流, 也是本文分析的重点; 另加设5个排污口站位(AP1、AP2、AP3、BP1、BP2), 分析沿岸污水输入的影响.通常枯水期营养盐浓度高, 水质超标严重, 样品具代表性.因此, 本研究于2015年11月6日(枯水期间)进行采样, 采样前1个月内无降雨, 河流流量较小(基流).用2.5 L有机玻璃采水器采集水样(0.5 m或1/2水深), 装于500 mL聚乙烯瓶, 置于带冰保温箱冷藏.利用WTW多参数水质仪(Multi 3430) 原位测定pH、DO、水温、电导率等.
水样当天带回实验室, 经GF/F膜过滤(预先450 ℃灼烧4 h), 收集滤液用于测定营养盐和硝酸盐氮氧同位素(其中14个站位), 滤膜上颗粒用于测定总悬浮颗粒物(TSM)和叶绿素a(Chl-a).实验简述如下:① 营养盐:采用AA3营养盐自动分析仪(德国Bran+Lucbbe公司)测定各形态氮(NH4+-N、NO3--N和NO2--N)浓度;经碱性过硫酸钾消解后同NO3--N方法测定溶解态总氮(DTN);最后可得溶解无机氮(DIN=[NH4+-N]+[NO3--N]+[NO2--N])和溶解有机氮(DON=DTN-DIN);NH4+-N、NO3--N和NO2--N检测限分别为0.01、0.01和0.001 mg·L-1(以N计), 10%样品平行测试误差 < 5%.② 硝酸盐氮氧同位素:利用缺乏N2O还原酶的反硝化细菌(Pseudomonas aureofaciens)将水样中的NO3--N和NO2--N(NOx)转化为N2O气体, 通过GasBench Ⅱ-IRMS(Thermo Scientific DELTA V advantage)测定N2O的氮氧同位素, 再经过氮同位素标准曲线校正后, 得到水样中NOx的氮氧同位素(Casciotti et al., 2002; Sigman et al., 2001).δ15N和δ18O测定精度分别为0.2‰和0.5‰.实测样品中, NO3--N占NOx的80%以上, 下文描述时用NO3--N代替NOx.③ TSM:过滤水样后的滤膜置于105 ℃烘箱中烘干至恒重, 称重得到总悬浮颗粒质量, 根据对应过滤体积计算TSM.④ 叶绿素a:另取一定体积水样经GF/F膜过滤, 滤膜用90%丙酮萃取后用Turner荧光计测定(Parsons et al., 1984).
2.3 数据处理与统计利用Parnell等(2010)开发的SIAR混合模型, 计算相关端元(来源)对河流NO3--N的贡献比例及其概率分布, 具体见式(1).本文考虑大气沉降、土壤氮、化肥、粪肥及污水等4个端元, 其氮、氧同位素组成参考报道值(邢萌等, 2016).假设式(1) 中的分馏因子cjk=0, 即假设河水中不存在微生物反硝化作用, 根据测定的河水δ15N和δ18O, 利用R语言软件中的SIAR程序包计算不同端元的贡献比例.

|
(1) |
式中, Xjk是第i个混合物的j同位素值, i= 1、2、3…N, j= 1、2、3…J;Sjk是第k个端元的j同位素值(k= 1、2、3…K);μjk为平均值;ωjk为标准偏差;pk为端元k的贡献比例;cjk是端元k在j同位素上的分馏因子;λjk为分馏因子的平均值;τjk为标准偏差;εij为剩余误差, 代表不同单个混合物之间未能确定的变量, 其平均值为0, 标准偏差为σj.
此外, 利用遥感目视解译和GIS软件获得过芸溪流域土地利用分布及面积, 运用SPSS软件进行监测点水质参数与对应汇水区土地利用占比(某类土地利用面积占总汇水面积的比例)相关分析.综合各类信息, 分析过芸溪氮污染关键源区及氨氮超标成因.
3 结果(Results) 3.1 河流理化参数空间分布特征过芸溪两主要支流的理化参数在沿程上有明显变化(图 1).支流2的DO、Chl-a含量和pH值(数据未显示)总体高于支流1, 支流2的B5站位(库塘)的DO出现异常高值(>15 mg·L-1), 支流1中游和支流2的多数站位呈耗氧状态.支流2及支流3(数据未显示)的Chl-a含量(10.46~172.3 μg·L-1)远远高于支流1(0.93~38.74 μg·L-1);排污口BP1出现Chl-a异常高值(189.8 μg·L-1).所有站位pH值范围为6.63~9.97.支流1的电导率为5~1532 μS·cm-1; 支流2为127~300 μS·cm-1, 在中上游段较为平稳, 在A3站位(支流2汇入)后沿下游方向陡升;支流3的电导率为206~300 μS·cm-1.
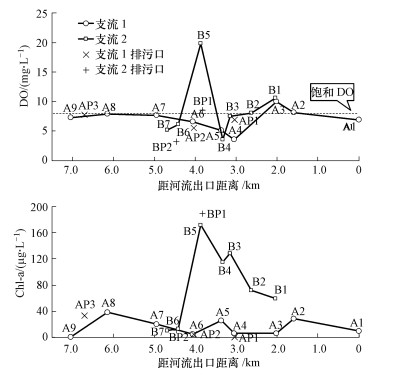 |
| 图 1 过芸溪两支流溶解氧和叶绿素a沿程变化 Fig. 1 Spatial variation of DO and Chl-a along the two tributaries of Guoyun River |
由图 2可知, 2条主要支流中各形态氮浓度范围分别是:NH4+-N 0.19~10.99 mg·L-1, NO2--N 0.003~0.670 mg·L-1, NO3--N 0.03~2.23 mg·L-1, DIN 0.57~11.70 mg·L-1, DON 0.92~3.01 mg·L-1, DTN 1.83~14.71 mg·L-1.支流2的NH4+-N浓度高于支流1, 特别是中下游段, 且多个站位NH4+-N浓度超过国家地表水环境质量标准(GB3838—2002)Ⅳ类标准限值(1.5 mg·L-1), 支流1超标0.31~2.01倍, 支流2超标0.51~3.55倍.此外, 支流2的NO2--N和DON浓度也显著高于支流1.各形态氮浓度在两支流上沿程变化趋势不尽一致(图 2), NO3--N浓度在支流1表现为沿下游方向有所上升, 而支流2则相反;NH4+-N和NO2--N浓度在两支流均沿下游方向有所抬升;DTN的沿程变化与DIN类似, 且在下游浓度有所抬升.受排污口影响, 沿程水质呈现波动特征.支流1(A3) 汇水面积是支流2(B1) 的1.4倍, 根据汇流后(A2) 电导率的变化(假设仅受混合影响)推算, 支流1的流量是支流2的1.5倍.因此, 支流2汇入支流1(干流)后会产生一定的稀释效应, 如图 2所示, A2站各项氮(除DON)的浓度介于A3站和B1站之间, 且主要受支流2影响.
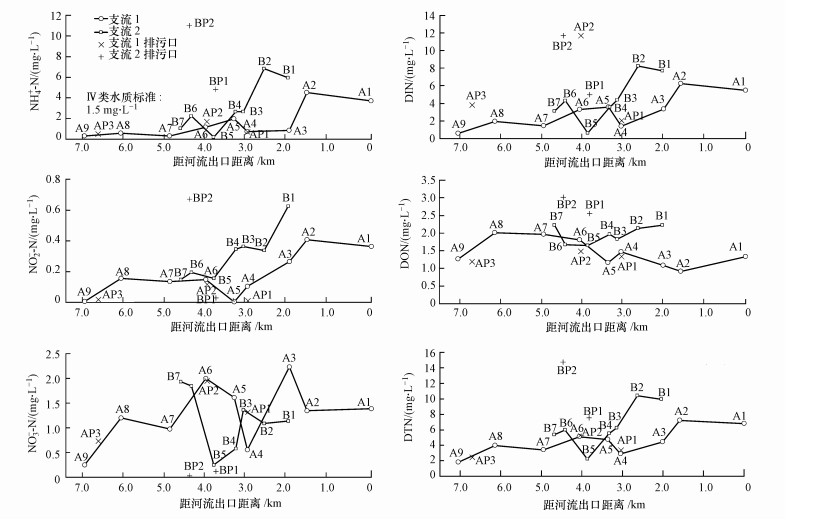 |
| 图 2 过芸溪两支流营养盐氮分形态浓度沿程变化 Fig. 2 Spatial variation of nitrogen concentrations along the two tributaries of Guoyun River |
两主要支流水中NH4+-N占DIN的比例较高(63%的站位NH4+-N占比高于50%).DIN与NH4+-N存在显著正相关(r=0.970, p<0.01), 表明大部分站位的DIN浓度受NH4+-N控制.此外, 支流3的各形态氮浓度分别为:NH4+-N1.90~5.07 mg·L-1, NO3--N 1.65~1.80 mg·L-1, DIN 3.65~6.98 mg·L-1, DON 1.49~3.22 mg·L-1, DTN 5.14 ~10.19 mg·L-1.
3.3 硝酸盐氮氧双同位素与端元贡献河流站位及污水口水样硝酸盐氮氧同位素组成汇总于图 3.大部分站位落在粪肥及生活污水、土壤有机氮的特征值区间.值得注意的是, 大部分氮氧同位素值都落在反硝化趋势线以下(除了A9和B7), 且所有站位δ18O-NO3-均处于可能受硝化作用影响的范围(-10‰~15‰).这暗示了硝化作用可能在各个河段普遍存在, 又进一步排除了水体的反硝化作用(A9和B7除外), 传统观点认为水体反硝化作用通常在DO < 2 mg·L-1时或在沉积物中发生(Kendall, 1998).利用SIAR模型得出, 在95%的统计概率下, 支流1的NO3--N来源贡献比例是:土壤氮33.6%, 粪肥及污水30.3%, 化肥27.5%和大气沉降8.6%;支流2的来源贡献比例是:土壤氮32.8%, 化肥29.4%, 粪肥及污水27.1%和大气沉降10.7%(图 4).
 |
| 图 3 典型硝酸盐端元组分氮氧同位素比值范围及过芸溪水中硝酸盐氮氧同位素分布 (注:粪肥及生活污水的δ15N-NO3-是3‰~17‰, δ18O-NO3-是-7‰~12‰(徐志伟等, 2014);土壤有机氮的δ15N-NO3-是3‰~8‰, δ18O-NO3-是-7‰~12‰(徐志伟等, 2014;Delconte et al., 2014);大气降水及化肥中铵盐的δ15N-NO3-是-4‰~6‰, δ18O-NO3-是-10‰~10‰(徐志伟等, 2014);化肥中硝酸盐的δ15N-NO3-是-2‰~4‰, δ18O-NO3-是17‰~25‰(徐志伟等, 2014;Nestler et al., 2011);降水中硝酸盐的δ15N-NO3-是-3‰~7‰, δ18O-NO3-是20‰~90‰(徐志伟等, 2014);由硝化作用产生的硝酸盐的δ18O-NO3-是-10‰~15‰(Kendall, 1998)) Fig. 3 General nitrate source fingerprints in a diagram of δ15N and δ18O values and those observed in the Guoyun River |
 |
| 图 4 利用SIAR模型计算的4种端元对于过芸溪两支流硝态氮的贡献比例 (图中箱线图按颜色由浅到深分别表示5%、25%、50%、75%、95%概率下的比例) Fig. 4 SIAR model estimated proportional contribution of four nitrate sources in the two tributaries of Guoyun River |
NH4-N浓度与相应汇水范围内土地利用占比有一定的关系(图 5).支流1的NH4+-N浓度与城镇及农村用地占比呈显著正相关(r=0.966, p < 0.01), 支流2的NH4+-N浓度与该项占比相关性不显著(r=0.709, p=0.075);两支流的NH4+-N浓度均与鱼塘面积占比呈显著正相关(支流1:r=0.916, p < 0.01;支流2:r=0.801, p < 0.05).此外, 支流1的NH4+-N浓度还与林地面积占比呈显著负相关(r=-0.667, p < 0.05);而两支流的NO3--N浓度与各类土地利用类型占比不存在相关关系.
 |
| 图 5 过芸溪氨氮浓度与汇水区土地利用面积占比的相关关系 (A3与A4(空心点)受日月谷温泉水排放影响, 在相关分析中剔除) Fig. 5 Relationship between ammonium concentration and land use proportion in associate catchment in the Guoyun River |
地表水中的NH4+-N主要来源于陆源污染(赵志瑞等, 2013), 过芸溪NH4+-N占DIN的比例远远高于NO3--N占比, 且从上游到下游波动上升, 说明该河流沿程吸纳了大量含高氨氮的污水.支流1的NH4+-N浓度与城镇及农村用地面积占比、鱼塘面积占比呈显著正相关, 与林地面积占比呈显著负相关, 说明其主要受生活污水和鱼塘养殖污水排放影响;支流2的NH4+-N浓度与鱼塘面积占比呈显著正相关, 说明养殖污水污染对其水质影响较大.支流2(也受支流3汇入影响)的NH4+-N浓度总体上高于支流1, 超标站位多, 相应的超标倍数也更大, 其氨氮污染程度比支流1严重.图 1显示了支流2的B5(库塘)及其下游站位的DO值和Chl-a值保持在较高水平, 说明采样期间该河段处于藻华前期.5个站位(B1~B5) 的Chl-a与NH4+-N呈显著负相关(p < 0.01), 说明藻类吸收降低了水中氨氮浓度.然而, 生物吸收并没有改变DIN向下游上升的趋势, 高污染河流氮的浓度变化主要受控于沿岸污染输入和累积.若藻华暴发后, 藻类将死亡降解并消耗大量DO值(Huang et al., 2003; 谢群等, 2009; Ni et al., 2016).
对比沿程相邻站位各形态氮浓度的变化幅度与方向(表 1), 发现NH4+-N去除量大于NO3--N, 而在二者浓度同时增加的河段, NO3--N增幅大于NH4+-N, 推断河流硝化作用较强烈, 尤其是支流1.已有研究表明, 流经耕地和城镇建设用地的河段, 可能由于地下水NO3--N的输入导致河流NO3--N增加(Zhang et al., 2014), 而大气沉降并不是这类河段NO3--N的主要来源(Mayer et al., 2002).河流DO值沿程微降或者不降反升(表 1), 而现场观察到河床硬质化、沉积物少, 说明该河流环境条件(没有缺氧)不利于厌氧反硝化脱氮,此推论与硝酸盐氮氧双同位素溯源结果一致(图 3).农田含氮化肥也会随地表或地下径流进入河流.支流1和支流2中下游(A1~A4、B1~B5) 的NO2--N(硝化或反硝化的中间产物)浓度沿程逐步上升, 同时NH4+-N和NO3--N浓度也大多呈上升趋势, 推测随着富含氨氮的污水汇入, 河流氨氧化作用(硝化第一步骤)较强而亚硝酸盐氧化(硝化第二步骤)较弱, 造成NO2--N在水中累积.
| 表 1 过芸溪沿程DO与氮的变化幅度及推断的主要来源和转化过程 Table 1 Change of DO and nitrogen forms by river channel segment and inferred major source and biogeochemical processes |
硝酸盐氮氧双同位素溯源结果(图 3)表明, 过芸溪大部分站位的NO3--N主要来源于土壤有机氮、粪肥及生活污水、化肥.土壤有机氮对二条主要支流的NO3--N来源贡献稍高于粪肥及生活污水比例(图 4).含氮化肥、养殖粪肥及生活污水有相当一部分进入土壤系统, 进而产生大量DON又随地表或地下径流排入河段(Mayer et al., 2002), 也可能与该地区水土流失较严重有关.在硝化过程中, 氨氮被氧化成NO3--N, 其氮氧同位素比值有变轻趋势(Kendall, 1998;Zhang et al., 2014).过芸溪沿下游方向硝酸盐氮氧同位素总体有降低趋势(图 4), 这进一步推断河流存在明显的硝化作用.大部分站位硝酸盐氮氧同位素值在反硝化趋势线以下(图 3), 显示河流内部反硝化作用不明显, 主要是由于水中DO均大于2 mg·L-1(图 1), 河道硬质化、沉积物少.反硝化信号不明朗还与较低的同位素富集因子及沿岸不同来源硝酸盐的混合有关(Mayer et al., 2002; Xue et al., 2014).越来越多的证据表明, 除了传统认为的厌氧反硝化, 环境中可能存在好氧反硝化作用, 特别是在氨氮较高的水体, 有可能会发生硝化-反硝化的耦合作用(Robertson et al., 1984;信欣等, 2014).今后应综合异养硝化、好氧反硝化菌和好氧反硝化速率的直接测定加以证实.需要注意的是, SIAR模型的结果只是对某站位一个特定时间段贡献比例的估计, 氮在流域内的各种循环转化可造成复杂的同位素分馏效应, 因此, 各端元贡献比例存在一定的不确定性.
4.2 关键源区识别与水体达标策略综合河流氮形态分布及转化过程、土地利用与水质关系和硝酸盐氮氧双同位素溯源的相关信息, 可基本探明过芸溪氮污染关键源区及氨氮超标的主要原因(图 6).过芸溪氮污染主要来自于面源污染, 其中, 生活污水和养殖废水占主导, 农田排水占较小的比例, 污染较重的河段位于支流1和支流2的下游段.支流1上游段周边分布有大量鱼塘和大面积耕地, 氮污染主要来自养殖废水和农田排水;中游段城镇建设用地和农村宅基地的比例增大, 生活污水影响加重;下游段主要流经鱼塘和耕地, 养殖废水和农田排水占主导.支流2上游段流经农村和耕地, 氮污染主要是生活污水和农田排水, 而中下游段流经养鸭场和鱼塘, 养殖废水大量增加.支流3也吸纳了大量的生活污水、养殖废水和部分农田排水.
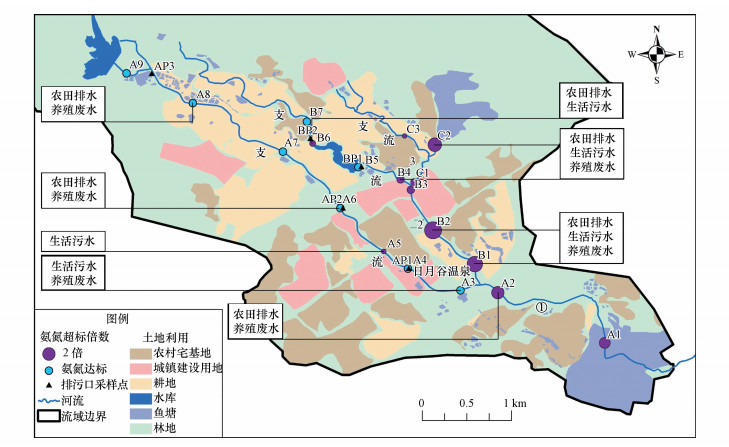 |
| 图 6 过芸溪氮污染关键源区及氨氮超标因素 Fig. 6 Critical source area of nitrogen pollution and major causes in Guoyun River |
针对过芸溪氮污染关键源区的空间分布和河道硬质化特征(自净能力弱), 建议采取“污染减排(控源)、生态修复(增容)、以海定陆(统筹)”的水体达标策略:① 分支流分河段治理, 从源头上控制污染排放.支流1上游和下游、支流2与支流3的中下游应清退养殖场所或通过整治实现养殖污染零排放;支流1中游、支流2和支流3的上游要重点控制农村生活污染.并通过“多规合一”, 优化产业结构布局, 做好环境功能区划、土地利用规划和城市总体规划的融合与衔接;② 重构流域水系生态廊道, 提高水质净化能力和环境容量.连通现有水塘、湿地和河流, 硬质化河道进行生态化改造, 沿岸设置植被缓冲带, 恢复水-土-泥体系和生物多样性高的河流自然生态.③ 以海定陆, 海陆统筹管理.近期以海水无机氮达标要求和海洋生态保护为目标导向, 在重要界面(主要支流汇入、行政区交界及河流-河口断面)建立水质水量的长期监测网络, 加强流域水质的动态监控, 为厦门湾城市群水环境保护与生态安全保障提供科学数据, 同时推进环保、水利、海洋跨部门测管协同机制的建立.
5 结论(Conclusions)1) 过芸溪全水系调查的氮形态数据表明, 63%的站位无机氮以氨氮为主(50%以上).河流氨氮污染向下游方向加重, 氨氮超标倍数支流2高于支流1.河流氨氮与相应汇水区内的城镇与农村宅基地、渔塘的面积占比均呈正相关, 与林地占比负相关, 反映了沿岸土地利用变化的水质效应.
2) 硝酸盐氮氧同位素组成及SIAR端元混合模型表明, 过芸溪两支流的土壤氮、粪肥及污水和化肥贡献了硝酸盐89%~91%的来源.各形态氮浓度和氮氧同位素比值向下游抬升, 主要与沿岸污水汇入有关.流域土壤和水体的硝化作用较强, 硬质化河道和富氧条件导致无显著反硝化作用.
3) 针对污染关键源区和河道硬质化, 建议采取“污染减排(控源)、生态修复(增容)、以海定陆(统筹)”的水体达标策略.分支流分河段进行污染削减, 优化产业结构布局、恢复河流自然生态, 提高水生态自净功能和环境容量, 在重要界面建立长期监测网络, 加强流域污染与水质监控, 推进海陆统筹、跨部门测管协同.
| [${referVo.labelOrder}] | Anisfeld S C, Barnes R T, Altabet M A, et al. 2007. Isotopic apportionment of atmospheric and sewage nitrogen sources in two Connecticut rivers[J]. Environmental Science & Technology, 41: 6363–6369. |
| [${referVo.labelOrder}] | Casciotti K L, Sigman D M, Hastings M G, et al. 2002. Measurement of the oxygen isotopic composition of nitrate in seawater and freshwater using the denitrifier method[J]. Analytical Chemistry, 74: 4905–4912. DOI:10.1021/ac020113w |
| [${referVo.labelOrder}] | Chang C C Y, Kendall C, Silva S R, et al. 2002. Nitrate stable isotopes:tools for determining nitrate sources among different land uses in the Mississippi River Basin[J]. Canadian Journal of Fisheries and Aquatic Sciences, 59: 1874–1885. DOI:10.1139/f02-153 |
| [${referVo.labelOrder}] | Chen F J, Jia G D, Chen J Y. 2009. Nitrate sources and watershed denitrification inferred from nitrate dual isotopes in the Beijiang River, south China[J]. Biogeochemistry, 94: 163–174. DOI:10.1007/s10533-009-9316-x |
| [${referVo.labelOrder}] | Chen N W, Hong H S. 2012. Integrated management of nutrients from the watershed to coast in the subtropical region[J]. Current Opinion in Environmental Sustainability, 4: 233–242. DOI:10.1016/j.cosust.2012.03.007 |
| [${referVo.labelOrder}] | Chen Z X, Liu G, Liu W G, et al. 2012. Identification of nitrate sources in Taihu Lake and its major inflow rivers in China, using delta N15-NO3- and delta O18-NO3- values[J]. Water Science and Technology, 66: 536–542. DOI:10.2166/wst.2012.193 |
| [${referVo.labelOrder}] | Delconte C A, Sacchi E, Racchetti E, et al. 2014. Nitrogen inputs to a river course in a heavily impacted watershed:A combined hydrochemical and isotopic evaluation (Oglio River Basin, N Italy)[J]. Science of the Total Environment, 466: 924–938. |
| [${referVo.labelOrder}] | Deutsch B, Mewes M, Liskow I, et al. 2006. Quantification of diffuse nitrate inputs into a small river system using stable isotopes of oxygen and nitrogen in nitrate[J]. Organic Geochemistry, 37: 1333–1342. DOI:10.1016/j.orggeochem.2006.04.012 |
| [${referVo.labelOrder}] | Huang X P, Huang L M, Yue W Z. 2003. The characteristics of nutrients and eutrophication in the Pearl River estuary, South China[J]. Marine Pollution Bulletin, 47(1/6): 30–36. |
| [${referVo.labelOrder}] | Kendall C. 1998. Tracing Nitrogen Sources and Cycling in Catchments//Isotope Tracers in Catchment Hydrology[M].Amsterdam:Elsevier.519-576 |
| [${referVo.labelOrder}] | Kohl D H, Shearer G, Commoner B. 1971. Fertilizer nitrogen:Contribution to nitrate in surface water in a corn belt watershed[J]. Science, 174: 1331–1334. DOI:10.1126/science.174.4016.1331 |
| [${referVo.labelOrder}] | Li S L, Liu C Q, Li J, et al. 2010. Assessment of the sources of nitrate in the Changjiang River, China using a nitrogen and oxygen isotopic approach[J]. Environmental Science & Technology, 44: 1573–1578. |
| [${referVo.labelOrder}] | 李国光, 赵兴华, 沙健, 等. 2014. 面向行政区的总氮污染源解析-以新安江流域重点区县GWLF模型应用为例[J]. 水资源与水工程学报, 2014, 25(6): 118–123. |
| [${referVo.labelOrder}] | Mayer B, Boyer E W, Goodale C, et al. 2002. Sources of nitrate in rivers draining sixteen watersheds in the northeastern US:Isotopic constraints[J]. Biogeochemistry, 57: 171–197. DOI:10.1023/A:1015744002496 |
| [${referVo.labelOrder}] | Nestler A, Berglund M, Accoe F, et al. 2011. Isotopes for improved management of nitrate pollution in aqueous resources:review of surface water field studies[J]. Environmental Science and Pollution Research, 18(4): 519–533. DOI:10.1007/s11356-010-0422-z |
| [${referVo.labelOrder}] | Ni Z, Wang S, Wang Y. 2016. Characteristics of bioavailable organic phosphorus in sediment and its contribution to lake eutrophication in China[J]. Environmental Pollution, 219(12): 537–544. |
| [${referVo.labelOrder}] | Paerl H W. 2006. Assessing and managing nutrient-enhanced eutrophication in estuarine and coastal waters:Interactive effects of human and climatic perturbations[J]. Ecological Engineering, 26: 40–54. DOI:10.1016/j.ecoleng.2005.09.006 |
| [${referVo.labelOrder}] | Parsons T R, Maita Y, Lalli C M. 1984. Manual of chemical and biological methods for seawater analysis[J]. International Review of Hydrobiology, 70: 903–904. |
| [${referVo.labelOrder}] | Robertson L A, Kuenen J G. 1984. Aerobic denitrification:a controversy revived[J]. Archives of Microbiology, 139(4): 351–354. DOI:10.1007/BF00408378 |
| [${referVo.labelOrder}] | Sigman D M, Casciotti K L, Andreani M, et al. 2001. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater[J]. Analytical Chemistry, 73: 4145–4153. DOI:10.1021/ac010088e |
| [${referVo.labelOrder}] | Weijters M J, Janse J H, Alkemade R, et al. 2009. Quantifying the effect of catchment land use and water nutrient concentrations on freshwater river and stream biodiversity[J]. Aquatic Conservation:Marine and Freshwater Ecosystems, 19: 104–112. DOI:10.1002/aqc.v19:1 |
| [${referVo.labelOrder}] | 吴在兴, 王晓燕. 2010. 流域空间统计模型SPARROW及其研究进展[J]. 环境科学与技术, 2010, 33(9): 87–90, 139. |
| [${referVo.labelOrder}] | 肖化云, 刘丛强. 2004. 氮同位素示踪贵州红枫湖河流季节性氮污染[J]. 地球与环境, 2004, 32(1): 71–75. |
| [${referVo.labelOrder}] | 谢群, 张瑜斌, 孙省利, 等. 2009. 流沙湾溶解氧的分布特征及其相关因素的探讨[J]. 环境科学与技术, 2009, 32(9): 39–44. |
| [${referVo.labelOrder}] | 信欣, 姚力, 鲁磊, 等. 2014. 耐高氨氮异养硝化-好氧反硝化菌TN-14的鉴定及其脱氮性能[J]. 环境科学, 2014, 35(10): 3926–3932. |
| [${referVo.labelOrder}] | 邢萌, 刘卫国, 胡婧. 2010. 浐河、涝河河水硝酸盐氮污染来源的氮同位素示踪[J]. 环境科学, 2010, 31(10): 2305–2310. |
| [${referVo.labelOrder}] | 邢萌, 刘卫国. 2016. 浐河、灞河硝酸盐端元贡献比例-基于硝酸盐氮、氧同位素研究[J]. 地球环境学报, 2016, 7(1): 27–36. |
| [${referVo.labelOrder}] | 徐志伟, 张心昱, 于贵瑞, 等. 2014. 中国水体硝酸盐氮氧双稳定同位素溯源研究进展[J]. 环境科学, 2014, 35(8): 3230–3238. |
| [${referVo.labelOrder}] | Xue D, Boeckx P, Wang Z. 2014. Nitrate sources and dynamics in a salinized river and estuary-a delta N15-NO3- and delta O18-NO3- isotope approach[J]. Biogeosciences, 11: 5957–5967. DOI:10.5194/bg-11-5957-2014 |
| [${referVo.labelOrder}] | Yue F J, Li S L, Liu C Q, et al. 2013. Using dual isotopes to evaluate sources and transformation of nitrogen in the Liao River, northeast China[J]. Applied Geochemistry, 36: 1–9. DOI:10.1016/j.apgeochem.2013.06.009 |
| [${referVo.labelOrder}] | Zhang Y, Li F D, Zhang Q Y, et al. 2014. Tracing nitrate pollution sources and transformation in surface-and ground-waters using environmental isotopes[J]. Science of the Total Environment, 490: 213–222. DOI:10.1016/j.scitotenv.2014.05.004 |
| [${referVo.labelOrder}] | Zhi J H, Ding A Z, Zhang S R. 2016. Nitrate sources and nitrogen biogeochemical processes in the Feng River in West China inferred from the nitrogen and oxygen dual isotope measurements of nitrate[J]. Desalination and Water Treatment, 57: 8243–8251. DOI:10.1080/19443994.2015.1021845 |
| [${referVo.labelOrder}] | 赵志瑞, 马斌, 张树军, 等. 2013. 高氨氮废水与城市生活污水短程硝化系统菌群比较[J]. 环境科学, 2013, 34(4): 1448–1456. |
 2017, Vol. 37
2017, Vol. 37



