2. 热带亚热带水生态工程教育部工程研究中心, 暨南大学, 广州 510632;
3. 广州市环境监测中心站, 广州 510030
2. Engineering Research Center of Tropic and Subtropic Aquatic Ecological Engineering, Ministry of Education, Guangzhou 510632;
3. Guangzhou Environmental Monitoring Station, Guangzhou 510030
洱海作为云南省第二大淡水湖, 是大理市饮用水的主要来源, 同时还具有农灌、渔业、旅游等重要功能(Wang et al., 2011), 保障洱海的饮用水源水质安全尤为重要.随着当地旅游产业蓬勃发展, 洱海富营养化问题日趋严重(王芸, 2008;倪兆奎等, 2011).近十年来, 洱海水质总体呈中营养状态, 但蓝藻水华现象时有发生, 尤其是每年夏、秋季节都会在大部分湖湾频繁发生, 并且微囊藻数量也在明显增多(卫志宏等, 2012;朱荣等, 2015;陈建良等, 2015).蓝藻水华不仅严重破坏水体生态系统, 其释放的毒素对水生动植物及人类的健康也造成威胁(Poste et al., 2011), 其中微囊藻毒素(microcystins, MCs)是最普遍, 造成危害最为严重的一种蓝藻毒素(Rastogi et al., 2014).微囊藻水华的频发增加了洱海微囊藻毒素的风险, Yu等(2014)于2010年对洱海毒素浓度进行调查, 结果发现秋季时水体毒素水平最高, 北部湖湾总微囊藻毒素LR最高浓度达3.06 μg·L-1, 远高于集中式生活饮用水地表水源地对MC-LR的限值1 μg·L-1(GB 3838—2002, 以下简称标准限值), 朱荣等(2015)研究发现洱海水鸟体内存在微囊藻毒素的富集, 洱海饮用水源地微囊藻毒素生态风险已经不容忽视.目前, 洱海蓝藻水华常规监测内容主要为氮磷营养盐、叶绿素和显微镜藻细胞计数(李泽坤, 2015), 对于水华爆发期间尤其是饮用水源区域水体产毒微囊藻丰度和微囊藻毒素的监测数据却较为缺乏, 而传统藻类定量法即显微镜观察法, 该法耗时长、工作量大且难以有效区分有毒和无毒藻株(Tan et al., 2009), 洱海水体产毒藻类丰度和微囊藻毒素浓度的有效和快速检测引起关注.荧光定量PCR技术可以通过检测水体中的微囊藻毒素合成酶基因快速预测水体中产毒微囊藻产毒潜能(Otten et al., 2012;Yen et al., 2012), 其具有灵敏度高、实验误差低、且能同时处理大批量样品等优势(李大命等, 2011a), 同时结合酶联免疫法快速、准确定量微囊藻毒素, 能高效评估水体微囊藻毒素的生态风险.
因此, 本研究重点关注洱海水华高发期的8—11月, 采用针对微囊藻毒素相关基因(微囊藻16S rDNA、微囊藻毒素合成酶基因mcyA)所建立的荧光定量PCR技术检测洱海主要旅游区和饮用水源区共7个位点的总微囊藻和产毒微囊藻丰度, 同时结合酶联免疫法(ELISA)对微囊藻毒素LR浓度的动态变化进行监测, 旨在揭示洱海饮用水源地微囊藻丰度和毒素的时空分布特征及环境影响, 以期为监测洱海蓝藻水华、预警饮用水源水质生态风险提供科学依据.
2 材料与方法(Materials and methods) 2.1 采样点分布和样品采集按洱海水域功能情况, 选取位于湖湾的7个位点S1~S7(图 1), S1~S3位于旅游区, S4~S7位于洱海主要饮用水源区(朱荣等, 2015), 采样点具体信息如表 1所示.采样时间为2015年洱海水华高发期(8—11月), 其中8、11月各采样1次、9、10月采样2次, 共计采样6次.每个位点采集表层水样2 L, 其中10 mL水样装于离心管中, 用于检测微囊藻毒素MC-LR;500 mL水样用玻璃纤维微孔滤膜(47 mm×0.22 μm, 上海兴亚)抽滤后-20 ℃冷冻保存, 待后续DNA提取;其他水样用于检测营养盐及叶绿素a.同时利用便携式水质分析仪(YSI ProPlus, Yellow Springs, USA)原位测定水体理化参数, 包括水温(T), pH、溶解氧(DO)等, 透明度(SD)采用塞氏盘测定.
 |
| 图 1 洱海采样位点示意图 Fig. 1 Distribution of sample sites in Lake Erhai |
| 表 1 洱海采样点信息 Table 1 Detailed information of sample sites in Lake Erhai |
水样微囊藻毒素通过ELISA检测试剂盒(Beacon, USA)进行检测(检测限为0.10 μg·L-1), 然后通过酶标仪测定.胞外微囊藻毒素(EMC)和总微囊藻毒素(TMC)的检测方法:① EMC:用注射器取水样1.0 mL, 然后通过水相尼龙针式滤器(13 mm×0.45 μm, ANPEL)过滤水样, 然后按试剂盒说明书进行检测;② TMC:用注射器取1.0 mL水样, 装在2 mL冻存管中, 放进液氮罐反复冻融3~5次, 使细胞充分破碎, 胞内毒素均释放到水相中, 然后用水相尼龙针式滤器过滤水样, 并按说明书方法进行检测.全程试验时间仅需2 h, 质控结果显示所选随机样品平行偏差均小于3%, ELISA试剂盒1.0 μg·L-1质控样的回收率为(125% ± 5%), 处于说明书给定的80%~130%范围之间, 实测结果准确可靠.
2.3 基因组DNA的提取将2.1节中滤膜通过液氮反复冻融3~5次, 使细胞充分破碎, 然后采用PowerWater® DNA Isolation Kit(MO-BIO, USA)提取试剂盒对冻融后的样品进行基因组DNA提取, 具体提取过程参照试剂盒说明书, 每个样品得到100 μL DNA, -20 ℃保存待用.
2.4 荧光定量PCR利用产毒微囊藻M.aeruginosaFACHB 905构建定量PCR标准曲线, 采用Hipure PlantDNA kit(美基生物, 广州)提取基因组DNA, 然后用Nano-100(奥盛, 杭州)测定DNA的浓度和纯度, 换算成基因拷贝数, 然后按10倍梯度进行逐级稀释, 设置6个浓度梯度制作标曲, 每个浓度3个平行.
荧光定量PCR所选用的引物基本信息如表 2所示, 其中引物16S-F和16S-R特异性扩增微囊藻16S rDNA用于总微囊藻种群定量研究, 引物mcyA-F和mcyA-R特异性扩增微囊藻毒素合成基因mcyA用于产毒微囊藻定量研究, 引物特异性检验通过对不同藻类基因组DNA进行PCR扩增.
| 表 2 Microcystis 16S rDNA和mcyA基因定量PCR反应引物序列 Table 2 Primers sequences targeting Microcytis 16S rDNA and mcyA genes for real time PCR |
通过CFXConnect荧光定量PCR仪(Bio-Rad, USA)进行PCR反应.qPCR反应体系体积为25 μL, 包括DNA模板2.0 μL, PCR正、反向引物(10 μmol·L-1)各1.0 μL, SYBR Premix Ex TapII 12.5 μL, 超纯水补足25 μL.反应条件为:95 ℃预变性30 s;95 ℃变性15 s, 58 ℃退火30 s, 72 ℃延伸30 s, 40个循环;最后进行溶解曲线分析.本研究每个样品设置3个平行, 同时设置阴性对照, 实验结果根据3个平行的平均Ct值和标准曲线得到目标基因的浓度.
2.5 营养盐和叶绿素a测定总氮(TN)、氨氮(NH4+-N)、硝酸盐氮(NO3--N)、总磷(TP)、高锰酸盐指数(CODMn)、叶绿素a均参照文献测定(金相灿, 1990).
2.6 数据处理与分析利用Origin 8.5和Excel 2013进行图表制作, 利用SPSS 18.0对数据进行相关性分析和单因素方差分析.
3 结果(Results) 3.1 荧光定量PCRMicrocystis 16S rDNA定量标准曲线方程Y= -3.091X+44.592(R2=0.99, 扩增效率为e=1.10), mcyA定量标准曲线方程Y= -3.306X+46.532(R2=0.99, 扩增效率为e=1.01), 其中Y表示定量PCR反应循环阈值, X表示目的基因拷贝数对数值, 定量检测区间为1×102~1×107 copies·μL-1.引物特性检验结果显示(表 3), Microcystis 16S rDNA引物对3种微囊藻和洱海水样基因组DNA扩增均为阳性, mcyA引物只对2种产毒微囊藻和洱海水样显示阳性结果.溶解曲线结果显示, Microcystis 16S rDNA和mcyA荧光定量PCR扩增产物解链的峰值温度分别为(86.0±1.0)、(81.5±1.0) ℃, 表明两种PCR扩增产物特异性较好.
| 表 3 引物特异性检验结果 Table 3 Specific test results of two primers |
研究期间, 洱海水体参数如表 4所示.洱海平均水温为21.2 ℃, 水质呈弱碱性, 溶解氧范围为4.96~10.80 mg·L-1, 水体透明度为1.3~2.8 m.TN和TP的平均浓度分别为0.97 mg·L-1和0.066 mg·L-1, TN/TP均值为17, 叶绿素a均值为15.87 μg·L-1.根据洱海营养状态评分标准(李泽坤等, 2015), 本研究期间洱海营养状态处于中营养向富营养的过渡阶段.
| 表 4 2015年8月至2015年11月期间洱海水体理化参数 Table 4 The physiochemical parameters of the water in Erhai Lake from August to October 2015 |
荧光定量PCR结果(图 2)显示, 研究期间洱海总微囊藻丰度和产毒微囊藻丰度变化趋势一致, 均为9月达到峰值后下降, 其中总微囊藻平均丰度为8.15×106 copies·L-1, 产毒微囊藻平均丰度为6.42×105 copies·L-1, 产毒微囊藻占总微囊藻的比例为1.0%~69.8%.
 |
| 图 2 洱海8—11月微囊藻、微囊藻毒素的变化情况 Fig. 2 Temporal variety of cell abundance of total Mircocystis, MC-producing Microcystis and microcystin in Lake Erhai in 2015 |
洱海总微囊藻毒素(TMC)和胞外微囊藻毒素(EMC)的检出率分别为95.2%和33.3%, TMC浓度范围为未检出~2.17 μg·L-1, EMC浓度在未检出~0.41 μg·L-1之间, 两者变化趋势一致(图 2), 均是10月达到最大值后开始下降.研究期间, 10月份总毒素接近甚至超过标准限值(1 μg·L-1), 且同时段各点胞外毒素均有检出.
3.4 洱海微囊藻和微囊藻毒素的空间分布洱海微囊藻丰度空间分布如图 3所示, 所选旅游区采样点(S1~S3) 总微囊藻丰度略高于饮用水源地(S4~S7), 其位于喜洲沙村湾S1位点总微囊藻丰度最高为1.7×107 copies·L-1;而产毒微囊藻丰度则是饮用水源地高于旅游区, 其位于海东湾采样点S6产毒微囊藻丰度最高1.4×106 copies·L-1, 显著高于其他位点(p < 0.05).如图 3所示, 总微囊藻毒素(TMC)分布与产毒微囊藻一致, 也表现为饮用水源地较高, 研究期间, 所有饮用水源地位点TMC全部检出, EMC检出率为25%, 其中挖色湾S5位点总毒素浓度均值最高, 超过标准限值(1 μg·L-1), 其他3个水源地点位TMC浓度也十分接近1 μg·L-1, 但水源地各位点EMC均值基本低于0.10 μg·L-1.
 |
| 图 3 洱海总微囊藻和微囊藻毒素的空间分布 Fig. 3 Spatial patterns of cell abundance of total Microcystis, MC-producing Microcystis and microcystin in Lake Erhai |
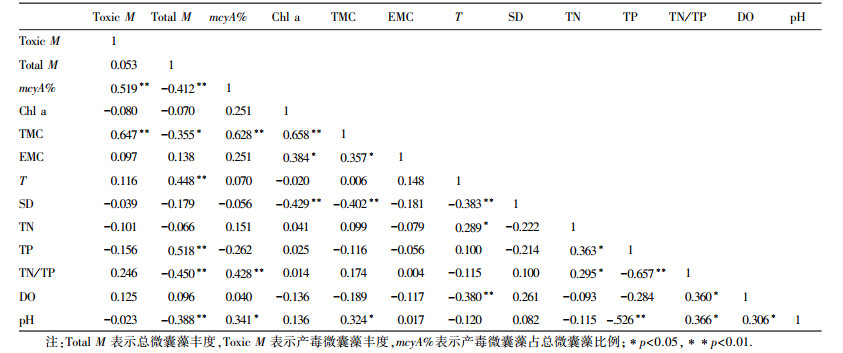
研究期间洱海采样点微囊藻丰度、微囊藻毒素LR含量与水体环境因子的相关性分析(表 5)显示, 总微囊藻丰度的主要限制因子为水温和TP(p < 0.01), 环境因子对产毒微囊藻影响不显著(p>0.05), 但其所占总微囊藻丰度的比例与水体pH(p < 0.05) 和TN/TP显著相关(p < 0.01).总微囊藻毒素与水体pH和透明度均显著相关(p < 0.01), 且总微囊藻毒素和胞外微囊藻毒素均与Chl a显著相关(p < 0.01), 说明在一定程度上测定水体Chl a值能对水体微囊藻释放的毒素进行预测.洱海总微囊藻毒素与产毒微囊藻比例的极显著正相关性(p < 0.01), 表明洱海总微囊藻毒素主要是由产毒微囊藻释放的, 因此通过检测产毒微囊藻丰度(mcyA)一定程度上能够指示洱海水体产毒潜能;总微囊藻毒素与mcyA、Chl a的极显著正相关(p < 0.01) 关系, 结合微囊藻毒素(TMC)浓度与产毒微囊藻(mcyA)丰度、Chl a含量的线性拟合公式(图 4), 通过检测产毒微囊藻丰度或者水体Chl a值能在一定程度上评估水体微囊藻毒素的风险.
| 表 5 洱海环境因子与微囊藻、微囊藻毒素的相关性分析(n=42) Table 5 Correlations cofficients between environmental factors and Microcystis, microcystin and Chl a (n=42) |
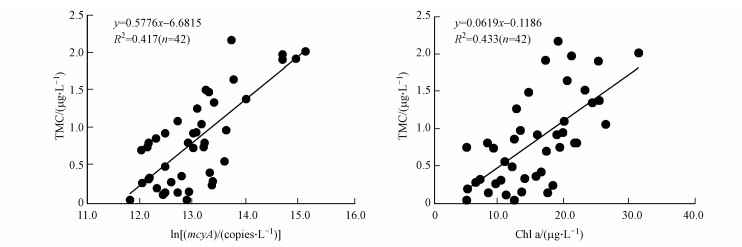 |
| 图 4 TMC与产毒微囊藻丰度、Chl a的相关关系 Fig. 4 Correlations between total microcystins and the toxic Microcystis, Chl a |
本研究应用荧光定量PCR分别以mcyA和Microcystis16S rDNA来定量产毒微囊藻和总微囊藻丰度, 并对两种基因所用引物特异性进行验证, 结果表明所选两对引物在标准品和洱海样品中均有较好的特异性, 与Li(2014)以往研究结果一致.qPCR检测的产毒微囊藻丰度与ELISA检测的毒素结果之间良好的相关性(图 4), 表明基于qPCR预测洱海微囊藻毒素具有一定的可行性, 该方法从水样DNA提取到上机定量可以在3 h内完成, 且可以对多个样品同时进行定量, 能够即时预警微囊藻水华及毒素风险.
洱海总微囊藻和产毒微囊藻丰度时间分布差异明显, 采样初期大理洱海区域出现频繁降雨可能不利于水华的发生(陈莉琼等, 2016), 总微囊藻丰度峰值出现在9月, 这与同期的较高水温与TP量(表 4)以及适宜的气候条件有关, 10月、11月总微囊藻丰度显著下降可能是因为温度降低, 微囊藻生长条件变差, 藻细胞出现死亡, 10月胞外毒素的明显增加也能证明这点(Li et al., 2014;Xu et al., 2010;李艳波等, 2005).尽管总微囊藻丰度在10月出现显著下降, 产毒微囊藻丰度却维持在一个较高水平, 产毒微囊藻占总微囊藻比例在10月达到最高, 这也成为微囊藻毒素的峰值出现在10月的有力佐证.研究期间, 洱海产毒微囊藻占总微囊藻比例在1.0%~69.8%, 其他研究如印度某水体产毒微囊藻占总微囊藻比值为0%~14%(Srivastava et al., 2012), 巢湖夏季和冬季该比值, 分别为8.4%~65.8%和0.5%~8.1%(李大命等, 2011a), 太湖蓝藻水华期间产毒微囊藻占总微囊藻比例为9.36%~41.21%(李大命等, 2011b)和20.5%~38.1%(李大命等, 2011c), 也有报道某些水体该比值能够达到100%(Davis et al., 2009), 相比较发现产毒微囊藻所占总微囊藻比例因水域、季节差异较大.
空间上, 北部旅游区位点总微囊藻丰度略高于南部饮用水源区, 这种明显地理差异性的分布特征可能与洱海盛行的西南风有关(Wang et al., 1998), 其中旅游区沙村湾TP显著高于其他点位, 而总微囊藻限制因子为P(陈建良等, 2015;苏春风等, 2013), 因而可能造成该区域总微囊藻丰度最高.产毒微囊藻与总微囊藻空间分布趋势不一致, 以饮用水源区位点值较高, 本研究显示环境因子对产毒微囊藻没有显著影响, Xu等(2010)对南京玄武湖全年调查发现, 温度显著影响总微囊藻丰度, 而与产毒微囊藻没有显著相关性, 这与本研究结果一致.也有研究(Yoshida et al., 2007)发现NO3--N能够显著提高产毒微囊藻的生长, 而本研究中NO3--N与产毒微囊藻无显著相关性, 这可能与洱海NO3--N浓度较低有关(Yu et al., 2014).在营养条件充足情况下, 水力条件、气候条件对产毒微囊藻丰度影响可能更为重要(Otten et al., 2012).环境因子对蓝藻产毒和毒素的释放迁移等环境行为有着错综复杂的作用关系, 随着水华生长的不同时期、不同地理位置和气象条件等诸多因素的改变而表现出不同程度和方式的影响行为(王菲凤等, 2011), 因而许多研究在分析微囊藻丰度、MCs浓度与环境因子的相互关系时差异很大.因此, 只通过对环境因子的考察很难有效预测蓝藻水华的毒性程度.
洱海微囊藻毒素主要是由产毒微囊藻产生(Yu et al., 2014), 因而受到产毒微囊藻丰度的显著影响, 其时空分布特征与产毒微囊藻丰度较为一致, 这也与文献报道一致.Otten等(2012)研究太湖水华期间产毒微囊藻和毒素空间分布, 结果发现, 两者分布规律一致.研究期间, 洱海总微囊藻毒素和胞外毒素均具有较高检出率, 其中10月份为洱海微囊藻毒素高风险期.洱海胞外微囊藻毒素基本处于较低水平( < 0.10 μg·L-1), 毛敬英(2012)和朱荣等(2015)也曾分别对洱海EMC-LR进行调查, 两者研究中洱海全湖平均值均低于0.03 μg·L-1, 表明洱海水华期间微囊藻毒素主要存在于藻细胞.我国饮用水源微囊藻毒素风险十分普遍, 王菲凤等(2011)研究福建山仔水库微囊藻毒素时空分布特征发现, 其最高浓度也出现于10月, 胞内毒素LR(IMC-LR)、胞外毒素LR(EMC-LR)分别高达11.43 μg·L-1和1.403 μg·L-1;杨再荣(2009)对贵州红枫湖微囊藻毒素调查发现, 胞内、外MC-LR最大值分别为9.90 μg·L-1和1.25 μg·L-1;朱文君(2013)于2012年7—8月对广东省各大水库进行调查, 结果显示, 多个水库均有微囊藻毒素污染, MC-LR检测量最高达到了3.40 μg·L-1.Yu等(2014)于2010洱海水华期间在北部湖湾检测到最高浓度为3.06 μg·L-1的总微囊藻毒素LR.相较而言, 本研究中微囊藻毒素污染状况较低且有所下降, 洱海水源水中胞外微囊藻毒素LR虽较低于标准限值(1 μg·L-1), 但水体中微囊藻毒素LR普遍检出, 总微囊藻毒素LR最高达到2.17 μg·L-1, 且毒素主要存在于藻细胞内, 经过水厂处理将会伴随着较为严重的藻细胞破损现象, 导致毒素释放影响出水水质(Jones et al., 1994;Zamyadi et al., 2012).且目前自来水厂往往缺乏针对微囊藻毒素的处理单元, 这将加剧洱海饮用水中微囊藻毒素的风险;同时, 微囊藻毒素可通过食物富集等途径危害人类健康, 有研究报道洱海水鸟体内检测出MC-LR的富集(朱荣等, 2015), 巢湖渔民由于长期摄入受MCs污染的水产品导致一定程度的肝损伤(Chen et al., 2009).因此, 水华期间洱海饮用水源地微囊藻毒素的生态风险需要引起重视.
本研究主要针对水华高风险季节(8—11月)研究洱海水源地产毒微囊藻和微囊藻毒素的分布特征, 评估其生态风险具有代表性, 同类研究也集中针对夏秋季的水域藻毒素的生态风险评估(Otten et al., 2012;朱荣等, 2015;刘洋等, 2016), 为了加强对水源区藻毒素风险的预测和调控, 开展对水源区微囊藻毒素的长期检测能提供更为完善的数据支撑和理论指导.
5 结论(Conclusions)1) 荧光定量PCR方法能够快速定量洱海中总微囊藻种群和产毒微囊藻丰度, 并且能有效预测洱海水体产毒潜能.
2) 总微囊藻丰度和产毒微囊藻丰度最高值均出现在9月, 水温和TP是调控洱海总微囊藻种群动态变化的重要环境因子, 限制P浓度增加能有效降低洱海微囊藻暴发风险, 环境因子对产毒微囊藻丰度影响不显著, 仅考察环境因子很难有效预测微囊藻水华的毒性程度.
3) 洱海饮用水源地微囊藻毒素检出率较高, 10月为高风险期, 其总微囊藻毒素接近或超过集中式生活饮用水地表水源地对MC-LR的限值(1.0 μg·L-1), 应加强水华期间微囊藻毒素监测力度, 保障洱海饮用水安全.
致谢(Acknowledgements): 非常感谢周兴安师兄, 赵定康先生在水样采集中提供的大力协助!| [${referVo.labelOrder}] | Chen J, Ping X, Li L, et al. 2009. First identification of the hepatotoxic microcystins in the serum of a chronically exposed human population together with indication of hepatocellular damage[J]. Toxicological Sciences, 108(1): 81–89. DOI:10.1093/toxsci/kfp009 |
| [${referVo.labelOrder}] | 陈建良, 胡明明, 周怀东, 等. 2015. 洱海蓝藻水华暴发期浮游植物群落变化及影响因素[J]. 水生生物学报, 2015, 39(1): 24–28. DOI:10.7541/2015.3 |
| [${referVo.labelOrder}] | 陈莉琼, 张娇, 陈晓玲, 等. 2016. 基于气象数据的洱海蓝藻水华驱动因子及预警研究[J]. 华中师范大学学报:自然科学版, 2016, 50(4): 606–611. |
| [${referVo.labelOrder}] | Davis T W, Berry D L, Boyer G L, et al. 2009. The effects of temperature and nutrients on the growth and dynamics of toxic and non-toxic strains of Microcystis during cyanobacteria blooms[J]. Harmful Algae, 8(5): 715–725. DOI:10.1016/j.hal.2009.02.004 |
| [${referVo.labelOrder}] | 金相灿. 1990. 湖泊富营养化调查(第2版)[M]. 北京: 中国环境科学出版社: 208–286. |
| [${referVo.labelOrder}] | Jones G J, Orr P T. 1994. Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determine by HPLC and protein phosphatase inhibition assay[J]. Water Research, 28(4): 871–876. DOI:10.1016/0043-1354(94)90093-0 |
| [${referVo.labelOrder}] | 李大命, 孔繁翔, 阳振, 等. 2011a. 巢湖夏季和冬季有毒微囊藻和无毒微囊藻种群丰度研究[J]. 环境科学学报, 2011a, 31(12): 2672–2680. |
| [${referVo.labelOrder}] | 李大命, 孔繁翔, 于洋, 等. 2011b. 太湖蓝藻水华期间水体和底泥中产毒微囊藻与非产毒微囊藻种群丰度研究[J]. 环境科学学报, 2011b, 31(2): 292–298. |
| [${referVo.labelOrder}] | 李大命, 孔繁翔, 张民, 等. 2011c. 太湖和巢湖夏季蓝藻水华期间产毒微囊藻和非产毒微囊藻种群丰度的空间分布[J]. 应用与环境生物学报, 2011c, 17(4): 480–485. |
| [${referVo.labelOrder}] | Li D, Gu A Z, He M. 2014. Quantification and genetic diversity of total and microcystin-producing Microcystis during blooming season in Tai and Yang-cheng lakes, China[J]. Journal of Applied Microbiology, 116(6): 1482–1494. DOI:10.1111/jam.2014.116.issue-6 |
| [${referVo.labelOrder}] | 李泽坤, 杨萍萍, 苏社飞. 2015. 2004-2013年洱海富营养化变化趋势[J]. 环境科学导刊, 2015, 34(1): 1–3. |
| [${referVo.labelOrder}] | 李艳波, 苑宝玲, 宋炜, 等. 2005. 水库水的藻毒素污染调查及产毒藻株的分离鉴定[J]. 福建师大学报(自然科学版), 2005, 21(3): 52–55. |
| [${referVo.labelOrder}] | 刘洋, 胡佩茹, 马思三, 等. 2016. 实时荧光定量PCR方法检测南太湖入湖口产毒微囊藻[J]. 湖泊科学, 2016, 28(2): 246–252. DOI:10.18307/2016.0202 |
| [${referVo.labelOrder}] | 毛敬英. 2012. 典型富营养化湖泊微囊藻毒素分布特征及主要影响因子差异性分析[D]. 成都: 西南交通大学 |
| [${referVo.labelOrder}] | 倪兆奎, 王圣瑞, 金相灿, 等. 2011. 云贵高原典型湖泊富营养化演变过程及特征研究[J]. 环境科学学报, 2011, 31(12): 2681–2689. |
| [${referVo.labelOrder}] | Otten T G, Xu H, Qin B, et al. 2012. Spatiotemporal patterns and ecophysiology of toxigenic microcystis blooms in Lake Taihu, China:implications for water quality management[J]. Environmental Science and Technology, 46(6): 3480–3488. DOI:10.1021/es2041288 |
| [${referVo.labelOrder}] | Poste A E, Hecky R E, Guildford S J. 2011. Evaluating microcystin exposure risk through fish consumption[J]. Environmental Science & Technology, 45(13): 5806–5811. |
| [${referVo.labelOrder}] | Rastogi R P, Sinha R P, Incharoensakdi A. 2014. The cyanotoxin-microcystins:current overview[J]. Reviews in Environmental Science and Bio/Technology, 13(2): 215–249. DOI:10.1007/s11157-014-9334-6 |
| [${referVo.labelOrder}] | Srivastava A, Cchoi G G, Ahn C Y, et al. 2012. Dynamics of microcystin production and quantification of potentially toxigenic Microcystis sp[J]. using real-time PCR[J].Water Research, 46(3): 817–827. |
| [${referVo.labelOrder}] | 苏春风, 代瑞华, 刘会娟, 等. 2013. 不同磷源及其浓度对铜绿微囊藻生长和产毒的影响[J]. 环境科学学报, 2013, 33(9): 2546–2551. |
| [${referVo.labelOrder}] | Tan X, Kong F, Yu Y, et al. 2009. Spatio-temporal variations of phytoplankton community composition assayed by morphological observation and photosynthetic pigment analyses in Lake Taihu (China)[J]. African Journal of Biotechnology, 8(8): 4977–4982. |
| [${referVo.labelOrder}] | Tillett D, Dittmann E, Erhard M, et al. 2000. Structural organization of microcystin biosynthesis in Microcystis aeruginosa PCC7806:an integrated peptide-polyketide synthetase system[J]. Chemistry & Biology, 7(10): 753–764. |
| [${referVo.labelOrder}] | 王菲凤, 仝川, 杨芳, 等. 2011. 福州山仔水库水华微囊藻毒素时空分布特征[J]. 环境科学学报, 2011, 31(3): 533–546. |
| [${referVo.labelOrder}] | Wang S M, Dou H S. 1998. A directory of lakes in China[M]. Beijing: Science Press. |
| [${referVo.labelOrder}] | 王芸. 2008. 洱海夏秋季蓝藻种群动态变化及水华成因分析[J]. 大理学院学报:综合版, 2008, 7(12): 39–42. |
| [${referVo.labelOrder}] | Wang Z, Wang Y, Hu M, et al. 2011. Succession of the phytoplankton community in response to environmental factors in north lake erhai during 2009-2010[J]. Fresenius Environmental Bulletin, 20(9): 2221–2231. |
| [${referVo.labelOrder}] | 卫志宏, 张利仙, 杨四坤, 等. 2012. 洱海浮游植物群落结构及季节演替[J]. 水生态学杂志, 2012, 33(4): 21–25. |
| [${referVo.labelOrder}] | Xu Y, Wang G, Yang W, et al. 2010. Dynamics of the water bloom-forming Microcystis and its relationship with physicochemical factors in Lake Xuanwu (China)[J]. Environmental Science and Pollution Research, 17(9): 1581–1590. DOI:10.1007/s11356-010-0345-8 |
| [${referVo.labelOrder}] | 杨再荣. 2009. 饮用水源水及自来水厂微囊藻毒素的变化和去除方法的研究[D]. 贵阳: 贵州师范大学 |
| [${referVo.labelOrder}] | Yen H K, Lin T F, Tseng I C. 2012. Detection and quantification of major toxigenic Microcystis genotypes in Moo-Tan reservoir and associated water treatment plant[J]. Journal of Environmental Monitoring Jem, 14(2): 687–696. DOI:10.1039/c1em10389j |
| [${referVo.labelOrder}] | Yoshida M, Yoshida T, Takashima Y, et al. 2007. Dynamics of microcystin-producing and non-microcystin-producing Microcystis populations is correlated with nitrate concentration in a Japanese lake[J]. Fems Microbiology Letters, 266(1): 49–53. DOI:10.1111/fml.2007.266.issue-1 |
| [${referVo.labelOrder}] | Yu G, Jiang Y, Song G, et al. 2014. Variation of Microcystis and microcystins coupling nitrogen and phosphorus nutrients in Lake Erhai, a drinking-water source in Southwest Plateau, China[J]. Environmental Science and Pollution Research, 21(16): 9887–9898. DOI:10.1007/s11356-014-2937-1 |
| [${referVo.labelOrder}] | Zamyadi A, Macleod S L, Fan Y, et al. 2012. Toxic cyanobacterial breakthrough and accumulation in a drinking water plant:a monitoring and treatment challenge[J]. Water Research, 46(5): 1511–1523. DOI:10.1016/j.watres.2011.11.012 |
| [${referVo.labelOrder}] | 朱荣, 王欢, 余得昭, 等. 2015. 2013年洱海水华期间微囊藻毒素和浮游植物动态变化[J]. 湖泊科学, 2015, 27(3): 378–384. DOI:10.18307/2015.0302 |
| [${referVo.labelOrder}] | 朱文君. 2013. 自然曝气生物滤床对微囊藻毒素的处理效果及机理研究[D]. 广州: 暨南大学 http://cdmd.cnki.com.cn/Article/CDMD-10559-1013027818.htm |
 2017, Vol. 37
2017, Vol. 37