Naproxen photodegradation under UV radiation in aqueous solution:Effect of different forms of nitrogen and iron
1 引言(Introduction)
药品及个人护理用品(Pharmaceutical and personal care products, PPCPs)的大量生产和使用, 使这类物质在水环境(包括地下水、地表水及饮用水)中广泛存在(Heberer et al., 2011; Zhang et al., 2011; Ternes, 1998; Kolpin et al., 2002).虽然PPCPs在水环境中的含量极低, 但这类物质普遍具有难生物降解的特性, 在污水处理厂中不能将其完全降解, 造成PPCPs及其代谢中间产物在水环境中不断累积, 增加了人类接触这些物质的风险(Panswad et al., 2000; Stefan et al., 2002; Bound et al., 2004; Smital et al., 2004).近年来, PPCPs作为新兴的污染物, 其环境行为已引起广泛关注.
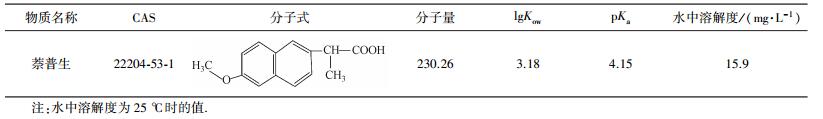
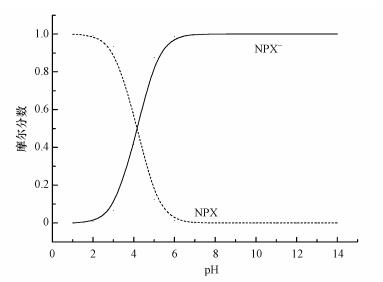
萘普生(Naproxen, NPX)是一种典型的PPCPs, 其理化参数见表 1(Trenholm et al., 2006), 形态分布见图 1. NPX具有抗炎、解热、镇痛的作用, 常用于非甾体消炎镇痛类非处方药, 是全球主要的解热镇痛药和最畅销的四大非处方药之一(Jones et al., 2002). NPX在使用过程中, 其母体及代谢产物通过人体或者动物排泄进入城市污水处理系统.由于NPX的难生物降解性, 在传统的污水处理工艺中去除率较低, 并随着污水出水的排放进入环境中.据报道, NPX在污水处理厂出水中检测到的浓度水平一般为0.1~2.6 μg·L-1(佟玲等, 2009; Boyd et al., 2005), 在水环境中的累积水平已经达到ng·L-1 (佟玲等, 2009).有医学研究表明, 长期摄入痕量水平的NPX能诱发心脏病、中风及肺部毒性效应(Fent et al., 2006; Domínguez et al., 2011; Hasan et al., 2012; Isidori et al., 2005).目前, 有关NPX的检测方法(王庆锋等, 1999;郭杰标等, 2014)和去除技术(纪夏玲等, 2016;林龙利等, 2016)已有文献报道, 但关于NPX在水环境中的环境行为研究则较少.
表 1(Table 1)
|
表 1 NPX的理化参数
Table 1 Physical and chemical parameters of NPX
|
表 1 NPX的理化参数
Table 1 Physical and chemical parameters of NPX
|
 |
光解是PPCPs类污染物在水环境中发生降解的一种重要途径, 由于在自然水体中常存在一些光敏性物质, 它们在光的照射下能产生活性氧物种(如1O2、·OH), 这些活性氧物种能与PPCPs发生反应(Kim et al., 2014; Lam et al., 2003; Meunier et al., 2000), 从而影响PPCPs的降解效果.在这些光敏物质中, 以NO3-和Fe3+在水环境中分布较为广泛.研究证明, 光诱导水体中NO3-产生1O2、·OH是水环境中活性氧物种的主要来源(And et al., 2014), 水体中Fe3+在光的诱导下同样能产生1O2、·OH活性氧物种, NO3-和Fe3+是水体中1O2和·OH产生的重要前驱.另一方面, NO3-和Fe3+会随着水体pE值的变化而分别转化为NO2-、NH4+, 以及Fe2+等不同形态, 当其形态发生变化时, 其光敏活性也会发生显著变化.研究不同形态的氮和不同形态的铁对NPX在水环境中的光降解影响, 对深入了解NPX在水环境中的归趋具有重要意义.
太阳辐射到地球表面的光包括紫外光、可见光和红外光, 紫外光的波长短, 光子能量大, 使其成为引起PPCPs类污染物降解的主要太阳光谱波段.因此, 本研究以300 W汞灯为光源, 模拟研究NPX在水环境中的降解行为.具体探讨水中存在的不同形态氮对NPX的光诱导行为, 以及水中存在的不同形态铁对NPX的光诱导行为, 并讨论屏蔽作用对NPX光降解的影响.
2 材料与方法(Materials and methods)
2.1 试剂
NPX、α-甲基-6-甲氧基-2-萘乙酸, 纯度>98%, 购自西亚试剂公司;乙腈、甲醇、乙醇均为色谱纯, 购自美国ACS恩科化学公司;硝酸钠、亚硝酸钠、硫酸铵、硫酸铁、硫酸亚铁、异丙醇均为分析纯, 购自成都科龙化工试剂公司;实验用水均为超纯水(Smart2 Pure超纯水/纯水一体化系统, 德国TKA).
2.2 实验方法
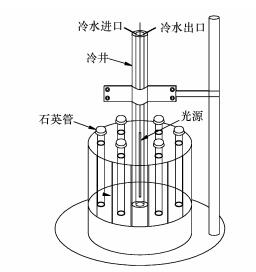
将0.1 g NPX溶于100 mL乙腈中, 配制成浓度为1 g·L-1的NPX母液.准确移取2.5 mL NPX母液于250 mL容量瓶中, 分别加入不同浓度的NaNO3溶液, 用超纯水定溶, 使容量瓶中NPX的浓度为10 mg·L-1, NO3-的浓度分别为0、0.01、0.1、0.5和1.00 mmol·L-1.摇匀后, 移取20 mL溶液至30 mL石英管中, 置于SGYⅡ型旋转光化学反应器内(图 2, 南京斯东柯电气设备有限公司), 控制反应器温度为(25±1) ℃, 用300 W汞灯照射(南京斯东柯电气设备有限公司), 每隔5 min取样1次, 用HPLC测定NPX浓度.每个时间点的样品至少设3个重复, 取平均值.含有NO2-、NH4+、Fe3+和Fe2+的NPX溶液的配制和光解方法同上.
2.3 分析测定方法
NPX采用高效液相色谱仪(LC-20AT, SHIMADZU)测定, 色谱条件:色谱柱是ZORBAX Eclipse XDS-C18柱(205 mm×4.6 mm, 5 μm);流动相是乙腈-纯水(70:30, 体积比);检测器是光电二极管阵列检测器(SPD-M20A), 检测波长为254 nm;流速1 mL·min-1, 进样量10 μL;柱温30 ℃.紫外分光光度计(UV-2100, 北京瑞利).
2.4 水环境pE值与N、Fe的形态
2.4.1 无机氮体系
pE=-lgαe, 其中, αe表示水溶液中的电子活度, 是衡量溶液中接收或迁移电子的相对趋势.pE值越小, 表示电子浓度越大, 溶液体系中迁移电子的趋势越强;相反, pE值越大, 表示电子浓度越小, 溶液体系中接收电子的趋势越强.在水溶液中, 无机氮主要以NO3-和NH4+的稳定形式存在.在一定条件下, 也可存在中间态NO2-.实验中, 假设水溶液中无机氮的总浓度为0.1 mmol·L-1, 则水中的pE值与NO3-、NO2-和NH4+三者间的关系如下所示: pE<5, 主要以NH4+形态存在(式(1)~(4));pE≈6.5, 主要以NO2-形态存在(式(5)~(6));pE>7, 主要以NO3-形态存在(式(6)~(7)).本研究考察了不同pE值下, 不同形态无机氮组成对NPX在紫外灯下的光降解影响.
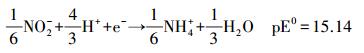
|
(1) |
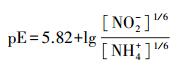
|
(2) |
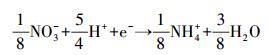
|
(3) |
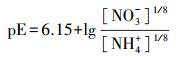
|
(4) |
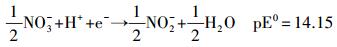
|
(5) |
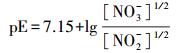
|
(6) |
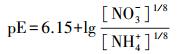
|
(7) |
2.4.2 铁体系
在水溶液中, 铁主要以Fe3+或Fe2+的形态存在.实验中, 假设水溶液中铁的总浓度为0.010 mmol·L-1, 则pE值对Fe3+-Fe2+-H2O体系中不同形态铁的浓度影响如下式所示.此外, 本研究还考察了不同pE值下, 不同形态铁组成对NPX在紫外灯下的光降解影响.
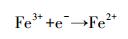
|
(8) |
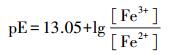
|
(9) |
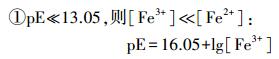
|
(10) |
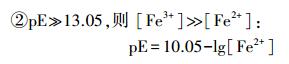
|
(11) |
2.5 光屏蔽因子测定法
光屏蔽因子Sλ可用于表示不同浓度的水中溶解性物质对目标物质直接光解的影响(葛林科, 2009).分别对含有不同浓度影响因子(NO3-、NO2-、Fe3+、Fe2+)的溶液进行紫外分光光度扫描, 收集波长范围200~450 nm的吸光度, 并计算某一波段点光屏蔽因子及总屏蔽因子, 公式如式(12)~(13) 所示.
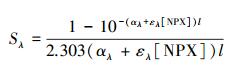
|
(12) |
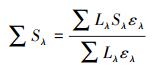
|
(13) |
式中, Sλ为影响因子在λ波长下对NPX的光屏蔽因子;∑Sλ为影响因子在紫外吸收波长范围内对NPX的总屏蔽因子;αλ为影响因子在λ波长下的吸光度(cm-1);ελ为NPX在λ波长下的摩尔吸光系数(L·cm-1·mol-1);[NPX]为NPX的浓度(mol·L-1);l为光程(cm);Lλ为相对光强.
2.6 NPX的光降解动力学
有研究表明, 一级动力学能较好地表达微量污染物的光降解(Chao et al., 2009), 速率常数K的表达式见式(14).对式(14) 积分可得式(15), 当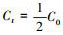 时, t=t1/2, 式(14) 可转变为t1/2=ln2/K.
时, t=t1/2, 式(14) 可转变为t1/2=ln2/K.
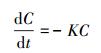
|
(14) |
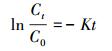
|
(15) |
式中, C为NPX的浓度(mol·L-1);K为光降解速率常数(min-1);t为反应时间(min);Ct为NPX在反应时间t时的浓度(mol·L-1);C0为NPX的初始浓度(mol·L-1).
3 结果与讨论(Results and discussion)
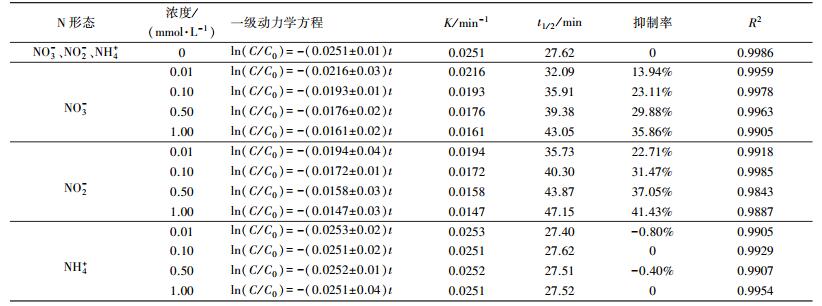
3.1 NO3-对NPX光降解的影响
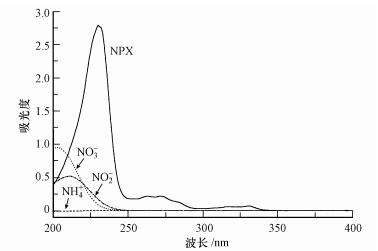
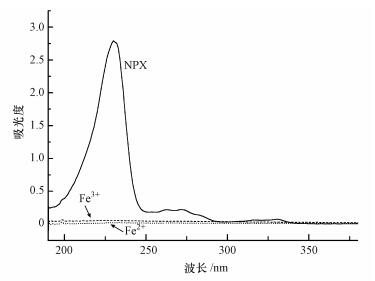
实验结果如表 2所示, 添加不同浓度的NO3-后, NPX的光降解能较好地符合一级动力学方程.溶液中加入NO3-后NPX的光降解受到抑制, NO3-浓度从0.01 mmol·L-1增加至1.00 mmol·L-1, NPX的光降解速率常数从0.0216 min-1递减至0.0161 min-1.在紫外线照射下, NO3-的吸收光谱(λ=190~250 nm)与NPX的吸收光谱(λ=200~300 nm)重合(图 3), 两者产生竞争吸收, NO3-能对NPX的光解产生屏蔽作用.根据本实验的前期研究(马杜娟等, 2013), 发现NPX光降解时, 自由基贡献率为R·OH=21.12%, R1O2=15.94%, RO2·-=64.14%.尽管NO3-吸收光后能产生·OH, 引发NPX的降解, 但总体看来, 屏蔽效应的作用更大, 这与张楠(2012)、邓芠等(2016)的研究结果类似.
表 2(Table 2)
|
表 2 不同形态N对NPX光降解影响的动力学方程及相关常数
Table 2 Kinetics of NPX photodegradation with different forms of inorganic nitrogen
|
表 2 不同形态N对NPX光降解影响的动力学方程及相关常数
Table 2 Kinetics of NPX photodegradation with different forms of inorganic nitrogen
|
 |
NO3-在紫外光的照射下产生NO3-激发态(式(16)), NO3-激发态能部分转化成NO2-和O(3P)(式(17)),同时部分转化成NO2·、·OH和OH-(式(18)).
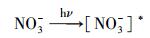
|
(16) |
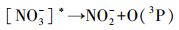
|
(17) |
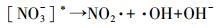
|
(18) |
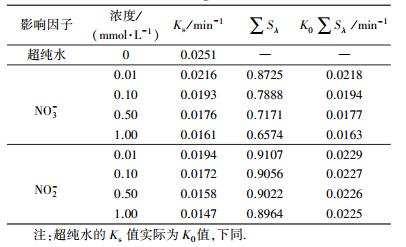
为考察NO3-的屏蔽影响, 对含有不同浓度NO3-的溶液进行紫外分光光度扫描, 收集λ=200~450 nm的吸光度, 根据式(12) 和(13), 计算得到各浓度NO3-的光屏蔽系数∑Sλ.理论速率常数K=K0∑Sλ, 与实际Ks相比, 两者相差不大(表 3).可知, 在溶液中NO3-对NPX的光降解产生的屏蔽影响是主导作用, 掩蔽效果随NO3-浓度的增加而增大, 屏蔽效果增强.同时, 体系中没有明显生成ROS促进NPX的光降解.
表 3(Table 3)
|
表 3 不同浓度NO3-、NO2-下NPX光降解速率常数及光屏蔽因子
Table 3 Photodegradation rate constants with NO3- or NO2- in different concentrations and screening factor
|
表 3 不同浓度NO3-、NO2-下NPX光降解速率常数及光屏蔽因子
Table 3 Photodegradation rate constants with NO3- or NO2- in different concentrations and screening factor
|
 |
3.2 NO2-对NPX光降解的影响
添加不同浓度的NO2-后, NPX的光降解能较好地符合一级动力学方程(表 2).溶液中加入NO2-后, NPX的光降解受到抑制.NO2-浓度从0.01 mmol·L-1增加至1 mmol·L-1, NPX的光降解速率常数从0.0194 min-1递减至0.0147 min-1.通过与NO3-对比发现, 相同添加浓度下, NO2-对NPX的抑制作用比NO3-大.除两者的吸收光谱部分重合, 产生竞争吸收外(图 3), NO2-既产生强氧化剂·OH(式(19)), 促进NPX的光降解, 但又在高浓度下, 部分NO2-能与·OH发生猝灭反应(式(20)~(21)), 此时NO2-表现为·OH的清除剂(Matykiewiczova et al., 2007;Shankar et al., 2007;Vione et al., 2007;Nelieu et al., 2008;Malouki et al., 2005;Mack et al., 1999), 抑制NPX的光降解.总体表现为:NO2-的添加能对NPX产生较强的光降解抑制作用.
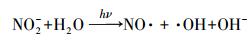
|
(19) |

|
(20) |
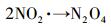
|
(21) |
同样引入光屏蔽系数考察NO2-对NPX的抑制作用.总屏蔽系数随NO2-浓度的增大而增加, 但增加效果不明显.根据式(12) 和(13), 计算得到理论速率常数K=K0∑Sλ.对比发现, 各浓度下对应的K均小于Ks值, 且随着NO2-浓度的增加, 两者相差越大(表 3).
根据前期研究发现, NPX光降解时, 自由基贡献率为R·OH=21.12%.由式(20) 可知, NO2-能淬灭溶液中的·OH.NO2-的浓度越大, 淬灭·OH的作用越强, NPX的降解速率下降越明显.由此可知, NO2-对NPX光降解不但产生光屏蔽作用, 且对·OH产生淬灭作用, 后者是产生抑制作用的主导因素.
3.3 NH4+对NPX光降解的影响
添加不同浓度的NH4+后, NPX的光降解能较好地符合一级动力学方程(表 2).溶液中加入NH4+后, NPX的光降解基本不受影响.NH4+的浓度从0.01 mmol·L-1增加至1 mmol·L-1, NPX的光降解速率常数基本没有变化.这是因为NH4+在紫外可见光范围内基本没有光吸收(图 3), 不会对NPX产生光量子竞争作用, 抑制NPX光降解, 也不会产生ROS促进NPX光降解.
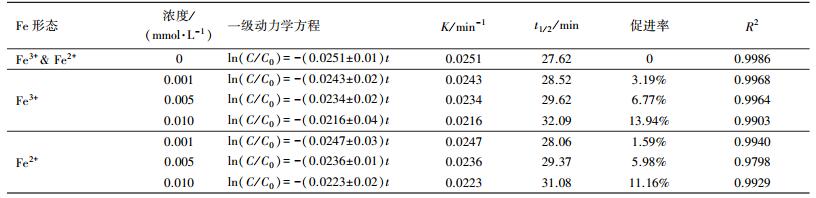
3.4 Fe3+对NPX光降解的影响
添加不同浓度的Fe3+后, NPX的光降解符合一级动力学方程, 实验结果如表 4所示.溶液中Fe3+的浓度从0.001 mmol·L-1增加至0.01 mmol·L-1, NPX的光降解速率从0.0243 min-1递减至0.0216 min-1.表明溶液中加入Fe3+后, NPX的光降解受到抑制, 且抑制强度随着Fe3+浓度的增大而增大.
表 4(Table 4)
|
表 4 不同形态Fe对NPX光降解影响的动力学方程及相关常数
Table 4 Kinetics of NPX photodegradation with different forms of iron
|
表 4 不同形态Fe对NPX光降解影响的动力学方程及相关常数
Table 4 Kinetics of NPX photodegradation with different forms of iron
|
 |
由图 4可知, Fe3+在190~350 nm间光吸收不明显, Fe3+对NPX产生光屏蔽效应主要是Fe3+与H2O结合形成Fe(OH)2+、Fe(OH)2+、二聚体[Fe(OH) ]24+和[Fe(H2O)6]3+等络合物(式(22)~(25)), 以及胶状物Fe(H2O)3.这些络合物与胶状物具有一定的光化学活性, 在光照下产生·OH, 促进NPX的光降解.同时, 这些络合物能降低反应体系的透光度, 抑制NPX的光降解.总体表现为:溶液中的Fe3+能对NPX的光降解产生抑制作用.
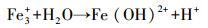
|
(22) |
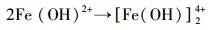
|
(23) |
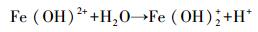
|
(24) |
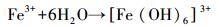
|
(25) |
考察Fe3+的光屏蔽系数发现, 各浓度下对应的K与Ks值相比, 相差不大(表 5), 即溶液中Fe3+对NPX的光降解产生的屏蔽影响是主导作用, 掩蔽效果随Fe3+浓度的增加而增大, 屏蔽效果增强.体系中没有明显生成ROS促进NPX的光降解.
表 5(Table 5)
|
表 5 不同浓度Fe3+、Fe2+下NPX光降解速率常数及光屏蔽因子
Table 5 Photodegradation rate constants with Fe3+ or Fe2+ in different concentrations and screening factor
|
表 5 不同浓度Fe3+、Fe2+下NPX光降解速率常数及光屏蔽因子
Table 5 Photodegradation rate constants with Fe3+ or Fe2+ in different concentrations and screening factor
|
 |
3.5 Fe2+对NPX光降解的影响
添加不同浓度的Fe2+后, NPX的光降解符合一级动力学方程, 实验结果如表 4所示.溶液中的Fe2+的浓度从0.001 mmol·L-1增加至0.01 mmol·L-1, NPX的光降解速率常数从0.0247 min-1递减至0.0223 min-1.从光降解速率的递减程度可以看出, 溶液中加入Fe2+后, NPX的光降解受到抑制, 抑制率随Fe2+浓度的增加而增大, 但抑制效果轻微.
由图 4可知, Fe2+在200~400 nm光谱范围内基本不产生光吸收.Fe2+对NPX光降解的轻微抑制作用, 初步推测是因为Fe2+易被氧化成Fe3+, 从而产生一系列的络合物和胶状物, 但Fe2+和水中O2的浓度都不高, 所以生成的络合物和胶状物浓度极低, 对NPX光降解产生的抑制作用也十分有限.
从表 5中可发现, Fe2+的光屏蔽系数比Fe3+的要小, 光屏蔽效应较弱.由此可以推测, Fe2+的光屏蔽作用是由浓度极低的络合物和胶状物产生的.
3.6 水体pE值变化时无机氮对NPX光降解的影响
当pE值从4.82增加至6.50时, 水中NH4+逐渐转化为NO2-, 随之NPX的光降解速率逐渐降低;pE值从6.50增加至8.15时, 水中NO2-又进一步转化为NO3-, 而NPX的光降解速率逐渐增大.不同pE值下, 无机氮对NPX光降解的抑制影响并不是简单的叠加关系(表 6).
表 6(Table 6)
|
表 6 不同pE值下无机氮对NPX光降解的影响
Table 6 Kinetics of NPX photodegradation with different forms of inorganic nitrogen at different pE value
|
表 6 不同pE值下无机氮对NPX光降解的影响
Table 6 Kinetics of NPX photodegradation with different forms of inorganic nitrogen at different pE value
|
 |
当pE≤4.82时, 水体中的无机氮主要以NH4+的形式存在.如前实验所示, NH4+对NPX的光降解影响不大, 此时NPX的光降解速率基本不变, 抑制率为0.当4.82<pE<6.50时, 水体中的无机氮逐渐转变成以NO2-的形式存在为主.随着NH4+逐渐减少, NO2-逐渐增加, NPX的光降解速率也逐渐减小, 实际抑制率从11.55%上升至31.43%.在这个pE值范围内, NPX的光降解主要是受到NO2-的抑制影响.当6.50<pE<8.15时, 水体中的无机氮逐渐转变成以NO3-的形式存在为主.随着NO2-逐渐减少, NO3-逐渐增加, NPX的光降解速率较上一阶段的速率有所增加.从前面的实验结果可知, NO2-对NPX的光降解抑制作用比NO3-的明显.所以在这一阶段中, 随着NO3-的主导作用增强, 水体中NO2-和NO3-对NPX光降解的共同抑制作用将有所减弱.
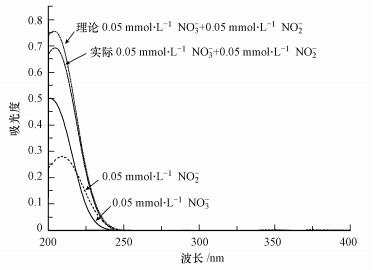
同时, 在表 6中通过对比可知, 无论在NO2-和NH4+共存, 还是在NO2-和NO3-共存时, 复合状态下对NPX的光降解抑制率均小于2种离子单独存在时的抑制率之和, 即实际抑制率都小于理论抑制率.这说明2种影响因子共存时, 对NPX的光降解存在拮抗作用.当NO2-和NH4+共存时, 可发生氨氧化反应(谢志儒, 2008), 具体如式(26) 所示, NO2-的浓度降低, 对NPX的抑制作用也随之减弱;当NO2-和NO3-共存时, 其吸光度小于二者单独存在时的吸光度之和(以0.05 mmol·L-1 NO3-和0.05 mmol·L-1 NO2-共存为例, 结果见图 5), 对NPX的光竞争减弱, 抑制作用降低.
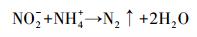
|
(26) |
3.6 水体pE值变化时铁对NPX光降解的影响
在本实验中, pE值从12.45递增至13.65时, NPX的光降解速率逐渐降低, 总体表现为对NPX光降解的抑制作用, 但对NPX光降解的抑制影响也不是简单的叠加关系(表 7).
表 7(Table 7)
|
表 7 不同pE值下铁体系对NPX光降解的影响
Table 7 Kinetics of NPX photodegradation with different forms of iron at different pE value
|
表 7 不同pE值下铁体系对NPX光降解的影响
Table 7 Kinetics of NPX photodegradation with different forms of iron at different pE value
|
 |
当pE<12.45时, 水体中的铁体系主要以Fe2+的形式存在.如前实验所示, Fe2+对NPX的光降解影响表现为轻微的抑制作用, 抑制率为11.16%.随着水体中pE值升高, 水体中的Fe2+逐渐减少, Fe3+逐渐增加, NPX的光降解速率也逐渐减小.当pE>13.65时, 水体中的铁体系逐渐转变为以Fe3+的形式存在为主, NPX的光降解主要是受到Fe3+的抑制影响.如前实验结果可知, Fe3+对NPX的光降解抑制作用比Fe2+明显.
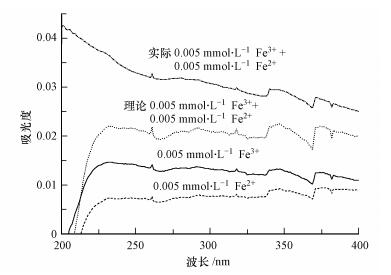
同时, 对比表 7中的数据可知, Fe2+和Fe3+共存, 复合状态下对NPX的光降解抑制率均大于各种离子单独存在时的抑制率之和, 即实际抑制率都大于理论抑制率.这说明Fe2+和Fe3+共存时, 对NPX的光降解存在协同作用.两者共存时, 其吸光度大于二者单独存在时的吸光度之和(以0.005 mmol·L-1 Fe3+和0.005 mmol·L-1Fe2+和共存为例, 结果见图 6), 对NPX的光竞争增强, 抑制作用增大.
4 结论(Conclusions)
1) 在紫外光照射下, NPX的光降解符合一级动力学规律.
2) NO3-和NO2-对NPX的光降解产生抑制作用, 作用强度随浓度的增加而增大.这是因为NO3-对NPX在吸收光谱波长范围(200~400 nm)内发生光子竞争吸收, 产生光屏蔽现象;NO2-除产生光屏蔽现象外, 还对·OH产生淬灭作用.
3) NH4+对NPX的光降解速率基本不产生影响,这是因为NH4+在紫外可见光范围内没有光吸收, 既不会对NPX产生光屏蔽, 也不会产生ROS促进NPX光降解.
4) Fe2+和Fe3+都对NPX的光降解产生较轻的抑制作用, Fe2+比Fe3+的抑制作用更弱, 因为Fe2+在水中生成的络合物和胶状物浓度极低.
5) 模拟了水体pE值的变化, 无机氮体系对NPX光降解的影响表明, 2种影响因子共存时, 两者对NPX的光降解存在拮抗作用;铁体系中, Fe3+和Fe2+共存对NPX的光降解存在协同作用.
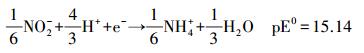
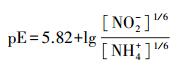
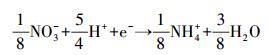
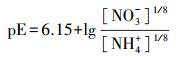
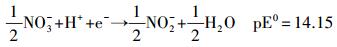
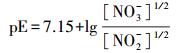
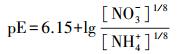
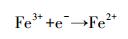
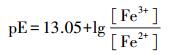
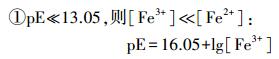
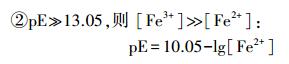
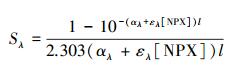
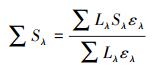
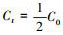
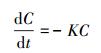
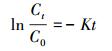
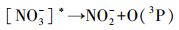
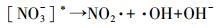
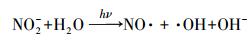

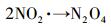
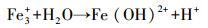
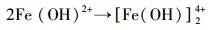
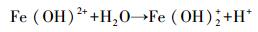
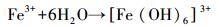
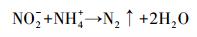
 2017, Vol. 37
2017, Vol. 37