厌氧氨氧化工艺自1995年被发现, 就引起了世界范围内的关注(Mulder et al., 1995) .厌氧氨氧化(anaerobic ammmonia oxidation, ANAMMOX) 是在厌氧的条件下, 以亚硝酸盐氮为电子受体, 氨氮作为电子供体, 最终产生氮气的过程(Van de Graaf et al., 1995) .相较于传统的脱氮硝化-反硝化工艺, 厌氧氨氧化具有脱氮负荷高、运行费用低、占地面积小等优点(Haaijer et al., 2005;Joss et al., 2009;Van der Star, 2007) .但同时厌氧氨氧化菌倍增时间长(培增时间11 d), 细胞产率低, 难以维持较高的生物浓度, 对环境条件敏感等(Strous et al., 1998;Strous et al., 1999;Strous et al., 1999) .因此厌氧氨氧化菌启动过程耗时较长.因此近年来关于厌氧氨氧化工艺的快速启动研究较多, 活性污泥(Wang et al., 2011) 、厌氧颗粒污泥(Tang et al., 2009) 、反硝化污泥(Chamchoi et al., 2007) 厌氧絮状污泥和颗粒污泥混合(张海芹等, 2015)等均已成功应用于厌氧氨氧化的启动, 但相关研究都只考察了厌氧氨氧化启动过程中氮负荷、反应器容积负荷及脱氮效率.各种种泥在启动厌氧氨氧化过程中的优缺点及启动过程中厌氧氨氧化菌群丰度变化及其他微生物群落变化研究较少, 因此探究何种污泥能够快速启动厌氧氨氧化反应器及其启动过程在中污泥的特性变化及微生物群落结构演替过程十分必要.
因此本研究选用城市污水处理厂活性污泥和厌氧颗粒污泥作为接种污泥启动厌氧氨氧化反应器.并考察不同接种污泥启动反应器中的污泥的形态、脱氮性能、容积氮负荷和氮去除负荷的差异, 同时采用高通量测序方法探究厌氧氨氧化在启动过程中微生物群落结构演替规律, 为厌氧氨氧化在实际工程应用提供理论指导.
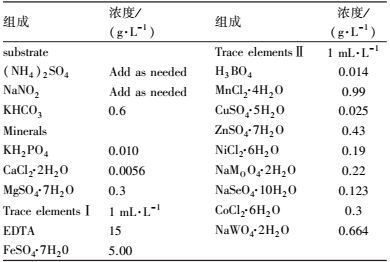
2 材料与方法(Materials and methods) 2.1 实验废水本试验采用模拟废水, (NH4)2SO4和NaNO2按需添加, 具体组成见表 1.
| 表 1 厌氧氨氧化模拟废水组成 Table 1 The composition of simulated wastewater for Anaerobic ammonium oxidation |
实验采用膨胀颗粒污泥床(EGSB)反应器进行实验, 反应器容积2 L, 其中有效容积1.96 L.反应器外部用黑布遮蔽, 模拟废水通过蠕动泵连续泵入反应器内, 反应产生的N2由反应器的三相分离器上部排出, 污泥从三相分离器沉到反应区, 出水从上部溢流堰流出.进水pH控制在7~8之间, 反应器温度保持在30~35 ℃.
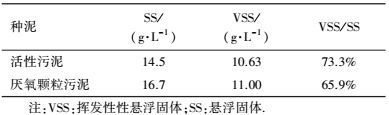
2.3 接种污泥接种污泥分别为城市污水处理厂二沉池污泥和厌氧颗粒污泥, 接种污泥用磷酸缓冲溶液清洗3遍后分别接种于两套完全相同的EGSB反应器中, 分别为A (接种城市污水处理厂活性污泥)和B (接种厌氧颗粒污泥).污泥接种量约为50 mL, 接种污泥的特性如表 2所示.
| 表 2 种泥的特性 Table 2 Properties of the seed sludge |
氨氮采用纳氏试剂分光光度法进行测定;亚硝酸盐氮采用N-(1-萘基)-乙二胺分光光度法进行测定;硝态氮采用麝香草酚分光光度法进行测定;总氮采用碱性过硫酸钾消解紫外分光光度法;MLSS和MLVSS采用重量法 (国家环境保护总局, 2002) .
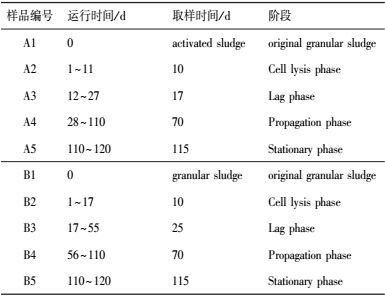
2.5 总DNA提取与16S rRNA基因PCR扩增污泥取样时间情况如表 3所示, 取自反应器的污泥于4000 r·min-1条件下离心10 min, 以获得约200 mg的污泥用于DNA提取.利用FastDNA土壤试剂盒(MP Biomedicals, CA, USA)对污泥中微生物DNA进行提取, 步骤遵循试剂盒要求操作.提取后的DNA样品用NanoDropND-2000(NanoDrop® ND-1000, NanoDrop Technologies, Willmington, DE, USA)测定浓度, 用1%凝胶电泳检查所提DNA片段长度.
| 表 3 微生物样本取样情况表 Table 3 Microbial sampling table |
利用16S rRNA通用引物515f (5′-GTGCCA GCMGCCGCGG-3′)和806r (5′- GGACTACHVGG GTWTCTAAT -3′)对提取合格的DNA样品进行PCR扩增.PCR扩增反应体系(20 μL): 5×FastPfu Buffer 4 μL, 2.5 mmol·L-1 dNTPs 2 μL, FastPfu Polymerase 0.4 μL, BSA0.2 μL, 上游引物 (50 μmol·L-1) 0.8 μL, 下游引物 (50 μmol·L-1)0.8 μL, 模板DNA10 ng, 加双蒸水至20 μL.PCR反应条件:95 ℃预变性3 min, 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃复性45 s, 27个循环, 最后72 ℃整体延伸10 min.
2.6 高通量测序及数据处理建库和测序工作委托上海美吉医药生物科技有限公司(上海, 中国)完成, 高通量测序是在Miseq (Illumina, 美国)测序平台上完成的.原始数据采用Mothur软件进行处理, 随后通过RDP (Cole et al., 2009) 进行分类, 数据分析方法根据Zhang等(2012) 提供的方法进行分析.
3 结果与讨论(Results and discussion) 3.1 A、B反应器中污泥形貌变化和厌氧氨氧化性能变化 3.1.1 A、B反应器中污泥形貌变化如图 1所示, A、B反应器接种的活性污泥和厌氧颗粒污泥分别为土黄色和黑色, 污泥形貌分别为絮状和颗粒.B反应器在启动过程中污泥变化情况如图 1中a、b、c所示, 从图中可以看出初始厌氧颗粒污泥颗粒较小, 颜色为黑色, 随着培养时间的增长, 小颗粒污泥比例减少, 大颗粒污泥和中颗粒污泥比例增加, 污泥颜色由原来的黑色转变为棕色;再随着培养时间的增长颗粒污泥粒径变化不大, 但污泥颜色由原来的棕色变为红褐色再到血红色颗粒污泥.图 1中d、e、f为活性污泥启动厌氧氨氧化的3个不同阶段, 从图中可以看出初始污泥为土黄色, 污泥呈现絮体形状, 随着培养时间增长反应器中出现片状絮体污泥, 污泥颜色呈现红褐色;到第70 d反应器中出现红色颗粒污泥, 随着培养时间增长到第119 d, 污泥呈现血红颗粒.厌氧氨氧化污泥因含有丰富的血红素而呈现红色(Molinuevo et al., 2009), 污泥颗粒的血红色深度可以表示厌氧氨氧化的活性.在第70 d时A反应器中出现明显的血红色片状污泥, B反应器中血红色不明显.而且在第119 d时A活性污泥反应器较B厌氧颗粒污泥反应器污泥颗粒血红色深.可以说明在70 d时A反应器中厌氧氨氧化活性大于B反应器, 同时在第119 d时A反应器中厌氧氨氧化富集丰度大于B反应器.
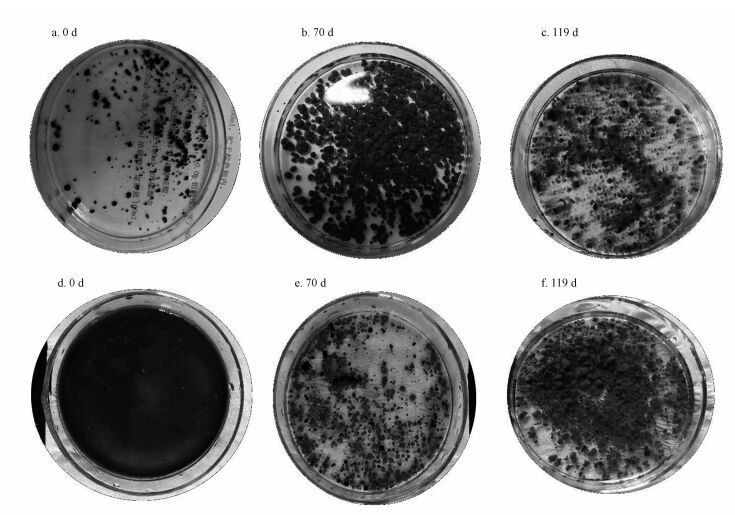 |
| 图 1 污泥的形态 (a 初始厌氧颗粒污泥;b 培养70 d厌氧颗粒污泥;c 以颗粒污泥为种泥培养成成熟的厌氧氨氧化颗粒污泥; d 初始活性污泥;e 培养70 d活性污泥;f 以活性污泥为种泥培养成成熟的厌氧氨氧化颗粒污泥) Fig. 1 Morphology of sludge |
根据氨氮的去除规律可将反应器启动分成4个阶段, 菌体自溶期(氨氮出水大于进水, 亚硝态氮基本除去)、活性停滞期(出水氨氮基本等于进水, 亚硝态氮出水升高)、活性提高期(氨氮和亚硝态氮同比例大幅度去除)和活性稳定期(氨氮和亚硝态氮都稳定去除且去除率都在90%以上)(唐崇俭等, 2011;张海芹等, 2015;Tang et al., 2009) .由图 2可以看出在培养初期出水氨氮明显大于进水氨氮, 亚硝酸盐去除率较大, 可以达到99%左右, 而且相较于A反应器(1~11 d), B反应器(1~17 d)阶段持续时间明显较长.Wouter等(Van der Star et al., 2007) 研究表明在此阶段厌氧氨氧化反应器中的主要反应为反硝化, 反应器中菌体自溶为反硝化提供充足的碳源, 亚硝酸盐以反硝化形式被去除, 所以亚硝酸盐的去除率较高.种泥中有机物溶解导致氨氮出现累积, 氨氮浓度升高.表明A、B反应器都进入到菌体自溶阶段.王毅力等(2009) 研究指出好氧活性污泥絮体的剪切稳定性比厌氧颗粒污泥更好, 所以厌氧颗粒表面的有机物更容易被溶解出来用于反应器中的反硝化反应.因此, 导致B反应器在菌体自溶阶段持续时间较A反应器时间长.随着培养时间的增长, A、B反应器氨氮出水浓度降低, 亚硝态氮出水浓度较上一阶段升高, 但A反应器在此阶段时间较短(12~27 d), 亚硝态氮出水浓度较菌体自溶阶段有微弱的升高(7.89 mg·L-1升高到21.81 mg·L-1), 氨氮出水浓度则明显降低(41.08 mg·L-1降低到15.15 mg·L-1).
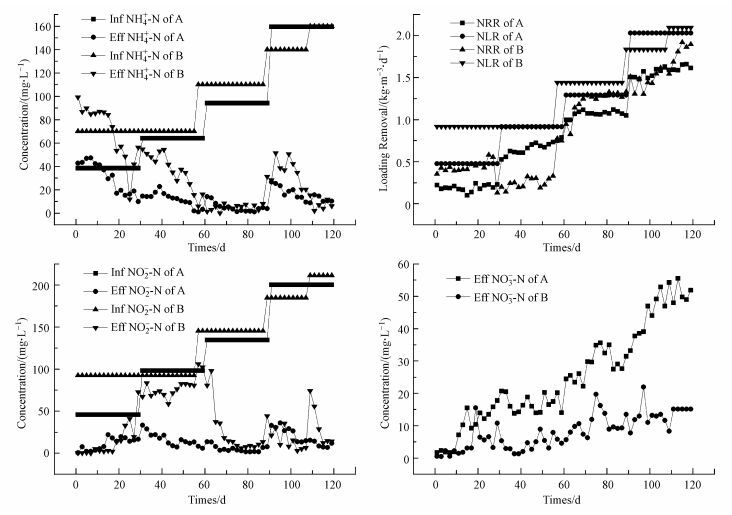 |
| 图 2 A、B反应器的厌氧氨氧化启动性能 (A 氨氮进出水浓度; B亚硝态氮进出水浓度;C硝态氮生成浓度;D氮去除率负荷, 氮容积负荷) Fig. 2 Performance of annommox start-up of A and B |
B反应器此阶段持续时间为(17~55 d), 亚硝态氮出水浓度较菌体自溶阶段明显增高 (2.27 mg·L-1升高到71.48 mg·L-1), 氨氮出水浓度则出现微弱的下降(73.94 mg·L-1降低到54.37 mg·L-1), 氨氮出水浓度的降低说明反应器中出现一定的厌氧氨氧化活性.但A反应器中氨氮的消耗量大于B反应器, 由图 2D和图 3可以看出A反应器中NO3--N产生量大于B反应器, A反应器中NO3--N/NH4+-N明显大于B反应器, 且B反应器中NO3-N产生量厌氧氨氧化反应理论值(0.26) .这说明A反应器的厌氧氨氧化活性大于B反应器, A反应器中反硝化活性仍然小于B反应器, 反硝化反应抑制了厌氧氨氧化活性, A反应器在此阶段持续时间为15 d, B反应器为38 d, A反应器在此阶段持续时间明显大于B反应器.此阶段为厌氧氨氧化的反应活性迟滞阶段.随着活性迟滞期阶段的结束, A (28~60 d)、B (56~90 d)反应器都出现了氨氮和亚硝态氮出水浓度的急剧下降, A氨氮的进水浓度由38 mg·L-1增加到64 mg·L-1, B氨氮进水浓度由70 mg·L-1增加到110 mg·L-1, 进水NH4+-N/NO2--N=1:1.32, 出水氨氮浓度都维持在5 mg·L-1以下, 亚硝态氮出水浓度维持在10 mg·L-1以下, A、B反应器的氮负荷分别为0.91 kg ·m-3·d-1和1.44 kg ·m-3·d-1(以氮计).此时氮负荷的增加促进厌氧氨氧化菌的富集, 表明反应器进入厌氧氨氧化活性增长阶段.随着氮负荷的进一步增加, A (60~110 d)、B (90~110 d) 两个反应器的进水氨氮浓度都增加到110 mg·L-1, 进水NH4+-N/NO2--N=1:1.32, A、B反应器氨氮和亚硝态氮的去除率都达到98%以上, A、B反应器的氮去除率负荷稳定为1.67 kg ·m-3·d-1和1.89 kg ·m-3·d-1, 表明A、B反应器都进入到活性稳定阶段.
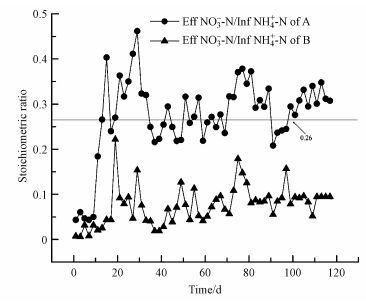 |
| 图 3 A、B反应器计量比 Fig. 3 The stoichiometric ratio of A and B |

|
(1) |
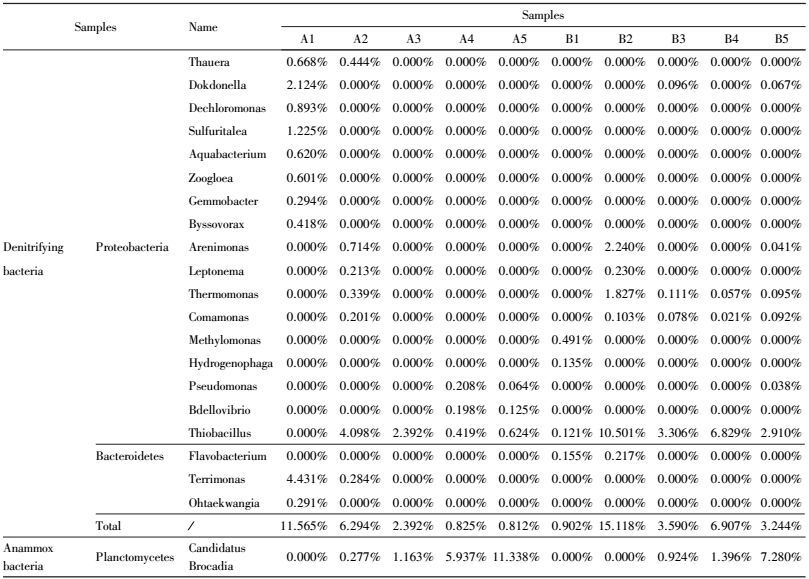
从图 4可以看出, A、B反应器中细菌群落结构多样性较为丰富, 在A、B两种不同接种污泥启动的反应器中Proteobacteria、Chloroflexi和Bacteroidetes为门水平上细菌种群结构丰度较高的细菌种类.随着厌氧氨氧化培养时间增加Planctomycetes丰度明显增加, A反应器中Planctomycetes的不同阶段丰度分别为0.44%、0.45%、1.18%、5.98%、11.39%, B反应器中Planctomycetes的不同阶段丰度为0.03%、0.04%、0.92%、1.41%、7.31%.从A、B两个反应器中不同阶段Planctomycetes丰度变化可以看出A反应器中在菌体自溶、活性迟滞期和活性提高期Planctomycetes的增长较B反应器快(A2、A3、A4;B2、B3、B4) .我们知道反硝化菌属在门水平上属于Proteobacteria和Bacteroidetes (Luo et al., 2013;Xia et al., 2008;Lu et al., 2014), 但同时A、B反应器Proteobacteria在菌体自溶(A2:35.37%和B2:42.89%)、活性迟滞(A3:19.09%和B3:18.33%)和活性提高阶段(A4: 12.80%和B4:11.86%)丰度相当, 但B反应器中Bacteroidetes的丰度(B2:10.63%、B3:4.02%和B4:2.23%)在此阶段明显高于A (A2:4.27%、A3:2.84%和A4:0.89%)反应器, 可以推断出B反应器中较高丰度的反硝化脱氮功能Bacteroidetes抑制了厌氧氨氧化菌Planctomycetes丰度的增长(Luo et al., 2013) .导致B反应器中厌氧氨氧化菌的活性受到抑制, 从而使相同时间内A反应器中厌氧氨氧化的丰度大于B反应器.A反应器中Chloroflexi由初始的1.37%增长到22.65%, Björnsson等研究表明 Chloroflexi在厌氧氨氧化污泥体系中起到支撑和骨架作用, 此外, Chloroflexi等丝状菌被认为是在厌氧造粒过程中起着重要的作用, 因为它们可能是形成小颗粒污泥的初始框架粒子, 作为颗粒污泥核心或载体(Björnsson et al., 2002) .因此A反应器中Chloroflexi丰度增长有助于污泥颗粒化形成.但在B反应器中Chloroflexi 的丰度会丰度由39.25%降低到23.64%随后又增长到48.37%.Chloroflexi门为异养的细菌会消耗有机物质如溶解性有机物(SMP)和胞外聚合物(EPS), 也有研究表明Chloroflexi参与到了降解一系列复杂的反应物中, 如多聚糖和蛋白质;在厌氧氨氧化反应器中Chloroflexi 主要消耗厌氧氨氧化菌衰老后产生的有机物(Kindaichi et al., 2012) .在厌氧氨氧化初期也会伴随着反硝化反应, 在B2、B3中Proteobacteria和Bacteroidetes中的丰度较高, 高丰度的Proteobacteria和Bacteroidetes反硝化菌消耗了反应器中大量的有机物, 导致Chloroflexi 可利用的有机物减少, Chloroflexi 的丰度会出现短暂的降低, 所以Chloroflexi 的丰度会由39.25%降低到23.64%.随着厌氧氨氧化活性增强, A、B反应器中Planctomycetes 的丰度增加, 反硝化菌门Proteobacteria和Bacteroidetes的减少, Chloroflexi可利用的有机物增加, Chloroflexi 的丰度又增加到48.37%.
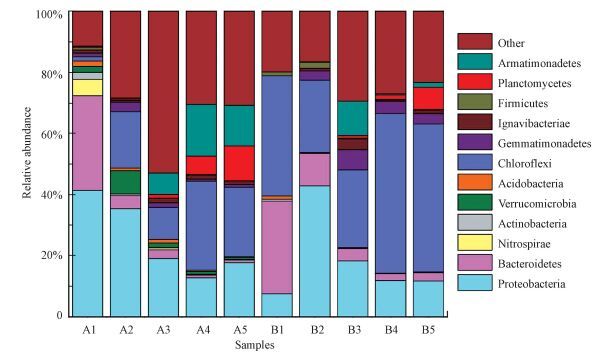 |
| 图 4 A、B反应器中污泥微生物在门水平上的群落结构 Fig. 4 Microbial community structure of sludge in A and B reactor |
图 5为A、B反应器中各阶段污泥样品的物种丰度热图, 对样本进行聚类分析, 样本菌群分布越类似则样本距离越近, 在聚类树中位置越靠近, 说明亲缘关系越近.A、B反应器在启动初期菌群(A1和B1) 差别较大, 随着反应器启动时间的增长, A、B反应器内菌群结构相似度增加(A5和B5), 同时也可以看出A、B反应器菌群演替情况, A反应器中样本A4和A5距离最近, 接着依次为A3、A2、A1, B反应器中B1和B2距离最近, B4和B5距离较近, B3与B4和B5距离较近, B1和B2与B3、B4、B5距离较远, 说明在B反应器中菌群结构变化大于A反应器, 但A、B反应器系统都逐渐向厌氧氨氧化系统演化, 并最终形成厌氧氨氧化反应菌群结构.
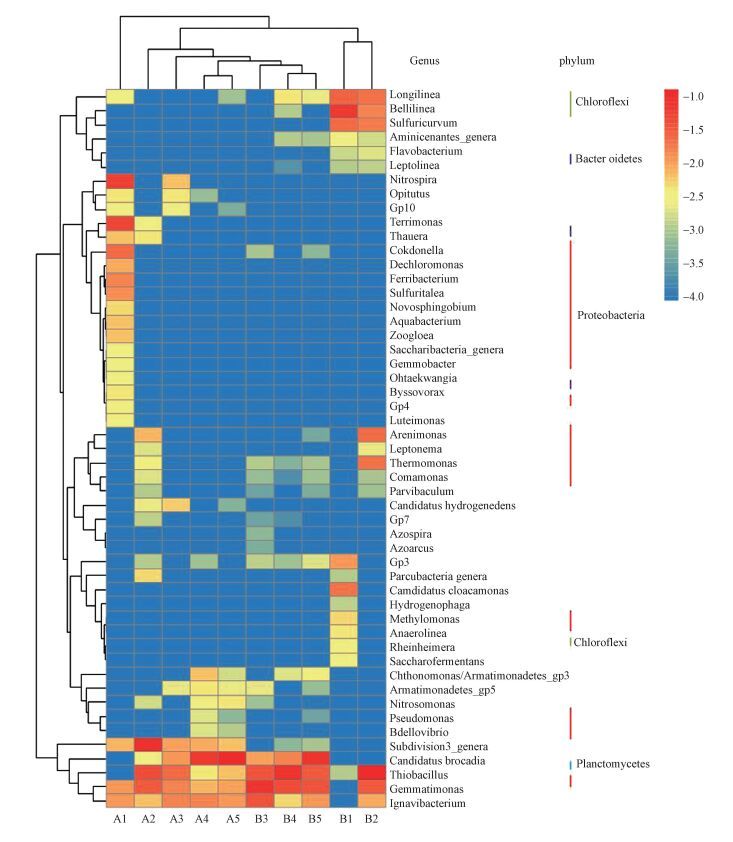 |
| 图 5 A、B反应器属水平上微生物群落结构变化 Fig. 5 Abundance of the major bacterial genera in the sludge samples of the A and B reactor |
由属水平上热图分析可知(图 5和表 4), 在属水平上A、B反应器中共检测到17种Proteobacteria反硝化菌属, 3种Bacteroidetes菌属(Lu et al., 2014; Heylen et al., 2007) .目前研究厌氧氨氧化菌共有5个属, 分别为Candidatus Brocadia, Candidatus Kuenenia, Candidatus Scalindua, Candidatus Anammoxoglobus 和 Candidatus Jettenia(Kuenen et al., 2008; Kartal et al., 2012), A、B反应器中厌氧氨氧化属均只检测到 Candidatus Brocadia.在属水平上检测到的菌群数量较少, 主要为反硝化菌属和厌氧氨氧化菌属, A反应器中反硝化菌原始丰度较高(11.57%), 在A2、A3、A 4、A5阶段反应器中反硝化菌的丰度(6.29%、2.39%、0.83%、0.81%)逐渐降低, 厌氧氨氧化菌Candidatus Brocadia的丰度逐渐增高(A1、A2、A3、A4、A5:0、0.28%、1.16%、5.94%、11.338%);在B反应器中反硝化菌的原始丰度为0.90%, 但随着培养时间的增长, 反硝化菌出现了短暂急剧增长过程(B2、B3、B4、B5:15.12%、3.59%、6.91%、3.24%), 厌氧氨氧化菌Candidatus Brocadia的增长速度相对于A反应器较慢(A1、A2、A3、A4、A5:0、0、0.92%、1.40%、7.28%), 这一结论进一步从属水平上说明了B颗粒污泥菌体自溶(A2、B2) 为反硝化菌增长提供了大量的有机物, 反硝化菌为异养菌, 倍增时间短, 导致反硝化菌的生长速率大于厌氧氨氧化速率(黄孝肖等, 2012), 反硝化的丰度急剧增高, 高丰度的反硝化菌抑制了厌氧氨氧化菌的增长, 所以在厌氧氨氧化培养过程中B颗粒污泥反应器菌体自溶阶段较A活性污泥明显.在活性迟滞阶段(A3、B3) A、B反应器中的反硝化菌丰度都进一步减少, B反应器的反硝化菌属丰度快速降低, 在这一阶段厌氧氨氧化菌属得到增长.随着培养时间的增加, 反硝化菌群(A4、A5;B4、B5) 的丰度进一步降低, 厌氧氨氧化菌群丰度增加, 但B反应器中反硝化菌群丰度大于A反应器, 说明颗粒污泥中可供利用的有机质的量较A活性污泥高, 特别是在厌氧氨氧化培养的初级阶段(菌体自溶和活性迟滞阶段), 高丰度的反硝化菌抑制了厌氧氨氧化的增长.
| 表 4 A、B反应器中反硝化菌属和厌氧氨氧化菌属比例 Table 4 Relative abundance of denitrifying genera and Anammox genera detected in the sludge samples by using 454 pyrosequencing |
1) 以活性污泥和厌氧颗粒污泥启动厌氧氨氧化工艺的过程中, A、B反应器都经历了菌体自溶、活性迟滞、活性提高和活性稳定4个阶段, 并成功启动厌氧氨氧化工艺;由于颗粒污泥的耐剪切性能不如活性污泥, 有机物在菌体自溶阶段大量释放, 导致B反应器在启动初期持续时间更长.
2) A、B反应器中门水平上反硝化主要菌群为Proteobacteria、Bacteroidetes, 厌氧氨氧化菌为 Planctomycetes, 在A、B反应器中菌体自溶和活性迟滞阶段Proteobacteria的丰度相当, 但B反应器中Bacteroidetes的丰度明显高于A反应器, 进一步说明在厌氧氨氧化启动过程中由于反硝化菌Bacteroidetes的抑制作用导致B颗粒污泥反应器在菌体自溶和活性迟滞阶段持续时间较A反应器长.
3) 在启动119 d, 其中A反应器中Candidatus Brocadia 丰度分别可以达到11.34%, 而B反应器中的丰度仅为7.28%, 相比较于厌氧颗粒污泥, 活性污泥在菌体自溶和活性迟滞阶段持续时间更短, 启动成功后丰度更高, 活性污泥更适用于启动厌氧氨氧化工艺.
| [${referVo.labelOrder}] | Björnsson L, Hugenholtz P, Tyson G W, et al. 2002. Filamentous Chloroflexi (green non-sulfur bacteria) are abundant in wastewater treatment processes with biological nutrient removalc[J]. Microbiology, 148(8): 2309–2318. DOI:10.1099/00221287-148-8-2309 |
| [${referVo.labelOrder}] | Cole J R, Wang Q, Cardenas E, et al. 2009. The Ribosomal Database Project: improved alignments and new tools for rRNA analysis[J]. Nucleic acids research, 37(suppl 1): D141–D145. |
| [${referVo.labelOrder}] | Chamchoi N, Nitisoravut S. 2007. Anammox enrichment from different conventional sludges[J]. Chemosphere, 66(11): 2225–2232. DOI:10.1016/j.chemosphere.2006.09.036 |
| [${referVo.labelOrder}] | 国家环境保护总局.2002.水和废水监测分析方法[M].(第四版).北京:中国环境科学出版社.88-284 |
| [${referVo.labelOrder}] | Haaijer S, van der Star W, Schmid M, et al. 2005. 10 years of research on the anaerobic oxidation of ammonium[J]. Biochem Soc Trans, 33: 119123. |
| [${referVo.labelOrder}] | 黄孝肖, 陈重军. 2102. 厌氧氨氧化与反硝化耦合反应研究进展[J]. 应用生态学报, 2102, 23(3): 849–856. |
| [${referVo.labelOrder}] | Joss A, Salzgeber D, Eugster J, et al. 2009. Full-scale nitrogen removal from digester liquid with partial nitritation and anammox in one SBR[J]. Environmental Science & Technology, 43(14): 5301–5306. |
| [${referVo.labelOrder}] | Kuenen J G. 2008. Anammox bacteria: from discovery to application[J]. Nature Reviews Microbiology, 6(4): 320–326. DOI:10.1038/nrmicro1857 |
| [${referVo.labelOrder}] | Kartal B, van Niftrik L, Keltjens J T, et al. 2012. Anammox—Growth physiology, cell biology, and metabolism[J]. Advances in microbial physiology, 60: 212. |
| [${referVo.labelOrder}] | Kindaichi T, Yuri S, Ozaki N, et al. 2012. Ecophysiological role and function of uncultured Chloroflexi in an anammox reactor[J]. Water Science and Technology, 66(12): 2556–2561. DOI:10.2166/wst.2012.479 |
| [${referVo.labelOrder}] | Heylen K, Vanparys B, Gevers D, et al. 2007. Nitric oxide reductase (norB) gene sequence analysis reveals discrepancies with nitrite reductase (nir) gene phylogeny in cultivated denitrifiers[J]. Environmental Microbiology, 9: 1072–1077. DOI:10.1111/emi.2007.9.issue-4 |
| [${referVo.labelOrder}] | Luo J, Liang H, Yan L, et al. 2013. Microbial community structures in a closed raw water distribution system biofilm as revealed by 454-pyrosequencing analysis and the effect of microbial biofilm communities on raw water quality[J]. Bioresource Technology, 148: 189–195. DOI:10.1016/j.biortech.2013.08.109 |
| [${referVo.labelOrder}] | Lu H, Chandran K, Stensel D, et al. 2014. Microbial ecology of denitrification in biological wastewater treatment[J]. Water Research, 64: 237–254. DOI:10.1016/j.watres.2014.06.042 |
| [${referVo.labelOrder}] | Mulder A, van de Graaf A A, Robertson L A, et al. 1995. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor[J]. FEMS Microbiology Ecology, 16(3): 177–183. DOI:10.1111/fem.1995.16.issue-3 |
| [${referVo.labelOrder}] | Molinuevo B, García M C, Karakashev D, et al. 2009. Anammox for ammonia removal from pig manure effluents: effect of organic matter content on process performance[J]. Bioresource Technology, 100(7): 2171–2175. DOI:10.1016/j.biortech.2008.10.038 |
| [${referVo.labelOrder}] | Strous M, Heijnen J J, Kuenen J G, et al. 1998. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms[J]. Applied Microbiology and Biotechnology, 50(5): 589–596. DOI:10.1007/s002530051340 |
| [${referVo.labelOrder}] | Strous M, Fuerst J A, Kramer E H M, et al. 1999a. Missing lithotroph identified as new planctomycete[J]. Nature, 400(6743): 446–449. DOI:10.1038/22749 |
| [${referVo.labelOrder}] | Strous M, Kuenen J G, Jetten M S M, et al. 1999b. Key physiology of anaerobic ammonium oxidation[J]. Applied and Environmental Microbiology, 65(7): 3248–3250. |
| [${referVo.labelOrder}] | Tang C, Zheng P, Mahmood Q, et al. 2009. Start-up and inhibition analysis of the Anammox process seeded with anaerobic granular sludge[J]. Journal of Industrial Microbiology & Biotechnology, 36(8): 1093–1100. |
| [${referVo.labelOrder}] | 唐崇俭. 2011. 厌氧氨氧化工艺特性与控制技术的研究 [D]. 杭州: 浙江大学博士论文. 31-39 |
| [${referVo.labelOrder}] | Van de Graaf A A, Mulder A, de Bruijn P, et al. 1995. Anaerobic oxidation of ammonium is a biologically mediated process[J]. Applied and Environmental Microbiology, 61(4): 1246–1251. |
| [${referVo.labelOrder}] | Van der Star W R L, Abma W R, Blommers D, et al. 2007. Startup of reactors for anoxic ammonium oxidation: experiences from the first full-scale anammox reactor in Rotterdam[J]. Water Research, 41(18): 4149–4163. DOI:10.1016/j.watres.2007.03.044 |
| [${referVo.labelOrder}] | Wang T, Zhang H, Gao D, et al. 2011. Enrichment of Anammox bacteria in seed sludges from different wastewater treating processes and start-up of Anammox process[J]. Desalination, 271(1): 193–198. |
| [${referVo.labelOrder}] | 王毅力, 黄承贵. 2009. 好氧污泥絮体与厌氧颗粒污泥的剪切稳定性分析[J]. 中国环境科学, 2009, 29(4): 380–385. |
| [${referVo.labelOrder}] | Xia Y, Kong Y, Thomsen T R, et al. 2008. Identification and ecophysiological characterization of epiphytic protein-hydrolyzing saprospiraceae (Candidatus Epiflobacter spp.) in activated sludge[J]. Applied & Environmental Microbiology, 74(7): 2229–2238. |
| [${referVo.labelOrder}] | Zhang T, Shao M F, Ye L, et al. 2012. 454 Pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants[J]. The ISME Journal, 6(6): 1137–1147. DOI:10.1038/ismej.2011.188 |
| [${referVo.labelOrder}] | 张海芹, 王翻翻, 李月寒, 等. 2015. 不同接种污泥 ABR 厌氧氨氧化的启动特征[J]. 环境科学, 2015(6): 2216–2221. |
 2017, Vol. 37
2017, Vol. 37