2. 福建师范大学湿润亚热带生态地理过程教育部重点实验室, 福州 350007;
3. 福建师范大学地理研究所, 福州 350007
2. Key Laboratory of Humid Subtropical Eco-geographical Process of the Ministry of Education, Fuzhou 350007;
3. Institute of Geography, Fujian Normal University, Fuzhou 350007
NI Jinzhi, E-mail:nijz@fjnu.edu.cn
三氯生(Triclosan, TCS)的化学名称为2, 4, 4′-三氯-2′-羟基二苯醚, 分子结构式见图 1, 其pKa值为8.14, 具有较高的辛醇-水分配系数(logKow=4.76), 在水中溶解度(25 ℃)较低, 为10 mg·L-1(Reiss et al., 2002;Ying et al., 2007).TCS是一种常见的广谱性杀菌剂和消毒剂, 广泛应用于制造香皂、牙膏、化妆品、洗发精等日化用品, 也常用于医疗用品和纺织品的消毒(Schweizer et al., 2001).研究发现, TCS的广泛应用使其不可避免地排放进入环境中, 在环境介质和生物体中TCS已被广泛检出(姚思睿等, 2015; Jongmun et al., 2010; Ying et al., 2007; Darius et al., 2003).此外, TCS还易于在生物体内富集(如藻类、鱼类、人体血液)(Melinda et al., 2007; Claudia et al., 2005; Margaretha et al., 2002), 同时可进一步破坏生物体内分泌系统的正常活动, 产生高毒性(Waller et al., 2009).由于TCS的高环境危害性, 因而迫切需要对其环境行为和处置方式进行深入研究.
 |
| 图 1 TCS的化学结构 Fig. 1 Chemical structure of triclosan |
生物炭(Biochar)是生物质在完全或部分缺氧的条件下热解( < 700 ℃)形成的一种固态的、难熔的、稳定的、高度芳香化的富含碳的材料(Verheijen et al., 2010; Lehmann et al., 2009).生物炭具有发达的孔隙结构和巨大的比表面积, 因此, 被广泛用于吸附环境中一系列不同类型的有机污染物, 如多环芳烃(PAHs)、多氯联苯(PCBs)和石油烃等(Zhou et al., 2005).制备生物炭的生物质原料多种多样, 如秸秆(Yuan et al., 2011)、木材(Reza et al., 2012)、稻壳(Graber et al., 2011)、刺果瓜(Rajapaksha et al., 2014)、动物粪便(袁金华等, 2011)、动物骨骼(Warren et al., 2009)等.互花米草(Spartina alterniflora)原产于大西洋西海岸及墨西哥湾, 由于人类有意引入或无意带入, 现在已成为全球海岸盐沼生态系统中最成功的入侵植物之一(Yang et al., 2009).自20世纪70年代末以来, 互花米草在我国广大的河口与沿海滩涂迅速引种, 取得了一定的生态和经济效益, 但也带来了一系列危害.许多国家正在将其作为入侵植物实施大范围的控制计划, 国家环保总局在2003年初公布了首批入侵我国的16种外来入侵种名单, 互花米草作为唯一的海岸盐沼植物名列其中(王卿等, 2006;邓自发等, 2006).如果以互花米草为原料来制备生物炭, 既可以对互花米草的入侵进行控制, 又可以为其资源化利用提供一条新途径.
由于生物炭具有较强的吸附性能, 将其添加到土壤中能够显著地影响有机污染物(如农药、多溴联苯醚、PAHs和PCBs)在土-水两相间的分配, 从而改变污染物的环境行为(Cornelissen et al., 2005).有关生物炭对TCS吸附方面的研究已有一些报道, 其对TCS的吸附主要受pH值、比表面积、阳离子交换量和零点电荷等因素影响(Oh et al., 2015;Tong et al., 2016).但相关研究主要是在水环境中进行的, 而土壤也是三氯生存在的重要汇, 由于土壤复杂的结构和性质, 使得生物炭添加的土壤与TCS发生作用的过程和机制也更为复杂, 值得研究.目前, 有关互花米草生物炭对污染物的吸附研究也有少量报道, 但主要是对水溶液中重金属Cu(Ⅱ)的去除研究(Li et al., 2013), 而有关互花米草生物炭对土壤中TCS环境行为的影响机制值得进一步探讨.因此, 本研究以互花米草为原料, 在300 ℃和600 ℃下将其热解制备成2种性质不同的生物炭, 研究生物炭添加的土壤对TCS的吸附行为, 探明生物炭影响土壤吸附TCS的机制, 同时为护花米草的资源化利用提供科学依据.
2 材料与方法(Materials and methods) 2.1 材料互花米草采自福州市闽江口鳝鱼滩湿地, 取回后剪成3~5 cm小段, 用自来水清洗3~5遍, 然后再用去离子水润洗3次, 放置于75~80 ℃的烘箱里烘干, 密封备用.供试土壤采自福州闽侯大学城黄壤表层土(0~20 cm), 新鲜土样采回后, 除去石子和植物残体, 然后取出一定量的土壤冻干粉碎过60目筛, 密封储存于干燥皿中备用.土壤的pH值为7.42, 有机碳和全氮的含量分别为7.48 g·kg-1和1.12 g·kg-1.土壤粒径组成中, 砂粒(>50 μm)含量为25.58%, 粉粒(2~50 μm)为47.93%, 黏粒( < 2 μm)为26.49%.TCS购自Sigma-Aldrich, 纯度为99%.
2.2 生物炭的制备利用管式炉(江苏前锦炉业, O-KTF1200) 制备生物炭.准确称取一定质量的互花米草原料置于真空管式炉中, 持续通入高纯N2, 使样品处于无氧环境, 再在设定的温度下热解2 h, 停止加热后, 待样品室温度降至常温, 将生物炭取出并称重计算生物炭的产率.生物炭粉碎过60目筛, 密封存储于棕色瓶中备用.在300 ℃和600 ℃的温度下制备的互花米草生物炭分别用BC300和BC600表示.
2.3 土壤和生物炭理化性质的测定 2.3.1 土壤理化性质的测定土壤总有机碳采用元素分析仪(Elementar Vario Max CN Germany)测定;土壤pH值用哈希pH计(配PHC301玻璃复合电极)测定, 水土比为2.5:1(V/m, mL/g);土壤粒径分布采用马尔文激光粒度仪2000型进行测定.
2.3.2 生物炭理化性质的测定称取0.50 g生物炭于石英舟中(2个重复), 置于马弗炉内, 在750 ℃下煅烧6 h, 烧制结束冷却到室温时取出, 称量灰分质量.BC300和BC600中C、H和N的百分含量用元素分析仪(ThermoFinnigan, Flash EA 1112) 测定, O元素含量由生物炭总量减去C、H、N元素和灰分的含量后计算得到.生物碳的红外谱采用KBr压片法, 傅里叶红外光谱分析仪(Thermo Nicolet 5700型)测定.生物炭的比表面积(SA)用NOVA-2000E表面分析仪测定, 计算BET-N2比表面积.
2.4 吸附实验吸附剂为BC600、BC300及添加生物炭的土壤, 其中, 土壤中生物炭的添加量分别为1.0%、2.0%和5.0%(质量分数).称取6份相同质量(10 g)的土壤样品于不同的玻璃离心管中, 分别称取不同量的生物炭(0.1、0.2和0.5 g)于相应的装有土壤的离心管中, 将离心管置于旋涡混合仪上振荡混合30 min, 保证生物炭和土壤颗粒充分混合均匀后, 密封避光保存备用.添加生物炭的土壤样品分别用1%BC300、2%BC300、5%BC300、1%BC600、2%BC600和5%BC600来表示.
吸附等温线采用批量平衡吸附实验的方法, 称取0.3 g吸附剂于40 mL棕色玻璃瓶中, 然后加入40 mL背景溶液(含0.01 mol·L-1 CaCl2的水溶液, pH值为7.07, 添加0.05 g·L-1的叠氮化钠来抑制微生物活性), 再用微量进样针加入不同初始浓度的TCS甲醇溶液(吸附体系中甲醇含量小于0.2%), 设置7个浓度点(0.5、1.0、2.0、4.0、5.0、6.0和8.0 mg·L-1), 每个浓度3个重复, 同时设置不添加吸附剂的空白组.样品瓶用聚四氟乙烯衬垫瓶盖密封, 置于(25.0±0.5) ℃恒温振荡箱中, 在120 r·min-1避光条件下振荡48 h(根据吸附动力学预实验结果, TCS在48 h时已达到表观吸附平衡).样品瓶取出后, 在2500 r·min-1下离心(湘仪H-1850R)10 min, 取1.0 mL上清液到2.0 mL的色谱瓶中待测.
2.5 TCS的分析与检测TCS的检测采用超高效液相色谱系统(Waters ACQUITY UPLCTM), UPLC紫外检测器, 色谱柱为Waters ACQUITY UPLCTM BEH C18柱(50 mm×2.1 mm, 1.7 μm);流动相为乙腈和超纯水(体积比为50:50);流速为0.3 mL·min-1, 检测波长为280 nm(周雪飞等, 2010), 柱温为40 ℃, 进样量为3.0 μL.TCS的浓度用外标法定量.
3 结果与讨论(Results and discussions) 3.1 生物炭的物理化学性质表 1为供试生物炭的理化性质.2种不同热解温度下制备的生物炭在产率、灰分、比表面积及C、H、N、O元素的质量分数等方面都存在明显差异, 其中, 产率大小为BC300>BC600, 比表面积、微孔面积大小排序为BC600>BC300, 说明随着热解温度的升高, 材料的裂解程度增加, 互花米草生物炭产率下降, 灰分增加, 孔隙结构逐渐发育, 表现为微孔逐渐增多, 孔隙度增大, 比表面积逐渐增大(陈再明等, 2013).
| 表 1 生物炭的性质 Table 1 Selected properties of biochar |
热解温度升高, 生物炭中C含量增加, 从39.32%(BC300) 上升到65.55%(BC600);相应的H、O含量则分别从3.08%和49.76%下降为2.19%和19.22%(表 1).H/C、O/C和(N+O)/C原子比常被用来表征有机质结构的芳香性、亲水性和极性大小(Chen et al., 2008).由表 1可知, 从BC300到BC600, 生物炭中H/C(0.08→0.03)、O/C(1.27→0.29) 和(N+O)/C(1.29→0.32) 的原子比都逐渐减小, 说明互花米草的升温裂解是一个炭化程度和芳香性逐渐增加, 而亲水性和极性不断减弱的过程.
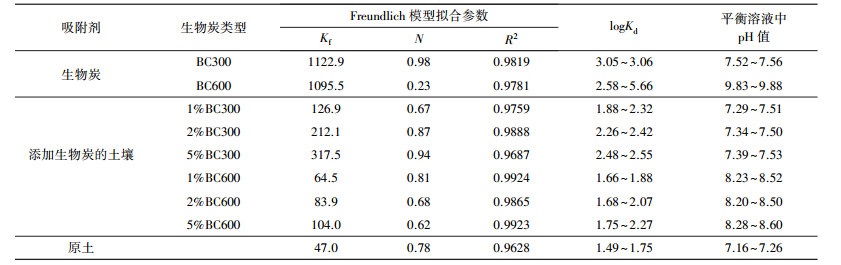
图 2是生物炭样品的傅里叶红外光谱图.3400 cm-1附近为酚羟基或醇羟基的O—H键伸缩振动吸收峰;2910 cm-1处为脂肪碳的甲基和亚甲基中C—H键伸缩振动吸收峰;2400~2100 cm-1处为C≡C和C≡N三键伸缩振动吸收峰;1675~1500 cm-1处为苯环CC双键伸缩振动吸收峰;在1100 cm-1处较大的峰为碳水化合物或多糖结构中的C—O键伸缩振动及无机物的Si—O键伸缩振动吸收峰;1000~650 cm-1处主要是与双键碳原子相连的C—H键弯曲振动吸收峰及脂类化合物C—C键伸缩振动吸收峰(郭兰等, 2015; Zhang et al., 2011; Qiu et al., 2008; Chun et al., 2004).由图 2还可知, BC300在3400、2910、2310和1600 cm-1处的吸收峰都明显高于BC600, 说明热解温度的升高, 生物炭中含氧官能团如羟基、羧基和羰基等几乎完全消失(Schmidt et al., 2000), 即极性官能团数量减少, 生物炭的疏水性增强, 炭化程度增加, 与元素分析的结果一致.
 |
| 图 2 生物炭红外光谱图 Fig. 2 FTIR spectra of biochar |
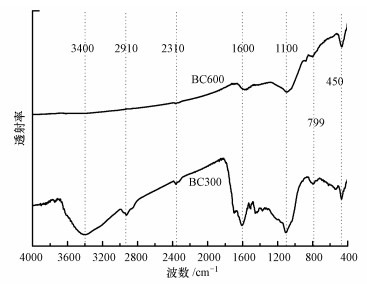
Freundlich吸附等温线模型是一种常用的等温线吸附模型, 本文采用Freundlich吸附等温线模型(式(1))对吸附数据进行拟合.
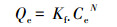
|
(1) |
式中, Qe为吸附平衡时吸附剂上TCS的吸附量(mg·kg-1);Ce为吸附平衡时水相中TCS的浓度(mg·L-1);Kf为Freundlich吸附系数(mg·kg-1·(mg·L-1)-1/N);N为拟合常数, 无量纲.N=1时为线性分配等温线, N < 1时为非线性等温线, N值越小表示等温线的非线性越大.Freundlich吸附等温线模型拟合的参数值见表 2, BC300和BC600对TCS吸附数据拟合的R2值为0.9781~0.9819, 说明Freundlich模型能很好地描述TCS在生物炭上的吸附行为.BC300和BC600的N值分别为0.98和0.23, 均小于1, 说明随着热解温度的升高, 生物炭对TCS的吸附非线性增强.生物炭吸附有机物的主要机理包括分配作用和表面吸附作用(Chen et al., 2008).分配作用表现为吸附等温线呈线性、非竞争吸附, 而表面吸附表现为非线性、竞争吸附.生物炭既含有“软碳”(无定形有机质)组分(吸附机理主要为分配作用), 又含有“硬碳”(致密芳香结构)组分(吸附机理主要为表面吸附作用).生物炭吸附有机污染物的主要机理是由这2种组分的相对含量决定的.一般来说, 随着生物炭制备温度的升高, 生物炭“软碳”含量逐渐减少, “硬碳”含量逐渐增加.生物炭的吸附机理从分配作用为主逐渐过渡到表面吸附为主, 等温吸附曲线也由线性逐渐过渡到非线性(石红蕾等, 2014; Chen et al., 2005).由表 2和图 3可以看出, BC300对TCS的吸附等温线趋于线性(N=0.98, 接近于1), 主要是因为BC300热解并不完全, 含有大量的未碳化有机质即“软碳”组分, 对TCS的吸附以分配作用为主;BC600对TCS的吸附等温线呈现较强的非线性(N=0.23, 远小于1), 是因为BC600热解完全, 以“硬碳”组分为主, 因而表面吸附作用占主导.
| 表 2 TCS的吸附等温线拟合参数 Table 2 Sorption isotherms parameters of triclosan |
 |
| 图 3 生物炭对TCS的吸附等温线(a.平衡吸附量, b.比表面积标准化吸附量) Fig. 3 Sorption isotherms of triclosan on biochar |
BC300和BC600对TCS吸附等温线见图 3a, 当TCS为低浓度时(Ce≤1 mg·L-1), 生物炭对TCS的吸附量为BC600>BC300;当TCS为较高浓度时(Ce> 1 mg·L-1), 吸附量为BC300>BC600.这主要是因为BC300对TCS的吸附以分配作用为主, 吸附呈线性增加;而BC600对TCS的吸附以表面吸附为主, 与表面吸附点位数量有关, 当吸附质的浓度较低时, 生物炭表面吸附点位充足, 吸附量也较大, 而当吸附质的浓度较高时, 由于表面吸附点位的限制, 以及吸附质间的竞争吸附, 导致吸附容量的增加趋势降低.Zhu等(2000)的研究也有相似的发现, 即在有机污染物浓度低的情况下, 表面吸附的贡献率要大于分配作用的贡献, 而在高浓度时, 则分配作用的贡献要更大一些.Chen等(2008)的研究也发现, 不同热解温度的秸秆生物炭, 对疏水性有机污染物的吸附机理可概括为以非炭化有机碳组分中的分配作用为主, 过渡到以炭化组分上的表面吸附为主.为进一步证明BC600对TCS的表面吸附作用, 对TCS在BC600和BC300上的吸附量进行了比表面积标准化处理(图 3b), 结果表明, 经比表面积标准化处理后, 所有平衡浓度下的比表面积标准化TCS吸附量都呈现BC300远远大于BC600.这主要是因为BC600对TCS的吸附以表面吸附为主, 特别是表面的物理吸附(疏水性作用和范德华力)为主, 比表面积越大, 吸附点位越多, 吸附量也越大.当吸附量经比表面积标准化后, BC600比表面积大小对TCS吸附的贡献作用被消除, 因而在实验所用的浓度下, 生物炭对TCS比表面积标准化的吸附量都表现为BC300>>BC600.
3.3 添加生物炭的土壤对TCS的吸附添加生物炭的土壤对TCS吸附数据的Freundlich模型拟合结果见表 2, R2值均大于0.96, 说明Freundlich模型能较好地描述TCS在添加生物炭的土壤上的吸附行为.拟合的N值为0.62~0.94, 均小于1, 表明添加不同比例生物炭的土壤对TCS的吸附存在不同程度的非线性.添加BC300土壤的N值为0.67~0.94, 且N值随BC300添加比例的增加而增大, 这是因为BC300中含有大量未炭化的有机质, 对TCS的吸附主要是分配作用, 所以随着BC300添加比例的增加, 土壤对TCS吸附的线性程度提高.添加BC600土壤的N值为0.62~0.81, 但N值随BC600添加比例的增加而减小, 这是因为BC600对TCS的吸附主要以表面吸附为主, 所以随着BC600含量的增加, 土壤对TCS吸附的非线性程度增强.
由表 2还可以看出, TCS在BC300和BC600生物炭上的logKd值分别为3.05~3.06和2.58~5.66, 是TCS在土壤中logKd值(1.49~1.75) 的2~3倍左右.向土壤中添加BC300和BC600生物炭都能显著促进土壤对TCS的吸附(表 2和图 4).同时,随着添加生物炭量的增加, 土壤对TCS的吸附量(Kf值、logKd值)也随之增加(表 2和图 4).
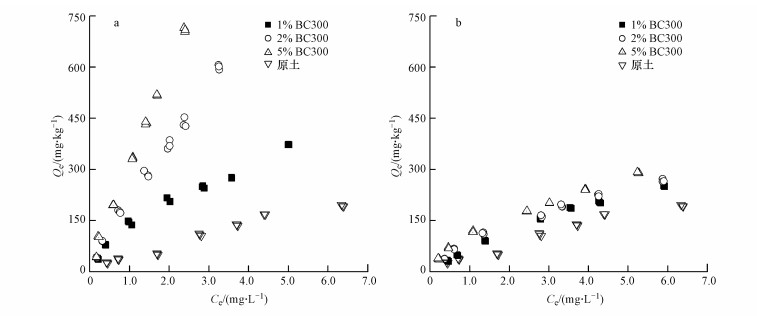 |
| 图 4 添加生物炭的土壤对TCS的吸附等温线(a.BC300, b.BC600) Fig. 4 Sorption isotherms of triclosan on soil with biochar addition |
比较图 4a和4b可以看出, 向土壤中添加相同比例的生物炭时, 添加BC300的土壤对TCS的吸附量都要高于添加BC600的土壤.由表 2可知, 在添加相同比例生物炭下, 添加BC300的土壤对TCS吸附的Kf和logKd值都大于相应的添加BC600的土壤.产生以上结果可能主要有以下3个方面的原因:① BC300对TCS的吸附主要是分配作用, 吸附量和吸附强度与溶液中TCS的浓度有关, 受外界竞争吸附的影响较小;而BC600虽然有较大的比表面积, 但吸附点位数量是固定的, 由于土壤中的有机小分子可以与TCS竞争生物炭上的吸附点位, 从而降低了生物炭对TCS的吸附(在生物炭-水体系中, 低浓度的TCS在BC600上的吸附量要大于BC300(图 3), 而添加BC300的土壤对TCS的吸附量都高于添加BC600的土壤); ② BC300的H/C、O/C、(O+N)/C比都大于BC600(表 1), 说明BC300表面极性更强, 有利于对极性化合物TCS的吸附;此外, BC300表面的官能团(羟基、羧基等)要远远大于BC600, 能够促进BC300对TCS的化学吸附(氢键、电子供受体的形成), 因此, 也导致了添加BC300的土壤对TCS的吸附强于添加BC600的土壤.③ pH值是影响离子型有机物吸附的一个重要因素, 当溶液pH高于TCS的pKa值(8.14) 时, 阴离子态TCS占多数;而在pH < pKa的环境中, 分子态TCS占多数(Wu et al., 2009; Trenholm et al., 2006).由表 1可得,BC600的pH值为9.88,明显高于BC300的7.80, 且在吸附试验过程中, 添加BC300土壤溶液的pH值为7.29~7.53, 要远小于8.14, TCS主要以分子态存在, 对分配作用影响不大;而添加BC600土壤溶液的pH值为8.20~8.60, 都高于TCS的pKa值, TCS主要以负电荷离子态存在, 而生物炭表面的羧基、酚羟基等也会失去质子带负电荷, 从而抑制生物炭对TCS的吸附.
4 结论(Conclusions)1) 高温(600 ℃)制备的护花米草生物炭有利于低浓度(Ce≤1 mg·L-1)TCS的吸附, 且以表面吸附为主, 比表面积大小是影响吸附量的主要因素;低温(300 ℃)制备的护花米草生物炭有利于高浓度(Ce> 1 mg·L-1)TCS的吸附, 且以分配作用为主, 生物炭内未炭化有机质的含量是影响吸附量的主要因素.
2) 互花米草生物炭的添加能够促进土壤对TCS的吸附, 且吸附量随生物炭添加比例的增加而增加;添加300 ℃制备生物炭的土壤对TCS的吸附要强于添加600 ℃制备生物炭的土壤, 主要是受到生物炭内未炭化有机质、表面官能团及pH值的影响.
3) 低温制备的护花米草生物炭能够有效地促进土壤对TCS的吸附, 为降低土壤中TCS的生物有效性提供一条可行的方法, 同时也为入侵物种护花米草的资源化利用提供一种有效途径.
| [${referVo.labelOrder}] | Claudia C, Carmela C, Roberto L G, et al. 2005. Application of methods for assessing the geno and cyto toxicity of triclosan to C.ehrenbergii[J]. Journal of Hazardous Materials, 122(3): 227–232. DOI:10.1016/j.jhazmat.2005.03.002 |
| [${referVo.labelOrder}] | Cornelissen G, Gustafsson O, Bucheli T D, et al. 2005. Extensive sorption of organic compounds to black carbon, coal, and kerogen in sediments and soils:Mechanisms and consequences for distribution, bioaccumulation, and biodegradation[J]. Environmental Science and Technology, 39(18): 6881–6895. DOI:10.1021/es050191b |
| [${referVo.labelOrder}] | Chen B L, Zhou D D, Zhu L Z, et al. 2008. Soption characteristics and mechanisms of organic contaminant to carbonaceous biosorbents in aqueous solution[J]. Science in China Series B:Chemistry, 51(6): 464–472. |
| [${referVo.labelOrder}] | Chun Y, Sheng G Y, Chou C T, et al. 2004. Compositions and sorptive properties of crop residue-derived chars[J]. Environmental Science and Technology, 38(17): 4649–4655. DOI:10.1021/es035034w |
| [${referVo.labelOrder}] | Chen B L, Johnson E J, Chefetz B, et al. 2005. Sorption of polar and nonpolar aromatic organic contaminants by plant cuticular materials:the role of polarity and accessibility[J]. Environmental Science and Technology, 39(16): 6138–6146. DOI:10.1021/es050622q |
| [${referVo.labelOrder}] | 陈再明, 陈宝梁, 周丹丹. 2013. 水稻秸秆生物炭的结构特征及其对有机污染物的吸附性能[J]. 环境科学学报, 2013, 33(1): 9–19. DOI:10.11654/jaes.2013.01.002 |
| [${referVo.labelOrder}] | Darius S, Simon F W, Armin H, et al. 2003. Environmental fate of triclosan in the River Aire Basin, UK[J]. Water Resources Research, 37(13): 3145–3154. DOI:10.1016/S0043-1354(03)00164-7 |
| [${referVo.labelOrder}] | 邓自发, 安树青, 智颖飙, 等. 2006. 外来种互花米草入侵模式与爆发机制[J]. 生态学报, 2006, 26(8): 2678–2686. |
| [${referVo.labelOrder}] | Graber E, Tsechansky L, Khanukov J, et al. 2011. Sorption, volatilization, and efficacy of the fumigant 1, 3-dichloropropene in a biochar-amended soil[J]. Soil Science Society, 75(4): 1365–1373. DOI:10.2136/sssaj2010.0435 |
| [${referVo.labelOrder}] | 郭兰, 魏然, 倪进治, 等. 2015. 生物炭添加对土壤中菲吸附行为的影响[J]. 亚热带资源与环境学报, 2015, 10(2): 32–38. |
| [${referVo.labelOrder}] | Jongmun C, Alison M C. 2010. Triclocarban and triclosan biodegradation at field concentrations and the resulting leaching potentials in three agricultural soils[J]. Chemosphere, 81: 494–499. DOI:10.1016/j.chemosphere.2010.07.040 |
| [${referVo.labelOrder}] | Lehmann J, Joseph S M. 2009. Biochar for environmental management:science and technology[J]. Forest Policy and Economics, 11: 535–536. DOI:10.1016/j.forpol.2009.07.001 |
| [${referVo.labelOrder}] | Li M, Liu Q, Guo L J, et al. 2013. Cu(Ⅱ)removal from aqueous solution by Spartina alterniflora derived biochar[J]. Bioresource Technology, 141: 83–88. DOI:10.1016/j.biortech.2012.12.096 |
| [${referVo.labelOrder}] | Melinda A C, Regina E E, Thomas W L, et al. 2007. Algal bio-accumulation of triclocarban, triclosan and methyl-triclosan in a North Texas wastewater treatment plant receiving stream[J]. Chemosphere, 67(10): 1911–1918. DOI:10.1016/j.chemosphere.2006.12.027 |
| [${referVo.labelOrder}] | Margaretha A E, Petersson M, Jari P, et al. 2002. Triclosan, acommonly used bactericide found in human milk and in the aquatic environment in Sweden[J]. Chemosphere, 46(9): 1485–1489. |
| [${referVo.labelOrder}] | Oh S Y, Seo Y D. 2015. Sorption of halogenated phenols and pharmaceuticals to biochar:affecting factors and mechanisms[J]. Environmental Science Pollutant Resource, 356(15): 4201–4208. |
| [${referVo.labelOrder}] | Qiu Y P, Cheng H Y, Xu C, et al. 2008. Surface characteristics of crop-residue-derived black carbon and lead(Ⅱ) adsorption[J]. Water Resources Research, 42: 567–574. DOI:10.1016/j.watres.2007.07.051 |
| [${referVo.labelOrder}] | Reiss R, Mackay N, Habig C, et al. 2002. An ecological risk assessment for triclosan in lotic systems following discharge from waste water treatment plants in the United States[J]. Environmental Toxicology and Chemistry, 21(11): 2483–2492. DOI:10.1002/etc.v21:11 |
| [${referVo.labelOrder}] | Reza M T, Lynam J G, Vasquez V R, et al. 2012. Pelletization of biochar from hydrothermally carbonized wood[J]. Environmental Progress and Sustainable Energy, 31(2): 225–234. DOI:10.1002/ep.v31.2 |
| [${referVo.labelOrder}] | Rajapaksha A U, Vithanage M, Lim J E, et al. 2014. Invasive plant-derived biochar inhibits sulfamethazine uptake by lettuce in soil[J]. Chemosphere, 111: 500–504. DOI:10.1016/j.chemosphere.2014.04.040 |
| [${referVo.labelOrder}] | Schweizer H P. 2001. Triclosan:A widely used biocide and its link to antibiotics[J]. FEMS Microbiology Letters, 202(1): 1–7. DOI:10.1111/fml.2001.202.issue-1 |
| [${referVo.labelOrder}] | Schmidt M W I, Noack A G. 2000. Black carbon in soils and sediments:Analysis, distribution, implications, and current challenges[J]. Global Biogeochemical Cycles, 14(3): 777–793. DOI:10.1029/1999GB001208 |
| [${referVo.labelOrder}] | 石红蕾, 周启星. 2014. 生物炭对污染物的土壤环境行为影响研究进展[J]. 生态学杂志, 2014, 33(2): 486–494. |
| [${referVo.labelOrder}] | Tong Y R, Mayer B K, McNamara P J. 2016. Triclosan adsorption using wastewater biosolids-derived biochar[J]. Water Research and Technology, 2(4): 1039–1049. |
| [${referVo.labelOrder}] | Trenholm R A, Vanderford B J, Holady J C, et al. 2006. Broad range analysis of endocrine disruptors and pharmaceuticals using gas chromatography and liquid chromatography tandem mass spectrometry[J]. Chemosphere, 65: 1990–1998. DOI:10.1016/j.chemosphere.2006.07.004 |
| [${referVo.labelOrder}] | Verheijen F G A, Jeffery S, Bastos A C, et al.2010.Biochar application to soils:A critical scientific review of effects on soil properties, processes and functions[R].978-92-79-14293-2.Ispra:Europen Commission, Joint Research Centre Institute for Environment and Sustainability. |
| [${referVo.labelOrder}] | Waller N J, Kookana R S. 2009. Effect of triclosan on microbial activity in Australian soils[J]. Environmental Toxicology and Chemistry, 28: 65–70. DOI:10.1897/08-224.1 |
| [${referVo.labelOrder}] | Warren G P, Robinson J S, Someus E. 2009. Dissolution of phosphorus from animal bone char in 12 soils[J]. Nutrient Cycling in Agroecosystems, 84(2): 167–178. DOI:10.1007/s10705-008-9235-6 |
| [${referVo.labelOrder}] | 王卿, 安树青, 马志军, 等. 2006. 入侵植物互花米草—生物学、生态学及管理[J]. 植物分类学报, 2006, 44(5): 559–588. |
| [${referVo.labelOrder}] | Wu C, Spongberg A L, Witter J D. 2009. Adsorption and degradation of triclosan and triclocarban in solis and biosolids-amended soils[J]. Agricultural and Food Chemistry, 57(11): 4900–4905. DOI:10.1021/jf900376c |
| [${referVo.labelOrder}] | Ying G G, Yu X Y, Kookana R S. 2007. Biological degradation of triclocarban and triclosan in a soil under aerobic and anaerobic conditions and comparison with environmental fate modelling[J]. Environment Pollution, 150(3): 300–305. DOI:10.1016/j.envpol.2007.02.013 |
| [${referVo.labelOrder}] | Ying G G, Rai S K. 2007. Triclosan in wastewaters and biosolids from Australian wastewater treatment plants[J]. Environment International, 33(2): 199–205. DOI:10.1016/j.envint.2006.09.008 |
| [${referVo.labelOrder}] | Yuan J H, Xu R K, Zhang H. 2011. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 102(3): 3488–3497. DOI:10.1016/j.biortech.2010.11.018 |
| [${referVo.labelOrder}] | Yang S G, Li J H, Zheng Z, et al. 2009. Characterization of Spartina alterniflora as feedstock for anaerobic digestion[J]. Biomass and Bioenergy, 33: 597–602. DOI:10.1016/j.biombioe.2008.09.007 |
| [${referVo.labelOrder}] | 姚思睿, 魏然, 倪进治, 等. 2015. 福州内河沉积物中三氯生和甲基三氯生的含量、来源及其生态风险[J]. 环境科学学报, 2015, 35(8): 2519–2525. |
| [${referVo.labelOrder}] | 袁金华, 徐仁扣. 2011. 生物质炭的性质及其对土壤环境功能影响的研究进展[J]. 生态环境学报, 2011, 20(4): 779–785. |
| [${referVo.labelOrder}] | 周雪飞, 陈家斌, 周世兵, 等. 2010. 三氯生检测方法的建立与优化[J]. 中国给水排水, 2010, 26(12): 126–129. |
| [${referVo.labelOrder}] | Zhou Q X, Sun F H, Liu R. 2005. Joint chemical flushing of soils contaminated with petroleum hydrocarbons[J]. Environment International, 31: 835–839. DOI:10.1016/j.envint.2005.05.039 |
| [${referVo.labelOrder}] | Zhang G, Zhang Q, Sun K, et al. 2011. Sorption of simazine to corn straw biochars prepared at different pyrolytic temperatures[J]. Environmental Pollution, 159(10): 2594–2601. DOI:10.1016/j.envpol.2011.06.012 |
| [${referVo.labelOrder}] | Zhu L Z, Chen B L. 2000. Sorption behavior of p-nitrophenol on the interface between anion-cation organobentonite and water[J]. Environmental Science and Technology, 34(14): 2997–3002. DOI:10.1021/es991460z |
 2017, Vol. 37
2017, Vol. 37