现阶段工业废气中挥发性有机化合物(Volatile Organic Compounds, VOCs)具有复合性、污染面广、毒害性强等特点, 它的有效处理一直是国内外工业废气净化领域的研究热点.相比传统的化学或物理方法(如焚烧法、吸收法等), 生物法利用微生物代谢活动降解污染物, 将其转化为CO2和H2O, 具有低成本和无二次污染的优点显示了它的良好应用前景(Rene et al., 2015; 聂国锋等, 2017).
生物法处理VOCs多为细菌.由于细菌适宜在湿润的环境中生长, 并且其细胞表面疏水性不高, 因此难以有效处理疏水性VOCs.此外, 对于那些降解过程中易产酸的VOCs, 细菌活性也会受到很大的影响(Lebrero et al., 2010; 陆李超等, 2014).真菌在干燥弱酸性的环境中较细菌具有更好的适应能力, 尤其是丝状真菌, 由于它可生长出比表面积较大的菌丝体, 易捕捉气相中的疏水性VOCs, 渐渐成为了VOCs生物处理技术中另一大类重要的微生物(Arriaga et al., 2005; Aizpuru et al., 2005; Vergara Fernández et al., 2008; García Peña I et al., 2008; Rene et al., 2012; Estrada et al., 2013).
高效复合菌剂作为一种生物强化技术, 能有效提高有毒有害物质的净化效果, 加快生物处理系统的启动, 提高容积负荷并改善系统运行性能(Chen et al., 2010).近年来, 国内外有不少对复合菌剂的研究.Janbandhu等(2011)利用Sphingobacterium sp., Bacillus cereus及一株新的Achromobacter菌株构建了菌剂, 14 d内, 对100 mg·L-1初始浓度的多环芳烃降解效率达到了100%.胡志航(2010)研发了具有较好稳定性的复合菌剂, 对二氯甲烷的去除能力可在常温下稳定保存30 d, 4 ℃下保存60 d甚至更长.杨卫兵(2010)分别以复合细菌菌剂和传统活性污泥启动生物滴滤塔净化苯、甲苯和邻二甲苯, 菌剂启动的反应器在第7 d就完成挂膜, 而活性污泥第24 d才完成挂膜, 明显缩短了传统生物滴滤塔的启动周期.
已报道的复合菌剂通常是由单一细菌构成, 还未有同时利用真菌和细菌构建菌剂的研究报道.本研究从已筛选获得的真菌与细菌中挑选菌株3株, 它们分别是降解α-蒎烯、乙酸丁酯和邻二甲苯的高效降解菌.3种化合物分属于不同类型的VOCs, 代表了烃类、酯类和芳香烃, 且它们也是木材加工业等行业排放废气的常见组分(Jin et al., 2006; 孙英等, 2015; 周学霞等, 2013).首先研究了3株菌共存时对底物的降解特性, 并将其接种于载体材料上, 经固体发酵制备获得真菌-细菌复合菌剂.考察菌剂对于混合VOCs的降解性能及储藏稳定性, 开展生物反应器的研究, 以期为该复合菌剂的工程化应用提供技术支撑.
2 材料方法(Materials and methods) 2.1 实验材料 2.1.1 菌株来源乙酸丁酯降解菌Aspergillus fumigates HD2、邻二甲苯降解菌Zoogloea resiniphila HJ由本实验室筛选获得, α-蒎烯降解菌Ophiostoma stenoceras LLC由西班牙拉科鲁尼亚大学的Kennes Christian教授赠予(Jin et al., 2007).以上菌株目前都保存在中国典型培养物保藏中心(中国武汉), 保藏编号分别为CCTCC No. M 2014531, No. M 2014175和No. M 2012235.其中, Aspergillus fumigates HD2和Ophiostoma stenoceras LLC为真菌, Zoogloea resiniphila HJ为细菌.
2.1.2 培养基无机盐培养基组分为NH4Cl 2.0 g·L-1、KH2PO4 4.5 g·L-1、K2HPO4 0.5 g·L-1、MgSO4·7H2O 0.1 g·L-1, 微量元素溶液2 mL·L-1.蒸馏水定容到1000 mL, pH值调至5.5, 110 ℃高温蒸汽灭菌40 min.
微量元素母液配方为FeCl3 120 mg·L-1、H3BO3 50 mg·L-1、CuSO4·5H2O 10 mg·L-1、KI 10 mg·L-1、MnSO4·4H2O 45 mg·L-1、Na2MoO4·2H2O 20 mg·L-1、ZnSO4·7H2O 75 mg·L-1、CoCl2·6H2O 50 mg·L-1、KAl(SO4)2·12H2O 20 mg·L-1、CaCl2·2H2O 13.25 mg·L-1、NaCl 10 mg·L-1.
土豆培养基(PDA)组分为土豆200 g·L-1、葡萄糖20 g·L-1、琼脂18 g·L-1.121 ℃高温蒸汽灭菌20 min.
LB培养基组分为蛋白胨10 g, 酵母膏5 g, NaCl 10 g, 蒸馏水1 L, 琼脂18 g, pH调至7.0~7.2, 121 ℃灭菌20 min.
2.1.3 实验仪器与试剂试剂:α-蒎烯, 乙酸丁酯, 邻二甲苯, 均为分析纯; 真菌DNA提取试剂盒, 细菌DNA提取试剂盒, 荧光定量PCR试剂盒, 均由美国Roche公司提供.
主要仪器:Agilent 6890气相色谱仪(美国安捷伦公司), LDZX-40SBI型立式自动电热压力蒸汽灭菌锅(上海申安医疗器械厂), LRH-250型生化培养箱(上海一恒科学仪器有限公司), DGG-9140A型电热恒温鼓风干燥箱(上海森信实验仪器有限公司), Lighter Cycler 96型荧光定量PCR仪(美国Roche公司), 752N型紫外可见分光光度计(上海仪电分析仪器有限公司).
2.2 混菌与单菌降解单一底物特性比较每一个底物设置两组, 其中一组接种单一菌, 另一组接种混合菌.摇瓶装液量为50 mL无机盐营养液, 菌株接种量相同, 并加入相应底物(每种底物初始浓度均保持在120 mg·L-1左右), 密封后置于30 ℃、160 r·min-1条件下培养, 每隔一定时间测定底物的降解效果和生物量.每组设置平行样和空白对照.
2.3 菌剂构建根据菌株对碳源及载体吸附特性的需求, 将麦麸、木屑和活性炭按质量比为1:2:1混合作为菌剂的载体(Li et al., 2015; Chen et al., 2016).
菌株活化后, 采用高密度发酵技术进行菌种扩培, 由于3株菌的生长特性不同, 扩培方法也不同.其中菌株Ophiostoma stenoceras LLC和Zoogloea resiniphila HJ采用发酵罐进行发酵培养, 对应的碳源分别为α-蒎烯和邻二甲苯.发酵期间, 控制发酵培养液pH和底物浓度, 从而保障活性菌体的数量.培养结束后, 将上述发酵培养液离心后获得菌体, 按质量比为1:1混合均匀后, 接种至灭过菌的固态发酵培养基(由麦麸、木屑和粉末活性炭组成), 并加入灭菌过的营养液(由酵母提取物、马铃薯和NaCl组成)进行固态发酵, 发酵温度为30 ℃, 发酵时间为48 h.固态发酵结束后, 将所得产物35 ℃下真空干燥后待用.菌株Aspergillus fumigates HD2活化后接种至加有乙酸丁酯的平板培养基, 培养3~5 d后获得大量孢子.将干燥获得的固态发酵产物和菌株Aspergillus fumigates HD2的孢子以一定的质量比混合均匀后, 即得真菌-细菌复合菌剂.整个制备流程如图 1所示.
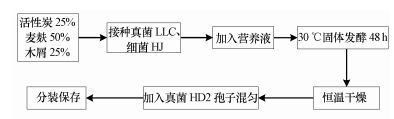 |
| 图 1 真菌-细菌复合菌剂制备流程示意图 Fig. 1 Schematic process of development of fungi-bacteria composite agent |
取0.5 g制备的复合菌剂接种于50 mL含α-蒎烯、乙酸丁酯和邻二甲苯的无机盐培养液中, 并以3株菌的混合活菌液作为对照, 测定它们对于混合底物的降解效果, 每一培养体系中生物量控制一致.每一种底物设置采用浓度递增的方式, 由60 mg·L-1增至120 mg·L-1和180 mg·L-1, 确保前一浓度的底物已降解完全后再提升底物浓度.当底物总浓度540 mg·L-1降解完全后, 停止添加底物, 进行饥饿期考察, 7 d后添加浓度均为180 mg·L-1的3种底物, 测定复合菌剂的降解性能恢复情况.实验需设置平行样和空白对照.
2.5 菌剂储存稳定性实验将制备好的菌剂在常温(25±5)℃和4 ℃下保存, 分别在0、7、30、90和180 d取0.5 g菌剂接种于灭过菌的无机营养液中.经过24 h活化后添加3种底物, 每种底物的初始浓度均在120 mg·L-1.将摇瓶置于30 ℃, 160 r·min-1的摇床上振荡培养, 每隔24 h测定其底物降解情况, 考察菌剂的储存稳定性.
2.6 菌剂与活性污泥接种反应器的运行性能比较选择火山岩作为填料, 其特性为孔隙发达、吸附性能良好、机械强度高且易于再生.由于填料对α-蒎烯, 乙酸丁酯及邻二甲苯具有吸附作用, 为了消除在实验中吸附作用对实验效果产生的影响, 在反应器添加填料后通入总浓度为300 mg·m-3混合废气(每一种底物浓度100 mg·m-3), 待进出口浓度基本保持一致后对反应器进行接种挂膜.
实验设置两个生物过滤塔, 内径65 mm, 填料层高度为35 cm.接种复合菌剂的记为1号塔, 接种物由生物量1:1的复合菌剂和驯化后的活性污泥混合而成; 仅接种活性污泥的记为2号塔, 接种物为生物量与1号塔相同的活性污泥.在反应器运行阶段, 采用间歇喷淋营养液, 每隔3 d喷淋1次.挂膜启动阶段, 总废气停留时间为60 s, 每一种底物浓度为80~100 mg·m-3.稳定运行阶段, 总废气停留时间为60 s, 每一种底物浓度为110~120 mg·m-3.
2.7 检测与分析方法 2.7.1 底物定量分析α-蒎烯、乙酸丁酯和邻二甲苯定量分析采用气相色谱(Agilent 6890) 分析, 气相色谱条件:色谱柱为HP-Innowax毛细管柱(30 m×0.32 mm×0.5 μm).进样口温度、检测器(FID)和柱温分别为210、200、90 ℃,色谱柱流量:1 mL·min-1, 进样量:800 μL, 载气:N2, 总流量:33.4 mL·min-1, 分流比((分流流速+柱体积流速):柱体积流速)为15:1, 氢气流:40 mL·min-1, 空气流量:450 mL·min-1.
2.7.2 菌群结构分析采用荧光定量PCR技术分析混合菌群中每株菌的生长情况.引物采用真菌通用引物、细菌通用引物和HD2特异性引物, 其上游引物分别为5′-TCCTCCGCTTATTGATATGC-3′, 5′-ACTCCTACGGGAGGCAGCAG-3′和5′-TCGGCGGGC CCGCCGTTTC-3′, 下游引物分别为5′-GGAAGT AAAAGTCGTAACAAGG-3′, 5′-ATTACCGCGGCTGC TGG-3′和5′-ACTGAATTCTGCAATTCACATTA-3′.PCR反应条件为95 ℃预变性10 min, 40个循环(95 ℃变性15 s, 60 ℃退火60 s, 72 ℃延伸15 s, 62 ℃荧光检测3 s).将获得的生物量(蛋白浓度)及与其对应的Cq值(由荧光定量PCR实验获得)建立标准曲线(表 1), 并根据实验测定的蛋白量来换算菌株的生物量.
| 表 1 生物量与Cq值关系标准曲线 Table 1 Standard curve of relation between biomass and Cq value |
蛋白质浓度采用Folin-酚法测定(胡俊等, 2012).乙液由上海荔达生物科技有限公司提供.每次测量前需临时配备甲液, 将4%的碳酸钠与0.2 mol·L-1的氢氧化钠等体积混合后为A液, 1%的硫酸铜和2%的酒石酸钾钠等体积混合后为B液, 最后将A、B液按50:1的体积比混合即得甲液.测样时, 先加入甲液5 mL和待测液1 mL, 混合后25 ℃水浴10 min, 再加入0.5 mL乙液, 立即混匀, 25 ℃下水浴30 min, 在700 nm波长下测其OD值.
3 结果与讨论(Results and discussion) 3.1 混菌与单菌降解单一底物特性比较在构建复合菌剂前, 需要对拟挑选的菌株开展底物降解性能研究, 考察其它菌存在时种间竞争等效应是否会影响菌株对底物的降解效果.混菌与单菌对单一底物的降解效果比较如图 2所示.可以发现, 对于α-蒎烯, 混菌要比单菌LLC降解效果稍好, 2 d内降解率分别为64.5%和69.6%, 8 d内两者都可将其降解完; 对于乙酸丁酯, 无论是单菌体系还是混菌体系, 均表现出较高的降解活性, 2 d内降解完全; 对于邻二甲苯, 单菌的降解效果比混菌略有优势但基本相近, 均能在8 d内完全去除.
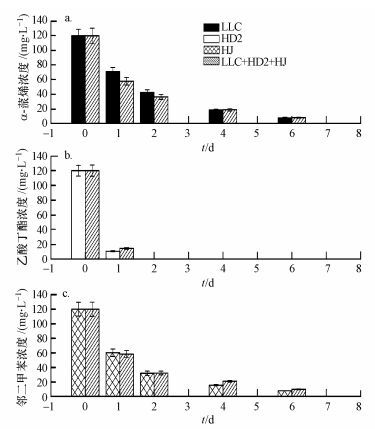 |
| 图 2 单菌和混合体系中底物浓度变化 Fig. 2 Concentration changes of substrates in single and mixed systems |
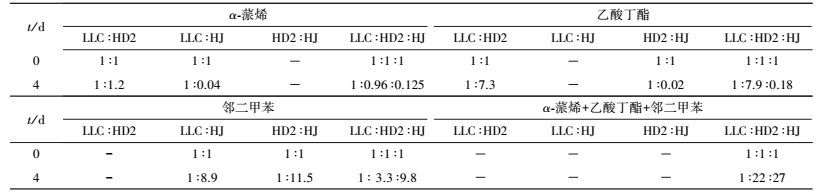
定期提取菌液并提取其DNA, 利用荧光定量PCR分析混合体系的菌群结构, 并和单底物混菌体系(两菌或三菌)作对比, 结果如表 2所示.
| 表 2 混合体系菌群结构变化 Table 2 Microbial structure of mixed system |
在混菌混底物体系中, 虽然降解初期, 细菌HJ表现出明显的优势(2 d时比例为1:15:34), 比例占了接近70%, 不过随后真菌HD2的生物量也开始快速上升, 并逐渐与细菌HJ生物量所占的比例接近, 说明细菌HJ和真菌HD2在混底物体系中生长情况良好.相对于真菌LLC, 菌株HJ和HD2生长具有明显优势, 真菌LLC生物量比例由最初的33%下降到2%, 虽然在生物量比例上菌株LLC处于劣势, 但并未影响α-蒎烯的降解效果, 分析其原因, 可能是由于菌株HD2对α-蒎烯也有降解能力.这个结论可以在以α-蒎烯作为唯一底物的实验中得到验证.可以发现HD2在生物量中所占的比例在4 d后超过了LLC, 说明这两株菌共存时HD2能表现出更好的生长优势.此外, 当以邻二甲苯为唯一碳源时, 实验发现LLC和HD2的生长情况也表现出很大的差异性, 说明邻二甲苯的存在, 对HD2生长的影响要稍大于对LLC的影响.
混菌混底物体系中, 虽然LLC的生长受到了影响, 但并未造成α-蒎烯降解效果的下降, 反而有所提升, 表明多底物并未对菌株产生太大的毒性作用.之前有不少研究表明种群多样性的增加有利于提升降解效率, 提高耐受阀值(王静, 2007; 何丽媛等, 2010; 邱清华等, 2013).所以这3株菌用于真菌-细菌复合菌剂制备具有可行性.
3.2 复合菌剂的持续性降解性能及饥饿期考察对制备的真菌-细菌复合菌剂进行持续降解效果测定, 结果如图 3所示.在底物浓度升高过程中, 菌剂与活菌液对3种底物的降解效果逐步接近并拥有相似的降解情况, 表明3株菌在菌剂制备过程中并未受到影响, 菌株仍保持较好的降解活性.
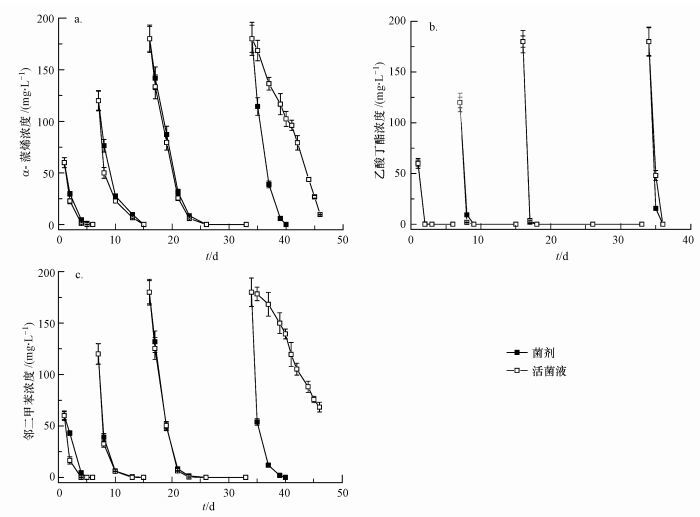 |
| 图 3 复合菌剂与活菌液对α-蒎烯、乙酸丁酯和邻二甲苯的持续性降解性能比较及饥饿期考察 Fig. 3 Degradation performance and starvation period observation between agent and suspension of α-pinene, butyl acetate and o-xylene |
之后对菌剂和活菌液进行为期1周的饥饿期考察, 然后再次添加180 mg·L-1浓度的底物, 可发现菌剂在24 h内表现出良好的降解性能, 尤其是对α-蒎烯和邻二甲苯, 菌剂的降解速率明显要快于活菌液, 24 h内对3种底物的降解率分别达到60%(α-蒎烯)、97%(乙酸丁酯)和90%(邻二甲苯), 5 d内实现对所有底物的完全降解, 说明饥饿期对菌剂的活性并没有太大影响.与菌剂不同, 活菌液降解性能直线下降, 24 h内对3种底物的降解率分别为6%(α-蒎烯)、73%(乙酸丁酯)和1%(邻二甲苯), 10 d内都未能实现对3种底物的完全降解.
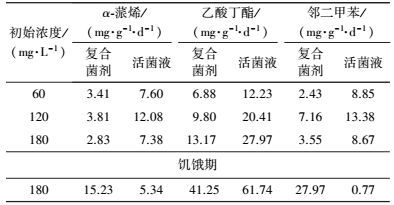
分别计算了复合菌剂和活菌液在不同时期的比降解速率, 结果如表 3所示.在3种底物中, 活菌液对邻二甲苯降解性能的下降尤为明显, 比降解速率由饥饿期前8.67 mg·g-1·d-1直接下降到了0.77 mg·g-1·d-1.经历饥饿期后, 菌剂对α-蒎烯及邻二甲苯的比降解速率分别为活菌接种液的2.85倍和36.32倍.另外, 实验还发现, 在饥饿期前, 活菌液对于3种底物的比降解速率均大于复合菌剂的比降解速率, 主要是菌剂载体(麦麸、木屑)中含有一定的有机营养物, 在使用过程中也可作为碳源供菌株利用, 因此复合菌剂的生物量增长量要远远大于活菌液, 使得表观比降解速率有所下降.
| 表 3 菌剂与活菌接种液比降解率对比 Table 3 Thecomparison of specific substrate utilization rates between microbial agents and suspension |
上述实验结果表明, 菌剂在饥饿期中, 可较大程度保持微生物存活率及其新陈代谢活性, 使其降解性能在该阶段得以更好的保持.另外也有研究表明, 固定化的菌群能更好的忍受包括饥饿期在内的环境条件(Cassidy et al., 1996; 张辉等, 2008).Wang等(2007)研究发现, 固定化的真菌Aspergillus fumigates表现出更高的生物密度及对恶劣环境的耐受程度, 这将提升微生物的降解性能及稳定性; 类似的结果也在针对细菌Bacillus sp.的研究中被发现, Tallur等(2009)通过比较固定化细菌Bacillus sp.与活菌液降解对甲酚发现固定化的细菌更能耐受pH和温度的变化; 同时, 真菌能以休眠孢子形态来度过外界恶劣的环境条件, 但细菌并不具备该功能, 因此在复合菌剂构建中加入真菌, 能进一步提升菌剂对恶劣环境的忍受能力(Elliot et al., 2002).
3.3 复合菌剂储藏稳定性试验复合菌剂的储藏稳定性直接关系到菌剂的使用、储存及运输是否方便.考察了真菌-细菌复合菌剂长期储存后的降解性能变化, 储存条件分别为4 ℃恒温及室温, 储存时间分别为7、30、90及180 d, 结果如图 4所示.常温下储存7 d时, 24 h内菌剂对乙酸丁酯、邻二甲苯的去除率下降较α-蒎烯明显, 分别下降了24%和18%, 而对α-蒎烯的去除率则在储存30 d后下降较明显, 下降了12%, 180 d后对于3种底物的去除率分别下降了10%(α-蒎烯)、5%(乙酸丁酯)和2%(邻二甲苯); 4 ℃储存90 d时, α-蒎烯和邻二甲苯去除效果下降明显, 分别下降了19%和20%, 180 d后对于3种底物的去除率分别下降了16%(α-蒎烯)、11%(乙酸丁酯)和17%(邻二甲苯).同时, 还比较了复合菌剂和菌液分别在4 ℃时储存不同时间的降解活性.可以发现, 活体菌液在4 ℃恒温储存对于各底物的降解活性下降非常迅速, 特别是α-蒎烯和邻二甲苯, 180 d后对3种底物的去除率分别下降了40%(α-蒎烯)、20%(乙酸丁酯)和46%(邻二甲苯).
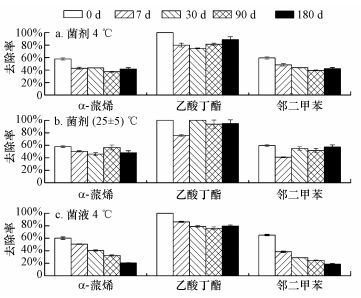 |
| 图 4 复合菌剂的储藏稳定性 Fig. 4 The stability of composite agent |
不管是4 ℃恒温还是室温储存过程中, 复合菌剂对底物的去除率均有小幅度的波动, 这可能是由于在降解及存储中, 载体可以提供给微生物生长的空间, 且载体与污染物分子间发生的化学-物理反应也可增进生物降解进程(Tomei et al., 2015).与4 ℃储存相比, 常温储存下菌剂能更快地恢复降解活性, 可能是由于室温储存时空气中的水分会与菌剂表面接触, 会使部分微生物停止休眠而进入生命活动阶段, 同时载体中存在一定的碳源(如麦麸), 会维持这些微生物的正常生命活动, 使得它们在使用过程中更快恢复活性.
常温储存下的菌剂去除效果要优于4 ℃储存的菌剂, 且可储存180 d仍保持对底物有较高的去除率, 与之前研究中的菌剂储存时间相比, 储存时间提升了2~3倍(叶峰等, 2009; Chen et al., 2010).生物菌剂的保存一直是制约其应用的重要障碍(蒋建东等, 2008).而本研究结果表明, 所选用的载体材料中的麦麸及木屑可能在一定程度上帮助微生物提升存活率并保持活性, 使其能长期保存, 为其工业化、商业化生产提供一定参考.
3.4 复合菌剂与活性污泥接种反应器运行性能比较作为有机废气净化过程的关键环节之一, 挂膜期运行的好坏与否情况将直接影响生物过滤塔的稳定性和降解性能(Michaud et al., 2002).同时挂膜时间的长短也是评价生物净化工艺运行的主要经济指标(田鑫等, 2004).考察了复合菌剂对生物滤塔运行效果的影响, 并与仅由活性污泥接种挂膜的生物滤塔比较.
在启动阶段, VOCs进气总浓度为250~350 mg·m-3, EBRT(空床停留时间, empty bed residence time)为60 s, 启动期进出口污染物总浓度变化及降解率变化如图 5所示, 接种复合菌剂的1号塔对底物的总去除率10 d后达到87%并维持稳定, 而仅接种污泥的2号塔总去除率在15 d达到64%并开始进入较为稳定的阶段.这些结果表明, 1号塔在稳定性和降解能力方面均要优于2号塔, 说明复合菌剂的使用可以在一定程度上缩短反应器启动期, 使其较快地进入稳定运行阶段.
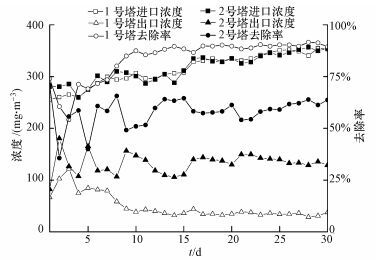 |
| 图 5 复合菌剂和活性污泥接种生物滴滤塔性能比较 Fig. 5 Performance comparison of composite agent and activated sludge for biotrickling filters |
进入稳定期后, 小幅提升进气的总浓度(将挂膜期的250~300 mg·m-3逐步提升到330 mg·m-3和350 mg·m-3)并保持7 d.1号塔在该阶段内保持较为稳定的净化效果, 总去除率为90%左右.2号塔虽具有较好的稳定性, 但其总去除率基本维持在60%左右, 明显低于1号塔.分别计算了1号塔和2号塔对于3种底物的去除负荷:1号塔对于α-蒎烯、乙酸丁酯和邻二甲苯的最高去除负荷分别为149.65、156.55和146.98 g·m-3·h-1, 2号塔对于α-蒎烯、乙酸丁酯和邻二甲苯的最高去除负荷分别为92.36、146.98和84.14 g·m-3·h-1.1号塔的去除负荷明显高于2号塔, Jin等(2006)利用Ophiostoma stenoceras LLC真菌接种生物过滤床对α-蒎烯的最大去除负荷为143 g·m-3·h-1, Hu等(2016)通过接种Zoogloea resiniphila HJ1和Methylobacterium rhodesianum H13的生物滴滤塔处理甲苯、邻二甲苯和二氯甲烷混合废气, 对邻二甲苯的最大去除负荷为49.5 g·m-3·h-1, 与上述结果相比, 本实验菌剂接种的反应器对混合废气表现了良好的去除性能.
4 结论(Conclusions)1) 采用混菌降解含α-蒎烯、乙酸丁酯和邻二甲苯的混合底物, 并未出现因种间竞争等原因而造成的降解性能下降的现象, 说明3株菌相互之间并不存在明显的抑制效应, 为构建“真菌-细菌”复合菌剂提供了可行性.
2) 利用麦麸、木屑和活性炭作为载体制备的菌剂具有较好的降解活性和储藏稳定性, 持续性降解活性与活菌液相似, 饥饿期过后, 菌剂对α-蒎烯和邻二甲苯的降解活性明显优于活菌液; 常温保存要优于4 ℃保存, 复合菌剂可保存180 d甚至更长时间, 对3种污染物的去除率没有出现降低现象.
3) 采用复合菌剂混合活性污泥接种生物过滤塔, 在生物膜形成时间和去除性能等方面均要优于采用单一活性污泥接种的生物过滤塔.
| [${referVo.labelOrder}] | Aizpuru A, Dunat B, Christen P, et al. 2005. Fungal biofiltration of toluene on ceramic rings[J]. Journal of Environmental Engineering, 131(3): 396–402. DOI:10.1061/(ASCE)0733-9372(2005)131:3(396) |
| [${referVo.labelOrder}] | Arriaga S, Revah S. 2005. Improving hexane removal by enhancing fungal development in a microbial consortium biofilter[J]. Biotechnology and Bioengineering, 90(1): 107–115. DOI:10.1002/(ISSN)1097-0290 |
| [${referVo.labelOrder}] | Cassidy M B, Lee H, Trevors J T. 1996. Environmental applications of immobilized microbial cells: A review[J]. Journal of Industrial Microbiology, 16(2): 79–101. DOI:10.1007/BF01570068 |
| [${referVo.labelOrder}] | Chen J M, Zhu R Y, Yang W B, et al. 2010. Treatment of a BTo-X-contaminated gas stream with a biotrickling filter inoculated with microbes bound to a wheat bran/red wood powder/diatomaceous earth carrier[J]. Bioresource Technology, 101(21): 8067–8073. DOI:10.1016/j.biortech.2010.05.096 |
| [${referVo.labelOrder}] | Chen Y, Wang X, He S, et al. 2016. The performance of a two-layer biotrickling filter filled with new mixed packing materials for the removal of H2S from air[J]. Journal of Environmental Management, 165: 11–16. DOI:10.1016/j.jenvman.2015.09.008 |
| [${referVo.labelOrder}] | Elliot S L, Mumford J D, de Moraes G J. 2002. The role of resting spores in the survival of the mite-pathogenic fungus Neozygitesfloridana from Mononychellustanajoa during dry periods in Brazil[J]. Journal of Invertebrate Pathology, 81(3): 148–157. DOI:10.1016/S0022-2011(02)00192-1 |
| [${referVo.labelOrder}] | Estrada J M, Hernández S, Muñoz R, et al. 2013. A comparative study of fungal and bacterial biofiltration treating a VOC mixture[J]. Journal of Hazardous Materials, 250: 190–197. |
| [${referVo.labelOrder}] | García Peña I, Ortiz I, Hernandez S, et al. 2008. Biofiltration of BTEX by the fungus Paecilomycesvariotii[J]. International Biodeterioration and Biodegradation, 62(4): 442–447. DOI:10.1016/j.ibiod.2008.03.012 |
| [${referVo.labelOrder}] | Hu J, Zhang L, Chen J, et al. 2016. Performance and microbial analysis of a biotrickling filter inoculated by a specific bacteria consortium for removal of a simulated mixture of pharmaceutical volatile organic compounds[J]. Chemical Engineering Journal, 304: 757–765. DOI:10.1016/j.cej.2016.06.078 |
| [${referVo.labelOrder}] | 何丽媛, 党志, 唐霞, 等. 2010. 混合菌对原油的降解及其降解性能的研究[J]. 环境科学学报, 2010, 30(6): 1220–1227. |
| [${referVo.labelOrder}] | 胡俊, 郑江玲, 吴越新, 等. 2012. 生物滴滤塔降解甲苯废气长期运行生物膜相特性研究[J]. 环境科学, 2012, 33(9): 2979–2986. |
| [${referVo.labelOrder}] | 胡志航. 2010. 二氯甲烷降解菌的分离鉴定, 微生物菌剂及基因文库的构建研究[D]. 杭州: 浙江工业大学 |
| [${referVo.labelOrder}] | Janbandhu A, Fulekar M H. 2011. Biodegradation of phenanthrene using adapted microbial consortium isolated from petrochemical contaminated environment[J]. Journal of Hazardous Materials, 187(1): 333–340. |
| [${referVo.labelOrder}] | Jin Y, Guo L, Veiga M C, et al. 2007. Fungal biofiltration of α-pinene: Effects of temperature, relative humidity, and transient loads[J]. Biotechnology and Bioengineering, 96(3): 433–443. DOI:10.1002/(ISSN)1097-0290 |
| [${referVo.labelOrder}] | Jin Y, Veiga M C, Kennes C. 2006. Performance optimization of the fungal biodegradation of α-pinene in gas-phase biofilter[J]. Process Biochemistry, 41(8): 1722–1728. DOI:10.1016/j.procbio.2006.03.020 |
| [${referVo.labelOrder}] | 蒋建东, 李荣, 陈凯, 等. 2008. 多功能农药降解基因工程菌剂保藏条件研究[J]. 农业环境科学学报, 2008, 27(4): 1686–1691. |
| [${referVo.labelOrder}] | Lebrero R, Rodriguez E, Martin M, et al. 2010. H2S and VOCs abatement robustness in biofilters and air diffusion bioreactors: a comparative study[J]. Water Research, 44(13): 3905–3914. DOI:10.1016/j.watres.2010.05.008 |
| [${referVo.labelOrder}] | Li G, Liang Z, An T, et al. 2015. Efficient bio-deodorization of thioanisole by a novel bacterium Brevibacillusborstelensis GIGAN1 immobilized onto different parking materials in twin biotricklingfilter[J]. Bioresource Technology, 182: 82–88. DOI:10.1016/j.biortech.2015.01.120 |
| [${referVo.labelOrder}] | 陆李超, 贾青, 成卓伟, 等. 2014. 真菌降解挥发性有机化合物的研究进展[J]. 环境污染与防治, 2014, 36(8): 78–83. |
| [${referVo.labelOrder}] | Michaud S, Bernet N, Buffière P, et al. 2002. Methane yield as a monitoring parameter for the start-up of anaerobic fixed film reactors[J]. Water Research, 36(5): 1385–1391. DOI:10.1016/S0043-1354(01)00338-4 |
| [${referVo.labelOrder}] | 聂国锋, 李莎, 姜理英, 等. 2017. DBD协同CuO/MnO2耦合生物滴滤塔降解氯苯的工艺性能分析[J]. 环境科学学报, 2017, 37(2): 528–537. |
| [${referVo.labelOrder}] | 邱清华, 哈尼帕, 邓绍云, 等. 2013. 石油降解混合菌剂的筛选及降解条件研究[J]. 中国农学通报, 2013, 29(3): 184–189. DOI:10.11924/j.issn.1000-6850.2012-1454 |
| [${referVo.labelOrder}] | Rene E R, Kar S, Krishnan J, et al. 2015. Start-up, performance and optimization of a compost biofilter treating gas-phase mixture of benzene and toluene[J]. Bioresource technology, 190: 529–535. DOI:10.1016/j.biortech.2015.03.049 |
| [${referVo.labelOrder}] | Rene E R, Mohammad B T, Veiga M C, et al. 2012. Biodegradation of BTEX in a fungal biofilter: influence of operational parameters, effect of shock-loads and substrate stratification[J]. Bioresource Technology, 116: 204–213. DOI:10.1016/j.biortech.2011.12.006 |
| [${referVo.labelOrder}] | 孙英, 刘二东. 2015. 气相色谱法测定环境空气中乙酸丁酯的方法探讨[J]. 环境与发展, 2015(5): 89–90. |
| [${referVo.labelOrder}] | Tallur P N, Megadi V B, Ninnekar H Z. 2009. Biodegradation of p-cresol by immobilized cells of Bacillus sp. strain PHN 1[J]. Biodegradation, 20(1): 79–83. |
| [${referVo.labelOrder}] | Tomei M C, Del Moro G, Di Iaconi C, et al. 2015. Enhanced biological wastewater treatment to produce effluents suitable for reuse[M]. Advanced Treatment Technologies for Urban Wastewater Reuse. Springer International Publishing. 79-105 |
| [${referVo.labelOrder}] | 田鑫, 廖强, 朱恂, 等. 2004. 陶瓷球填料生物膜滴滤塔挂膜启动工艺及对甲苯废气的净化性能实验研究[J]. 环境科学学报, 2004, 24(5): 834–840. |
| [${referVo.labelOrder}] | Vergara-Fernández A, Hernández S, Revah S. 2008. Phenomenological model of fungal biofiltersfor the abatement of hydrophobic VOCs[J]. Biotechnology and Bioengineering, 101(6): 1182–1192. DOI:10.1002/bit.v101:6 |
| [${referVo.labelOrder}] | Wang B E, Hu Y Y. 2007. Comparison of four supports for adsorption of reactive dyes by immobilized Aspergillus fumigatusbeads[J]. Journal of Environmental Sciences, 19(4): 451–457. DOI:10.1016/S1001-0742(07)60075-8 |
| [${referVo.labelOrder}] | 王静. 2007. 混合菌的构建及其对硝基苯的好氧生物降解[D]. 大连: 大连理工大学 |
| [${referVo.labelOrder}] | 杨卫兵. 2010. 复合菌剂及其高效菌株降解BTX的性能和机理研究[D]. 杭州: 浙江工业大学 |
| [${referVo.labelOrder}] | 叶峰, 张丽丽, 吴石金, 等. 2009. 降解三苯类复合微生物菌剂的制备及性能[J]. 中国环境科学, 2009, 29(3): 300–305. |
| [${referVo.labelOrder}] | 张辉, 李培军, 王桂燕, 等. 2008. 固定化混合菌修复油污染地表水的研究[J]. 环境工程学报, 2008, 2(12): 1613–1617. |
| [${referVo.labelOrder}] | 周学霞, 姚伟国, 杨冰雪, 等. 2013. 生物滴滤塔处理邻二甲苯废气研究[J]. 浙江大学学报:理学版, 2013, 40(1): 71–75. |
 2017, Vol. 37
2017, Vol. 37